Method Article
Functional Calcium Imaging in Entwicklungsländern Kortikale Netzwerke
In diesem Artikel
Zusammenfassung
Spontane Aktivitäten zu entwickeln neuronalen Netzen kann mit Hilfe AM-Ester Formen von Calcium-sensitiven Indikator Farbstoffe werden. Änderungen der intrazellulären Calcium, was darauf hinweist neuronale Aktivierung, werden als vorübergehende Veränderungen in Indikator Fluoreszenz mit ein-oder Zwei-Photonen-Imaging nachgewiesen werden. Dieses Protokoll kann für eine Reihe von entwicklungs-abhängige neuronale Netze angepasst werden In-vitro-.
Zusammenfassung
Ein Markenzeichen Muster der Aktivität in der Entwicklung des Nervensystems ist spontan, synchronisiert Netzwerk-Aktivität. Synchronized Aktivität in intakten Rückenmark, Hirnstamm, Netzhaut, Kortex und dissoziierten neuronalen Kultur Vorbereitungen beobachtet worden. Während der Dauer der spontanen Aktivität, depolarisieren Neuronen zu feuern einzelne oder Bursts von Aktionspotentialen, die Aktivierung vieler Ionenkanäle. Depolarisation aktiviert spannungsabhängigen Calcium-Kanäle auf Dendriten und Dornen, die Calcium-Einstrom zu vermitteln. Sehr synchronisierte elektrische Aktivität von lokalen neuronalen Netzwerken mit Feldelektroden gemessen worden. Diese Technik ermöglicht eine hohe zeitliche Abtastraten aber geringere räumliche Auflösung durch integrierte Auslesen mehrerer Neuronen an der einen Elektrode. Einzel-Zell-Auflösung der neuronalen Aktivität ist es möglich mittels Patch-Clamp-Elektrophysiologie an einzelnen Neuronen zu messen Brennen Aktivität. Allerdings ist die Fähigkeit, von einem Netzwerk-Maßnahme, um die Anzahl der Neuronen gepatcht s begrenztimultaneously, und in der Regel nur ein oder zwei Neuronen. Die Verwendung von Calcium-abhängigen Fluoreszenz-Indikator-Farbstoffen ist die Messung der Aktivität synchronisiert über ein Netzwerk von Zellen aktiviert. Diese Technik bietet sowohl eine hohe räumliche Auflösung und eine ausreichende zeitliche Abtastung, um spontane Aktivität des sich entwickelnden Netzwerk aufzuzeichnen.
Ein wesentliches Merkmal des neu bildenden kortikalen und hippokampalen Netzwerken während der Pre-und frühen postnatalen Entwicklung ist spontan, synchrone neuronale Aktivität (Katz & Shatz, 1996; Khaziphov & Luhmann, 2006). Dies korreliert Netzwerk-Aktivität wird angenommen, dass für die Erzeugung von funktionalen Schaltungen in der Entwicklung des Nervensystems (Spitzer, 2006) von wesentlicher Bedeutung. In beiden Primaten und Nagetiere Gehirn, sind frühe elektrische und Kalzium-Netzwerk Wellen beobachtet prä-und postnatal in vivo und in vitro (Adelsberger et al, 2005;. Garaschuk et al, 2000;.. Lamblin et al, 1999). Diese frühen Aktivitätsmuster, die bekanntlich mehrere Steuergeräte sindEntwicklungsprozesse, einschließlich der neuronalen Differenzierung, Synaptogenese und Plastizität (Rakic & Komuro, 1995;. Spitzer et al, 2004) sind von entscheidender Bedeutung für die korrekte Entwicklung und Reifung der kortikalen Schaltkreisen.
In diesem JoVE Video zeigen wir die Methoden zur Bild spontane Aktivität in der Entwicklung kortikalen Netzwerke. Calcium-sensitive Indikatoren, wie Fura 2-AM-Ester diffuse über die Zellmembran, wo intrazelluläre Esterase-Aktivität spaltet die AM-Ester, die Zell-impermeante Form von Indikator-Farbstoff zu verlassen. Die impermeante Form des Indikators hat Carbonsäuregruppen, die in der Lage, dann erkennen und binden Kalzium-Ionen intrazellulär sind .. Die Fluoreszenz der Calcium-sensitiven Farbstoff wird vorübergehend durch Bindung an Kalzium verändert. Einzel-oder Multi-Photonen-Imaging-Techniken eingesetzt, um die Änderung in Photonen aus dem Farbstoff emittiert werden, und damit deuten auf eine Veränderung der intrazellulären Calcium. Darüber hinaus sind diese Calcium-dependent Indikatoren können mit anderen fluoreszierenden Markern kombiniert werden, um Zelltypen innerhalb des aktiven Netzwerk zu untersuchen.
Protokoll
1. Machen horizontal entorhinalen-hippocampalen Hirnschnitten
Entorhinalen-hippocampalen Hirnschnitten werden mit anatomischen Führer, in eine 3D-Übersicht über die Region nach Canto, Wouterlood & Witter (2008) Neuronale Plastizität ID 381243 9 detailliert.
- Machen 500ml Scheibe Lösung mit Sauerstoff mit Carbogen Gas (95% Sauerstoff, 5% Kohlendioxid) für mindestens 20 Minuten und dann einfrieren 250ml bis vereist. Minuten vor dem Schneiden, Zerkleinern und Mixen der Scheibe Eis mit den restlichen 250 ml sprudelnden Scheibe Lösung für die Präparation und zum Schneiden in der Slicing Kammer eingesetzt werden.
- Machen 200ml r-ACSF (Recovery ACSF) und mindestens 500 ml e-ACSF (experimental ACSF)-Lösung. Kontinuierlich mit Sauerstoff beide Lösungen mit Carbogen Gas (95% Sauerstoff, 5% Kohlendioxid) für mindestens 20 Minuten vor dem Gewebe Vorbereitung.
- Dieses Protokoll gilt für Mäuse aus postnatalen Tag bis zu einem Maximum von 3 Wochen alt 0. Köpfen der animal, entsprechend den örtlichen Ethikkommission Verfahren und sezieren aus dem Gehirn schnell in eine Petrischale mit eiskaltem Scheibe Lösung in Schritt 1 vorbereitet, vor (siehe Tabelle 1 für Lösungen und Reagenzien).
- Übertragung des Gehirns auf ein Filterpapier mit Scheibe Lösung getränkt und trennen Sie die zwei Hemisphären mit einer scharfen Rasierklinge. Übertragen einer Hemisphäre wieder in eiskalten Scheibe Lösung.
- Entfernen Sie das Kleinhirn der anderen Hemisphäre. Flip das Gehirn auf seine Mittellinie und schneiden Sie die Oberseite des Gehirns mit einem leichten Winkel zum rostralen Ende.
- Flip das Gehirn auf die Schnittfläche (dorsalen) Oberfläche und kleben Sie es auf das Gewebe Inhaber der Hobel auf den Kopf, indem Sie ihn mit einem Wattestäbchen.
- Slice-300 um dicken Hirnschnitten mit einer niedrigen Frequenz und Geschwindigkeit in den restlichen eiskalten Scheibe Lösung in Schritt 1 vorgenommen. Unter unseren Bedingungen, verwenden wir ein Thermo Fisher Scientific Vibratom (Microm, HM 650V) bei Einstellungen 0,05 mm / s und 36Hz.
- AlsSobald eine Scheibe geschnitten wird, überträgt sie in ein Stück Halter (getaucht) mit Sauerstoff Artificial Cerebro Spinal Fluid (ACSF) (2,5 Mg 2 +, 1,6 mm Ca 2 +, siehe Tabelle 2) bei Raumtemperatur. Eine höhere Magnesiumkonzentration in r-ACSF reduziert den Einstrom von Kalzium in die Neuronen über NMDA-Rezeptoren nach Aufschneiden und in unserer Erfahrung führt zu einer besseren Qualität der Scheiben für Experimente. Wenn nötig, schneiden Sie die zweite Gehirnhälfte danach.
- Lassen Sie die Scheiben für eine Stunde zu erholen.
| Slice-Lösung (in mM) - 10 | |
| 110 | Cholinchlorid |
| 25 | NaHCO 3 |
| 11,6 | 11,6 |
| 10 | D-Glucose |
| 7 | MgCl 2 |
| 3,1 | sodiumpyruvate |
| 2,5 | KCl |
| 1,25 | NaH 2 PO 4 |
| 0,5 | CaCl 2 |
Tabelle 1. Recipe for slice Lösung.
| ACSF (in mM) | |
| 125 | NaCl |
| 26 | NaHCO 3 |
| 10 | D-Glucose |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (Rückgewinnung / Versuch) |
| 1,6 | CaCl 2 |
| 1,25 | NaH 2 PO 4 |
Tabelle 2. Rezept für Erholung (r-ACSF) und experimentelle (E-ACSF)-Lösung.
2. Vorbereitung der Färbung chBernstein
Zum Laden der Zellen mit der Calcium-abhängigen Indikator oder Zell-spezifische Marker, müssen Scheiben auf eine Kammer für die Färbung übertragen werden. Obwohl Handelskammern erhältlich sein können, kann man leicht vom Standard Laborgerät für sehr wenig Geld zusammengestellt werden. Die wichtigsten Merkmale einer solchen Kammer sind, dass die Scheiben sind zwischen 30 und 35 ° C erwärmt, inkubiert in einer kontinuierlich Sauerstoff Medium und dass die Kammer von Licht abgeschirmt.
- Mit einem beheizten Stab, machen ein kleines Loch in der Seitenwand von zwei Einweg-Polystyrol-Petrischalen (35 und 100 mm Durchmesser), die gerade groß genug, um einen Abschnitt der Silikonschlauch (Durchmesser ca. 1,5 mm) erlauben passieren wird.
- Thema der Silizium-Schlauch durch das Loch in der kleinen Petrischale und bilden eine Schleife in der inneren Wand der kleinen Schale.
- Verwenden Sie Sekundenkleber an das offene Ende des Schlauches Dichtung und kleben den Rest des Schlauchs an der Innenwand der Petrischale.
- Mit einer Nadel, um feine Löcher in gleichmäßigen Abständen in-den Schlauch innerhalb der inneren Petrischale.
- Kleben Sie den kleineren Petrischale in den größeren, mit beiden Löcher ausgerichtet. Führen Sie das andere Ende des Silizium-Schlauch durch das Loch in der Wand der größeren Petrischale.
- Für die Schnittstelle Gericht, nehmen Sie eine Zellkultur und-Einsatz mit halbdurchlässige Membran und mit einem erwärmten Skalpell, schneiden Sie die Spitze 1 cm Entfernung auf einer flachen Schale zu verlassen, um die Scheiben während der Inkubation zu halten.
- Auf dem Deckel des größeren Petrischale, machen Sie ein Loch ca.. 0,5-1cm Durchmesser für Carbogen (95% O 2, 5% CO 2) erlauben, in die Kammer strömen.
- Werfen Sie einen 5 oder 10ml Kunststoff-Spritze. Mit einem beheizten Skalpell einen abgewinkelten Schnitt, das Ende der Spritze entfernen und halten ein paar cm Länge Spritzenrohr mit der Spitze. Mit Sekundenkleber, befestigen Sie die Schnittfläche des Spritzenrohr der Petrischale Deckel, über die 0,5-1cm Durchmesser Loch.
- Bringen Sie Silikonschlauch undubing Anschluss an die Spitze der Spritze. Schließen Sie das andere Schlauchverbinder den Silikonschlauch Eingabe der Basis der Petrischalen.
- Schließen Sie beide Rohre mit einem Regler für Carbogen (95% O 2, 5% CO 2) zu versorgen. Legen Sie die Färbung Kammer auf einer heißen Platte für die Inkubation zwischen 30-35 ° C. Sicherstellen, dass die Kammer von Licht kann während der gesamten Inkubation Verfahren abgeschirmt werden. Die Färbung Kammer ist nun zusammenzusetzen und zu gebrauchen für Stück Inkubation.
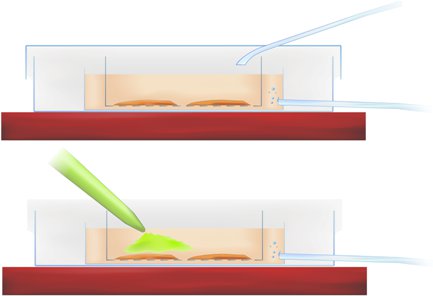
Methodik Abbildung 1. Querschnitt durch die Färbung Kammer zeigt Scheibe Inkubation (oben) und Anwendung von Calcium-sensitiven Indikator (pipettiert grünen Farbstoff, unten).
3. Die Färbung der Scheiben
Während einer Behandlung mit Fluoreszenzfarbstoffen vermeiden Ausbleichen durch die Arbeit mit wenig Licht und halten den Farbstoff und ter gefärbten Gewebeschnitten in der Dunkelheit zwischen Handling.
- Legen Sie die Färbung Kammer auf einer Heizplatte (35 ° C), die Verbindung zu einem Carbogen Gasversorgung und füllen Sie es mit etwa 1,5 ml r-ACSF aus der Scheibe Halter.
- Legen Sie die Schnittstelle Gericht in der Färbung Kammer und füllen Sie es mit 1ml ACSF.
- Stellen Sie sicher, eine gute Carbogen Versorgung in der Färbung Kammer zur ACSF sprudelnden auf eine sanfte und gleichmäßig zu halten.
- Add 9 ul DMSO und 1 ul Pluronsäure (20% in DMSO Stammlösung, Invitrogen) in ein Fläschchen mit 50 ug Fura 2-AM. Vortex der Farbstoff-Mix für 15 Minuten.
- Übertragen Sie die Scheiben in die Schnittstelle Schüssel und Pipette den Farbstoff in der r-ACSF direkt über dem Hippocampus und entorhinalen Kortex region of interest, wie in der Methode Abbildung 1 (oben) angegeben, eine endgültige Farbstoffkonzentration von 50mm.
- Schließen Sie den Deckel der Färbung Kammer inkubieren der Farbstoff für 20 bis 40 Minuten, je nach Alter des Tieres (siehe Tabelle 3).
- Transfer die Scheiben wieder in die Scheibe Halter.
| Alter (postnatale Tage) | Inkubationszeit (min) |
| 20 | |
| P8-P9 | 25 |
| p10-p11 | 30 |
| p12-13 | 35 |
| > P13 | 40 |
Tabelle 3. Inkubationszeiten für verschiedene Altersstufen, im Labor empirisch ermittelt.
4. Andere Farbstoffe und älteren Gewebe
Vielleicht wegen der erhöhten Myelinisierung im Hirngewebe, Scheiben von älteren Nager nehmen nicht Fura 2-AM-Ester, die sich leicht. Um die Aufnahme dieser Farbstoff eine Vorinkubationsschritt mit Cremophor EL (Sigma) für Gehirne von Mäusen bei P13 und älter 11 verwendet zu erleichtern. Cremophor ist ein nichtionisches Tensid als Hilfsstoff in vielen pharmazeutischen verwendetal-Anwendungen. Ohne diesen Schritt finden wir, dass Zell-spezifische Kennzeichnung extrem arm und inkonsistent innerhalb der kortikalen Schicht ist.
- Transfer alten Scheiben in eine flache Schüssel mit Vorinkubation 3ml r-ACSF und 8 ul 0,5% Cremophor (Sigma) erhitzt auf 35 ° C für 3 Minuten gefüllt.
- Übertragen Sie die Scheiben in die Schnittstelle Schüssel und folgen Sie den normalen Färbung (Schritte 4-7, siehe oben).
Calcium Farbstoffe laden beide Neuronen und nicht-Neuronen in der Schicht Vorbereitung. Zu identifizieren und zu unterscheiden zwischen diesen Zelltypen innerhalb des Netzwerks, kann Sulforhodamin 101 (SR101) zu kennzeichnen Astrozyten innerhalb der Schicht verwendet werden.
Die Färbung der Scheiben für Sulforhodamin 101
Folgen Sie den Schritten 1-3 wie zuvor (Abschnitt 3).
Nehmen Sie 1 ul 10 mM Stammlösung von Sulforhodamin (Sigma) aus seiner Lagerung bei -20 ° C und lösen sich in 999 ul r-ACSF einer 10 uM Lösung zu geben. Pipette die violette Farbstoff over die Scheiben nach wie vor (Schritte 5-7), so dass die Scheiben Inkubation für einen Zeitraum von 15 Minuten.
Mikroglia und Endothelzellen sind beschriftet mit FITC Tomaten Lektin Farbstoff
Folgen Sie den Schritten 1-3 wie zuvor.
Nehmen Sie 25 ul 2mg/ml Lycopersicon esculentum (Tomate) Lektin FITC Konjugat (L0401, Sigma) Stammlösung in 2,5 ml r-ACSF bis 20 pg / ml-Konzentration zu geben. Pipette den Farbstoff über die Scheiben nach wie vor (Schritte 5-7), so dass die Scheiben Inkubation für einen Zeitraum von 45 Minuten.
Beachten Sie, dass es nicht möglich, diesen Farbstoff mit einem Calcium-sensitiven Indikator wie Fura 2-AM oder Oregon Green BAPTA-1 (OGB-1), dass in den grünen Bereich des Spektrums, da die Photonen von beiden Farbstoffe fluoreszieren abgestrahlt wird kombinieren bei überlappenden Wellenlängen. Doch es gibt auch andere Kalzium-Indikator-Farbstoffen wie Calcium orange, Fura Red, die in Kombination mit geeigneten Filtern oder Texas-Red-Lektin-Konjugate verwendet werden können, nämlich kombinierenh Kalzium-Indikator-Farbstoffen im grünen Spektrum.
5. Anbringen Scheiben, um die Aufnahme Kammer
Während Imaging-Scheiben müssen unter dem Mikroskop stabil. Normalerweise wird ein Metall-Harfe ist in der Lage, halten Sie das Gewebe kann aber ungleich verzerren die Oberfläche der Scheibe, so dass nur ein Teil des Sichtfeldes für die Bildgebung im Fokus. Um dies zu vermeiden, sind Scheiben, um die Aufnahme Kammer mit Polyethylenimin (PEI) stecken.
- Bereiten Sie die PEI-Lösung (1 ml Polyethylenimin-Lösung in 250ml Borsäure-Puffer (Tabelle 4)). Stellen Sie sicher, das PEI vollständig auflöst (über Nacht rühren).
- Füllen Sie die Aufnahme Kammern mit PEI-Lösung, so dass die Unterseite mit Flüssigkeit mindestens eine Stunde abgedeckt ist, bevor Sie die Scheiben anwenden möchten
- Waschen Sie die Aufnahme Kammern mit destilliertem Wasser und dann mit r-ACSF aus der Aufnahmekammer.
- Übertragen einer Scheibe in ein Aufnahmestudio Kammer.
- Entfernen Sie die r-ACSF mit einer Pipette und die Position der slEis in der Mitte mit einem Pinsel.
- Entfernen Sie die r-ACSF rund um die Scheibe mit Stücken von Filterpapier. Für Stabilität und Haftung, ist es wichtig, dass es keine ACSF rund um die Scheibe nicht mehr.
- Pipette ca. 0,5-1ml ACSF, abhängig von der Größe der Aufnahme Kammer, auf die Scheibe. ACSF sollte gerade bedeckt die Scheibe Oberfläche.
- Legen Sie die Aufnahme Kammer mit der Scheibe in einem großen feuchten Schnittstelle Container, mit Carbogen durchströmt, und lassen Sie die Scheiben für mindestens eine Stunde zu erholen.
| PEI-Lösung | |
| 1ml | Poly (ethylenimin)-Lösung |
| in 250ml Borsäure-Puffer | |
| 40 mM | Borsäure |
| 10 mM | Natriumtetraboratdecahydrat |
Tabelle 4. Rezept PEI-Lösung.
6. ImAltern
Calcium-abhängigen Indikatorfarbstoffe können abgebildet entweder ein-oder zwei-Photonen-Mikroskopie werden. Verwendung von Zwei-Photonen-Imaging nur aktiviert Indikatorfarbstoff im fokalen Volumen der Region von Interesse, wodurch die Menge an Streulicht in das Gewebe. Darüber hinaus ermöglicht es eine bessere Eindringtiefe des Lichtes in der Scheibe.
Für funktionelle Kalzium-Imaging verwenden wir ein Titan-Saphir-Laser von Coherent gekoppelt mit einem Olympus-Mikroskop geliefert mit einem 20x-Objektiv (NA 0,95) und eine Trimscope System von LaVision Biotec. Die Trimscope System ermöglicht Frame Scan mit 64 Teilstrahlen gleichzeitig und ist mit einer Hamamatsu C9100 EM-CCD-Kamera für schnelle Frame-Abtastraten gekoppelt.
- Positionieren Sie die Aufnahme Kammer unter dem Mikroskop und ein stabiles Perfusion mit bildgebenden e-ACSF (1,6 Ca 2 + / 1,5 Mg 2 +-Verhältnis (Tabelle 2)) erhitzt, um eine physiologische Temperatur von minimal 30 ° C.
- Focuns in die Region of Interest (ROI) mit Beleuchtung mit weißem Licht. Vermeiden Sie es, die Scheibe länger als nötig dem Licht.
- Wählen Sie die Wellenlänge, Imaging Blickfeld, die Scan-Frequenz, Pixel-Dichte und zusätzliche Software-Optionen gelten für das Gewebe und biologische Signale, die Sie messen möchten. Für Calcium Netzwerk Imaging mit Fura 2-AM wir in der Regel wählen, eine Wellenlänge von 820nm, ein 250x250 um Imaging-Bereich der Ansicht, eine linescanning Frequenz von 1200Hz und 2-mal-2-Binning. Dies führt zu einer Frametime von ca. 100ms und somit ein bildgebendes Frequenz von etwa 10Hz.
- Prüfen Sie, ob Sie Ihren ROI im Fokus ist mit einem kontinuierlichen Scan-Modus und ausgewählten Wellenlänge von Laserlicht. Stellen Sie den Fokus und Intensität des Laserstrahls zu Pixel Sättigung und Bleichen des Bildes zu vermeiden.
- Machen Sie einen Zeitraffer Film Ihrer ROI. Wir in der Regel die Übernahme zweier Zeitraffer-Filme von 2000 Frames pro.
- Für Zell-Erkennung und Identifizierung, werfen Sie einen z-Stack mit einer Schrittweite von 1 um und imag e + / 20 um rund um Ihre abgebildet Fokusebene.
7. Repräsentative Ergebnisse
Erfolgreiche Beladung von Calcium-Indikatoren sind Fura 2-AM in Abbildung 1 in der Entwicklung Neokortex und entorhinalen Kortex Netzwerke mit Multiphotonen Imaging gezeigt. Einige Farbstoff ist nach wie vor als Hintergrundfärbung in das Gewebe, sondern Zelle Soma und in einigen Fällen sind proximalen Dendriten deutlich sichtbar und getrennt vom umgebenden Neuropil. Wenn das Laden nicht erfolgreich war, ist sehr wenig Zell-spezifische Färbung zu beobachten und kleinen Clustern von Farbstoff-Spots sind oft auf der Schnittfläche in tote Membran Ablagerungen sichtbar.
In diesen Screenshots ist das Netzwerk der Zellen deutlich sichtbar in einer einzigen Ebene der Fokus für die gleichzeitige Cell Imaging. Die Verwendung eines Metall-Harfe oder unvollständige Verkleben der Scheibe, um die Aufnahme Kammer kann in einer unebenen Oberfläche slice Ergebnis abgebildet.
550fig1.jpg "alt =" Bild 1 "/>
Abbildung 1. Fura 2-AM-Ester geladen entwickeln Neokortex (A, links) und entorhinalen (B, rechts) Netzwerke. Scale-Bars 100 um.
Zur Trennung Neuronen aus Astrozyten, co-Anwendung Sulforhodamin 101 mit Fura 2-AM-Ester ermöglicht die Trennung von Zelltypen innerhalb des Netzwerks.
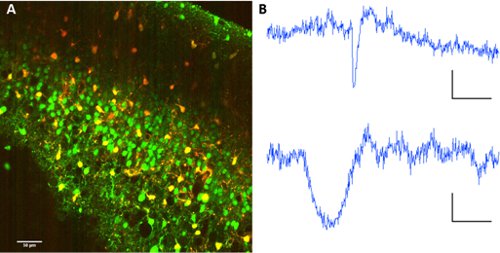
Abbildung 2. Astrocyte Markierung mit Sulforhodamin 101. Eine Co-Kennzeichnung von Fura 2-AM-Ester und Sulforhodamin 101. Anregungswellenlänge: 820nm. Bild-Sammlung auf PMTs mit dichroitischen Spiegel 560/70nm für Wellenlänge Trennung. B Repräsentative Fluoreszenz-Spuren von einem Neuron (oben) und ein Astrozyten (unten). Maßstabsbalken 60 sec, AF 10 (au fluo).
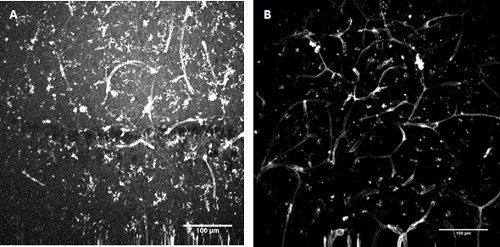
Abbildung 3. FITC-konjugierten Lycopersicon esculentum (Tomate) Lektin-Färbung . Kennzeichnung von Mikroglia und Endothelzellen bei der Entwicklung der Maus Hippocampus (A) und oberflächlichen entorhinalen Cortex (B).
Calcium Indikatorfarbstoffe werden verwendet, um read-out-Aktivitäten von mehreren Zellen gleichzeitig in die Entwicklung kortikalen und hippokampalen Netzwerke.
Abbildung 4. Dynamische Kalzium Transienten in hippokampalen und kortikalen Netzwerke.
Movie 1: Fura 2-AM-Ester Beladung von Maus entorhinalen Kortex während der zweiten Lebenswoche.
Klicken Sie hier, um Film 1 zu sehen.
Movie 2: Fura 2-AM-Ester Beladung von Maus Hippocampus während der ersten Lebenswoche.
Klicken Sie hier, um Film 2 zu sehen.
Movie 3: Fluo-4 Laden von Maus Kortex, während der ersten Lebenswoche.
50movie3.avi "> Klicken Sie hier, um Film 3 zu sehen.
Im Falle von Fura 2-AM-Ester, Zell-Aktivierung, die eine Depolarisation induzierte Einstrom von Calcium, nimmt Farbstofffluoreszenz. Für Farbstoffe wie Fluo-4, ist das Gegenteil der Fall und Zell-Depolarisation wird als eine Erhöhung der Photonen-Emissionen beobachtet. Somatische Kalzium Transienten sind vor allem gemessen, sondern Aktivität in größeren proximalen Dendriten können auch bei einigen Präparaten zu sehen, wie es in Movie 2 gezeigt.
Auslesen der Netzwerk-Aktivität kann quantifiziert mit kommerziellen oder in-house Software-Scripte werden. In unserem Labor-, Zell-Erkennung und Netzwerk-Aktivität gemessen und analysiert in einem semi-automatisierte Weise mit in-house-Code für Matlab (Mathworks).
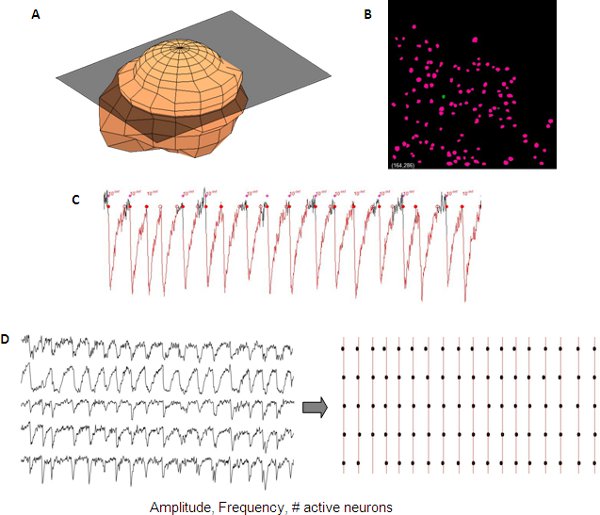
Abbildung 5. Vertreter Analyse synchronisiert Kalzium Transienten aus einem Entwicklungsland kortikalen Netzwerk. 3D-Darstellung von einem Neuron ( A) für die automatische Erstellung eines Neurons Maske (B) aus einer z-Stack für die automatisierte Erkennung Neuron. Messungen der Calcium-Transienten sind Amplitude, Frequenz und Anzahl der aktiven Zellen, die aus einzelnen Neurons Daten (C) gelesen werden können. Synchrony zwischen verschiedenen Spuren sichtbar gemacht werden mit Hilfe eines Raster-Plot (D).
Diskussion
Die Methoden zeigen wir hier zeigen, geeignete Protokolle für Kalzium-Imaging von Netzwerk-Dynamik von identifizierbaren Zellen innerhalb der Entwicklung kortikalen und hippokampalen Netzwerke in der Maus und auch im Gehirn der Ratte. Diese Methoden bieten eine optimale räumliche Auflösung zu einem lokalen Netzwerk der Zelle SOMAS gleichzeitig visualisieren zur Messung überschwellige Aktivität. Zeitliche Auflösung des Netzwerk-Aktivität kann variiert werden, je nach Rahmen Akquisition CCD-Kamera-Einstellungen, um zu signalisieren, zu optimieren: Lärmmessungen für lange überschwellige Ereignisse, die typischerweise in der Entwicklung des Nervensystems gefunden. Diese Protokolle sind nicht zu hippocampalen und kortikalen Netzwerke, sondern auch Label-Zellen während der Entwicklung des Nervensystems beschränkt. Die Einschränkung dieser Methode ist, dass nur überschwellige Aktivität aufgezeichnet werden können.
Offenlegungen
LaVision Biotec GmbH (Bielefeld, Deutschland) unterstützte die Vorlage Gebühren dieses Manuskripts Artikel.
Danksagungen
Die Arbeit im Labor wird durch Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO) (917.10.372) zu RMM unterstützt. JD ist es, die EU FP7 BrainTrain Programm (verbundenen www.brain-train.nl ). Wir danken Pieter Laurens-Baljon und Sabine Schmitz (beide CNCR, VU University Amsterdam) für Bilder von FP Multielektroden Array Wellenformen und neuronalen Kulturen in der Videosequenz verwendet.
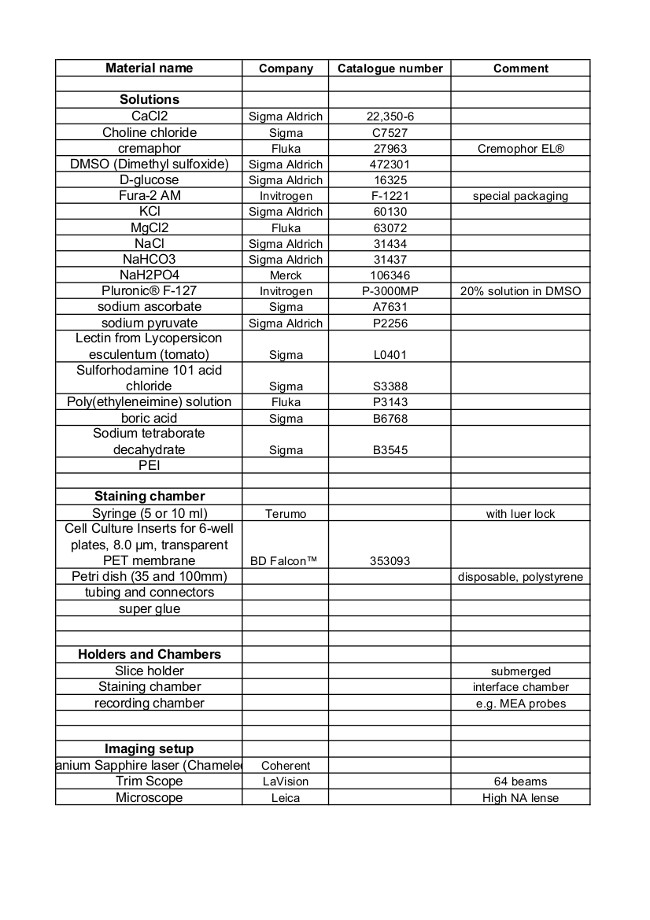
Materialien
Referenzen
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten