Method Article
皮質ネットワークの開発で機能的カルシウムイメージング
要約
神経回路網の開発の自発的な活動は、カルシウム感受性インジケータ染料のAM -エステルフォームを使用して測定することができます。神経細胞活性化を示す細胞内カルシウムの変化は、、1つまたは2つの光子イメージングとインジケーターの蛍光の過渡変化として検出されます。このプロトコルは分化依存的神経回路網の範囲に適合させることができる in vitroで。
要約
神経系の開発における活動の特徴パターンが自発的、同期ネットワークアクティビティが発生しています。同期活動はそのまま脊髄、脳幹、網膜、大脳皮質および解離神経培養の準備で観察されている。自発活動の期間中、ニューロンは、多くのイオンチャネルを活性化し、単一または活動電位のバースト発火への脱分極。脱分極は、カルシウム流入を仲介する樹状突起と棘上電位依存性カルシウムチャネルを活性化する。高度に同期電気的活動は、フィールド電極を使用してローカル神経回路網から測定されています。この技法は、一方の電極に起因する読出し複数のニューロンの統合に高い時間サンプリングレートが低い空間分解能を可能にします。神経活動の単一細胞の解像度では、アクティビティを発射測定するために、単一のニューロンにパッチクランプ電気生理学を使用することが可能です。しかし、ネットワークから測定する能力は、ニューロンパッチを適用したsの数に制限されていますimultaneously、通常は唯一の1つまたは2つのニューロンです。カルシウム依存性蛍光指示薬染料の使用は、細胞のネットワークを介して同期して活性の測定を可能にしました。この手法は、高い空間分解能と開発ネットワークの自発的活動を記録するのに十分な時間的サンプリングの両方を与える。
前と出生後早期開発中に新たに形成皮質と海馬ネットワークの重要な特徴は、自発的、同期神経活動(; Khaziphov&ルーマン、2006カッツ&シャッツ、1996)である。この相関ネットワークの活動は、発展途上の神経系における機能的な回路の世代(スピッツァー、2006)のために不可欠であると考えられている。霊長類と齧歯類の脳の両方で、初期の電気とカルシウムネットワークの波が前と出産後、in vivoおよびin vitroで観察される(Adelsbergerら、2005;。Garaschukら、2000;。。Lamblinら、1999)。いくつかを制御することが知られているこれらの初期の活動パターン、神経分化、シナプス形成と可塑性(。ラキッチ&小室、1995;スピッツァーら、2004)を含む発達過程は皮質回路の正しい発展と成熟のための非常に重要です。
このJoveのビデオでは、皮質ネットワークの開発における画像自発活動するために使用されるメソッドを示しています。細胞内のエステラーゼ活性は、切断、細胞膜を通過するようなフラなどのカルシウム感受性の指標、2 - AMエステルのびまん性指示薬の細胞非透過性フォームのままにエステル思います。インジケータの透過性の形態は、細胞内カルシウムイオンを検出して結合することができるカルボン酸基を持っています..カルシウム感受性色素の蛍光が一過性にカルシウムと結合する際に変更されます。シングルまたはマルチフォトンイメージング技術は、色素から放射される光子の変化を測定するため、細胞内カルシウムの変化を示すために使用されます。さらに、これらのカルシウム- Dependent指標は、アクティブなネットワーク内での細胞型を調査するために他の蛍光マーカーと組み合わせることができます。
プロトコル
1。水平嗅内-海馬脳切片を作成
嗅内-海馬脳切片はカント、Wouterlood&ウィッター(2008)神経可塑性のID 381243 9によると、解剖学的なガイドを使用して行う地域の3D概要に記載されています。
- 少なくとも20分間carbogenガス(酸素95%、5%炭酸ガス)と酸素を、スライスのソリューションの500ミリリットルを確認してからアイスまで、250ミリリットルフリーズ。スライス前の分、解剖のために、スライスチャンバー内で切断するために使用する残りの250ミリリットルバブリングスライスのソリューションとスライス氷を粉砕してブレンド。
- R - ACSF(回収ACSF)とe - ACSF(実験ACSF)溶液の少なくとも500ミリリットルの200ミリリットルを加えます。組織の準備の前に少なくとも20分間carbogenガス(酸素95%、5%二酸化炭素)と連続的に酸素を送り込むの両方のソリューション。
- このプロトコルは、3週齢の上限にUP 0生後からマウスで有効です。アニマを刎ねるlは、ローカルの倫理委員会の手順に従って、そして上記の、ステップ1で調製した氷冷スライス溶液の入ったペトリ皿の中で急速に脳を解剖する(ソリューション&試薬については表1を参照)。
- スライスのソリューションを含浸させた濾紙の上に脳を転送し、鋭いカミソリの刃を持つ2つの半球を分離する。氷冷スライスのソリューションに戻って一方の半球を転送する。
- 他の半球の小脳を削除します。その正中線上に脳を反転し、吻側端に向かって少し角度を持つ脳の上部を切り取ります。
- 優しく、綿棒で押して、上下逆さまにスライサーのティッシュホルダーの上にカット(背側)表面と接着その上に脳を反転します。
- ステップ1で作成した残りの氷冷スライスのソリューションで、低周波数と速度を用いて300μm厚の脳スライスをスライス。私たちの条件の下で、我々は、設定が0.05ミリメートル/ sと36Hzでサーモフィッシャーサイエンティフィックビブラトーム(Microm、HM 650V)を使用します。
- としての室温で、( 表2参照2.5mmのMg 2 +を 、1.6mmのCa 2 +)のスライスがカットされるとすぐに、酸素を人工脳脊髄液(ACSF)を含むスライスホルダー(水中)にそれを転送する。 R - ACSFの高いマグネシウム濃度のスライスや我々の経験では、次のNMDA受容体を介した神経細胞へのカルシウムの流入を減少させる、実験用のスライスの質の向上につながります。必要に応じて、その後第二大脳半球をカット。
- 回復するために一時間のスライスにしておきます。
| スライスの溶液(mMで) - 10 | |
| 110 | 塩化コリン |
| 25 | 飽和NaHCO 3 |
| 11.6 | 11.6 |
| 10 | D -グルコース |
| 7 | MgCl 2の |
| 3.1 | sodiumpyruvate |
| 2.5 | 塩化カリウム |
| 1.25 | のNaH 2 PO 4 |
| 0.5 | CaCl 2で |
表1。スライスのソリューションのためのレシピ。
| ACSF(mMで) | |
| 125 | NaClを |
| 26 | 飽和NaHCO 3 |
| 10 | D -グルコース |
| 3 | 塩化カリウム |
| 2.5/1.5 | MgCl 2の (回復/実験) |
| 1.6 | CaCl 2で |
| 1.25 | のNaH 2 PO 4 |
表2。両方のリカバリ(R - ACSF)と実験(電子ACSF)ソリューションのためのレシピ。
2。染色chの準備アンバー
カルシウム依存性インジケータまたは細胞特異的マーカーを有する細胞をロードするには、スライスには、染色手順のためのチャンバーに転送する必要があります。商業室が利用できるかもしれないが、いずれかが簡単に非常に少ないコストで標準的な実験装置から組み立てることができます。このようなチャンバーの主な機能は、スライスが30と35との間に暖めていることです° C、継続的に酸素化された媒体にしてチャンバーを光から遮蔽されているインキュベート。
- 加熱ロッドを使用して、シリコンチューブのセクションでは、(直径約1.5mm)の通過を許可するのに十分なだけ大きいである2使い捨てのポリスチレンシャーレ(35と100ミリメートルの直径)の側の壁に小さな穴を作る。
- 小さなペトリ皿の穴からシリコンチューブを通し、小さな皿の内側の壁の内側のループを形成する。
- チューブの開放端を密封し、ペトリ皿の内側の壁にチューブの残りを固執する瞬間接着剤を使用してください。
- 針を使用して、内側のペトリ皿内のチューブで、等間隔の間隔で微細な穴を作る。
- 整列の両方の穴と大きい方の内側接着剤は、小さなペトリ皿、。より大きなペトリ皿の壁の穴からシリコンチューブのもう一方の端を通します。
- インタフェースの皿のために、半透膜とよく挿入細胞培養を利用し、加熱メスを使用して、インキュベーション中にスライスを保持するために浅い皿を残すために離れてトップ1センチメートルをカット。
- より大きなペトリ皿の蓋に、穴の約を行います。チャンバー内に流入するcarbogen(95%O 2、5%CO 2)を可能にするために0.5〜1センチメートル直径。
- 5または10mlのプラスチック製の注射器を取る。加熱メスを用いて、注射器の端を削除し、先端に注射器のチューブの数cmの長さを維持するために斜めにカットを行います。瞬間接着剤を使用して、0.5〜1センチメートル直径の穴を介して、ペトリ皿の蓋に注射器のチューブの切断面を取り付けます。
- シリコンチューブを取り付け、でシリンジの先端にコネクタをubing。シャーレの底に入るシリコンチューブに別のチューブコネクターを取り付けます。
- carbogen(95%O 2、5%CO 2)電源用のレギュレータに、両方のチューブを接続してください。 30から35の間インキュベーションのためのホットプレート上での染色室℃を置きますチャンバー全体インキュベーションの過程で光から遮蔽することができることを確認します。染色槽は組み立てとスライスのインキュベーションのために使用できる状態になります。
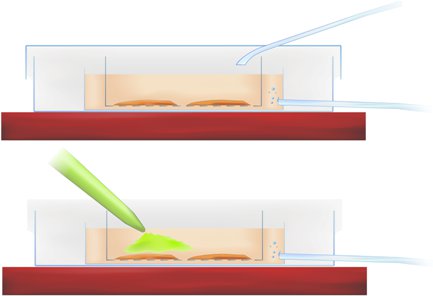
方法論の図1。スライスのインキュベーション(上記)とカルシウム感受性インジケータ( 下の緑色の色素を、ピペッティング)のアプリケーションを示す染色槽の断面図。
3。スライスの染色
蛍光色素を含むすべての処理を通して、少しの光で動作することにより、退色を避けるためと染料を維持し、t彼は、処理の間に暗闇の中で組織を染色した。
- 熱板(35℃)で染色槽を置く、carbogenガス供給に接続し、スライスホルダーから約1.5ミリリットルR - ACSFで塗りつぶす。
- 染色のチャンバー内にインターフェースの皿を置き、1ミリリットルACSFで塗りつぶす。
- 穏やかな、安定したレートでACSFのバブリングを維持するために染色室内の良好なcarbogenの供給を確保する。
- 50μgのフラ2 - AMのバイアルに9μlのDMSOと1μlのロニック酸(DMSOストック溶液に20%、Invitrogen社 ) を追加します。渦15分間染料混合。
- インタフェースの皿にスライスを移し、50mmの最終的な染料濃度を達成するため、直接などの方法論を図1(上記)に示された関心の海馬と嗅内皮質の領域に、上のR - ACSFに染料をピペット。
- 染色チャンバーの蓋を閉め、20色素を静置 - 動物の年齢に応じて40分(表3参照)。
- トランスバックスライスホルダーにスライスFER。
| 年齢(生後日数) | インキュベーション時間(分) |
| 20 | |
| P8 - P9 | 25 |
| P10 - P11 | 30 |
| P12 - 13 | 35 |
| > P13 | 40 |
表は、3。異なる年齢のためのインキュベーション時間は、ラボで経験的に決定された。
4。他の染料と古い組織
おそらく、脳組織の増加髄鞘形成のために、古いげっ歯類からのスライスは、簡単にフラ2 - AMエステルを占有しません。クレモフォールEL(Sigma)を用いたプレインキュベーションステップはP13、11より古いでマウスの脳のために使用されているこの色素の取り込みを促進する。クレモフォールは、多くの薬学の賦形剤として使用される非イオン性界面活性剤です。らのアプリケーション。このステップがなければ、我々は、細胞特異的ラベリングは皮質切片全体に非常に悪いと矛盾していることがわかります。
- 3ミリリットルR - ACSFと℃で3分間35に加熱8μlの0.5%クレモホール(シグマ)で満たされた浅いプレインキュベーション皿に古いスライスを転送する。
- インタフェースの皿にスライスを転送し、通常の染色手順(手順4 - 7、上記参照)に従ってください。
カルシウムの染料は、スライス標本で神経細胞と非神経細胞の両方をロードする。識別し、ネットワーク内でこれらの細胞型を区別するために、スルホローダミン101(SR101)がスライス内アストロサイトを標識するために使用することができます。
スルホローダミン101のスライスの染色
(セクション3)以前のように手順1〜3に従ってください。
-20℃での貯蔵からスルホローダミン(シグマ)の10mMのストック溶液の1μlを取り、10μM溶液を得た、999μlのR - ACSFに溶解する。紫色の染料OVをピペットでER前と同じようにスライス(5-7ステップ)、15分間インキュベートスライスを残して。
ミクログリアと内皮細胞は、FITCトマトレクチンの色素を使用したラベルが付いています
前と同じ手順1〜3に従ってください。
2mg/mlトマトesculentum(トマト)レクチンFITCコンジュゲート(L0401、シグマ)20μg/ mlの濃度になるように2.5ミリリットルR - ACSFにストック溶液の25μlを取る。 45分の期間インキュベートスライスを残して、(5-7ステップ)以前と同じようにスライス上に染料をピペット。
(注)、それは両方の色素から光子が放出されるので、スペクトルの緑の範囲で蛍光を発するフラ2 - AMまたはオレゴングリーンBAPTA - 1(OGB - 1)のようなカルシウム感受性インジケータでは、この色素を結合することはできません。重複する波長で。しかし、ウィットを結合するために適切なフィルタまたはテキサス - レッドレクチンコンジュゲートと組み合わせて使用することができるようなカルシウムオレンジ、フラレッドのような他のカルシウムインジケータの色素が存在する緑のスペクトルにおけるhはカルシウムインジケータの色素。
5。録音室にスライスの取り付け
イメージングのスライス中に顕微鏡下で安定であることが必要。通常、金属製のハープは、組織を押したままに配置されますが、それは不規則に焦点のイメージングのためのビューのフィールドの一部だけを与えて、スライスの表面を歪めることができる。これを避けるために、スライスは、ポリエチレンイミン(PEI)を使って録音室に立ち往生している。
- PEI溶液(250ミリリットルホウ酸緩衝液(表4)の1ミリリットルポリエチレンイミン溶液)を調製します。 PEIは、完全に溶解することを確認してください(一晩撹拌)。
- スライスを適用する前に、底部は、流体、少なくとも1時間に覆われるように、PEI溶液と録音室を埋める
- 保持室から蒸留水とし、R - ACSFで録音室を洗ってください。
- 録音室に1つのスライスを転送する。
- ピペットと位置SLとR - ACSFを削除します。ブラシを使用して中間の氷。
- filterpaperの切れ端を使ってスライスの周りにR - ACSFを削除します。安定性と遵守のために、それはもはやスライスの前後にはACSFがないことが重要です。
- ピペットで約0.5〜1ミリリットルACSF、スライスの上に、録音室のサイズに応じて。 ACSFは、単にスライス面をカバーする必要があります。
- carbogenで灌流大型加湿インタフェースの容器、中にスライスして録音室を置き、スライスが少なくとも1時間で回復しましょう。
| PEIソリューション | |
| 1ミリリットル | ポリ(エチレンイミン)ソリューション |
| 250ミリリットルホウバッファに | |
| 40mmの | ホウ酸 |
| 10mMの | 四ホウ酸ナトリウム十水和物 |
表4。レシピPEIのソリューション。
6。 IM高齢化
カルシウム依存性インジケータの色素は、1段階または2光子顕微鏡を用いて画像化することができます。二光子イメージングを使用すると、唯一のため、組織における光散乱の量を減らし、関心領域の焦点体積中にインジケータの色素を活性化する。さらに、それは、スライスへの光の良い深さの浸透を可能にします。
機能的カルシウムイメージングのために我々は、20倍対物レンズ(NA 0.95)とLaVision Biotec社でTrimscopeシステムでオリンパスの顕微鏡にコヒーレント結合によって供給されるチタンサファイアレーザーを使用してください。 Trimscopeシステムは、同時に64レットでフレーム走査を可能にし、高速フレームスキャンレートのための浜松C9100 EM - CCDカメラで結合されている。
- 顕微鏡下で録音室を置き、最小限の30以上の生理的温度℃に加熱したイメージング、電子ACSF(1.6のCa 2 + / 1.5のMg 2 +の比(表2))で安定した血流を確立する
- FOC白色光照明を使用して関心(ROI)の領域に私たち。必要以上に長く光にスライスを放置しないでください。
- 波長、撮影視野、走査周波数、画素密度と測定したい組織と生体信号に対して適用される追加ソフトウェアオプションを選択します。フラとカルシウムのネットワークイメージングのための2 - AM我々は、通常、820nmの波長、視野の250 × 250μmのイメージング分野、linescanningの1200Hzの周波数と2 × 2ビニングを選択します。こうして約100ミリ秒と約10Hzのイメージング周波数のframetimeでこの結果。
- あなたの投資収益率は、連続スキャンモードとlaserlightの選択された波長を使用してフォーカスがあるかどうかを確認します。画像のピクセル飽和と漂白を避けるために、フォーカスとレーザー強度を調整します。
- あなたのROIのタイムラプスムービーを作成。我々は、一般的に2000フレームずつの2つのタイムラプスムービーを取得する。
- 細胞の検出及び識別するために、1μmのステップサイズを用いたとimag Zスタックを取る焦点のあなたのイメージ化された飛行機の周りの電子+ /20μmである。
7。代表的な結果
カルシウムインディケーターのロードが成功、フラ2 - AMは、多光子イメージングを用いた新皮質と嗅内皮質のネットワークを開発する際に、図1に示されています。いくつかの染料はまだ組織のバックグラウンド染色が細胞体として、いくつかのケースに存在する、近位樹状突起がはっきりと神経網を周囲から分離されています。ロードが成功していない場合は、ほとんど細胞特異的染色が観察され、色素斑の小さなクラスターは死んだ細胞膜の破片でスライスの表面にしばしば表示されている。
これらのスクリーンショットでは、細胞のネットワークは、同時に細胞イメージングのための焦点の一つの面ではっきりと見える。録音室に金属のハープやスライスの不完全な付着の使用は、撮像すべき不均一なスライスの表面に発生する可能性があります。
550fig1.jpg"altが="図1"/>
図1。フラ2 - AMエステル-ロードされて新皮質の開発(左)と嗅内(B、右)のネットワーク。スケールバーは100μm。
アストロサイトからニューロンを分離するために、フラとローダミン101の共同アプリケーション2 - AMエステルは、ネットワーク内の細胞型の分離が可能になります。
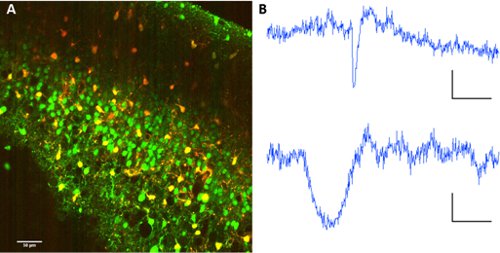
図2。スルホローダミン101の星状膠細胞ラベリング。フラ2 - AMエステルおよびスルホローダミン101の共同ラベル。励起波長:820nm。ニューロン(上記)とアストロサイト(下記)から波長分離用560/70nmでダイクロイックミラーによる光電子増倍管上の画像コレクション。B代表蛍光のトレース。スケールバーは60秒、ΔF10(AU蛍光)。
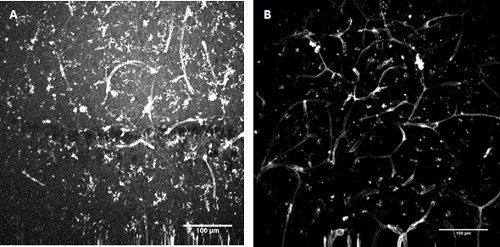
図3。 FITC標識トマトesculentum(トマト)レクチン染色 。マウスの海馬(A)と表面的な嗅内皮質(B)の開発におけるミクログリアと内皮細胞のラベリング。
カルシウム指示薬の色素が皮質と海馬のネットワークを開発する際に、同時に複数の細胞からの活動を読み出すために使用されます。
図4。海馬と皮質ネットワークにおける動的なカルシウムトランジェント。
動画1:第二出生後の週の間にマウス嗅内皮質のフラ2 - AMエステルのロード。
動画1を表示するにはここをクリック。
動画2:出生後第1週の間にマウスの海馬のフラ2 - AMエステルのロード。
映画2を表示するにはここをクリック。
動画3:出生後第1週中にマウス皮質のであるFluo - 4負荷、。
50movie3.aviは">映画を見たい方はここをクリックしてください。
フラ2 - AMエステルの場合には、カルシウムの脱分極誘発流入が関与する細胞の活性化は、色素の蛍光を減少させます。このようにみたFluo - 4などの染料の場合、反対はtrueですと、細胞の脱分極は、光子の排出量の増加として観察される。体細胞のカルシウムトランジェントは主に測定が大きい近位樹状突起における活動しているムービー2に示すように、また、いくつかの準備で見ることができます。
読み出し、ネットワークアクティビティのは、商業目的または社内ソフトウェアのスクリプトを使用して定量することができる。私たちの研究室、細胞の同定およびネットワークアクティビティで測定され、MATLAB(Mathworks社)の社内コードを使って半自動化された方法で分析した。
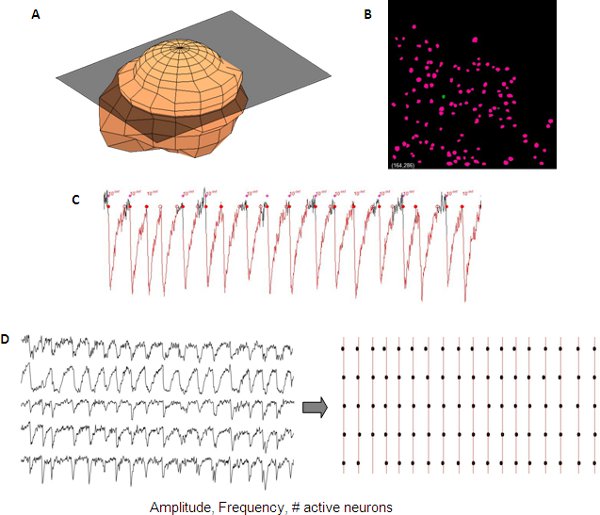
図5。開発皮質ネットワークから同期したカルシウムトランジェントの代表的な分析。一つのニューロンの三次元表現( A)が自動的に自動化されたニューロンの検出のための(B)Z -スタックからニューロンのマスクを作成するために使用される。カルシウムトランジェントの測定は、単一のニューロンのデータ(C)から読み出すことができるアクティブなセルの振幅、周波数および#などがあります。別のトレース間の同調性は、ラスタープロット(D)を用いて可視化することができます。
ディスカッション
我々はマウスでもラットの脳で皮質と海馬のネットワークの開発の中に識別の細胞からネットワークダイナミクスのカルシウムイメージングに適したプロトコルを表示するここに示す方法。これらのメソッドは、閾値上の活性を測定するため、同時に細胞についてSOMAのローカルネットワークを可視化するために最適な空間分解能を提供しています。通常、発展途上の神経系に見られる長い期間の閾値上のイベントのための騒音測定:ネットワークアクティビティの時間分解能は、信号を最適化するために、フレーム取り込みCCDカメラの設定に応じて、変化させることができる。これらのプロトコルは、発展途上の神経系全体に海馬と皮質のネットワークだけでなく、ラベルの細胞に限定されていません。このメソッドの制限は、その唯一の閾値上のアクティビティが記録できることです。
開示事項
LaVisionバイオテク社(ビーレフェルト、ドイツ)は、この原稿の記事の投稿料を後援した。
謝辞
ラボでの作業はRMMにNederlandse Organisatie voor Wetenschappelijk Onderzoek(NWO)(917.10.372)によってサポートされています。 JDは、EUのFP7 BrainTrainプログラム(に提携していますwww.brain - train.nl )。我々は、FP多電極アレイの波形とビデオシーケンスで使用されているニューロン培養のイメージのためにピーターローレンス- Baljonとザビーネシュミッツ(CNCR、VU大学アムステルダムの両方を)感謝。
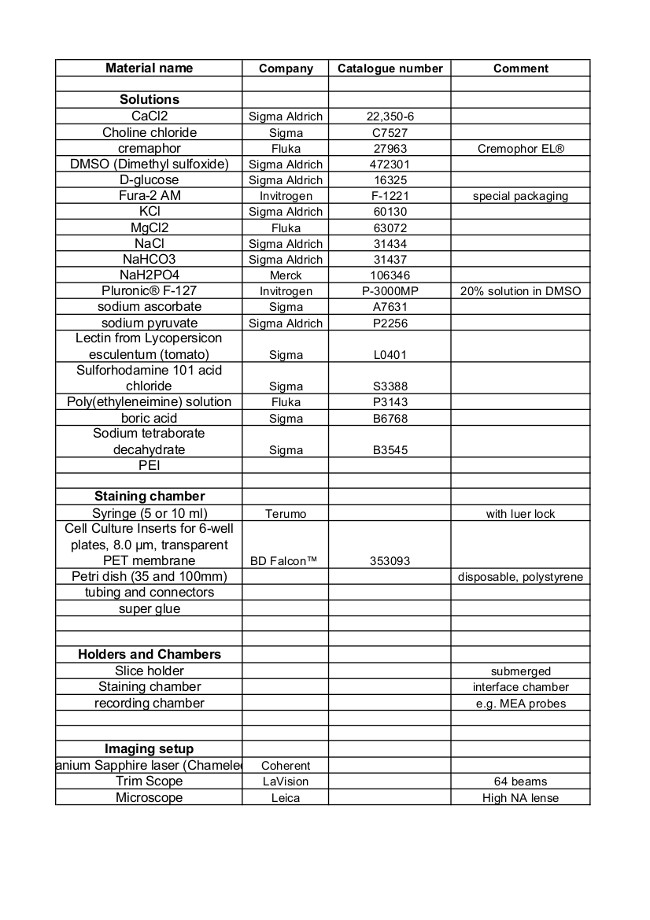
資料
参考文献
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved