Method Article
Imagen de calcio funcionales en el desarrollo de redes corticales
En este artículo
Resumen
La actividad espontánea de la creación de redes neuronales se puede medir con AM-éster formas de tintes indicadores sensibles de calcio. Cambios en el calcio intracelular, lo que indica la activación neuronal, se detectan los cambios transitorios de la fluorescencia con un indicador o imagen de dos fotones. Este protocolo puede ser adaptado para una serie de redes neuronales del desarrollo que dependen de In vitro.
Resumen
Un patrón distintivo de la actividad en el sistema nervioso en desarrollo es una actividad espontánea, sincronizar la red. Actividad sincronizada se ha observado en intacta la médula espinal, tronco cerebral, la retina, la corteza y disociado preparativos cultivo neuronal. Durante los períodos de actividad espontánea, las neuronas se despolarizan de disparo simple o ráfagas de potenciales de acción, la activación de muchos canales de iones. Despolarización activa canales dependientes de voltaje de calcio en las dendritas y espinas que median el influjo de calcio. Actividad altamente eléctrica sincronizada se ha medido a partir de las redes locales de neuronas con electrodos de campo. Esta técnica permite una alta frecuencia de muestreo temporal pero de menor resolución espacial debido a la gestión integrada de lectura de múltiples neuronas en uno de los electrodos. Resolución única célula de la actividad neuronal es posible con patch-clamp electrofisiología en las neuronas individuales para medir la actividad de disparo. Sin embargo, la capacidad de medir de una red se limita a la cantidad de neuronas parcheado simultaneously, y por lo general es sólo una o dos neuronas. El uso de calcio dependientes de tintes indicadores fluorescentes ha permitido a la medición de la actividad sincronizada a través de una red de células. Esta técnica ofrece una alta resolución espacial y temporal de muestreo suficiente para registrar la actividad espontánea de la red de desarrollo.
Una característica clave de la nueva formación de redes corticales y del hipocampo durante el desarrollo postnatal antes y temprano es espontánea, la actividad neuronal sincronizada (Katz y Shatz, 1996; Khaziphov y Luhmann, 2006). Esta actividad de la red correlacionadas se cree que es esencial para la generación de circuitos funcionales en el sistema nervioso en desarrollo (Spitzer, 2006). En tanto los primates y el cerebro de roedores, a principios de electricidad y las ondas de calcio de la red se observan antes y después del nacimiento en vivo e in vitro (Adelsberger et al, 2005;. Garaschuk et al, 2000;.. Lamblin et al, 1999). Estos patrones de las primeras actividades, que se sabe que el control de variasprocesos de desarrollo incluyendo la diferenciación neuronal sinaptogénesis y plasticidad (Rakic y Komuro, 1995;. Spitzer et al, 2004) son de vital importancia para el correcto desarrollo y maduración de los circuitos corticales.
En este video JOVE, que demuestran los métodos utilizados para la actividad espontánea de la imagen en el desarrollo de redes corticales. Calcio sensible a los indicadores, como la Fura 2-AM éster difusa a través de la membrana celular donde la actividad de la esterasa intracelular rompe el AM ésteres de salir de la forma de células impermeable de tinte indicador. La forma de impermeant indicador tiene grupos ácido carboxílico que son capaces de detectar y luego se unen los iones de calcio intracelular .. La fluorescencia del colorante sensible al calcio se altera transitoriamente al unirse al calcio. Técnicas de imagen de una o varias de fotones se utilizan para medir el cambio de los fotones emitidos por el medio de contraste, y por lo tanto indicar una alteración en el calcio intracelular. Además, estas calcio-dindicadores ependent se puede combinar con otros marcadores fluorescentes para investigar los tipos de células dentro de la red activa.
Protocolo
1. Hacer horizontal entorrinal-hipocampo rebanadas de cerebro
Entorrinal-hipocampo rebanadas de cerebro se realizan con guías anatómicas, se detalla en una visión en 3D de la región de acuerdo con Canto, Wouterlood y Witter (2008) ID Plasticidad Neural 381 243 9.
- Hacer 500 ml de solución de corte, oxigenar con carbogen gas (95% de oxígeno, 5% de dióxido de carbono) durante al menos 20 minutos y luego se congelan hasta 250 ml con hielo. Minutos antes de cortar, triturar y mezclar el hielo con la rebanada restante porción de 250 ml solución de burbujas que se utilizará para la disección y para el corte en la cámara de corte.
- Hacer 200 ml de r-ACSF (recuperación ACSF) y al menos 500 ml de e-ACSF (experimental ACSF) solución. Continuamente oxigenar ambas soluciones con carbogen gas (95% de oxígeno, 5% de dióxido de carbono) durante al menos 20 minutos antes de la preparación del tejido.
- Este protocolo es válido para los ratones desde el primer día postnatal 0 hasta un máximo de 3 semanas de edad. Decapitar el ánimal, de acuerdo con los procedimientos locales de comité de ética, y diseccionar el cerebro rápidamente en una placa de Petri que contiene helado de solución de corte preparado en el Paso 1, más arriba (véase la Tabla 1 para las soluciones y reactivos).
- Transferencia del cerebro en un papel de filtro empapado con la solución de cortar y separar los dos hemisferios con una navaja afilada. Transferencia de un hemisferio de nuevo en helado solución rebanada.
- Quitar el cerebelo del otro hemisferio. Da la vuelta al cerebro en su línea media y cortar la parte superior del cerebro con una ligera inclinación hacia el extremo rostral.
- Da la vuelta al cerebro en el corte (dorsal) y la superficie de goma en el soporte del tejido de la máquina de cortar hacia abajo empujando suavemente con un bastoncillo de algodón.
- Cortar rodajas de 300 micras de espesor del cerebro con una baja frecuencia y la velocidad en el helado restante solución de corte hecha en el paso 1. Bajo nuestras condiciones, se utiliza un Thermo Fisher Scientific vibratome (Microm, HM 650V) con ajustes de 0,05 mm / s, y 36Hz.
- Comopronto como una rodaja se corta, la transferencia a un soporte de corte (sumergido), que contiene oxigenada artificial Cerebro líquido cefalorraquídeo (ACSF) (2,5 Mg 2 +, Ca 2 + 1,6 mm, ver Tabla 2) a temperatura ambiente. A mayor concentración de magnesio en la r-ACSF reduce la entrada de calcio en las neuronas a través de receptores NMDA siguiente corte y en nuestra experiencia, conduce a una mejor calidad de rodajas para los experimentos. Si es necesario, cortar el hemisferio cerebral segundos después.
- Agregar las rodajas de una hora para recuperarse.
| Solución de corte (en mm) - 10 | |
| 110 | cloruro de colina |
| 25 | NaHCO3 |
| 11.6 | 11.6 |
| 10 | D-glucosa |
| 7 | MgCl2 |
| 3.1 | sodiumpyruvate |
| 2.5 | KCl |
| 1.25 | NaH 2 PO 4 |
| 0.5 | CaCl2 |
Tabla 1. Receta para la solución de corte.
| ACSF (en mM) | |
| 125 | NaCl |
| 26 | NaHCO3 |
| 10 | D-glucosa |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (recuperación / experimento) |
| 1.6 | CaCl2 |
| 1.25 | NaH 2 PO 4 |
Tabla 2. Receta para tanto la recuperación (r-ACSF) y la solución experimental (e-ACSF).
2. Preparación de la ch tinciónámbar
Para cargar las células con el indicador dependiente de calcio o un marcador específico de células, las rebanadas deben ser transferidos a una cámara para el procedimiento de tinción. A pesar de las cámaras comerciales pueden estar disponibles, fácilmente se puede montar desde el equipo estándar de laboratorio a muy bajo costo. Las características principales de esta cámara es que los cortes son calentadas a entre 30 y 35 ° C, se incubaron en un medio continuamente oxigenada y que la cámara está protegido de la luz.
- Usando una vara caliente, hacer un pequeño agujero en la pared lateral de dos platos desechables de poliestireno de Petri (35 y 100 mm de diámetro), que es lo suficientemente grande para permitir que una sección de tubo de silicona (aproximadamente 1,5 mm de diámetro) para pasar a través.
- Tema del silicio tubería a través del agujero en la pequeña placa de Petri y la forma de un bucle dentro de la pared interna del plato pequeño.
- Utilice pegamento para sellar el extremo abierto del tubo y se adhieren el resto de la tubería a la pared interna de la placa de Petri.
- Usando una aguja, hacer los agujeros bien a intervalos uniformemente espaciados en el tubo en el interior de placa de Petri.
- Pegue los más pequeños dentro de una caja de petri el más grande, con dos agujeros alineados. Pase el otro extremo de la manguera de silicona a través del agujero en la pared de la mayor placa de Petri.
- Para el plato de interfaz, un cultivo de células de inserción y con membrana semipermeable y el uso de una piscina climatizada de bisturí, cortar la parte superior de 1 cm de distancia para dejar un plato poco profundo para mantener los cortes durante la incubación.
- En la tapa de la mayor caja de Petri, hacer un agujero aproximadamente. 0.5-1cm de diámetro para permitir la carbogen (95% O 2, 5% CO 2) para el flujo en la cámara.
- Tome un 5 o jeringa de 10 ml de plástico. El uso de un bisturí con calefacción, hacer un corte en ángulo para eliminar el extremo de la jeringa y mantener una longitud de unos pocos centímetros del tubo de la jeringa con la punta. Utilizando pegamento, colocar la superficie de corte del tubo de la jeringa a la tapa de caja de Petri, sobre el agujero de 0.5-1cm de diámetro.
- Conecte el tubo de silicona y enubing conector a la punta de la jeringa. Conecte otro conector del tubo de la manguera de silicona entrar en la base de los platos de Petri.
- Conectar hasta dos tubos de un órgano regulador para carbogen (95% O 2, 5% CO 2) de suministro. Coloque la cámara de manchas en una placa caliente para la incubación de entre 30-35 º C. Asegúrese que la cámara se pueden proteger de la luz durante todo el proceso de incubación. La cámara de tinción ya está listo para montar y utilizar para la incubación de corte.
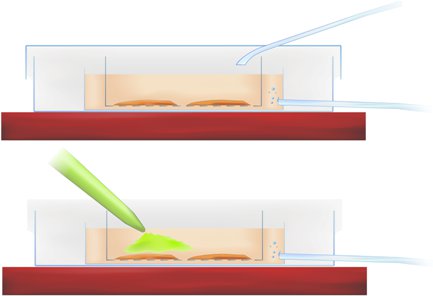
Metodología de la Figura 1. Corte transversal de la cámara que muestra manchas de incubación corte (arriba) y la aplicación de indicadores sensibles al calcio (pipeta de tinta verde, más abajo).
3. Tinción de cortes
A lo largo de toda manipulación participación de los tintes fluorescentes, evitar photobleaching al trabajar con poca luz y mantener el tinte y el tmanchó los tejidos en la oscuridad, entre la manipulación.
- Ponga la cámara de manchas en una placa de calor (35 ° C), se conecta a un suministro de gas carbogen y llenarlo con aproximadamente 1,5 ml r-ACSF del titular de la corte.
- Coloque el plato de la interfaz de la cámara de tinción y llenarlo con 1 ml ACSF.
- Asegurar un suministro carbogen bien en la cámara de tinción para mantener el burbujeo ACSF a un ritmo suave y constante.
- Añadir 9 l DMSO y un ácido plurónico l (20% en DMSO solución madre, Invitrogen) en un vial de 50 mg Fura 2-AM. Vortex la mezcla de colorante por 15 minutos.
- La transferencia de las rebanadas en el plato de la interfaz y la pipeta de la tinta en la r-ACSF directamente sobre la región del hipocampo y corteza entorrinal de interés, como se indica en la figura Metodología 1 (arriba), consiguiendo una concentración final de 50 mM tinte.
- Cierre la tapa de la cámara de tinción e incubar el tinte de 20 a 40 minutos dependiendo de la edad del animal (ver Tabla 3).
- Transfer las rebanadas de nuevo en el soporte de corte.
| Edad (días después del parto) | Tiempo de incubación (min) |
| 20 | |
| P8-P9 | 25 |
| p10-p11 | 30 |
| p12-13 | 35 |
| > P13 | 40 |
Tabla 3. Los tiempos de incubación para las diferentes edades, empíricamente determinado en el laboratorio.
4. Otros colorantes o más tejidos
Tal vez debido a un aumento en la mielinización del tejido cerebral, las rebanadas de roedores más viejos no ocupan Fura 2-AM éster tan fácilmente. Para facilitar la absorción de este tinte se utiliza un paso de preincubación con Cremophor (Sigma) para los cerebros de los ratones en P13 y mayores 11. Cremophor es un surfactante no iónico utilizado como excipiente en muchos farmacéuticosAl aplicaciones. Sin este paso, nos encontramos con que las células específicas de etiquetado es muy deficiente e inconsistente a lo largo de la porción cortical.
- La transferencia de las rebanadas de edad en un plato poco profundo lleno de preincubación con 3 ml r-ACSF y 8 cremophor l 0,5% (Sigma) se calienta a 35 ° C durante 3 minutos.
- La transferencia de las rebanadas en el plato de la interfaz y siga el procedimiento de tinción normal (pasos 4-7, véase más arriba).
Colorantes de calcio cargar tanto las neuronas y no las neuronas en la preparación de división. Para identificar y distinguir entre estos tipos de células dentro de la red, sulforodamina 101 (SR101) se puede utilizar para los astrocitos etiqueta dentro de la división.
La tinción de las rodajas de sulforodamina 101
Siga los pasos 1-3 como antes (sección 3).
Tome 1 l de solución madre 10 mM de sulforodamina (Sigma) a partir de su almacenamiento a -20 ° C y se disuelven en 999 l r-ACSF para dar una solución 10 mM. Pipeta de la púrpura ov tinteer los cortes como antes (pasos 5-7), dejando las rodajas de incubación por un período de 15 minutos.
Microglia y las células endoteliales son etiquetados con tinte FITC lectina del tomate
Siga los pasos 1-3 como antes.
Tomar 25 l de 2mg/ml Lycopersicon esculentum (tomate) lectinas FITC (L0401, Sigma) en 2,5 ml de solución madre r-ACSF para dar 20 mg / ml de concentración. Pipeta la tintura sobre las rebanadas de antes (pasos 5-7), dejando las rodajas de incubación por un período de 45 minutos.
Tenga en cuenta, no es posible combinar este color con un indicador sensible al calcio como la Fura 2-AM o Oregon Green BAPTA-1 (OGB-1) que la fluorescencia en el rango verde del espectro, ya que los fotones de ambos colorantes, se emitirá en longitudes de onda se superponen. Sin embargo, hay otro indicador de calcio colorantes tales como calcio naranja, rojo Fura que se pueden utilizar en combinación con los filtros adecuados o Texas-Red conjugados lectina de combinar el ingenioh indicador de calcio colorantes en el espectro de color verde.
5. Colocación de las rebanadas a la cámara de grabación
Durante las rebanadas de imágenes tienen que ser estables bajo el microscopio. Por lo general, un arpa de metal se coloca para mantener el tejido, pero de forma desigual puede distorsionar la superficie de la loncha, dando sólo una parte del campo de visión de imágenes en el enfoque. Para evitar esto, los segmentos están pegados a la cámara de grabación con polietilenimina (PEI).
- Prepare la solución de PEI (1 ml de solución tampón Polietilenimina en 250ml bórico (tabla 4)). Asegúrese de que el PEI se disuelve por completo (agitación durante una noche).
- Llene las cámaras de la grabación con una solución de PEI para que el fondo está cubierto de líquido por lo menos una hora antes de que desee aplicar los cortes
- Lave las cámaras de grabación con agua destilada y después con r-ACSF de la cámara de retención.
- Transferencia de una porción en una cámara de grabación.
- Retire la r-ACSF con una pipeta y la posición del slhielo en el centro con un cepillo.
- Retire la r-ACSF en todo el sector mediante obras de filterpaper. Para la estabilidad y la adhesión, es importante que no hay ACSF todo el trozo más.
- Pipeta de 1 ml aproximadamente de 0,5 ACSF, dependiendo del tamaño de la cámara de grabación, en la división. ACSF sólo debe cubrir la superficie de corte.
- Ponga la cámara de grabación con la rebanada en un recipiente grande interfaz humidificado, perfundidos con carbogen, y dejar que las rodajas de recuperar por lo menos durante una hora.
| PEI solución | |
| 1 ml | Poli (etilenimina) solución |
| en tampón bórico 250ml | |
| 40mm | ácido bórico |
| 10 mM | de sodio decahidrato tetraborato |
Tabla 4. Receta PEI solución.
6. Imenvejecimiento
Dependientes de calcio tintes indicadores se pueden visualizar utilizando uno o microscopía de dos fotones. El uso de dos fotones de imagen sólo se activa tinte indicador en el volumen central de la región de interés, lo que reduce la cantidad de luz que se difunda en el tejido. Además, permite una mejor profundidad de penetración de la luz en el sector.
Para obtener imágenes funcionales de calcio se utiliza un láser de titanio zafiro suministrados por junto coherente de un microscopio Olympus con un objetivo de 20x (NA 0,95) y un sistema de Trimscope por LaVision Biotec. El sistema permite Trimscope marco de escaneo de 64 beamlets al mismo tiempo y se combina con un Hamamatsu C9100 EM-CCD de la cámara para un rápido escaneo marco de tarifas.
- La posición de la cámara de registro bajo el microscopio y establecer una perfusión estable con imágenes e-ACSF (1,6 Ca 2 + / 1.5 Mg 2 + proporción (tabla 2)) se calienta a una temperatura más fisiológica de un mínimo de 30 ° C.
- Focnos en la región de interés (ROI) con iluminación de luz blanca. Evite exponer el sector a la luz más de lo necesario.
- Elija la longitud de onda, campo de la imagen de vista, la frecuencia de exploración, la densidad de píxeles y más opciones de software de aplicación para las señales de los tejidos biológicos y se desea medir. Para imágenes de calcio de la red con Fura 2-AM que suelen elegir una longitud de onda de 820nm, un campo de imagen de 250x250 m de vista, una frecuencia de 1200Hz linescanning y hurgar en la basura de 2 por 2. Esto se traduce en una frametime de alrededor de 100 ms y por lo tanto una frecuencia de imagen de alrededor de 10Hz.
- Compruebe si su retorno de la inversión está en el foco utilizando un modo de escaneo continuo y longitud de onda seleccionada de Laserlight. Ajustar el enfoque y la intensidad del láser para evitar la saturación de píxeles y el blanqueo de la imagen.
- Hacer una película timelapse de su retorno de la inversión. Por lo general la adquisición de dos películas timelapse de 2000 cuadros cada uno.
- Para la detección de células y la identificación, tomar un z-stack con un tamaño de paso de 1 micra y imag e + / 20 m alrededor de su avión de imágenes de foco.
7. Los resultados representativos
Carga de los indicadores de éxito de calcio, Fura 2-AM se muestran en la Figura 1 en el desarrollo de las redes de la corteza entorrinal y la neocorteza utilizando imágenes multifotónica. Un poco de tinte aún está presente en la tinción de fondo en el soma celular y tisular, pero en algunos casos, las dendritas proximales son claramente visibles y separados de los alrededores de neuropilo. Si la carga no ha tenido éxito, es muy poco específico de las células se observa tinción y pequeños grupos de manchas de tinte se encuentra visible en la superficie de corte en los escombros de membrana muertos.
En estas capturas de pantalla, la red de células es claramente visible en un solo plano de enfoque para obtener imágenes de células simultáneamente. El uso de un arpa de metal o adherencia incompleta de la división para la cámara de registro puede resultar en una superficie de corte desigual a explorar.
550fig1.jpg "alt =" Figura 1 "/>
Figura 1. Fura 2-AM-éster cargado desarrollo neocortical (A, izquierda) y las redes entorrinal (B, derecha). Las barras de escala 100 micras.
Para separar las neuronas de los astrocitos, co-aplicación de sulforodamina 101 con Fura 2-AM éster permite la separación de los tipos de células dentro de la red.
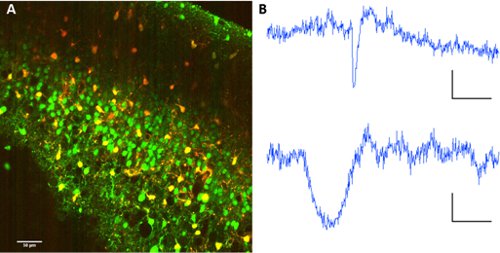
Figura 2. Etiquetado de los astrocitos con sulforhodamina 101. Un Co-etiquetado de Fura 2-AM éster y sulforodamina 101. Longitud de onda de excitación: 820nm. Colección de imágenes de PMTs con espejo dicroico en 560/70nm para la separación de longitudes de onda. B Representante de fluorescencia rastros de una neurona (arriba) y un astrocito (abajo). Escala de barras 60 seg, Df 10 (au fluo).
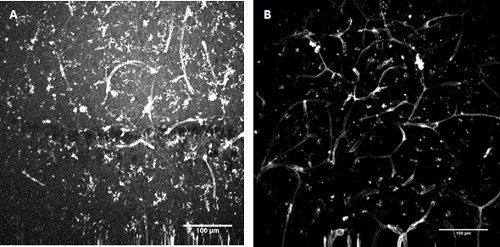
Figura 3. Conjugado con FITC Lycopersicon esculentum (tomate) lectina tinción . Etiquetado de microglia y las células endoteliales en el desarrollo de hipocampo del ratón (A) y la superficial corteza entorrinal (B).
Colorantes de calcio indicador se utilizan para lectura de la actividad de las células de forma simultánea en el desarrollo de las redes corticales y del hipocampo.
Figura 4. Transitorios dinámicos de calcio en las redes del hipocampo y la corteza.
Película 1: Fura 2-AM de carga éster de ratón corteza entorrinal durante la semana después del parto segundo.
Haga clic aquí para ver la película 1.
Película 2: Fura 2-AM de carga éster del hipocampo del ratón durante la primera semana postnatal.
Haga clic aquí para ver la película 2.
Película 3: Fluo-4 de carga de la corteza del ratón, durante la primera semana postnatal.
50movie3.avi "> Haga clic aquí para ver la película 3.
En el caso de la Fura 2-AM éster, activación de las células involucran un flujo inducido por la despolarización de calcio, disminuye la fluorescencia del tinte. De tintes como Fluo-4, es todo lo contrario y despolarización de la célula se observa como un aumento de las emisiones de fotones. Somáticos transitorios de calcio se mide principalmente, pero la actividad en las grandes dendritas proximales también se puede ver en algunas preparaciones, como se muestra en la película 2.
Lectura de la actividad de la red se puede cuantificar el uso de scripts de software comercial o interno. En nuestro laboratorio de células de identificación, y la actividad de la red se mide y analiza de una manera semi-automática utilizando el código de la casa de Matlab (Mathworks).
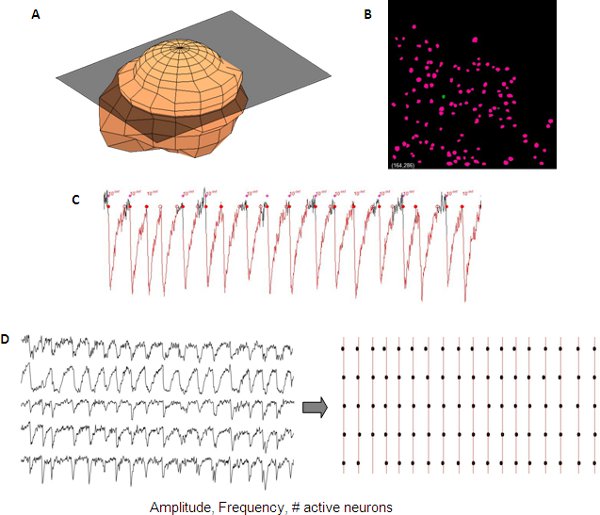
Figura 5. Análisis representativo de los transitorios de calcio sincronizado de una red de desarrollo cortical. Representación 3D de una neurona ( A) que se utiliza para crear automáticamente una máscara de la neurona (B) a partir de una z-stack para la automatización de la detección de las neuronas. Las mediciones de los transitorios de calcio incluyen amplitud, frecuencia y n º de células activas que se pueden leer de una sola neurona de datos (C). Sincronía entre diferentes rastros se pueden visualizar mediante un gráfico en mapa de bits (D).
Discusión
Los métodos que demostrar aquí muestran protocolos adecuados para la imagen de calcio de la dinámica de la red a partir de células de identificación en el desarrollo de redes corticales y del hipocampo en el ratón y también en el cerebro de la rata. Estos métodos proporcionan una resolución espacial óptima para visualizar una red local de somas celulares al mismo tiempo para medir la actividad por encima del umbral. La resolución temporal de la actividad de la red puede variar, dependiendo de la configuración del marco de la adquisición de la cámara CCD, para optimizar la señal: las mediciones de ruido por mucho tiempo los acontecimientos duración por encima del umbral, por lo general se encuentran en el sistema nervioso en desarrollo. Estos protocolos no se limitan a las redes del hipocampo y la corteza, sino también las células de la etiqueta a través del sistema nervioso en desarrollo. La limitación de este método es que la actividad por encima del umbral sólo se pueden grabar.
Divulgaciones
LaVision Biotec GmbH (Bielefeld, Alemania), patrocinada por los honorarios de presentación de este artículo manuscrito.
Agradecimientos
Trabajar en el laboratorio con el apoyo de Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO) (917.10.372) para RMM. JD está afiliado a la Unión Europea del 7 º PM BrainTrain programa ( www.brain-train.nl ). Damos las gracias a Pieter Laurens-Baljon y Sabine Schmitz (tanto CNCR, VU University Amsterdam) para obtener imágenes de formas de onda de FP amplia multielectrodo y culturas neuronal utilizada en la secuencia de vídeo.
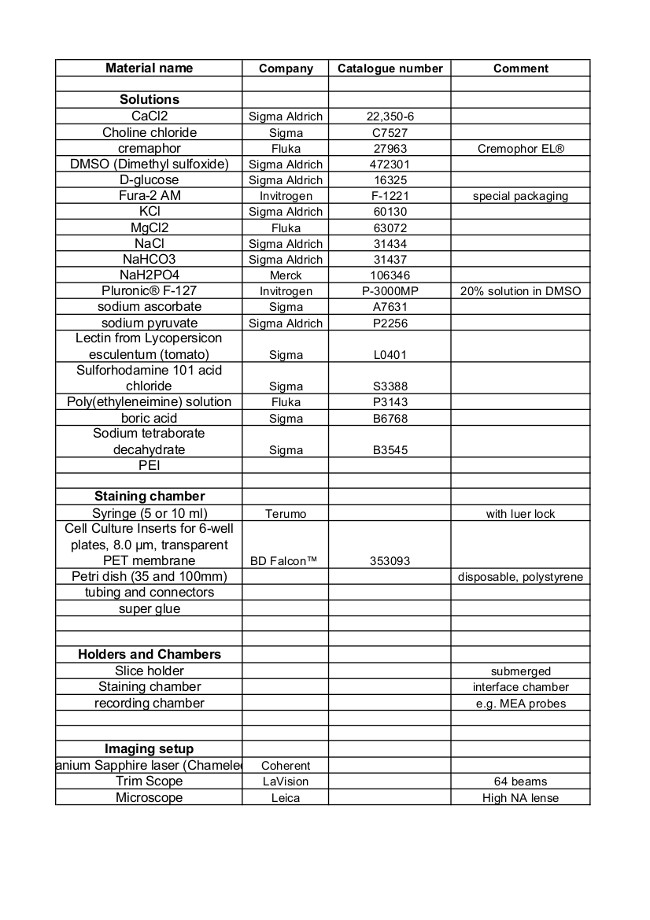
Materiales
Referencias
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados