Method Article
Imagem de cálcio funcional em desenvolvimento de redes Cortical
Neste Artigo
Resumo
Atividade espontânea de desenvolvimento de redes neuronais podem ser medidos utilizando-AM éster formas de corantes de cálcio sensível indicador. Alterações de cálcio intracelular, o que indica a ativação neuronal, são detectados como alterações transitórias na fluorescência indicador com um ou dois fótons de imagem. Este protocolo pode ser adaptada para uma série de developmentally dependentes de redes neuronais In vitro.
Resumo
Um padrão de marca da atividade no desenvolvimento de sistemas nervosos é espontânea, a atividade de rede sincronizados. Atividade sincronizada tem sido observada em intactas da medula espinhal, tronco cerebral, retina córtex, e dissociado preparações cultura neuronal. Durante os períodos de atividade espontânea, os neurônios despolarizar a tiro simples ou rajadas de potenciais de ação, ativando canais iônicos muitos. Despolarização ativa dos canais de cálcio sobre os dendritos e espinhas que medeiam influxo de cálcio. Altamente sincronizada atividade elétrica foi medida a partir de redes locais neuronal utilizando eletrodos de campo. Esta técnica permite altas taxas de amostragem temporal, mas de baixa resolução espacial, devido à gestão integrada de leitura dos neurônios múltiplos em um eletrodo. Resolução única célula de atividade neuronal é possível usando patch-clamp eletrofisiologia em neurônios individuais para medir a atividade de queima. No entanto, a capacidade de medir a partir de uma rede é limitado ao número de neurônios remendado simultaneously e, normalmente, é apenas um ou dois neurônios. O uso de cálcio-dependente corantes fluorescentes indicador permitiu a medição da atividade sincronizada através de uma rede de células. Esta técnica dá tanto de alta resolução espacial e amostragem temporal suficiente para gravar a atividade espontânea da rede em desenvolvimento.
Uma característica fundamental do recém-formando redes corticais e do hipocampo durante o pré-e no início de desenvolvimento pós-natal é espontânea, a atividade neuronal sincronizado (Katz & Shatz, 1996; Khaziphov & Luhmann, 2006). Esta atividade de rede correlacionados acredita-se ser essencial para a geração de circuitos funcionais no sistema nervoso em desenvolvimento (Spitzer, 2006). Em ambos os primatas e roedores do cérebro, no início elétrica e ondas rede de cálcio são observados no pré e pós-natal in vivo e in vitro (Adelsberger et al, 2005;. Garaschuk et al, 2000;.. Lamblin et al, 1999). Estes primeiros padrões de atividade, que são conhecidos para controlar váriosprocessos de desenvolvimento, incluindo a diferenciação neuronal sinaptogênese e plasticidade (Rakic & Komuro, 1995;. Spitzer et al, 2004) são de importância fundamental para o correto desenvolvimento e maturação do circuito cortical.
Neste vídeo Jove, demonstramos os métodos utilizados para a atividade espontânea imagem no desenvolvimento de redes cortical. Cálcio indicadores sensíveis, tais como Fura 2-AM difusa éster através da membrana celular onde a atividade intracelular esterase cliva a AM ésteres de deixar a forma de células-impermeant de corante indicador. A forma impermeant do indicador possui grupos ácido carboxílico que são capazes de detectar e, em seguida, ligar íons de cálcio intracelular .. A fluorescência do corante de cálcio-sensível é transitoriamente alterada ao se ligar ao cálcio. Técnicas de imagem única ou multi-fotão são usados para medir a mudança de fótons sendo emitidos a partir do corante, e, portanto, indicam uma alteração no cálcio intracelular. Além disso, esses d-cálcioependent indicadores podem ser combinados com outros marcadores fluorescentes para investigar tipos de células dentro da rede ativa.
Protocolo
1. Fazendo horizontal fatias entorrinal-hipocampal do cérebro
Fatias entorrinal-hipocampal do cérebro são feitas usando guias anatômicos, detalhados em um panorama 3D da região de acordo com Canto, Wouterlood & Witter (2008) ID plasticidade neural 381.243 9.
- Faça 500ml de solução fatia, oxigenar com carbogênio de gás (95% de oxigênio, dióxido de carbono 5%) para pelo menos 20 minutos e depois congelar até 250ml gelada. Minutos antes de cortar, esmagar e misturar o gelo fatia com a solução fatia restante 250ml borbulhante a ser utilizado para dissecção e para o corte na câmara de corte.
- Faça 200ml de r-ACSF (recuperação ACSF) e pelo menos 500ml de e-ACSF (experimental ACSF) solução. Continuamente oxigenar ambas as soluções com carbogênio de gás (95% de oxigênio, dióxido de carbono 5%) para pelo menos 20 minutos antes da preparação do tecido.
- Este protocolo é válido para ratos desde o primeiro dia pós-natal 0 até um máximo de 3 semanas de idade. Decapitar o animal, de acordo com procedimentos legais de comitê de ética, e dissecar o cérebro rapidamente em uma placa de Petri contendo solução gelada fatia preparada na Etapa 1, acima (ver Tabela 1 para soluções e reagentes).
- Transferência do cérebro em um papel de filtro embebido com solução de cortar e separar os dois hemisférios com uma lâmina afiada. Transferência de um hemisfério de volta gelada solução fatia.
- Remova o cerebelo do outro hemisfério. Virar o cérebro em sua linha média e cortar a parte superior do cérebro com um ligeiro ângulo para o final rostral.
- Virar o cérebro para o corte (dorsal) de superfície e cola-lo no suporte de tecido do slicer de cabeça para baixo empurrando levemente com um cotonete.
- Slice 300 mm de espessura fatias de cérebro usando uma baixa frequência e velocidade nos restantes gelada solução fatia feita na Etapa 1. Nas nossas condições, nós usamos um Thermo Fisher Scientific vibratome (Microm, HM 650V) em configurações de 0,05 mm / s e 36 Hz.
- ComoAssim que uma fatia é cortada, transferi-lo em um suporte fatia (submersa) contendo oxigenados Artificial líquor (ACSF) (2.5mm Mg 2 +, Ca 2 + 1,6 mm, ver Tabela 2) à temperatura ambiente. A maior concentração de magnésio em r-ACSF reduz o influxo de cálcio em neurônios via receptores NMDA após corte e em nossa experiência, leva a uma melhor qualidade de fatias de experimentos. Se necessário, corte o hemisfério cerebral segundo depois.
- Deixe as fatias de uma hora para se recuperar.
| Solução fatia (em mM) - 10 | |
| 110 | cloreto de colina |
| 25 | NaHCO 3 |
| 11,6 | 11,6 |
| 10 | D-glucose |
| 7 | MgCl 2 |
| 3,1 | sodiumpyruvate |
| 2,5 | KCl |
| 1,25 | NaH 2 PO 4 |
| 0,5 | CaCl 2 |
Tabela 1. Receita para solução fatia.
| ACSF (em mM) | |
| 125 | NaCl |
| 26 | NaHCO 3 |
| 10 | D-glucose |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (experimento de recuperação /) |
| 1,6 | CaCl 2 |
| 1,25 | NaH 2 PO 4 |
Tabela 2. Receita para tanto a recuperação (r-ACSF) e solução experimental (e-ACSF).
2. Preparação do ch coloraçãoâmbar
Para carregar as células com o indicador de cálcio-dependente ou célula específica marcador, fatias precisam ser transferidos para uma câmara para o procedimento de coloração. Embora as câmaras comerciais podem estar disponíveis, um pode ser facilmente montado a partir de equipamentos de laboratório padrão por muito pouco custo. As principais características de tal câmara são de que as fatias são aquecidos para entre 30 e 35 ° C, incubadas em um meio continuamente oxigenada e que a câmara está protegido contra a luz.
- Usando uma vara aquecida, faça um pequeno furo na parede lateral de duas placas de Petri descartáveis de poliestireno (35 e 100mm de diâmetro) que é apenas grande o suficiente para permitir uma seção de tubo flexível de silicone (cerca de 1,5 milímetro de diâmetro) para passar.
- Tubo de rosca o silício através do furo na placa de Petri pequenas e formar um laço dentro da parede interna do prato pequeno.
- Use supercola para vedar a extremidade aberta do tubo e ficar o resto do tubo à parede interna da placa de Petri.
- Usando uma agulha, faça furos bem em intervalos uniformemente espaçados na tubulação dentro da placa de Petri interior.
- Cole a menor placa de Petri dentro do maior, com ambos os buracos alinhados. Passe a outra extremidade do tubo flexível de silicone através do buraco na parede da placa de Petri maiores.
- Para o prato interface, tomar uma cultura de células inserir bem com membrana semi-permeável e usando um bisturi aquecido, corte a um centímetro de distância top para deixar um prato raso para manter as fatias durante a incubação.
- Na tampa da placa de Petri maiores, fazer uma cerca buraco. 0.5-1 centímetro de diâmetro para permitir carbogênio (95% O 2, 5% de CO 2) para o fluxo para a câmara.
- Dê uma 5 ou 10ml seringa de plástico. Usando um bisturi aquecido, faça um corte em ângulo para remover a extremidade da seringa e manter um comprimento de alguns poucos centímetros do tubo de seringa com a ponta. Usando super cola, prenda a superfície de corte do tubo de seringa para a tampa placa de Petri, sobre o buraco de 0,5 um centímetro de diâmetro.
- Anexar tubo flexível de silicone e emubing conector para a ponta da seringa. Anexar outro conector da tubulação para o tubo de silicone de entrar na base da placas de Petri.
- Conectar até dois tubos de um órgão regulador para carbogênio (95% O 2, 5% CO 2) de abastecimento. Coloque a câmara de coloração em uma chapa quente para incubação entre 30-35 ° C. Assegurar a câmara pode ser protegido contra a luz durante o processo de incubação inteiro. A câmara de coloração está agora pronto para montar e usar para a incubação fatia.
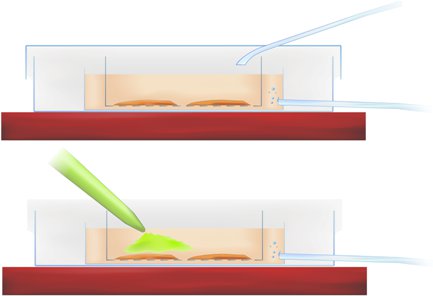
Metodologia Figura 1. Corte transversal da câmara de coloração mostrando fatia de incubação (acima) e aplicação de cálcio sensível indicador (pipetado verde corante, abaixo).
3. Coloração das fatias
Ao longo de qualquer manipulação que envolvem corantes fluorescentes, evite fotobranqueamento trabalhando com pouca luz e manter o corante e tele manchada tecido no escuro entre a manipulação.
- Coloque a câmara de coloração em uma placa de calor (35 ° C), conectá-lo a uma fonte de gás carbogênio e preenchê-lo com cerca de 1,5 ml r-ACSF do titular fatia.
- Coloque o prato de interface na câmara de coloração e preenchê-lo com 1ml ACSF.
- Garantir um fornecimento carbogênio boa na câmara de coloração para manter a borbulhar ACSF um ritmo suave estável.
- Adicionar 9 DMSO mL e 1 mL de ácido PLURONIC (20% em DMSO solução estoque, Invitrogen) em um frasco de 50 mg Fura 2-AM. Vortex a mistura de corante por 15 minutos.
- Transferir as fatias no prato de interface e pipetar o corante para o r-ACSF diretamente sobre a região do córtex entorrinal e do hipocampo de interesse, como indicado na figura Metodologia 1 (acima), obtendo uma concentração final de corante de 50mm.
- Feche a tampa da câmara de coloração e incubar a tintura de 20-40 minutos, dependendo da idade do animal (ver Tabela 3).
- Transfer as fatias de volta no suporte fatia.
| Idade (dias pós-natal) | Tempo de incubação (min) |
| 20 | |
| p8-p9 | 25 |
| p10-p11 | 30 |
| p12-13 | 35 |
| > P13 | 40 |
Tabela 3. Os tempos de incubação para diferentes idades, empiricamente determinada em laboratório.
4. Corantes e outros mais velhos de tecido
Talvez devido ao aumento da mielinização no tecido cerebral, fatias de roedores mais velhos não ocupam Fura 2-AM ester que facilmente. Para facilitar a absorção deste corante uma etapa pré-incubação usando Cremophor EL (Sigma) é usado para cérebros de ratos em P13 e mais velho 11. Cremophor é um tensoativo não-iônico utilizado como excipiente farmacêutico, em muitosaplicações al. Sem este passo, descobrimos que células específicas de rotulagem é extremamente pobre e uniforme em toda a fatia cortical.
- Transferência de fatias de idade em um prato raso cheio de pré-incubação de 3 ml r-ACSF e 8 mL Cremophor 0,5% (Sigma) aquecido a 35 ° C por 3 minutos.
- Transferir as fatias no prato de interface e siga o procedimento de coloração normal (Passos 4-7, veja acima).
Corantes de cálcio carregar tanto os neurônios e não neurônios na preparação fatia. Para identificar e distinguir entre estes tipos celulares dentro da rede, sulforhodamine 101 (SR101) pode ser usado para astrócitos rótulo dentro da fatia.
Coloração das fatias para sulforhodamine 101
Siga os passos 1-3 como antes (seção 3).
Tome 1 ml de solução estoque de 10 mM sulforhodamine (Sigma) a partir de seu armazenamento a -20 ° C e dissolver em 999 mL r-ACSF para dar uma solução a 10 mM. Pipetar o roxo corante over as fatias como antes (passos 5-7), deixando as fatias de incubação por um período de 15 minutos.
Microglia e células endoteliais são rotulados com corante FITC lectina de tomate
Siga os passos 1-3 como antes.
Tomar 25 mL de 2mg/ml Lycopersicon esculentum (tomate) lectina conjugado FITC (L0401, Sigma) em solução estoque 2,5 ml r-ACSF dar 20 concentração mg / ml. Pipetar o corante sobre as fatias como antes (passos 5-7), deixando as fatias de incubação por um período de 45 minutos.
Note, não é possível combinar o corante com um indicador de cálcio-sensíveis como Fura 2-AM ou Oregon Verde BAPTA-1 (OGB-1) que apresentam fluorescência na faixa verde do espectro desde os fótons de ambos os corantes serão emitidos em comprimentos de onda sobrepostas. No entanto, existem outras cálcio indicador de corantes como cálcio laranja, Fura Red que pode ser usado em combinação com filtros adequados ou conjugados Texas-Red lectina de combinar inteligênciah cálcio indicador de corantes no espectro verde.
5. Colocar as fatias para a câmara de gravação
Fatias durante o exame precisa ser estável sob o microscópio. Normalmente, uma harpa de metal é colocada para segurar o tecido, mas pode distorcer de forma desigual a superfície da fatia, dando apenas uma parte do campo de visão para a imagem em foco. Para evitar isso, as fatias estão presos à câmara de gravação usando Polyethylenimine (PEI).
- Prepare a solução PEI (1 ml solução Polietilenoimina em tampão bórico 250ml (tabela 4)). Verifique se o PEI se dissolva completamente (agitar durante a noite).
- Preencha as câmaras de gravação com a solução de PEI para que o fundo é coberto com o fluido pelo menos uma hora antes que você deseja aplicar as fatias
- Lavar as câmaras de gravação com água destilada e depois com r-ACSF da câmara de holding.
- Transferência de uma fatia em uma câmara de gravação.
- Remover o r-ACSF com uma pipeta e posição do slgelo no meio, utilizando uma escova.
- Remover o r-ACSF todo o slice usando pedaços de filterpaper. Para a estabilidade e aderência, é importante que não há ACSF volta a fatia mais.
- Pipeta de aproximadamente 0,5-1ml ACSF, dependendo do tamanho da câmara de gravação, para o slice. ACSF deve apenas cobrir a superfície da fatia.
- Coloque a câmara de gravação com a fatia em um recipiente grande interface umidificado, perfundidos com carbogênio, e deixe as fatias de recuperar pelo menos uma hora.
| PEI solução | |
| 1ml | Poly solução (etilenoimina) |
| em tampão bórico 250ml | |
| 40mm | ácido bórico |
| 10mM | tetraborato de sódio |
Tabela 4. Recipe solução PEI.
6. Imenvelhecimento
Corantes cálcio-dependente indicador pode ser fotografada usando um ou dois fótons de microscopia. Uso de dois fótons de imagem só ativa corante indicador dentro do volume focal da região de interesse, reduzindo assim a quantidade de dispersão de luz no tecido. Além disso, ela permite uma melhor penetração profundidade da luz para o slice.
Para geração de imagens funcionais de cálcio, usamos um laser de titânio safira fornecidos pela aliada coerente a um microscópio Olympus com um objetivo 20x (NA 0,95) e um sistema de Trimscope por LaVision Biotec. O sistema permite Trimscope quadro de varredura com 64 beamlets simultaneamente e é acoplado a um Hamamatsu C9100 câmera EM-CCD para um rápido quadro de varredura de taxas.
- Posição da câmara de gravação sob o microscópio e estabelecer uma perfusão estável com imagem e-ACSF (1,6 Ca 2 + / 1,5 Mg 2 + relação (tabela 2)) aquecido a uma temperatura mais fisiológica mínima de 30 ° C.
- Foc-nos para a região de interesse (ROI) com uma iluminação de luz branca. Evite expor a fatia à luz mais do que o necessário.
- Escolher o comprimento de onda, campo de imagem de vista, a freqüência de varredura, densidade de pixels e opções de software adicionais aplicáveis para os sinais dos tecidos biológicos e que pretende medir. Para geração de imagens de cálcio rede com Fura 2-AM que normalmente escolher um comprimento de onda de 820nm, um campo de imagem 250x250 mM de vista, uma freqüência de 1200Hz linescanning e 2-por-2 binning. Isso resulta em uma frametime de cerca de 100ms e, assim, uma freqüência de imagem de cerca de 10Hz.
- Verifique se o seu ROI está em foco usando um modo de varredura contínua e comprimento de onda selecionado de Laserlight. Ajustar o foco e intensidade do laser para evitar a saturação de pixel e branqueamento de sua imagem.
- Fazer um filme timelapse de seu ROI. Normalmente, adquirir dois filmes timelapse de 2000 frames cada.
- Para a detecção e identificação de células, tomar um z-stack usando um stepsize de 1 mm e imag e + / 20 mM em torno de seu plano com imagens de foco.
7. Resultados representativos
Carregamento de sucesso dos indicadores de cálcio, Fura 2-AM são mostrados na Figura 1 no desenvolvimento de redes córtex entorrinal neocortical e usando imagens multifotônica. Alguns corantes ainda está presente como coloração de fundo na soma de tecido, mas celulares e em alguns casos, dendritos proximais são claramente visíveis e separado em torno neuropil. Se o carregamento não foi bem sucedida, muito pouco coloração celular específica é observada e pequenos aglomerados de manchas de corante são frequentemente visíveis na superfície da membrana fatia em restos mortos.
Nessas imagens, a rede de células é claramente visível em um único plano de foco para imagens de células simultâneas. Uso de uma harpa de metal ou furando incompleta da fatia para a câmara de gravação pode resultar em uma superfície irregular fatia a ser trabalhada.
550fig1.jpg "alt =" Figura 1 "/>
Figura 1. Fura 2-AM ester-carregados desenvolvimento neocortical (A, à esquerda) e entorrinal (B, à direita) redes. Bares Escala 100 mm.
Para separar os neurônios de astrócitos, co-aplicação de sulforhodamine 101 com Fura 2-AM ester permite a separação de tipos de células dentro da rede.
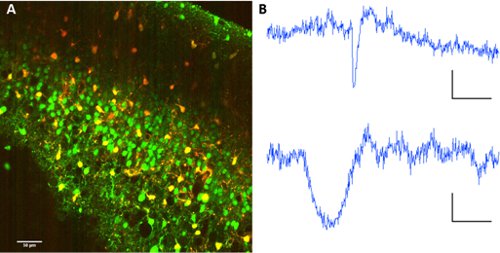
Figura 2. Rotulagem de astrócitos com sulforhodamine 101. A Co-rotulagem de Fura 2-AM éster e sulforhodamine 101. Comprimento de onda de excitação: 820nm. Coleção de imagens sobre PMTs com espelho dicróico em 560/70nm para a separação de comprimento de onda. B traços Representante de fluorescência de um neurônio (acima) e um astrócitos (abaixo). Escala de barras 60 seg, ΔF 10 (au fluo).
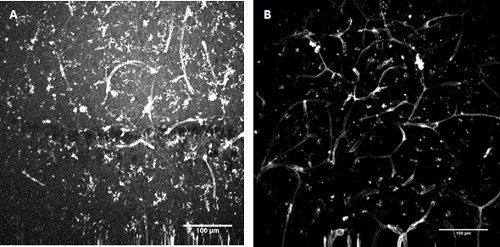
Figura 3. FITC-conjugado Lycopersicon esculentum coloração lectina (tomate) . Rotulagem de microglia e células endoteliais no desenvolvimento do hipocampo do rato (A) e superficial córtex entorrinal (B).
Corantes indicador de cálcio são usados para leitura a atividade de várias células simultaneamente no desenvolvimento de redes cortical e hipocampal.
Figura 4. Dinâmicas transientes de cálcio em redes hipocampal e cortical.
Movie 1: Fura 2-AM loading éster do mouse córtex entorrinal durante a semana pós-natal segundo.
Clique aqui para ver filme 1.
Filme 2: Fura 2-AM loading éster do hipocampo do rato durante a primeira semana pós-natal.
Clique aqui para ver filme 2.
Filme 3: Fluo-4 carregamento de rato córtex, durante a primeira semana pós-natal.
50movie3.avi "> Clique aqui para assistir filme 3.
No caso do Fura 2-AM éster de ativação das células, envolvendo um fluxo despolarização induzida de cálcio, diminui a fluorescência de corantes. Para corantes como Fluo-4, o oposto é verdadeiro e despolarização celular é observado como um aumento das emissões de fótons. Transientes de cálcio somáticas são principalmente medidos mas a atividade em maior dendrites proximal também pode ser visto em algumas preparações, como mostrado no filme 2.
Leia-out de atividade de rede podem ser quantificados utilizando scripts software comercial ou in-house. Em nosso laboratório de identificação de células e atividade de rede é medido e analisado de uma forma semi-automatizada utilizando in-house código para Matlab (Mathworks).
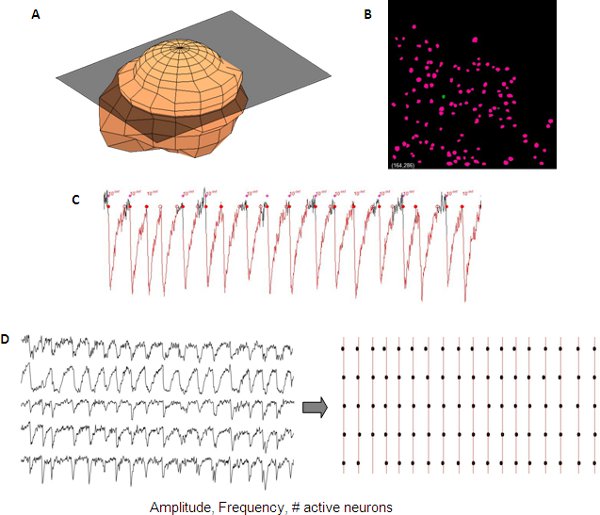
Figura 5. Análise representativa de transientes de cálcio sincronizados a partir de uma rede de desenvolvimento cortical. Representação 3D de um neurônio ( A) utilizado para criar automaticamente uma máscara de neurônio (B) a partir de um z-stack para detecção neurônio automatizado. Medidas de transientes de cálcio incluem amplitude, a freqüência ea quantidade de células ativas que podem ser lidos a partir de dados único neurônio (C). Sincronia entre diferentes traços podem ser visualizadas através de um enredo raster (D).
Discussão
Os métodos que demonstrar aqui mostrar protocolos adequados para a imagem latente de cálcio da dinâmica de rede a partir de células identificáveis dentro desenvolvimento de redes corticais e do hipocampo em ratos e também no cérebro de ratos. Estes métodos oferecem resolução espacial ideal para visualizar uma rede local de somas de células simultaneamente para medir a atividade suprathreshold. Resolução temporal de atividade de rede pode ser variado, dependendo da estrutura de aquisição configurações da câmera CCD, para otimizar o sinal: medições de ruído para provas de longa duração suprathreshold, normalmente encontrados no sistema nervoso em desenvolvimento. Esses protocolos não estão restritos a redes de hipocampo e cortical, mas também células rótulo em todo o sistema nervoso em desenvolvimento. A limitação desse método é que a atividade suprathreshold só pode ser gravado.
Divulgações
LaVision Biotec GmbH (Bielefeld, Alemanha) patrocinou as taxas de envio deste artigo manuscrito.
Agradecimentos
Trabalho no laboratório é apoiado pela Nederlandse Organisatie voor Wetenschappelijk Onderzoek (NWO) (917.10.372) a RMM. JD é filiada à FP7 UE BrainTrain programa ( www.brain-train.nl ). Agradecemos a Pieter Laurens-Baljon e Sabine Schmitz (ambos CNCR, VU University Amsterdam) para imagens de multieletrodo FP disposição formas de onda e culturas neuronais usados na seqüência de vídeo.
Materiais
Referências
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados