Method Article
Функциональной визуализации кальция в развивающихся Корковая сетей
В этой статье
Резюме
Спонтанная активность развивающихся нейронных сетей может быть измерена с помощью AM-эфир форм кальция чувствительных красителей индикатора. Изменения внутриклеточного кальция, что указывает на нейронную активацию, определяются как временные изменения в индикаторе флуоресценции с одно-или двух-фотонной обработки изображений. Этот протокол может быть адаптирован для различных развивающих-зависимых нейронных сетей В пробирке.
Аннотация
A hallmark pattern of activity in developing nervous systems is spontaneous, synchronized network activity. Synchronized activity has been observed in intact spinal cord, brainstem, retina, cortex and dissociated neuronal culture preparations. During periods of spontaneous activity, neurons depolarize to fire single or bursts of action potentials, activating many ion channels. Depolarization activates voltage-gated calcium channels on dendrites and spines that mediate calcium influx. Highly synchronized electrical activity has been measured from local neuronal networks using field electrodes. This technique enables high temporal sampling rates but lower spatial resolution due to integrated read-out of multiple neurons at one electrode. Single cell resolution of neuronal activity is possible using patch-clamp electrophysiology on single neurons to measure firing activity. However, the ability to measure from a network is limited to the number of neurons patched simultaneously, and typically is only one or two neurons. The use of calcium-dependent fluorescent indicator dyes has enabled the measurement of synchronized activity across a network of cells. This technique gives both high spatial resolution and sufficient temporal sampling to record spontaneous activity of the developing network.
A key feature of newly-forming cortical and hippocampal networks during pre- and early postnatal development is spontaneous, synchronized neuronal activity (Katz & Shatz, 1996; Khaziphov & Luhmann, 2006). This correlated network activity is believed to be essential for the generation of functional circuits in the developing nervous system (Spitzer, 2006). In both primate and rodent brain, early electrical and calcium network waves are observed pre- and postnatally in vivo and in vitro (Adelsberger et al., 2005; Garaschuk et al., 2000; Lamblin et al., 1999). These early activity patterns, which are known to control several developmental processes including neuronal differentiation, synaptogenesis and plasticity (Rakic & Komuro, 1995; Spitzer et al., 2004) are of critical importance for the correct development and maturation of the cortical circuitry.
In this JoVE video, we demonstrate the methods used to image spontaneous activity in developing cortical networks. Calcium-sensitive indicators, such as Fura 2-AM ester diffuse across the cell membrane where intracellular esterase activity cleaves the AM esters to leave the cell-impermeant form of indicator dye. The impermeant form of indicator has carboxylic acid groups which are able to then detect and bind calcium ions intracellularly.. The fluorescence of the calcium-sensitive dye is transiently altered upon binding to calcium. Single or multi-photon imaging techniques are used to measure the change in photons being emitted from the dye, and thus indicate an alteration in intracellular calcium. Furthermore, these calcium-dependent indicators can be combined with other fluorescent markers to investigate cell types within the active network.
протокол
1. Создание горизонтальной энторинальной-срезах гиппокампа мозга
Энторинальной-срезах гиппокампа головного мозга с использованием анатомических справочников, подробно изложены в 3D-обзор региона в соответствии с Canto, Wouterlood и Виттер (2008) нейронной пластичности ID 381243 9.
- Сделать 500 мл ломтик решение, с кислородом карбогена газа (95% кислорода, 5% углекислого газа), по крайней мере 20 минут, а затем заморозить до 250 мл ледяной. За несколько минут до нарезки, раздавить и смешать ломтик льда с оставшимися 250 мл раствор срез восходящей, которые будут использоваться для вскрытия и для резки в нарезки камеры.
- Сделать 200 мл р-ACSF (восстановление ACSF) и не менее 500 мл электронной ACSF (экспериментальная ACSF) решение. Постоянно кислородом обоих растворах с карбогена газа (95% кислорода, 5% углекислого газа), по крайней мере за 20 минут до подготовки ткани.
- Этот протокол действителен для мышей от послеродовой день 0 до максимум 3 недель. Обезглавьте анимал, в соответствии с местными этические процедуры комитета, а рассекать из мозга быстро в чашке Петри содержащие ледяной решение ломтик подготовленной на шаге 1, выше (см. Таблицу 1 для решений и реагентов).
- Передача мозга на фильтровальной бумаге пропитанной часть решения и разделения двух полушарий с острым лезвием бритвы. Передача одного полушария обратно в ледяную решение срез.
- Удаление мозжечка другом полушарии. Флип мозга на его средней линии и отрезали верхнюю часть мозга с небольшим углом к ростральной конца.
- Флип мозга на срез (спинной) поверхности и приклеить ее на ткань держателя слайсер с ног на голову, слегка отталкиваясь ватным тампоном.
- Фрагмент 300 мкм, толстые ломтики мозга с помощью низкой частоты и скорости в остальных ледяной решение ломтик сделали в шаге 1. В наших условиях, мы используем Thermo Fisher Scientific vibratome (Microm, ТМ 650V) в настройках 0,05 мм / с и 36Hz.
- Кактолько срез вырезать, перевести его в часть держателя (погруженной), содержащих окисленные Искусственный Cerebro спинномозговой жидкости (ACSF) (2,5 Mg 2 +, 1,6 мм Са 2 +, см. таблицу 2) при комнатной температуре. Выше концентрация магния в г-ACSF уменьшает приток кальция в нейроны через NMDA рецепторы следующие нарезки и по нашему опыту, приводит к улучшению качества ломтиками для экспериментов. При необходимости, сократить второй полушарие головного мозга впоследствии.
- Оставьте ломтики в течение одного часа, чтобы оправиться.
| Фрагмент решения (в мм) - 10 | |
| 110 | холина хлорид |
| 25 | NaHCO 3 |
| 11,6 | 11,6 |
| 10 | D-глюкозы |
| 7 | MgCl 2 |
| 3,1 | sodiumpyruvate |
| 2,5 | KCl |
| 1,25 | NaH 2 PO 4 |
| 0,5 | CaCl 2 |
Таблица 1. Рецепт для среза решение.
| ACSF (в мм) | |
| 125 | NaCl |
| 26 | NaHCO 3 |
| 10 | D-глюкозы |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (восстановление / эксперимента) |
| 1,6 | CaCl 2 |
| 1,25 | NaH 2 PO 4 |
Таблица 2. Рецепт для восстановления (г-ACSF) и экспериментальные (электронная ACSF) решение.
2. Подготовка окрашивания чянтарь
Для загрузки клеток с кальций-зависимых индикаторов или клеточно-специфическим маркером, ломтики должны быть переданы в камеру для окрашивания процедуры. Хотя коммерческие палаты могут быть доступны, можно легко собрать из стандартного лабораторного оборудования для очень низкой цене. Основные характеристики такой камеры является то, что ломтики нагревают до от 30 до 35 ° C, инкубировали в непрерывно кислородом среде и камера защищена от воздействия света.
- Использование нагревается стержень, сделайте небольшое отверстие в боковой стенке два одноразовых чашках Петри полистирола (35 и 100 мм в диаметре), который достаточно велик, чтобы позволить разделе кремния трубы (диаметром около 1,5 мм), чтобы пройти.
- Тема кремния трубки через отверстие в небольшой чашке Петри и образуют замкнутый контур внутри внутренней стенке небольшое блюдо.
- Используйте суперклей для герметизации открытого конца трубы и придерживаться остальные трубы к внутренней стенке чашки Петри.
- Использование иглы, сделать тонкую отверстия в равномерно расположенных интервалов в трубы во внутренних чашке Петри.
- Клей меньше чашки Петри в большую, как с отверстиями выровнены. Тема другом конце трубки кремния через отверстие в стене большую чашку Петри.
- Для интерфейса блюдо, возьмите культуре клеток вставить хорошо с полупроницаемую мембрану и с помощью нагретого скальпеля, вырезать верхнюю 1см прочь покинуть мелкое блюдо провести ломтики во время инкубации.
- На крышке большие чашки Петри, сделать отверстие ок. 0,5-1см диаметром, чтобы обеспечить карбогена (95% O 2, 5% СО 2) течь в камеру.
- Возьмите 5 или 10 мл пластиковый шприц. Использование подогревом скальпель, чтобы вырезать угловые, чтобы удалить конце шприца и держать несколько см в длину шприца трубку с наконечником. Использование суперклей, приложите сократить поверхность шприца трубки к крышке чашки Петри, на 0,5-1см диаметром отверстия.
- Прикрепите трубку кремния и наubing разъем для наконечника шприца. Присоединить другой трубки разъем для кремния трубки ввода базы чашках Петри.
- Подключите обе трубки на регулятор для карбогена (95% O 2, 5% СО 2) предложения. Место окрашивания камеры на горячей плите для инкубации между 30-35 ° C. Обеспечить камеры могут быть защищены от света в течение всего процесса инкубации. Окрашивание камере готов собрать и использовать для среза инкубации.
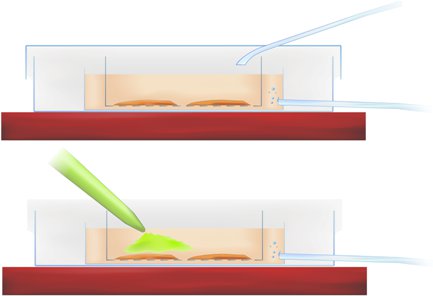
Методология рисунке 1. Поперечное сечение окрашивания камеры показывает срез инкубации (см. выше) и применение кальций-чувствительный индикатор (пипеткой зеленого красителя, ниже).
3. Окрашивание срезов
На протяжении любой обработке с участием флуоресцентные красители, избегать фотообесцвечивания, работая с мало света и держать краски и тон окрашивали ткань в темной между обработкой.
- Положите окрашивания камеры на пластинчатый теплообменник (35 ° С), подключите его к газоснабжения карбогена и залейте его около 1,5 мл р-ACSF с ломтиком держателя.
- Место интерфейс блюдо в камере окрашивания и залейте его 1 мл ACSF.
- Обеспечить хороший запас карбогена в камере окрашивания держать пузырящийся ACSF на нежной, постоянной скоростью.
- Добавить 9 мкл ДМСО и 1 мкл кислоты плуроник (20% в растворе ДМСО акций, Invitrogen) в пузырек с 50 мкг Фура 2-AM. Vortex красителя смесь на 15 минут.
- Передача срезы в интерфейсе блюдо и пипетки красителя в г-ACSF прямо над гиппокампа и коры энторинальной интересующей нас области, как указано в методологии рисунке 1 (см. выше), достижение окончательной концентрации красителя 50 мм.
- Закройте крышку камеры окраски и инкубировать красителя в течение 20 - 40 минут в зависимости от возраста животного (см. таблицу 3).
- Трансфер ломтиками обратно в часть держателя.
| Возраст (послеродовых дней) | Время инкубации (мин) |
| 20 | |
| P8-p9 | 25 |
| p10-p11 | 30 |
| p12-13 | 35 |
| > P13 | 40 |
Таблица 3. Инкубационный время для разных возрастов, эмпирически определяется в лаборатории.
4. Другие красители и старше ткани
Возможно, из-за увеличения миелинизации в мозговой ткани, кусочки от старых грызунов, не занимают Фура 2-AM, что эфир легко. Для облегчения поглощения этого красителя предварительной инкубации шаг, используя кремофор EL (Sigma) используется для мозге мышей на P13 и старше 11. Кремофор является неионных сурфактант, используемый в качестве наполнителя во многих фармацевтическихдр. применений. Без этого шага, мы обнаружили, что клетка конкретных маркировка крайне бедных и непоследовательной всей коры срез.
- Передача старые срезы в мелкое блюдо предварительной инкубации заполнены 3 мл р-ACSF и 8 мкл 0,5% Кремофор (Sigma) нагревается до 35 ° С в течение 3 минут.
- Передача срезы в интерфейсе блюдо и следовать обычной процедуре окрашивания (шаги 4-7, см. выше).
Кальций красителей нагрузки обоих нейронов и не-нейронов в срезе подготовки. Чтобы определить и различить эти типы клеток внутри сети, sulforhodamine 101 (SR101) может быть использован для обозначения астроциты в срез.
Окрашивание срезов для sulforhodamine 101
Выполните действия 1-3, как раньше (раздел 3).
Принимать по 1 мкл 10 мМ раствор запас sulforhodamine (Sigma) от его хранения при температуре -20 ° С и растворяют в 999 мкл т-ACSF дать 10 мкМ раствора. Внесите пурпурный краситель овэ ломтики как и раньше (шаги 5-7), в результате чего ломтики инкубации в течение 15 минут.
Микроглии и эндотелиальные клетки помечены использованием красителя FITC лектин помидор
Выполните действия 1-3, как раньше.
Возьмите по 25 мкл 2mg/ml Lycopersicon esculentum (томат) лектин FITC сопряжены (L0401, Sigma) маточного раствора в 2,5 мл р-ACSF дать 20 мкг / мл. Внесите красителя на ломтики как и раньше (шаги 5-7), в результате чего ломтики инкубации в течение 45 минут.
Обратите внимание, что невозможно совместить этот краситель с кальций-чувствительный индикатор Фура, как 2-АМ или Орегон Зеленый BAPTA-1 (ОГБ-1), флуоресцируют в зеленой области спектра с фотонами с обеих красители будут выделяться при перекрытии длин волн. Тем не менее, Есть другие кальций-индикатор красители, такие как кальций оранжевый, красный Фура, которые могут использоваться в сочетании с соответствующими фильтрами или Техасе Красной конъюгатов лектин объединить умч кальций-индикатор красителей в зеленом спектре.
5. Прикрепление ломтики с записью камеры
Во время ломтиками изображения должны быть стабильными под микроскопом. Обычно металл арфа находится на нужном ткани, но она может неравномерно искажать поверхность среза, давая лишь часть поля зрения для работы с изображениями в фокусе. Чтобы избежать этого, ломтики привязаны к записи камеры использованием полиэтиленимина (PEI).
- Подготовка решения PEI (1мл полиэтиленимин решение в 250 мл буфера борной (таблица 4)). Убедитесь в том, PEI растворяется полностью (размешать на ночь).
- Заполните записи камер с решением PEI так, чтобы дно покрыто жидкостью по крайней мере за час до вы хотите применить ломтиками
- Вымойте записи камер с дистиллированной водой, а затем с г-ACSF от проведения камере.
- Передача один ломтик в записи камеры.
- Удалить г-ACSF с пипеткой и положение SLльда в середине при помощи кисти.
- Удалить г-ACSF вокруг слайс, используя куски filterpaper. Для стабильности и приверженности, важно, что нет ACSF вокруг среза больше.
- Внесите примерно 0,5-1мл ACSF, в зависимости от размера записи камеры, на срезе. ACSF должна только покрыть срез поверхности.
- Положите записи камеры с нарежьте большими увлажненный контейнер интерфейс, озарен карбогена, и пусть ломтиками восстановить, по крайней мере один час.
| PEI решение | |
| 1 мл | Поли (этиленимина) решение |
| в 250 мл борной буфер | |
| 40 | борная кислота |
| 10 мМ | декагидрат тетрабората натрия |
Таблица 4. Рецепт PEI решение.
6. Imстарение
Кальций-зависимые красителей показатель может быть отображены с помощью либо одно-или двух-фотонной микроскопии. Использование двухфотонного изображений только активирует индикатор красителя в фокальном объеме область интереса, тем самым уменьшая количество света, разброс в ткани. Кроме того, она позволяет лучше глубина проникновения света в срез.
Для функциональной визуализации кальция мы используем титан сапфирового лазера поставляемые Когерентные связан с микроскопом Olympus с 20-кратным цель (NA 0,95) и Trimscope системы LaVision Биотек. Trimscope система позволяет кадровой развертки с 64 beamlets одновременно и в сочетании с Hamamatsu C9100 EM-CCD камера для быстрого сканирования кадра ставок.
- Позиция записи камере под микроскопом и установить стабильные перфузии с изображениями электронной ACSF (1,6 Ca 2 + / 1,5 Mg 2 + коэффициент (таблица 2)) нагревается до температуры более физиологических минимальной 30 ° C.
- Focнас в области интереса (ROI) с помощью белой подсветкой света. Не подвергайте квант света дольше, чем необходимо.
- Выбор длины волны, визуализация поля зрения, частота сканирования, плотность пикселей и дополнительные опции программного обеспечения применяется для тканей и биологических сигналов вы хотите измерить. Для кальция сети изображения с 2-Фура утра мы обычно выбирают длиной волны 820nm, 250x250 мкм визуализации поля зрения, linescanning частотой 1200 Гц и 2-на-2 биннинга. Это приводит к frametime около 100 мс и, следовательно, изображение частотой около 10 Гц.
- Убедитесь, что рентабельность инвестиций в фокусе использовании непрерывного режима сканирования и выбранной длины волны laserlight. Настройка фокуса и интенсивности лазерного излучения, чтобы избежать пикселей насыщения и отбеливания изображения.
- Сделать timelapse фильм рентабельность инвестиций. Как правило, мы приобрести две timelapse фильмов 2000 кадров в каждом.
- Для обнаружения и идентификации ячейки, взять Z-Stack использованием шага от 1 мкм и мнимой е + / 20 мкм вокруг вашего отображаемого плоскости фокуса.
7. Представитель результаты
Успешная загрузка кальция показатели, Фура 2-АМ показаны на рисунке 1 в развитии коры головного мозга и коры энторинальной сетей с использованием многофотонного изображений. Некоторые краска по-прежнему присутствует в качестве фона окрашивания в ткани, но сома клетки и в некоторых случаях, проксимальные дендриты хорошо заметны, и отделен от окружающих нейропиля. Если загрузка не была успешной, очень мало клеточного специфического окрашивания наблюдается и малых кластеров красителя пятна часто видны на срезе поверхности в мертвый мусор мембраны.
В этих скриншотов, сеть ячеек отчетливо видна в одной плоскости фокуса для одновременной визуализации клеток. Использование арфы металла или неполной налипание фрагмент в записи камеры может привести к неровной поверхности среза для включения в образ.
550fig1.jpg "ALT =" Рисунок 1 "/>
Рисунок 1. Фура 2-АМ эфир загружены развивающихся неокортекса (слева) и энторинальной (B, справа) сетей. Шкала баров 100 мкм.
Для отдельных нейронов из астроцитов, совместное применение sulforhodamine 101 с Фура 2-АМ эфир обеспечивает возможность разделения типов клеток в пределах сети.
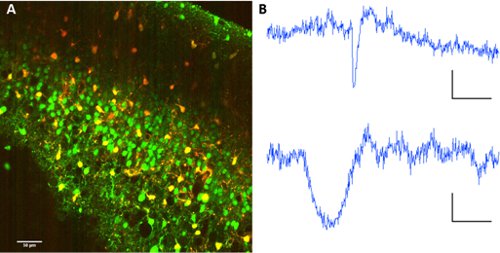
Рисунок 2. Астроцитов маркировки с sulforhodamine 101. Сотрудничество маркировки Фура 2-AM эфира и sulforhodamine 101. Длина волны возбуждения: 820nm. Изображение коллекции ФЭУ зеркальные в 560/70nm для длины волны разделения. B представитель флуоресценции следы от нейрона (вверху) и астроциты (ниже). Шкала баров 60 сек, ΔF 10 (а.е. флуоресценции).
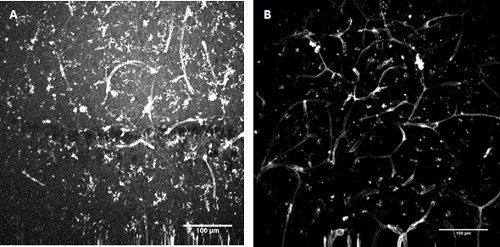
Рисунок 3. FITC-сопряженных Lycopersicon esculentum (томат) лектин окрашивания . Маркировки микроглии и клеток эндотелия в развитии мыши гиппокампа (А) и поверхностные энторинальной коры (B).
Красители кальция индикатор используется для считывания деятельности из нескольких ячеек одновременно в развивающихся коры и гиппокампа сетей.
Рисунок 4. Динамические переходных кальция в гиппокампе и корковых сетей.
Фильм 1: Фура 2-АМ эфир загрузки мыши энторинальной коры во время второго послеродовой недели.
Щелкните здесь для просмотра фильмов 1.
Фильм 2: Фура 2-АМ эфир загрузки мыши гиппокампа в течение первой послеродовой недели.
Щелкните здесь для просмотра фильмов 2.
Фильм 3: Fluo-4 загрузка мыши мозга, во время первой послеродовой недели.
50movie3.avi "> Нажмите сюда, чтобы посмотреть фильм 3.
В случае Фура 2-АМ эфир, активации клеток с участием деполяризации вызванного притоком кальция, уменьшается флуоресценции красителей. Для красители, такие как Fluo-4, наоборот, и клетка деполяризации наблюдается как увеличение выбросов фотонов. Переходных соматических кальция в основном измеряется, но деятельность в более крупных проксимальных дендритов можно видеть в некоторых препаратов, как показано в кино 2.
Считывание сетевой активности может быть определена количественно с использованием коммерческих или в доме скрипты программного обеспечения. В нашей лаборатории, идентификация клеток и сетевую активность измеряется и анализируется в полуавтоматическим способом, используя внутренний код для Matlab (Mathworks).
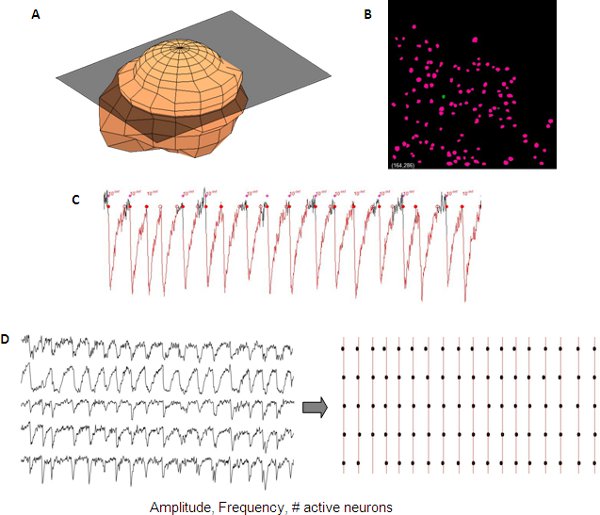
Рисунок 5. Представитель анализа синхронизации переходных кальция из развивающихся корковых сети. 3D изображение одного нейрона ( ), используемые для автоматического создания маски нейрона (В) от Z-Stack для автоматического обнаружения нейрона. Измерения переходных кальция включают амплитуды, частоты и # активных клеток, которые могут быть считаны данные с одного нейрона (С). Синхронность между различными следы могут быть визуализированы использованием растровых сюжет (D).
Обсуждение
Методы, которые мы здесь продемонстрировать шоу подходящей протоколов для кальция визуализации сети динамики от идентифицируемых клеток в развивающихся коры и гиппокампа сетей в мышь, а также в головном мозге крыс. Эти методы обеспечивают оптимальное пространственное разрешение для визуализации локальной сети клеточных РРОС одновременно для измерения сверхпороговой деятельности. Временное разрешение сетевой активности может варьироваться, в зависимости от кадра приобретение ПЗС настройки камеры, чтобы оптимизировать сигнал: шум измерений для длительного сверхпороговой событий, как правило, находится в развивающейся нервной системы. Эти протоколы не ограничены гиппокампа и коры сетей, но и этикетка клеток по всему развивающейся нервной системы. Ограничение этого метода является то, что только деятельность сверхпороговой могут быть записаны.
Раскрытие информации
LaVision Биотек ГмбХ (Билефельд, Германия), спонсором представления сборы этой рукописи статьи.
Благодарности
Работа в лаборатории поддерживается Nederlandse Organisatie Вур Wetenschappelijk Onderzoek (NWO) (917.10.372) для RMM. JD является филиалом Евросоюза FP7 BrainTrain программы ( www.brain-train.nl ). Мы благодарим Питера Laurens-Baljon и Сабина Шмитц (оба CNCR, VU University Amsterdam) для изображений FP многоэлектродной массива сигналов и нейронных культур, используемых в видеоряд.
Материалы
Ссылки
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены