Method Article
Imagerie fonctionnelle en calcium développement des réseaux corticaux
Dans cet article
Résumé
L'activité spontanée de développer des réseaux neuronaux peuvent être mesurées en utilisant AM-ester formes de colorants indicateurs sensibles au calcium. Modifications du calcium intracellulaire, indiquant l'activation neuronale, sont détectés comme des changements transitoires de la fluorescence indicateur avec un ou deux photons d'imagerie. Ce protocole peut être adapté pour une gamme de stade de développement qui dépendent des réseaux neuronaux In vitro.
Résumé
Un motif caractéristique de l'activité dans le développement du système nerveux est spontanée, l'activité du réseau synchronisé. L'activité synchronisée a été observée dans la moelle intacte, le tronc cérébral épinière, la rétine, le cortex et dissocié les préparatifs de la culture neuronale. Pendant les périodes d'activité spontanée, les neurones à dépolariser incendie unique ou salves de potentiels d'action, l'activation des canaux ioniques nombreuses. Dépolarisation active les canaux calciques voltage-dépendants sur les dendrites et les épines qui interviennent dans l'influx de calcium. Hautement synchronisée activité électrique a été mesurée à partir de réseaux neuronaux locaux en utilisant des électrodes sur le terrain. Cette technique permet des taux élevés de l'échantillonnage temporel, mais faible résolution spatiale due à intégrer lecture des neurones multiples en une seule électrode. Résolution cellule unique de l'activité neuronale est possible en utilisant de patch-clamp électrophysiologie sur des neurones de tir unique pour mesurer l'activité. Cependant, la capacité à mesurer à partir d'un réseau est limité au nombre de neurones patché simultaneously, et est généralement seulement un ou deux neurones. L'utilisation de calcium-dépendante colorants indicateurs fluorescents a permis à la mesure de l'activité synchronisée à travers un réseau de cellules. Cette technique donne à la fois haute résolution spatiale et temporelle suffisante d'échantillonnage pour enregistrer l'activité spontanée du réseau de développement.
Une caractéristique clé du nouveau-formant des réseaux corticaux et hippocampiques au cours du développement postnatal de pré-et le début est spontanée, synchronisée activité neuronale (Katz et Shatz, 1996; Khaziphov & Luhmann, 2006). Cette activité de réseau en corrélation est considérée comme essentielle pour la génération de circuits fonctionnels dans le système nerveux en développement (Spitzer, 2006). Dans les deux primates et le cerveau de rongeurs, début électrique et les ondes du réseau de calcium sont observées avant et après la naissance in vivo et in vitro (Adelsberger et al, 2005;. Garaschuk et al, 2000;.. Lamblin et al, 1999). Ces schémas d'activité précoce, qui sont connus pour le contrôle de plusieursprocessus de développement, y compris la différenciation, synaptogenèse et la plasticité neuronale (Rakic & Komuro, 1995;. Spitzer et al, 2004) sont d'une importance critique pour le développement et la maturation correcte des circuits corticaux.
Dans cette vidéo, parbleu, nous démontrons les méthodes utilisées pour l'activité spontanée d'image dans le développement de réseaux corticaux. Calcium indicateurs sensibles, tels que Fura 2-AM diffuse ester travers la membrane cellulaire où l'activité estérase intracellulaire clive le PM esters de quitter le formulaire de cellules imperméants du colorant indicateur. La forme de l'indicateur a imperméants groupes acides carboxyliques qui sont capables de détecter et ensuite lier les ions de calcium intracellulaire .. La fluorescence du colorant sensible au calcium est transitoirement modifié lors de la liaison au calcium. Les techniques d'imagerie simple ou multi-photons sont utilisés pour mesurer le changement de photons émis par le colorant, et indiquent ainsi une altération de calcium intracellulaire. En outre, ces calcium-dindicateurs ependent peut être combiné avec d'autres marqueurs fluorescents pour enquêter sur les types de cellules au sein du réseau actif.
Protocole
1. Faire des tranches de cerveau horizontale entorhinal-hippocampique
Tranches de cerveau entorhinal-hippocampique sont faites en utilisant des guides anatomiques, détaillées dans un aperçu en 3D de la région selon Canto, Wouterlood & Witter (2008) ID plasticité neuronale 381 243 9.
- Faire 500ml de solution tranche, oxygènent avec carbogène de gaz (95% d'oxygène, le dioxyde de carbone de 5%) pendant au moins 20 minutes et puis congeler 250ml jusqu'au glacé. Minutes avant de trancher, écraser et mélanger la glace tranche avec la solution restante bouillonnant 250ml tranche pour être utilisés pour la dissection et pour la coupe dans la chambre de trancher.
- Faire 200ml de r-ACSF (récupération ACSF) et au moins 500ml d'e-ACSF (expérimental ACSF) solution. Continuellement oxygéner les deux solutions avec carbogène de gaz (95% d'oxygène, le dioxyde de carbone de 5%) pendant au moins 20 minutes avant la préparation des tissus.
- Ce protocole est valable pour les souris de jour postnatal 0 jusqu'à un maximum de 3 semaines. Décapitez l'animal, selon les procédures locales du comité d'éthique, et disséquer le cerveau rapidement dans une boîte de Pétri contenant une solution glacée tranche de prêt à l'étape 1, ci-dessus (voir le tableau 1 pour les solutions et réactifs).
- Transfert du cerveau sur un papier filtre imbibé avec une solution tranche et séparer les deux hémisphères avec une lame de rasoir. Transfert d'un hémisphère de nouveau dans une solution glacée tranche.
- Retirez le cervelet de l'autre hémisphère. Retourner le cerveau sur sa ligne médiane et de couper la partie supérieure du cerveau avec un léger angle vers la fin rostrale.
- Retourner le cerveau sur le coupé (dorsale) de surface et le coller sur le support tissu de la trancheuse à l'envers en poussant doucement avec un coton-tige.
- Trancher les tranches 300 um d'épaisseur du cerveau en utilisant une faible fréquence et de vitesse dans la solution glacée restante tranche de fait à l'étape 1. Dans nos conditions, nous utilisons un Thermo Fisher Scientific vibratome (Microm, HM 650V) avec les réglages de 0,05 mm / s et 36Hz.
- CommeDès qu'un morceau est coupé, le transférer dans un support de tranche (immergée) contenant oxygénée artificielle cérébro rachidien (ACSF) (2,5 mM Mg 2 +, Ca 2 + 1,6; voir tableau 2) à température ambiante. Une concentration élevée de magnésium en R-ACSF réduit l'afflux de calcium dans les neurones via les récepteurs NMDA suivantes tranchage et dans notre expérience, conduit à une meilleure qualité de tranches pour des expériences. Si nécessaire, couper l'hémisphère cérébral secondes plus tard.
- Laissez les tranches d'une heure pour récupérer.
| Solution de Slice (en mm) - 10 | |
| 110 | chlorure de choline |
| 25 | NaHCO 3 |
| 11,6 | 11,6 |
| 10 | D-glucose |
| 7 | MgCl 2 |
| 3.1 | sodiumpyruvate |
| 2.5 | KCl |
| 1,25 | NaH 2 PO 4 |
| 0.5 | CaCl 2 |
Tableau 1. Recette pour solution tranche.
| ACSF (en mM) | |
| 125 | NaCl |
| 26 | NaHCO 3 |
| 10 | D-glucose |
| 3 | KCl |
| 2.5/1.5 | MgCl 2 (récupération / expérience) |
| 1.6 | CaCl 2 |
| 1,25 | NaH 2 PO 4 |
Tableau 2. Recette à la fois pour la récupération (R-ACSF) et expérimentale (e-ACSF) solution.
2. Préparation de la coloration CHambre
Pour charger les cellules avec l'indicateur de calcium-dépendante ou d'une cellule marqueur spécifique, les tranches doivent être transférés dans une chambre pour la procédure de coloration. Bien que les chambres commerciales peuvent être disponibles, on peut facilement être assemblé à partir de matériel de laboratoire standard pour un coût minime. Les principales caractéristiques d'une telle chambre sont que les tranches sont chauffés entre 30 et 35 ° C, incubées dans un milieu constamment oxygénée et que la chambre est à l'abri de la lumière.
- En utilisant une tige chauffée, faire un petit trou dans la paroi latérale de deux boîtes de Pétri en polystyrène jetables (35 et 100 mm de diamètre) qui est juste assez grand pour permettre une section de tube de silicium (environ 1,5 mm de diamètre) de passer à travers.
- Enfiler le tube de silicone à travers le trou dans la petite boîte de Petri et de former une boucle à l'intérieur de la paroi intérieure de la coupelle.
- Utilisez la superglue pour sceller l'extrémité ouverte du tube et coller le reste de la tubulure à la paroi intérieure de la boîte de Pétri.
- En utilisant une aiguille, percez des trous fines à intervalles régulièrement espacés dans le tube dans le plat intérieur de Pétri.
- Collez les petites boîtes de Pétri à l'intérieur du plus grand, avec deux trous alignés. Passer l'autre extrémité du tube de silicium à travers le trou dans le mur de la grande boîte de Pétri.
- Pour le plat d'interface, de prendre une culture de cellules insérez bien avec membrane semi-perméable et en utilisant un chauffage scalpel, couper le haut de 1 cm loin de laisser un plat peu profond pour tenir les tranches pendant l'incubation.
- Sur le couvercle de la plus grande boîte de Pétri, faire un trou d'environ. 0.5-1cm de diamètre pour permettre carbogène (95% d'O 2, 5% de CO 2) à s'écouler dans la chambre.
- Prenez une seringue en plastique de 5 ou 10ml. L'utilisation d'un bistouri chauffée, faire une coupe en biais pour enlever l'extrémité de la seringue et de garder une longueur de quelques cm de tube de la seringue avec l'embout. En utilisant la superglue, fixez la surface de coupe du tube de la seringue pour le couvercle boîte de Pétri, sur le trou de 0,5 à 1 cm de diamètre.
- Fixez tube de silicium et àubing connecteur à l'extrémité de la seringue. Joindre un autre raccord du tube à la tubulure de silicium entrant dans la base de la boîte de Pétri.
- Connectez jusqu'à deux tubes d'un régulateur pour carbogène (95% d'O 2, 5% de CO 2) d'alimentation. Placez la chambre coloration sur une plaque chauffante pour l'incubation entre 30-35 ° C. Assurer la chambre peut être à l'abri de la lumière durant le processus d'incubation entier. La chambre de coloration est maintenant prêt à assembler et à utiliser pour l'incubation tranche.
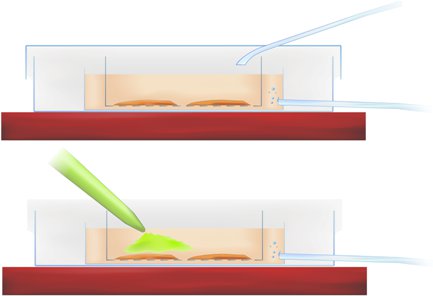
Figure Méthodologie 1. Cross-section de la chambre d'incubation coloration montrant tranche (ci-dessus) et l'application de calcium indicateur sensible (pipette colorant vert, ci-dessous).
3. Coloration des tranches
Tout au long de toute manipulation impliquant des colorants fluorescents, éviter photoblanchiment en travaillant avec peu de lumière et de garder le colorant et tIl a taché le tissu dans le noir entre la manipulation.
- Mettez la chambre de coloration sur une plaque de chaleur (35 ° C), le connecter à un approvisionnement en gaz carbogène et le remplir avec environ 1,5 ml r-ACSF du détenteur tranche.
- Placer le plat dans la chambre de l'interface coloration et le remplir avec 1ml ACSF.
- Assurer un approvisionnement carbogène bonne dans la chambre de coloration de garder le bouillonnement ACSF à un doux rythme soutenu.
- Ajouter 9 ul de DMSO et 1 acide pluronique ul (20% dans le DMSO solution mère, Invitrogen) dans un flacon de 50 mg 2-AM Fura. Vortex du mélange de colorant pour 15 minutes.
- Transférer les tranches dans le plat d'interface et la pipette du colorant dans la r-ACSF directement sur la région du cortex entorhinal et l'hippocampe d'intérêt, comme indiqué dans la figure 1 Méthodologie (ci-dessus), la réalisation de la concentration finale de teinture de 50mm.
- Fermez le couvercle de la chambre de coloration et incuber le colorant pour 20 - 40 minutes selon l'âge de l'animal (voir tableau 3).
- TransFer les tranches dans le support de tranche.
| Âge (jour postnatal) | Le temps d'incubation (min) |
| 20 | |
| P8-P9 | 25 |
| p10-p11 | 30 |
| p12-13 | 35 |
| > P13 | 40 |
Tableau 3. Les temps d'incubation pour des âges différents, empiriquement déterminée en laboratoire.
4. D'autres colorants et plus le tissu
Peut-être en raison de la myélinisation accrue dans le tissu cérébral, des tranches de vieux rongeurs ne prennent pas Fura 2-AM ester facilement. Afin de faciliter l'absorption de ce colorant une étape de préincubation utilisant Cremophor EL (Sigma) est utilisée pour des cerveaux de souris au P13 et plus 11. Cremophor est un tensio-actif non ionique utilisé comme excipient dans de nombreux pharmaceutiquesapplications al. Sans cette étape, nous constatons que la cellule spécifique d'étiquetage est extrêmement pauvre et incohérente à travers la tranche corticale.
- Transfert des tranches dans un plat vieux préincubation peu profonde remplie de 3ml r-ACSF et 8 crémophor ul de 0,5% (Sigma) chauffée à 35 ° C pendant 3 minutes.
- Transférer les tranches dans le plat d'interface et de suivre la procédure normale coloration (étapes 4-7, voir ci-dessus).
Colorants calcium de charge à la fois les neurones et non les neurones dans la préparation tranche. Afin d'identifier et de distinguer entre ces différents types cellulaires au sein du réseau, sulforhodamine 101 (SR101) peut être utilisé pour l'étiquette des astrocytes dans la tranche.
Coloration des tranches pour sulforhodamine 101
Suivez les étapes 1-3 comme avant (section 3).
Prendre 1 l de solution stock 10mm de sulforhodamine (Sigma) à partir de son stockage à -20 ° C et se dissolvent dans 999 ul r-ACSF pour donner une solution à 10 uM. Pipeter l'pourpre, over les tranches comme avant (étapes 5-7), laissant les tranches d'incubation pour une période de 15 minutes.
Microglie et les cellules endothéliales sont étiquetés à l'aide de colorants FITC lectine de tomate
Suivez les étapes 1-3 comme avant.
Prenez 25 pl de 2mg/ml Lycopersicon esculentum (tomate) lectine conjugué FITC (L0401, Sigma) solution stock dans 2.5ml r-ACSF pour donner 20 pg / ml de concentration. Pipeter le colorant sur les tranches comme avant (étapes 5-7), laissant les tranches d'incubation pour une période de 45 minutes.
Remarque, il n'est pas possible de combiner cette teinture avec un indicateur sensible au calcium comme le Fura 2-AM ou Oregon Green BAPTA-1 (OGB-1) qui émettent une fluorescence verte dans la gamme du spectre, depuis les photons issus de deux colorants seront émis aux longueurs d'ondes qui se chevauchent. Cependant, il existe d'autres indicateurs de calcium colorants tels que le calcium orange, rouge Fura qui peut être utilisé en combinaison avec des filtres appropriés ou conjugués lectine du Texas-Red à combiner l'esprith calcium indicateur de colorants dans le spectre vert.
5. Fixation des tranches à la chambre d'enregistrement
Tranches d'imagerie cours doivent être stables sous le microscope. Habituellement une harpe métallique est placée à maintenir enfoncé le tissu, mais il peut déformer la surface inégale de la tranche, ce qui donne seulement une partie du champ de vue pour l'imagerie in focus. Pour éviter cela, les tranches sont collés à la chambre d'enregistrement utilisant polyéthylènimine (PEI).
- Préparer la solution PEI (1ml solution de polyéthylèneimine dans borique tampon 250ml (tableau 4)). Assurez-vous que la PEI se dissout complètement (agiter durant la nuit).
- Remplissez les chambres d'enregistrement avec une solution PEI afin que le fond est recouvert de liquide au moins une heure avant que vous souhaitez appliquer les tranches
- Lavez les chambres d'enregistrement avec de l'eau distillée, puis avec r-ACSF de la chambre de détention.
- Transfert d'une tranche dans une chambre d'enregistrement.
- Retirez le r-ACSF avec une pipette et la position du SLglace au milieu avec un pinceau.
- Retirez le r-ACSF autour de la tranche en utilisant des morceaux de papier filtre. Pour la stabilité et l'adhérence, il est important qu'il n'y ait pas ACSF autour de la tranche de plus.
- Pipeter environ 0,5-1ml ACSF, selon la taille de la chambre d'enregistrement, sur la tranche. ACSF devrait juste couvrir la surface tranche.
- Mettez la chambre d'enregistrement avec la tranche dans un conteneur d'interface humidifié grande, perfusés avec carbogène, et laissez les tranches de récupérer au moins une heure.
| PEI solution | |
| 1ml | Poly (éthylèneimine) solution de |
| borique dans un tampon de 250ml | |
| 40 mM | acide borique |
| 10mM | décahydrate de tétraborate de sodium |
Tableau 4. Recette PEI solution.
6. Imle vieillissement
Colorants indicateurs calcium-dépendante peut être imagée en utilisant soit un ou microscopie à deux photons. Utilisation de l'imagerie à deux photons ne s'active que colorant indicateur dans le volume focal de la région d'intérêt, réduisant ainsi la quantité de dispersion de la lumière dans les tissus. Par ailleurs, il permet une meilleure profondeur de pénétration de la lumière dans la tranche.
Pour l'imagerie fonctionnelle de calcium, nous utilisons un laser titane saphir fournis par couplé cohérente à un microscope Olympus avec un objectif 20x (NA 0,95) et un système Trimscope par LaVision Biotec. Le système permet Trimscope cadre de la numérisation avec 64 beamlets simultanément et est couplé avec un Hamamatsu C9100 EM-caméra CCD pour la numérisation rapide trame taux.
- Position de la chambre d'enregistrement sous le microscope et d'établir une perfusion stable avec l'imagerie électronique ACSF (1,6 Ca 2 + / Mg 2 + 1,5 Ratio (tableau 2)) chauffée à une température plus physiologique minimale de 30 ° C.
- Focnous dans la région d'intérêt (ROI) en utilisant un éclairage en lumière blanche. Évitez d'exposer la tranche à la lumière plus longtemps que nécessaire.
- Choisissez la longueur d'onde, Imagerie de vue, la fréquence de balayage, la densité de pixels et d'options logicielles supplémentaires applicable pour les signaux des tissus biologiques et que vous souhaitez mesurer. Pour l'imagerie du réseau de calcium avec Fura 2-AM, nous choisissent généralement une longueur d'onde de 820nm, un champ de 250x250 um imagerie de vue, une fréquence de 1200Hz linescanning et 2 par 2 binning. Il en résulte une frametime d'environ 100ms et donc une fréquence d'environ 10Hz imagerie.
- Vérifiez si votre ROI est au point en utilisant un mode de balayage continu et de longueur d'onde sélectionnée Laserlight. Ajuster l'intensité du laser et de se concentrer pour éviter la saturation des pixels et de blanchiment de votre image.
- Faire un film timelapse de votre ROI. Nous généralement l'acquisition de deux films de 2000 timelapse images chacun.
- Pour la détection et l'identification de cellules, de prendre un z-stack avec un stepsize de 1 um et l'IMAG e + / 20 um autour de votre avion imagée de concentration.
7. Les résultats représentatifs
Chargement réussi d'indicateurs de calcium, Fura 2-AM sont présentés dans la figure 1 dans le développement des réseaux du cortex entorhinal et le néocortex en utilisant l'imagerie multiphotonique. Certains colorants est toujours présent comme une coloration de fond dans le soma, mais le tissu cellulaire et dans certains cas, des dendrites proximales sont clairement visibles et séparés des environs neuropile. Si le chargement n'a pas été réussie, très peu de cellules spécifiques coloration n'est observée et les petits amas de taches de teinture sont souvent visibles sur la surface de tranches dans les débris de membrane morts.
Dans ces screenshots, le réseau de cellules est clairement visible dans un seul plan d'orientation pour l'imagerie cellulaire simultanée. L'utilisation d'une harpe métallique ou coller incomplète de la tranche de la chambre d'enregistrement peut donner lieu à une surface inégale tranche à imager.
550fig1.jpg "alt =" Figure 1 "/>
Figure 1. Fura 2-AM ester chargée de développement du néocortex (A, à gauche) et entorhinal (B, à droite) des réseaux. Barres d'échelle 100 um.
Pour séparer les neurones des astrocytes, co-application de la sulforhodamine 101 avec Fura 2-AM ester permet la séparation des types de cellules au sein du réseau.
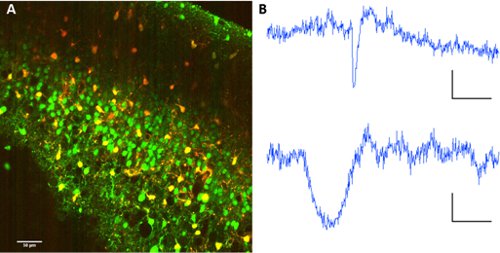
Figure 2. L'étiquetage des astrocytes avec sulforhodamine 101. Un co-marquage des Fura 2-AM ester et sulforhodamine 101. Longueur d'onde d'excitation: 820nm. Collection d'images sur le PMT avec miroir dichroïque à 560/70nm pour la séparation d'onde. B traces représentant la fluorescence d'un neurone (ci-dessus) et un astrocyte (ci-dessous). Échelle barres 60 sec, AF 10 (UA fluo).
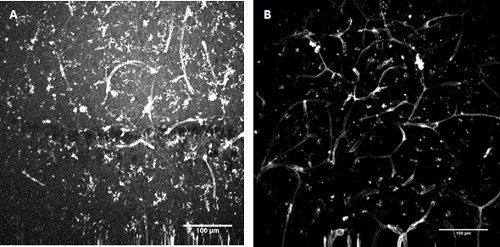
Figure 3. Conjuguée au FITC Lycopersicon esculentum coloration lectine (tomate) . Étiquetage de la microglie et les cellules endothéliales dans le développement de l'hippocampe de souris (A) et superficielles cortex entorhinal (B).
Colorants indicateurs de calcium sont utilisés pour l'activité de lecture à partir des cellules multiples simultanément dans le développement de réseaux corticaux et hippocampiques.
Figure 4. Transitoires de calcium dynamique dans les réseaux de l'hippocampe et du cortex.
Vidéo 1: Fura 2-AM de chargement ester de la souris cortex entorhinal lors de la semaine postnatale secondes.
Cliquez ici pour voir le film 1.
Film 2: Fura 2-AM de chargement ester de l'hippocampe de souris pendant la première semaine postnatale.
Cliquez ici pour voir le film 2.
Film 3: Fluo-4 de chargement de la souris cortex, durant la première semaine postnatale.
50movie3.avi "> Cliquez ici pour regarder le film 3.
Dans le cas de Fura 2-AM activation des cellules ester, impliquant un afflux induit par la dépolarisation de calcium, diminue la fluorescence de colorants. Pour les colorants comme le Fluo-4, c'est le contraire qui est vrai et la dépolarisation des cellules est observée comme une augmentation des émissions de photons. Transitoires de calcium somatiques sont essentiellement mesurée mais l'activité dans les grandes dendrites proximales peut aussi être vu dans certaines préparations, comme indiqué dans Movie 2.
Lecture d'activité du réseau peuvent être quantifiés en utilisant des scripts ou des logiciels commerciaux en interne. Dans notre identification de la cellule de laboratoire, et l'activité du réseau est mesurée et analysée de façon semi-automatisée en utilisant en interne le code pour Matlab (Mathworks).
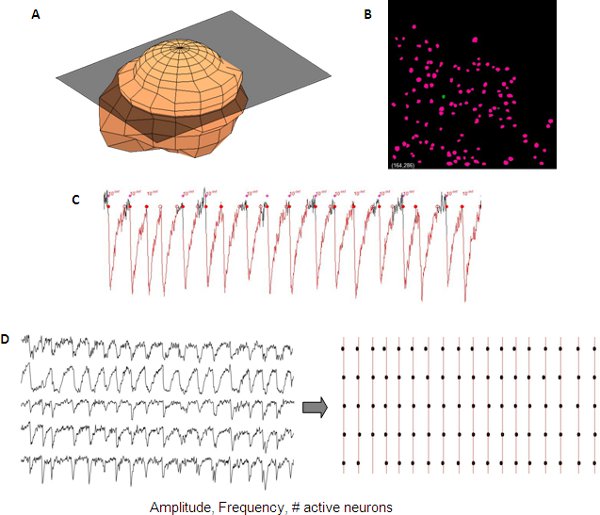
Figure 5. Représentant de l'analyse des transitoires de calcium synchronisés à partir d'un réseau en développement cortical. Représentation 3D d'un neurone ( A) utilisé pour créer automatiquement un masque neurone (B) de a à z-pile pour la détection automatisée des neurones. Mesures transitoires du calcium incluent l'amplitude, la fréquence et nombre de cellules actives qui peuvent être lues à partir des données seul neurone (C). Synchronie entre des traces différentes peuvent être visualisées en utilisant une intrigue tramée (D).
Discussion
Les méthodes que nous démontrons ici montrent protocoles appropriés pour l'imagerie calcique de la dynamique du réseau à partir de cellules identifiables dans le développement de réseaux corticaux et hippocampiques chez la souris et aussi dans le cerveau du rat. Ces méthodes fournissent une résolution spatiale optimale pour visualiser un réseau local de cellules soma simultanément pour mesurer l'activité supraliminaire. La résolution temporelle de l'activité du réseau peut varier, selon le cadre de l'acquisition des paramètres caméra CCD, pour optimiser le signal: les mesures de bruit de longue durée des événements supraliminaire, on trouve généralement dans le système nerveux en développement. Ces protocoles ne sont pas limités à des réseaux de l'hippocampe et du cortex, mais aussi marquer les cellules à travers le système nerveux en développement. La limitation de cette méthode est que l'activité supraliminaire ne peut être enregistrée.
Déclarations de divulgation
LaVision Biotec GmbH (Bielefeld, Allemagne) a parrainé les frais de soumission de cet article manuscrit.
Remerciements
Le travail en laboratoire est soutenu par la Nederlandse Organisatie voor Onderzoek Wetenschappelijk (NWO) (917.10.372) pour RMM. JD est affilié au programme FP7 de l'UE BrainTrain ( www.brain-train.nl ). Nous remercions Pieter Laurens-Baljon et Sabine Schmitz (tous deux CNCR, VU University Amsterdam) pour des images de formes d'onde FO array multiélectrodes et les cultures neuronales utilisées dans la séquence vidéo.
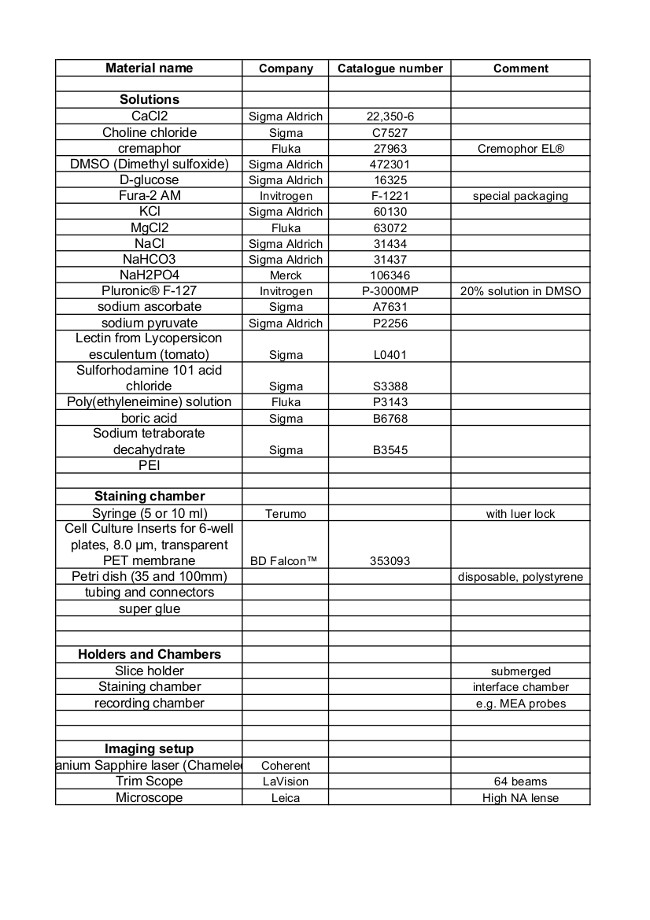
matériels
Références
- Katz, L. C., Shatz, C. J. Synaptic activity and the construction of cortical circuits. Science. 274, 1133-1138 (1996).
- Khazipov, R., Luhmann, H. J. Early patterns of electrical activity in the developing cerebral cortex of humans and rodents. Trends in Neurosciences. 29, 414-418 (2006).
- Spitzer, N. C. Electrical activity in early neuronal development. Nature. 444, 707-712 (2006).
- Adelsberger, H., Garaschuk, O., Konnerth, A. Cortical calcium waves in resting newborn mice. Nat. Neurosci. 8, 988-990 (2005).
- Garaschuk, O., Linn, J., Eilers, J., Konnerth, A. Large-scale oscillatory calcium waves in the immature cortex. Nat. Neurosci. 3, 452-459 (2000).
- Lamblin, . Electroencephalography of the premature and term newborn. Maturational aspects and glossary. Neurophysiol. Clin. 29, 123-219 (1999).
- Rakic, P., Komuro, H. The role of receptor/channel activity in neuronal cell migration. J. Neurobiol. 26, 299-315 (1995).
- Spitzer, N. C., Root, C. M., Borodinsky, L. N. Orchestrating neuronal differentiation: patterns of Ca2+ spikes specify transmitter choice. Trends. Neurosci. 27, 415-421 (2004).
- Canto, C. B., Wouterlood, F. G., Witter, M. P. What does the anatomical organization of the entorhinal cortex tell us. Neural. Plast. , 381243-381243 (2008).
- Bureau, I., Shepherd, G. M., Svoboda, K. Precise development of functional and anatomical columns in the neocortex. Neuron. 42, 789-801 (2004).
- Ikegaya, Y., Le Bon-Jego, M., Yuste, R. Large-scale imaging of cortical network activity with calcium indicators. Neuroscience research. 52, 132-138 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon