Method Article
使用穆林精密切肺片对肺动脉内下氧肺血管收缩进行视频形态分析
摘要
缺氧肺血管收缩(HPV)是一种重要的生理现象,通过它,在肺气孔缺氧与通气匹配。促成HPV的主要血管部分是血管内动脉。在这里,我们描述了我们的方案,分析直径为20-100微米的murine肺血管的HPV。
摘要
急性肺缺氧导致肺血管收缩(HPV),也称为冯·欧拉-利耶斯特兰德机制,用于将肺灌注与通气相匹配。到目前为止,基本机制尚未完全了解。促成HPV的主要血管部分是血管内动脉。此血管部分负责单个阿辛斯的血液供应,该支气管被定义为肺部分流到末期支气管的部分。腹内动脉大多位于肺部的这一部分,许多常用技术(如在孤立的灌注肺中测量肺动脉压力或从解剖的近肺动脉段1,2中强制记录)无法选择性地到达。通过实时共聚焦激光扫描发光显微镜对子体容器的分析仅限于直径达50μm的3型血管。
我们提供一种技术来研究20-100微米内径范围内的肺内动脉的HPV。它基于精确切肺切片 (PCLS) 中横截面动脉的视频形态分析。这种方法允许定量测量内径在20-40μm之间的小 血管内部 动脉的血管活性,这些动脉位于柱状管旁的紫外体隔膜的谷类中,以及内径在40-100μm之间的较大 前动脉 ,这些动脉与支气管和支气管相邻。与麻醉和通风小鼠的子膜血管的实时成像相比,PCLS 的成像分析是在无剪切应力的条件下进行的。在我们的实验模型中,两个动脉段在暴露于1%O2 的中等气体中时都表现出单相HPV,在缺氧30-40分钟后反应减弱。
引言
在大多数全身血管床中,缺氧诱发血管扩张,与肺血管缺氧引起的血管收缩相比。这种针对肺部特异性对降低氧张力的反应称为缺氧肺血管收缩(HPV),在几秒钟内发病,切换回正常氧通气后迅速逆转。虽然HPV已知超过60年,但导致血管收缩的细胞氧传感器和信号级联仍在争论之中。有一个相对广泛的共识,缺氧引起红氧化物和ROS的变化是必不可少的HPV和肺高血压的发展(在西尔维斯特 等人审查。4 和 舒麦克 等人。5)) 我们自己的数据支持线粒体呼吸链复杂II在HPV6,7中的中心作用。最近,王 等人提出了一个全新的氧气感应和HPV概念:根据他们的数据,他们提出,心室缺氧是由相邻的毛细管感应导致内皮细胞膜去极化。反应通过内皮细胞的连接40间隙交汇点传播,导致上游动脉8的平滑肌肉细胞收缩。
肺动脉沿着气道运行,与气道一起分支,直径不断减少,最后向位于肺壁的毛细血管系统供血。这种动脉循环由解剖学和功能上不同的部分组成。近部导管动脉的特点是壁内有丰富的弹性纤维,然后是完全肌肉化的肺内动脉,主要控制肺血管阻力。分步,这些动脉进入肌肉层不完整的部分,最后血管没有光滑的肌肉活性免疫细胞。用血液喂养单个肺癌的癌内动脉代表部分肌肉部分6。同样,肺动脉系统并不代表低氧反应的均匀结构,但表现出明显的区域多样性9,10。例如,在从大鼠肺缺氧中分离出的近邻肺动脉会引起双相反应,显示短时间的初始快速收缩,在完全放松后,随后是第二次缓慢但持续收缩的11。在从大鼠肺肺痛中分离出的抗性动脉中,作为肺动脉的第四和第五分裂(外径<300微米),缺氧导致单相收缩9。早在1971年,格拉齐尔和穆雷就从用低氧气体混合物通风的狗肺毛细血管红细胞浓度变化的测量结果得出结论,缺氧引起的血管抵抗力增加主要发生在毛细血管12的上游。如今,麻醉和机械通风小鼠完整肺部的内在显微镜是分析肺微血管13,14的有力工具。胸壁上圆形窗户的切除使肺表面具有微观的可访问性,并允许对直径高达 50μm 的胸腔下肺血管进行分析。通过将这项技术与FITC-德克斯特兰、塔布奇 等人的输液相结合。表明只有直径为30-50μm的中型动脉对缺氧有显著反应,缺氧持续60分钟,30分钟后轻微衰减。相比之下,直径为20-30μm的小动脉对缺氧3只表现出轻微的反应。然而,这种技术不允许分析直径大于50μm的动脉,因为这些血管位于肺组织太深。
为了弥合对穆林肺大肺和非常小肺动脉(如下胸血管)的分析差距,我们采用了马丁 等人描述的方法。用于分析气道15的自反应。基于一种糖凝胶灌输技术,它有助于从这种相对柔软和弹性的器官中精确切肺片 (PCLS) 的制备。在内径在20-100微米的横断面动脉的PCLS血管内,可以通过显微镜直接观察。在 PCLS 的低氧潜伏期间应用药物,可以分析其对 HPV 的影响。这种技术还特别重要,可以应用于基因工程小鼠。根据动脉在肺部的位置,我们将动脉分类为癌前血管和癌内血管,其内径分别为20-40微米和40-100微米。在功能视图下,血管内动脉为单个肺癌提供血液,癌前动脉是前血管部分。在数码相机上录制图片可以随后对血管功能进行量化。这种 PCLS 模型的一个明显属性是缺乏对内皮作用的剪切应力。相比之下,在灌注容器中,急性HPV会导致剪切应力增加,从而诱导二级机制,如NO释放16。此外,使用 PCLS 可以测量 HPV,而不会对肺外神经或荷尔蒙产生影响。与细胞培养系统相比,例如由犬肺动脉平滑肌细胞17制备的细胞培养,血管壁的组织结构几乎完全保存下来。
总之,该协议为分析潜在的分子氧传感器和/或细胞通路提供了一个有用的方法,这些通道负责在无剪切应力条件下,内径在20-100 μm之间的肺内动脉的HPV。
研究方案
1. 气体混合物、设备、仪器和解决方案的准备
本节描述了协议所需的设备和设置。其他详细信息和制造商信息可在随附的表格中找到。
- 获取或准备以下气体混合物:
- 两瓶含有普通气体混合物的瓶由21%O 2、5.3%CO2、73.7%N2组成。
- 一瓶低氧气体混合物由1%O2,5.3%CO2,93.7%N2组成。
- 收集以下设备:
- 微波炉,用于熔化糖。
- 加热柜,用于从肺部洗掉糖(见下文)。将连接到含有普通气体混合物的瓶子的管子插入机柜中。
- 带适当剃须刀刀片的振动器,用于将肺切成 200 μm 厚的切片。如果振动器配有制冷设置,以冷却振动盆中的缓冲器,则是有利的。
- 安装在倒置显微镜上的流式超级输液室,用于分析肺动脉内HPV。
- 为了便于将肺部固定到腔室底部,将尼龙串连接到铂环(自建)。加入灌注室,加入渗透泵,流量率分别调整为0.7毫升/分钟和6毫升/分钟。
- 组装设备,以便在实验期间,介质存储在 37 °C 的水浴中,并使用 21 G x 4 3/4 罐装气与常氧化或低氧气体一起冒泡。此外,使用气瓶的第二个连接,允许将正常氧化/低氧气体混合物送入灌注室的空气空间。确保该系统的所有管子都加气。
- 安装在直立倒显微镜上的CCD摄像机可记录所分析的动脉图像。
- 准备以下文书:
- 为准备肺部:一套无菌解剖,包括一把粗糙的剪刀和两对钳子,一把用于打开胸部的细剪刀,一把微剪刀在气管上切一个洞,用于填充气管,缝制棉布(约20厘米),用于气管的连结,以防止气管外流。
- 用于用蔗糖填充气道:将 2 毫升注射器连接到 IV 内流管的柔性塑料管(20 G x 1 1/4)。
- 对于用缓冲器灌注肺部:将一个 50 毫升的注射器固定为缓冲储液库,在工作地点上方约 40 厘米处,用于小鼠准备。
- 对于缓冲区外流:将注射器连接到连接 25 G x 1 罐的管子上。使用管子夹子将流出量调整到约 1 滴/秒(约 0.3-0.4 毫升/分钟)。
- 准备以下缓冲区和媒体:
- 制作 1,000 毫升 HEPES-林格缓冲区(10 m M HEPES、136.4 mM 纳克、5.6 mM KCl、1 mM MgCl2+6H2O、2.2 mM 卡Cl2+2H2O、11 mM 葡萄糖、pH 7.4)。将无菌过滤缓冲区(滤波器的孔大小:0.2 μm)存放在4°C。
- 在开始肺部隔离前约30分钟准备以下解决方案:
- 溶解 1.5% w/v 低熔点在 HEPES-林格缓冲区(总体积 10 毫升)中产生,并在微波炉中烹饪将其熔化。随后,通过将冷却柜存放在加热柜中,将其冷却至 37 °C。预热2毫升注射器,将糖汁填充到肺气道中。
- 服用 20 毫升 HEPES-林格缓冲器,将肝素添加到 250 I.U./ml 的最终浓度中,并将缓冲区加热至 37 °C。 使用前立即将硝基普鲁斯钠添加到最终浓度为 75 μM。这是从肺血管中流出血液的灌注缓冲器。
- 将 200 毫升 HEPES-环形缓冲器放入玻璃烧杯中,并将其存放在冰上。这个缓冲器将需要冷却充满糖分的孤立肺。
- 在玻璃烧杯中填充约 200 毫升 MEM,并补充 1% 青霉素/链霉素,并将它存放在加热柜中的 37 °C。用普通气体混合物气泡介质。这将用于从肺部切除糖。
- 预热 2 瓶 MEM 补充 1% 青霉素/链霉素在水浴到 37 °C,并泡沫他们与正常氧化和低氧气体混合物,分别至少 2 小时之前开始视频形态测量。每次测量大约需要 250 毫升 MEM。
- 收集以下其他材料:
- 70%用于消毒。
- 肝素库存溶液(25.000 I.U./5 毫升),储存在 4 °C(见上文)。
- 无供体硝基钠(尼普鲁斯)的库存溶液:10 mM H2O,储存在冰上(见上文)。
- 血栓类U46619的库存溶液:10微米乙醇,储存在冰上。
- 超级胶水。
- 缝制棉布,在填充气管后进行气管的套合。
2. 动物
在10-25周时使用两性的小鼠(例如C57Bl6菌株)。HPV 也可以在淘汰菌株和相应的野生类型菌株中进行分析。
所有实验均按照国家卫生研究院关于保护和使用实验动物的准则进行,并经当地机构委员会批准。
3. 穆林肺的隔离和精密切肺片的制备
- 用颈椎脱位杀死老鼠。杀死后,立即用 70% EtOH 消毒腹腔身体表面,并使用粗糙的剪刀将皮肤沿腹腔中线从下巴切到骨盆。
注意:由于已知异氟兰等吸入性麻醉剂对血管张力有影响,因此不使用挥发性麻醉剂。 - 腹腔打开后,将肠道循环放在一边,切断大腹血管出血。用细剪刀穿透隔膜后,肺部会因空气进入胸腔而崩溃。使用剪刀将隔膜从劣质胸腔孔中分离。横切肋骨和锁骨,以去除裂口笼的腹腔部分。
注意:重要的是,肺部在这一步没有受损,否则肺部腹胀与糖将是不可能的!仅使用无菌仪器和实验室玻璃器皿。 - 在开始肺血管的灌注之前,在心脏的左心室切一个小孔以释放缓冲。用含有肝素和硝基酸钠(灌注缓冲剂)的温暖(37 °C)HEPES-Ringer缓冲液填充注射器储液,并通过右心室缓慢地灌注肺血管。
注意:当肺改变颜色并出现白色时,灌注是有效的。在这一步骤中,在灌注缓冲中加入硝基普鲁斯钠非常重要:这防止癌前动脉从周围的组织撕裂。 - 从气管中取出唾液腺、小肌肉和结缔组织。将气管与周围的结缔组织和线缝棉在食道和气管之间分离,以供以后结扎。
- 使用微切刀在两个相邻的气管软骨之间将一个小孔切入气管的上部。现在,通过小孔将静脉注射管的柔性塑料管插入气管中,用缝纫棉小心修复。慢慢地用温暖(37°C)低熔点来填充气道。观察肺:起初右肺开始扩张,然后是左肺。当两个肺的充气量与 体内 情况相当时,填充完成(根据性别、年龄和体重的不同,大约为 1.2-2.0 毫升)。
注意:如果只有一个肺扩张,塑料管可能插入太深,使其到达支气管。在这种情况下,它必须拉出一点点。请记住,当阿加罗斯逐渐冷却时,它就会凝固。 - 当肺部充满时,同时拔出塑料管,用缝纫棉将气管盖上,以防止糖水外流。随后,切开连字上方的气管 ,将肺 和心脏从胸前分离出来。
注意:对于初学者,在封口步骤中向同事寻求支持可能会有所帮助。 - 将器官包转移到冰冷的 HEPES-环状缓冲器中,以凝固糖体。这种情况在几分钟内发生。
- 分离单个肺叶,并在颤动的标本支架上用超级胶水固定一个叶。
注意:在支架上贴一块香槟软木塞是有帮助的,在切割弹性肺组织时,它起到倾斜的作用。根据所使用的肺叶及其在标本支架上的方向,获得的PCLS可能更适合分析小型或大型血管。我们主要使用左叶和右颅叶来准备 PCLS。要获得横截面小腹腔内动脉,将颅右叶与横梁粘在支架上,从外围切开。要获得横截面的癌前动脉,将右叶的腰围与香槟软木塞对齐。 - 使用配备新鲜剃须刀刀片的振动器将肺叶切成 200 μm 厚片(速度:12 = 1.2 mm/秒;频率: 100; 振幅: 1.0)。在充满 4 °C 冷 HEPES-环缓冲器的振动盆中收集 PCLS。
注意:建议冷却 HEPES 环,但不必要。 - 要去除糖,将器官部分转移到装满约 200 毫升 37 °C 暖 MEM 的玻璃烧杯中。将烧杯放入加热柜中,将管子与含有普通气体混合物的瓶子连接在一起。用规范的气体气泡MEM,使肺部在介质中缓慢移动。大约2小时后,填充空域的"糖斑"将从肺组织中取出。这可以从这样一个事实中得到承认,即这些部分不再在介质顶部游泳,而是在烧嘴的底部沉淀。
4. PCLS肺动脉视频形态分析
- 对于肺动脉内的视频形态分析,将一个 PCLS 转移到充满 1.2 毫升正常毒气 MEM 的流式超级输液室中。用尼龙串连接到铂环修复房间底部的 PCLS(外/内直径:14/10 mm)。
- 微观扫描 PCLS,寻找内径在 20-100 μm 之间的横截面动脉。
注意:动脉的流明由扁平的内皮细胞衬里。周围的平滑肌肉细胞可以在相位对比图像中识别为围绕流明的"暗环"(见 图 2中的相位对比图像)。相比之下,气道可以通过最初伪两化的柱状上皮识别,在进入胸膜表面的路上,它通过进入一个简单的柱状上皮,然后是一个简单的腹膜上皮。- 在每个实验的开始测量内径。
注意:在稍微倾斜切割的容器中,管状结构的真正内径可以以 90° 角确定到流明最长的轴。内径为 40 μm 的大型前动脉与支气管和支气管相邻,直径为 > 40 μm。内径<40μm的小腹内动脉位于藻类和藻类管道6旁边的紫外体隔膜丛中。
- 在每个实验的开始测量内径。
- 试验设计:
- 开始每个实验的"适应阶段",其中室中注入了规范的毒气介质(流速:0.7毫升/分钟;10分钟)。接下来,测试容器的可行性:通过添加10μM U46619(最终浓度0.1μM;10分钟;无流量)添加12微升来分析动脉收缩性。
注意:对于此工作,当发光面积至少减少 30% 时,容器被定义为可行(有关测量方法,请参阅下文)。 - 用规范毒气介质(流速:6毫升/分钟;10分钟)洗掉药物后,通过应用3微升10m尼普鲁斯(最终浓度25微米;10分钟;无流量)来扩张动脉。
- 再次,用规范的气体介质(流量:6毫升/分钟)洗10分钟,然后以0.7毫升/分钟的流量10分钟取出药物。
- 通过用低氧气化介质(流速:0.7毫升/分钟;40分钟)孵化PCLS诱导低氧肺血管收缩。通过额外的管系统,将低氧气体混合物送入灌注室的空气空间。
- 用普通气态介质洗20分钟,取出缺氧介质(流量:6毫升/分钟)。
- 在每个实验结束时,在灌注室中加入1.2微升的10μM U46619(最终浓度0.01微米;20分钟;无流量),以诱导血管收缩。
注意:此最后一步允许确定缺氧反应的变化(例如,在缺氧阶段同时应用药物或在从淘汰鼠标应变准备的 PCLS 中观察到)是否特定于缺氧引起的收缩,或者它是否反映了对收缩的一般影响。0.01 μM 的浓度与 U46619 的 EC50 值相对应,该值在以前的浓度收缩测量中估计(未公布)。 - 使用另一种 PCLS 在灌注室的空气空间中使用常态氧化物而不是低氧气体 MEM 和常态气体混合物进行控制实验。
- 开始每个实验的"适应阶段",其中室中注入了规范的毒气介质(流速:0.7毫升/分钟;10分钟)。接下来,测试容器的可行性:通过添加10μM U46619(最终浓度0.1μM;10分钟;无流量)添加12微升来分析动脉收缩性。
5. 血管活性和图形呈现分析
- 在整个实验过程中,使用合适的软件每分钟从横截面动脉拍照。
- 使用合适的软件使用全屏图片用手衬里内部边界来评估容器发光区域的变化。
注意:分析每一秒的图片以获得清晰的图形就足够了。但是,当流式超输液室中的一个条件更改为另一个条件时,分析每一张图片。如果无法分析一张照片,其余图片将作为备份。
不幸的是,这个耗时的步骤必须用手完成,而不是通过适当的程序,因为有时血细胞被连接到血管壁,在测量过程中移动,或者它不是一个完美的横截面的血管,而是一个切线部分,其中内边界的可靠定位只能在视觉控制下完成。 - 将实验开始时容器流明区域获得的价值定义为100%,并将血管收缩或稀释表示为该值的相对减少或增加。
- 对于每个实验,使用合适的软件根据时间绘制相对发光区域。
- 要总结几个实验,绘制相对发光区域 +/- 平均误差 (SEM) 与时间的相关方法。
注:为了清楚地介绍各种物质对缺氧或U46619诱发的肺血管收缩或敲除小鼠菌株的缺氧反应的影响,可以从图中省略测试容器生存能力的实验的初始阶段。在这种情况下,在接触减少氧气时获得的值被定义为 100%。
6. 统计分析
- 分析与克鲁斯卡尔-瓦利斯和曼-惠特尼测试的实验组之间的差异,p≤0.05被认为显著,p≤0.01具有显著性。
注:有关PCLS的准备和操作使用的其他信息,请参阅20,21。
结果
图1给出了大癌前动脉HPV的测量结果和小腹内动脉图2的测量结果。在相对比图像(图1A和2A)中,很明显,根据这两类动脉在肺组织内的位置来区分它们是可能的:在近邻运行的癌前动脉 支气管和支气管(图1A),而腹中动脉位于紫藤塞,周围是阿尔韦奥拉(图2A)。稍加练习,就可以在相对比图片(图 1A 和 2A)上看到响应 U46619 的发光区域的变化。然而,低氧肺血管收缩往往不那么明显,只有在对发光区域的变化(图1B,1C,2B和,2C)的完全评估后才会变得清晰。出于教条的原因,我们给出了一个预血管动脉的例子,它显示了异常明显的血管收缩。平均而言,HPV 可减少 20-30% 的发光面积。
图 2 显示,用有或没有50微米皮纳西迪尔(线粒体ATP敏感钾通道的非选择性开瓶器)孵育的低氧气中基孵育的小腹腔内动脉的录音,药物的抑制作用变得清晰可见。实验的最后一部分显示了药物在HPV上的作用的选择性:由血栓丹模拟U46619引起的血管收缩不会因为添加皮纳西迪尔而改变。事实上,暴露在脊杆菌的动脉曲线明显低于其他两条,但光泽面积仅减少U46619的程度是可比的。在这种情况下,HPV 的不完全回归导致了曲线之间的差异。在此图中还包括暴露于正常毒气介质的动脉作为附加控制。在这种情况下,发光区域没有变化可检测。
图 3 显示了关于皮纳西迪尔对HPV影响的一系列测量数据。为了比较两组统计差异,用克鲁斯卡尔-瓦利斯和曼-惠特尼测试分析了所指示的时间点数据集。HPV在皮纳西迪尔面前被明确废除,而U46619引起的收缩则保持不变。
或者,可以通过比较穆勒-雷德茨基等人描述的曲线下区域来识别群体之间的差异 。22
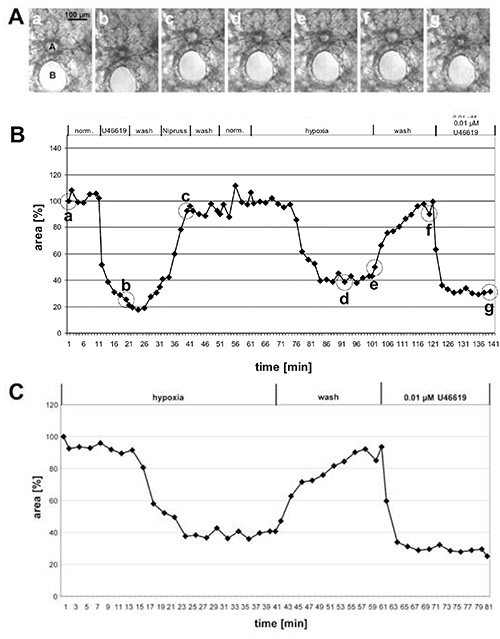
图1。 测量大癌前动脉的HPV。(A) 横截面预支线动脉(a)的相位对比图像,该动脉运行在横截面支气管(B)的附近。这些照片是在(B)中按圆圈指示的时间点拍摄的:在测量 (a) 的开始,在 U46619 (b) 治疗结束时,在接触尼普鲁斯 (c) 结束时,在低氧气态介质 (d, e) 中 30 或 40 分钟后,在用常态气态介质 (f) 清洗后,以及在 U46619 (g) 的最终应用后。在图(B) 中,发光区域的变化是与时间相拉动的,而实验开始时的发光区域被定义为 100%,血管收缩/分化被定义为相对值。在这种情况下,缺氧会导致发光面积减少 60%。(C) 为了更清楚地介绍缺氧反应,不包括测试血管活性的实验的初始阶段,但暴露在减少的氧气之前获得的值被设定为100%(另见图2)。单击此处查看更大的图像。
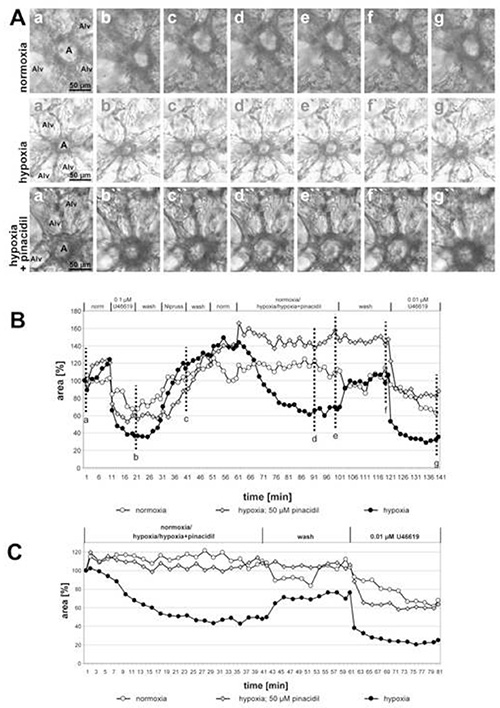
图2。皮纳西迪尔(线粒体ATP敏感钾通道的非选择性开口;米托卡特尔)对小腹腔内动脉HPV的影响。(A) 腹内动脉 (a) 位于紫藤塞帕的古塞。阿尔韦卢斯。这些实验中应用的个体条件的序列在图(B) 的标题中给出。缺氧暴露是在存在或没有 50 μM 皮纳西迪尔的情况下进行的。控制孵化用规范的毒气介质进行。(A)中显示的图片是在测量的开始(a, a', a"), 在 U46619 治疗结束时拍摄的 (b, b', b"),在接触尼普鲁斯(c, c', c"),30或40分钟后在低氧或正常氧化气体介质(d, d', d"; e, e', e"), 洗涤后与规范毒气介质 (f, f', f"), 并在 U46619 (g, g', g") 的最终应用后。为了更清楚地介绍对诺莫夏/缺氧/缺氧+皮纳西迪尔的反应,在接触常态氧/低氧气介质之前获得的值被设定为 100%(C)。单击此处查看更大的图像。
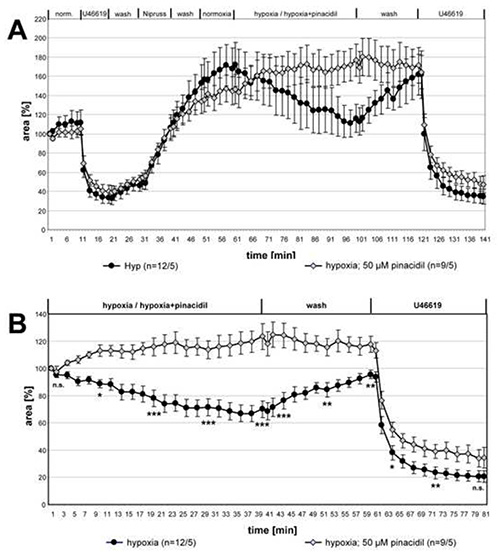
图3。通过皮纳西迪尔抑制HPV。 与有或没有50微米皮纳西迪尔的低氧气化介质接触的小型腹腔动脉的录音被总结并作为SEM±手段呈现。在 (A) 提供完整的录音中,在 (B) 显示与低氧潜伏开始时值相关的相关数据。在暴露于含有皮纳西迪尔的低氧气体介质的五氯苯酚中,无法检测到血管活性。U46619诱发的血管收缩不受药物影响。括号中的"n"是指制作 PCLS 的动脉/动物数量。换句话说,第一个数字描述了分析的肺部的计数,第二个数字给出了准备这些部分的小鼠的计数。在给定时间点,两组之间的差异都经过了意义测试。n.s.: 不重要,*: p≤0.05, **: p≤0.01, ***: p≤0.001. 单击此处查看更大的图像。
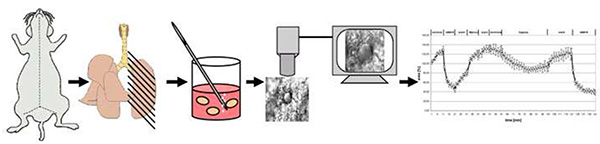
图4。方法的示意图概述。 简言之,老鼠死于颈椎错位。胸部打开后,肺部充满低熔点,冷却后切成200微米厚的精密切肺片(PCLS)。在37 °C下去除糖后,一个PCLS被转移到流经的超级输液室中,在超级输液室中,它暴露在中度或中等气体中,1%O2。血管活性被记录为发光区域的变化。 单击此处查看更大的图像。
讨论
分离通风和灌注小鼠肺是分析肺血管系统对氧气供应变化的生理反应的极好模型,允许连续测量肺动脉压力1。然而,该模型不允许识别和分析这些血管段(s)显示对缺氧的最强反应。这是我们对PCLS的视频形态分析的优势,它有助于测量内径为20-100微米的单个动脉的HPV。 PCLS代表着一个有吸引力 的体外 模型,因为它们与它们所准备的器官非常相似。与细胞培养系统相比,所有细胞类型都存在于其原始组织基质配置中。此外,一个肺足以准备许多PCLS,以便至少部分实验可以通过使用来自同一小鼠的部分进行标准化。根据罗素和伯奇23 的3R概念(生命科学中实验室动物的减少、精炼和替代),这一事实也主张使用PCLS。
然而,我们必须记住,组织被破坏,通过切割与振动和纵向信号,例如通过内皮细胞,由Kübler 等人假设。14 不再可能。
最初,PCLS主要应用于生化、药理学和毒理学研究,但同时它们也用于测量支气管收缩、粘膜功能和血管反应(请参阅桑德森20 和戴维斯21)。举行 等人。他们进行了一项研究,比较了分离香水和通风小鼠肺和PCLS24的模型。他们通过分析气道和肺血管对各种内源介质的反应,发现整个肺的重要特征在PCLS中得以保持。
在PCLS中,低氧条件不是通过气道建立的,而是通过在低氧气中孵化肺部。我们使用血液气体分析仪分析了中等气的氧气部分压力(pO2),分别为1%O 2、5.3%CO2、93.7%N 2和21%O2、5.3%CO2、73.7%N2。在将其送入灌注室之前,低氧气体MEM的pO2为40 mmHg,而正常毒气介质为160 mmHg6。 在完整的肺HPV诱导时,肺气孔pO2下降到50毫米汞下25,这种情况可以明显模仿应用低氧气体介质。我们关于HPV范围的数据与通过不同实验方法获得的结果非常匹配。山口等人。通过实时共聚焦激光扫描发光显微镜,将分离的老鼠肺应用于检查直径为20-30微米的微维斯,并配以具有图像强化器10的高灵敏度相机。他们观察到肺暴露在缺氧后直径平均减少2.7微米。我们可以计算出,当我们在系统中测量发光面积时,发光面积减少20%,直径减少约15%。
在我们的实验中,我们分别将动脉分类为前血管和癌内血管,其内径分别为40-100微米和20-40微米。在人类中,从肌肉动脉向非肌肉动脉的过渡发生在直径为70-100μm的范围内。在小鼠中,平滑的肌肉细胞的外径为20μm26。因此,无法分析直径小于 20μm 的动脉,因为根据相位对比图像无法可靠识别这些动脉。在刻度的另一端,直径超过 100 μm 的容器在 PCLS 中很难找到,通常从周围组织中剥离出来。
实际上,一些分子候选者被讨论为分子氧传感器或导致HPV的信号级联的组成部分(请参阅西尔维斯特等人的审查)。4)) 一旦有适当的淘汰小鼠,可使用视频形态学分析与野生类动物相比,癌前动脉和癌内动脉的血管活性。然而,PCLS也被用于其他问题:法鲁等人。雇用他们来描述出生后肺内皮依赖性扩张的发展,29日和PCLS准备从豚鼠每天暴露在烟雾或空气中2周,用于证明香烟烟雾对血管活性的影响,通过诱导内皮功能障碍30。
协议中的关键步骤
在我们的实验中,我们把动脉分类为前腹(内径为40-100微米)和腹内(内径为20-40微米)。特别是对于用于分析较大血管的肺部的准备,在灌注缓冲中加入硝基磷钠非常重要。这种药物可防止血管在样品制备过程中收缩,从而防止血管从周围组织撕裂,导致血管不完全蒸发生。灌注缓冲液中的硝基磷钠对于准备肺部并不那么重要,肺部应该用于分析小动脉,因为它们被牢固地固定在肺部隔膜上。
所有实验都应从测试动脉反应性的孵化开始。很少,我们获得了肺准备,其中没有船舶对承包商或扩张器的反应是检测不到的。我们不知道原因:可能是填充到肺部的糖体积太大或太低,因此将器官切入PCLS并不是最佳的。或者,可以想象,在灌输过程中,糖体冷却速度过快,导致破坏性的剪切应力。如果在单个 PCLS 中无法检测到可行的动脉,则必须丢弃该部分,并由另一条动脉替换。
关于动脉可行性的决定是基于对U46619的回应做出的。U46619 在浓度为 0.1 μM 时应用会诱发血管收缩,经过一些锻炼后,在屏幕上的图像序列中可直接看到这种收缩。由于血管活性存在一些差异,我们通过测量接触药物或仅接触药物的肺部的血管反应来调查药物对HPV的影响。
单个动脉的HPV在显微镜中通常很难检测到,平均而言,它会导致发光面积减少约20-30%。然而,动脉直径的微小变化对电流阻力有明显的输入。根据具有R=电阻和r=半径的等式"R=1/r 4",流阻力与半径的第四个功率成反比。让我举一个例子:一条"理想动脉",其圆形横截面直径为40μm(r=20 μm),发光面积约为1,260μm2。当发光面积减少 20% 时,我们可以计算出容器的直径减少 10.5% 至 35.8 μm(r=17.9 μm)。根据上述等式,该船的阻力将从6.25 x10-6增加到9.71 x 10-6,即约55%。如果发光面积减少30%,半径将减少约16%,但阻力将增加约100%。虽然这些计算是一种过于简单化,其中层压血流和刚性管的血管形式被假定为,它暗示了已经很小的直径变化对流量阻力的影响。
披露声明
作者没有什么可透露的。
致谢
这项研究由卓越集群心肺系统赞助。
材料
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
参考文献
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。