Method Article
Analisi videomorfometrica della vasocostrizione polmonare ipossica delle arterie intrapolmonari utilizzando fette polmonari tagliate con precisione murina
In questo articolo
Riepilogo
La vasocostrizione polmonare ipossica (HPV) è un importante fenomeno fisiologico con cui alla perfusione polmonare ipossia alveolare viene abbinata alla ventilazione. Il principale segmento vascolare che contribuisce all'HPV è l'arteria intra-acinare. Qui descriviamo il nostro protocollo per l'analisi dell'HPV dei vasi polmonari murini con diametri di 20-100 μm.
Abstract
L'ipossia alveolare acuta causa vasocostrizione polmonare (HPV) - nota anche come meccanismo von Euler-Liljestrand - che serve ad abbinare la perfusione polmonare alla ventilazione. Finora, i meccanismi sottostanti non sono pienamente compresi. Il principale segmento vascolare che contribuisce all'HPV è l'arteria intra-acinare. Questa sezione del vaso è responsabile dell'apporto di sangue di un singolo acino, che è definito come la porzione di distale polmonare a un bronchiolo terminale. Le arterie intra-acinari si trovano principalmente in quella parte del polmone che non può essere raggiunta selettivamente da una serie di tecniche comunemente utilizzate come la misurazione della pressione arteria polmonare in polmoni perfusi isolati o registrazioni di forza da segmenti di arteria polmonare prossimale sezionati1,2. L'analisi dei vasi subpleurali mediante microscopia a scansione laser confocale in tempo reale è limitata a recipienti con un diametro fino a 50 μm3.
Forniamo una tecnica per studiare l'HPV delle arterie intrapolmonari murine nell'intervallo di diametri interni di 20-100 μm. Si basa sull'analisi videomorfometrica delle arterie sezionate incrociate in fette polmonari tagliate di precisione (PCLS). Questo metodo consente la misurazione quantitativa della vasoreattività di piccole arterie intra-acinari con diametro interno compreso tra 20-40 μm che si trovano a soffici di setti alveolari accanto a condotti alveolari e di arterie preacinari più grandi con diametri interni tra 40-100 μm che corrono adiacenti a bronchi e bronchiole. A differenza dell'imaging in tempo reale dei vasi subpleurali nei topi anestetizzati e ventilati, l'analisi videomorfometrica del PCLS avviene in condizioni libere da sollecitazioni di taglio. Nel nostro modello sperimentale entrambi i segmenti arteriosi presentano un HPV monofasico quando esposti a gas medi con 1% O2 e la risposta svanisce dopo 30-40 minuti all'ipossia.
Introduzione
Nella maggior parte dei letti vascolari sistemici l'ipossia induce vasodilatazione, rispetto alla vasocostrizione causata dall'ipossia nella vascuola polmonare. Questa risposta specifica del polmone alla tensione dell'ossigeno abbassata è chiamata vasocostrizione polmonare ipossica (HPV), si insedia in pochi secondi e si inverte rapidamente dopo il ritorno alla ventilazione normossica. Sebbene l'HPV sia noto da più di 60 anni, i sensori di ossigeno cellulare e le cascate di segnalazione che hanno portato alla vasocostrizione sono ancora in discussione. C'è un ampio consenso sul fatto che i cambiamenti redox e ROS evocati dall'ipossia sono essenziali per l'HPV e lo sviluppo dell'ipertensione polmonare (recensita in Sylvester et al. 4 e Schumacker et al. 5). I nostri dati supportano un ruolo centrale del complesso II della catena respiratoria mitocondriale in HPV6,7. Recentemente, Wang et al. presentato un concetto completamente nuovo per il rilevamento dell'ossigeno e HPV: Sulla base dei loro dati propongono che l'ipossia alveolare sia percepita dai capillari adiacenti causando la depolarizzazione della membrana delle cellule endoteliali. La risposta viene propagata tramite connexion 40 giunzioni gap delle cellule endoteliali che portano alla costrizione delle cellule muscolari lisce delle arteriole a monte8.
Le arterie del polmone corrono lungo le vie aeree, si ramificano con loro, diminuiscono continuamente di diametro e infine forniscono sangue al sistema capillare situato nelle pareti alveolari. Questa circolazione arteriosa è composta da segmenti anatomicamente e funzionalmente distinti. Le arterie del condotto prossimale, caratterizzate da un'abbondanza di fibre elastiche nelle pareti, sono seguite da arterie intrapolmonari completamente muscolose che controllano in gran parte la resistenza vascolare polmonare. Passo dopo passo, queste arterie transitano in segmenti in cui lo strato muscolare diventa incompleto, e infine i vasi sono liberi da cellule actina-immunoreattive muscolari lisce. L'arteria intra-acinare che alimenta un singolo acino polmonare con sangue rappresenta un segmento parzialmente muscolare6. Allo stesso modo, il sistema arterioso polmonare non rappresenta una struttura uniforme per quanto riguarda la risposta ipossica, ma mostra una marcata diversitàregionale 9,10. Ad esempio, nelle arterie polmonari prossimali isolate dai polmoni del ratto l'ipossia induce una risposta bifasica, mostrando una contrazione rapida iniziale di breve durata che - dopo un rilassamento incompleto - è seguita da una seconda contrazione lenta masostenuta 11. Nelle arterie di resistenza isolate dal parenchima polmonare del ratto come quarta e quinta divisione delle arterie polmonari (diametro esterno <300 μm), l'ipossia causa costrizione monofasica9. Già nel 1971 Glazier e Murray conclusero dalle misurazioni dei cambiamenti nella concentrazione capillare di globuli rossi nei polmoni dei cani ventilati con miscele di gas ipossia che l'aumento indotto dall'ipossia nella resistenza vascolare si è verificato principalmente a monte dei capillari12. Al giorno d'oggi, la microscopia intravitale di polmoni intatti di topi anestetizzati e ventilati meccanicamente rappresenta un potente strumento per l'analisi della microvascolarepolmonare 13,14. L'escissione di una finestra circolare nella parete toracica dà accesso microscopico alla superficie del polmone e consente l'analisi di vasi polmonari subpleurali con un diametro fino a 50 μm. Combinando questa tecnica con l'infusione di FITC-dextran, Tabuchi et al. dimostrato che solo arteriole di medie dimensioni con diametri di 30-50 μm mostrano una marcata risposta all'ipossia che ha sostenuto per un periodo di 60 minuti con una lieve attenuazione dopo 30 minuti. Al contrario, piccole arteriole con diametri di 20-30 μm hanno mostrato solo una risposta minore all'ipossia3. Tuttavia, questa tecnica non consente l'analisi di arterie con diametro maggiore di 50 μm poiché questi vasi si trovano troppo in profondità nel tessuto polmonare.
Al fine di colmare il divario nell'analisi di arterie polmonari grandi e molto piccole (come i vasi subpleurali) dei polmoni murini, abbiamo adottato un metodo che è stato descritto da Martin et al. per l'analisi della reattività delle vie aeree15. Basato su una tecnica di instillazione del gel di agarosio, facilita la preparazione di fette polmonari tagliate di precisione (PCLS) da questo organo relativamente morbido ed elastico. All'interno del PCLS la vasoreattività delle arterie sesate incrociate con diametro interno compreso tra 20-100 μm può essere osservata direttamente mediante videomicroscopia. L'applicazione di farmaci durante l'incubazione ipossica del PCLS consente l'analisi dei loro effetti sull'HPV. È di particolare importanza che questa tecnica possa essere applicata anche al topo geneticamente modificato. In base alla loro posizione all'interno del polmone, classifichiamo le arterie come vasi pre e intra-acinari, con diametri interni rispettivamente di 20-40 μm e 40-100 μm. Sotto una visione funzionale l'arteria intra-acinare fornisce un singolo acino polmonare con sangue e l'arteria pre-acinare sono le sezioni precedenti del vaso. La registrazione di immagini su una fotocamera digitale consente la successiva quantificazione della vasoreazione. Un attributo ovvio di questo modello PCLS è la mancanza di sollecitazione di taglio che agisce sull'endotelio. Al contrario, nei recipienti perfusi l'HPV acuto porta ad un aumento dello stress da taglio, inducendo così meccanismi secondari come il rilascio di NO16. Inoltre, l'uso del PCLS consente misurazioni di HPV senza influenze neurali o ormonali extrapolmonari. A differenza dei sistemi di coltura cellulare, ad esempio preparati da cellule muscolari lisce arteriose polmonari canine17, l'architettura istologica della parete del vaso è quasi completamente preservata.
In sintesi, questo protocollo fornisce un metodo utile per l'analisi di potenziali sensori molecolari di ossigeno e/o vie cellulari responsabili dell'HPV delle arterie intrapolmonari con diametri interni tra 20-100 μm in condizioni libere da sollecitazioni di taglio.
Protocollo
1. Preparazione di miscele di gas, attrezzature, strumenti e soluzioni
In questa sezione vengono descritte le attrezzature e le attrezzature necessarie per il protocollo. Ulteriori dettagli e informazioni sul produttore sono disponibili nella tabella di accompagnamento.
- Ottenere o preparare le seguenti miscele di gas:
- Due bottiglie con miscela di gas normossico composta da 21% O2,5,3% CO2,73,7% N2.
- Una bottiglia con miscela di gas ipossico composta da 1% O2,5,3% CO2,93,7% N2.
- Raccogliere le seguenti attrezzature:
- Un forno a microonde, per sciogliere l'agarosio.
- Un armadio riscaldante, per lavare l'agarosio dalle sezioni polmonari (vedi sotto). Inserire un tubo collegato a una bottiglia con miscela di gas normossico nell'armadio.
- Un vibratomo con lamette appropriate, per tagliare i polmoni in fette spesse 200 μm. È vantaggioso se il vibratomo è arredato con un set di refrigerazione per raffreddare il tampone nel bacino del vibratomo.
- Una camera di superfusione flow-through montata su un microscopio invertito, per l'analisi dell'HPV delle arterie intrapolmonari.
- Per facilitare la fissazione delle sezioni polmonari sul fondo della camera, collegare le corde di nylon a un anello di platino (autocostruito). Unire la camera di perfusione a una pompa peristaltica con portate regolate rispettivamente a 0,7 ml/min e 6 ml/min.
- Assemblare l'apparecchiatura in modo che durante gli esperimenti il supporto sia conservato in un bagno d'acqua a 37 °C e bolleto con gas normossico o ipossico utilizzando cannule 21 G x 4 3/4. Utilizzare inoltre un secondo collegamento dalla bombola di gas per consentire di insessare le miscele normossiche/ipossiche di gas nello spazio d'aria della camera di perfusione. Assicurarsi che tutti i tubi di questo sistema siano a tenuta di gas.
- Una telecamera CCD montata su un microscopio verticale rovesciato per registrare le immagini dell'arteria analizzata.
- Preparare i seguenti strumenti:
- Per la preparazione dei polmoni: un set di sezionamento sterile che include una forbice ruvida e due paia di forcep, una forbice fine per l'apertura del torace, un microscissore per tagliare un buco nella trachea per riempire l'agarosio e cucire cotone (circa 20 cm) per la legatura della trachea per prevenire il deflusso dell'agarosio.
- Per il riempimento delle vie respiratorie con agarosio: collegare una siringa da 2 ml al tubo di plastica flessibile di una cannula indwelling IV (20 G x 1 1/4).
- Per la perfusione dei polmoni con tampone: fissare una siringa da 50 ml come serbatoio tampone a circa 40 cm sopra il luogo di lavoro per la preparazione del topo.
- Per il deflusso del tampone: collegare la siringa a un tubo a cui è attaccata una cannula 25 G x 1. Utilizzare un morsetto sul tubo per regolare il deflusso a circa 1 goccia/sec (circa 0,3-0,4 ml/min).
- Preparare i buffer e i supporti seguenti:
- Fare 1.000 ml di tampone HEPES-Ringer (10 mM HEPES, 136,4 mM NaCl, 5,6 mM KCl, 1 mM MgCl2•6H2O, 2,2 mM CaCl2•2H2O, 11 mM di glucosio, pH 7,4). Conservare il tampone filtrato sterile (dimensione dei pori del filtro: 0,2 μm) a 4 °C.
- Circa 30 minuti prima di iniziare l'isolamento dei polmoni preparano le seguenti soluzioni:
- Sciogliere l'1,5% con agarosio a basso punto di fusione nel tampone HEPES-Ringer (volume totale 10 ml) e scioglierlo cuoti in un forno a microonde. Successivamente, raffreddarlo fino a 37 °C mediante stoccaggio in un armadio riscaldante. Prewarm la siringa da 2 ml per riempire l'agarosio nelle vie respiratorie polmonari.
- Prendere 20 ml del tampone HEPES-Ringer, aggiungere l'eparina ad una concentrazione finale di 250 I.U./ml e riscaldare il tampone a 37 °C. Immediatamente prima dell'uso aggiungere nitroprusside di sodio a una concentrazione finale di 75 μM. Questo è il tampone perfusione per la corsa dal sangue dalla vascucolatura polmonare.
- Mettere il tampone HEPES-Ringer da 200 ml in un bicchiere di vetro e conservarlo sul ghiaccio. Questo tampone sarà necessario per raffreddare i polmoni isolati riempiti di agarosio.
- Riempire circa 200 ml di MEM integrato con 1% di penicillina/streptomicina in un bicchiere e conservarlo a 37 °C nell'armadio riscaldante. Bollare il mezzo con miscela di gas normossico. Questo verrà utilizzato per la rimozione dell'agarosio dalle sezioni polmonari.
- Prewarm 2 bottiglie di MEM integrate con 1% di penicillina/streptomicina in bagno d'acqua a 37 °C e bollarle con miscela di gas normossico e ipossia, rispettivamente, per almeno 2 ore prima di iniziare le misurazioni videomorfometriche. Saranno necessari circa 250 ml di MEM per misurazione.
- Raccogliere i seguenti materiali aggiuntivi:
- 70% EtOH per la disinfezione.
- Soluzione stock di eparina (25.000 I.U./5 ml), conservata a 4 °C (vedi sopra).
- Soluzione stock del nitroprusside di sodio donatore di NO (Nipruss): 10 mM in H2O, conservato sul ghiaccio (vedi sopra).
- Soluzione stock di tromboxane analogico U46619: 10 μM in etanolo, conservato su ghiaccio.
- Supercolla.
- Cucire cotone per la legatura della trachea dopo il riempimento con agarosio.
2. Animali
Utilizzare topi (ad esempio del ceppo C57Bl6) di entrambi i sessi all'età di 10-25 settimane. L'HPV può anche essere analizzato in ceppi knockout e nei corrispondenti ceppi di tipo selvatico.
Tutti gli esperimenti sono stati eseguiti secondo le linee guida NIH per la cura e l'uso di animali da esperimento, e sono stati approvati dai consigli istituzionali locali.
3. Isolamento dei polmoni murini e preparazione di fette polmonari tagliate di precisione (PCLS)
- Uccidi il topo per lussazione cervicale. Immediatamente dopo l'uccisione, sterilizzare la superficie del corpo ventrale con il 70% di EtOH e utilizzare la forbice ruvida per tagliare la pelle lungo la linea mediana ventrale dal mento al bacino.
Nota: Poiché è noto che gli anestetici inalatori come l'isoflurane hanno un impatto sul tonovascolare 18,19, non utilizzare anestetici volatili. - Dopo l'apertura della cavità addominale, mettere da parte gli anelli intestinali e regolare i grandi vasi addominali per il sanguinamento. Dopo aver penetrato il diaframma con la forbice fine, i polmoni collasseranno a causa dell'ingresso dell'aria nella cavità pleurica. Utilizzare la forbice per staccare il diaframma dall'apertura toracica inferiore. Tagliare lateralmente le costole e la clavicola per rimuovere la parte ventrale della gabbia di strappo.
Nota: È importante che i polmoni non siano danneggiati in questo passaggio poiché altrimenti il gonfiore dei polmoni con agarosio sarà impossibile! Utilizzare solo strumenti sterili e vetrerie da laboratorio. - Prima di iniziare la perfusione della vascuola polmonare, tagliare un piccolo foro nel ventricolo sinistro del cuore per scaricare il tampone. Riempire il serbatoio della siringa con tampone HEPES-Ringer caldo (37 °C) contenente eparina e nitroprusside di sodio (tampone perfusione) e perfondere lentamente la vascucolatura polmonare attraverso il ventricolo destro.
Nota: La perfusione è efficiente quando i polmoni cambiano colore e hanno un aspetto bianco. In questo passaggio è importante aggiungere nitroprusside di sodio nel tampone perfusione; ciò impedisce alle arterie pre-acinari di derubare dal tessuto circostante. - Rimuovere le ghiandole salivari, i piccoli muscoli e il tessuto connettivo dalla trachea. Scollegare la trachea dal tessuto connettivo circostante e filo cucire cotone tra esofago e trachea per una successiva legatura.
- Utilizzare il microscissore per tagliare un piccolo foro nella parte superiore della trachea tra due cartilagine tracheali vicine. Ora inserisci il tubo di plastica flessibile di una cannula indwelling IV attraverso il piccolo foro nella trachea e fissalo con cura con il cotone da cucito. Riempire lentamente le vie aeree con l'agarosio a basso punto di fusione caldo (37 °C). Osserva i polmoni: All'inizio il polmone destro inizia ad espandersi seguito dal polmone sinistro. Il riempimento viene completato quando entrambi i polmoni sono gonfiati a un volume paragonabile alla situazione in vivo (circa 1,2-2,0 ml a seconda del sesso, dell'età e del peso).
Nota: Se un solo polmone si espande, il tubo di plastica potrebbe essere stato inserito troppo in profondità in modo che abbia raggiunto il bronco. In questo caso, deve essere estratto un po '. Tieni presente che l'agarosio si solidificherà quando si raffredda gradualmente. - Quando i polmoni sono pieni, estrarre contemporaneamente il tubo di plastica e ligare la trachea con il cotone da cucito per evitare il deflusso dell'agarosio. Successivamente, tagliare la trachea sopra la legatura e staccare i polmoni e il cuore in blocco dal petto.
Nota: per i principianti, potrebbe essere utile chiedere supporto a un collega nella fase di legatura. - Trasferire il pacchetto d'organo nel tampone HEPES-Ringer ghiacciato per solidificare l'agarosio. Questo accade in pochi minuti.
- Separare i singoli lobi polmonari e fissare un lobo con supercolla sul supporto del campione del vibratomo.
Nota: È utile attaccare un pezzo di sughero di champagne sul supporto che funge da spiedo durante il taglio del tessuto polmonare elastico. A seconda del lobo polmonare utilizzato e del suo orientamento sul supporto del campione, il PCLS ottenuto può essere più adatto per l'analisi di vasi piccoli o grandi. Per lo più usiamo il lobo sinistro e il lobo cranici destro per la preparazione del PCLS. Per ottenere piccole arterie intra-acinari sezionate, incollare il lobo destro cranicio con l'ilum al supporto e affettare dalla periferia. Per ottenere arterie pre-acinari sedottate, allineare l'hilum del lobo destro con il sughero di champagne. - Utilizzare un vibratomo dotato di una lama di rasoio fresca per tagliare il lobo polmonare in fette spesse 200 μm (velocità: 12 = 1,2 mm /sec; frequenza: 100; ampiezza: 1,0). Raccogliere il PCLS nel bacino del vibratomo riempito con tampone HEPES-Ringer freddo a 4 °C.
Nota: Si consiglia il raffreddamento della suoneria HEPES ma non essenziale. - Per la rimozione dell'agarosio, trasferire le sezioni d'organo in un bicchiere riempito con circa 200 ml di MEM caldo a 37 °C. Mettere il becher nell'armadio di riscaldamento in cui viene inserito un tubo unito a una bottiglia con miscela di gas normossico. Bollare il MEM con il gas normossico in modo che le sezioni polmonari si muovano lentamente nel mezzo. Dopo circa 2 ore, le "placche di agarosio" che riempiono gli spazi aerei verranno rimosse dal tessuto polmonare. Questo può essere riconosciuto dal fatto che le sezioni non nuotano più sulla parte superiore del mezzo ma si depositano sul fondo del becher.
4. Analisi videomorfometrica delle arterie intrapolmonarie del PCLS
- Per l'analisi videomorfometrica delle arterie intrapolmonari, trasferire un PCLS nella camera di superfusione flow-through riempita con MEM gassato normossico da 1,2 ml. Fissare il PCLS nella parte inferiore della camera con corde di nylon collegate a un anello di platino (diametro esterno/interno: 14/10 mm).
- Scansionare microscopicamente il PCLS alla ricerca di arterie seghe incrociate con diametri interni tra 20-100 μm.
Nota: Il lume delle arterie è rivestito da cellule endoteliali piatte. Le cellule muscolari lisce circostanti possono essere identificate nell'immagine di contrasto di fase come un "anello scuro" che circonda il lume (vedi immagini di contrasto di fase nella figura 2). Al contrario, le vie aeree possono essere identificate dall'epitelio colonnare inizialmente pseudostratificato che transita sulla strada verso la superficie pleurica in un semplice epitelio colonnare seguito da un semplice epitelio cuboidale.- Misurare il diametro interno all'inizio di ogni esperimento.
Nota: nei vasi leggermente tagliati obliquamente, il vero diametro interno della struttura tubolare può essere determinato in un angolo di 90 ° rispetto all'asse più lungo del lume. Grandi arterie pre-acinari con diametri interni >40 μm corrono adiacenti a bronchi e bronchiole. Piccole arterie intra-acinari con diametro interno <40 μm si trovano a soffici di setti alveolari accanto ad alveolae e condotti alveolari6.
- Misurare il diametro interno all'inizio di ogni esperimento.
- Progettazione sperimentale:
- Iniziare ogni esperimento con una "fase di adattamento" in cui la camera è perfusa con mezzo gassato normossico (portata: 0,7 ml/min; 10 min). Successivamente, testare la vitalità del vaso: Analizzare la contrattilità dell'arteria con l'aggiunta di 12 μl di 10 μM U46619 (concentrazione finale 0,1 μM; 10 min; nessun flusso).
Nota: Per questo lavoro, un recipiente è definito vitale quando l'area luminare è ridotta di almeno il 30% (per il metodo di misurazione vedi sotto). - Dopo aver lavato il farmaco con mezzo gassato normossico (portata: 6 ml/min; 10 min) dilatare l'arteria con l'applicazione di 3 μl di Nipruss da 10 mM (concentrazione finale 25 μM; 10 min; nessun flusso).
- Ancora una volta, rimuovere il farmaco con un lavaggio di 10 minuti con mezzo gassato normossico (portata: 6 ml / min) seguito da 10 minuti a un flusso di 0,7 ml / min.
- Indurre vasocostrizione polmonare ipossica per incubazione del PCLS con mezzo gassato ipossia (portata: 0,7 ml/min; 40 min). Con un sistema di tubi aggiuntivo, alimentare la miscela di gas ipossia nello spazio d'aria della camera di perfusione.
- Rimuovere il mezzo ipossia con un lavaggio di 20 minuti con mezzo gassato normossico (portata: 6 ml/min).
- Alla fine di ogni esperimento, aggiungere 1,2 μl di 10 μM U46619 (concentrazione finale 0,01 μM; 20 min; nessun flusso) alla camera di perfusione per indurre vasocostrizione.
Nota: Questo passaggio finale consente di determinare se un cambiamento nella risposta ipossia (ad esempio indotto dall'applicazione simultanea di un farmaco in fase ipossica o osservato in un PCLS preparato da un ceppo di topo knockout) è specifico per la costrizione indotta da ipossia o se riflette un impatto generale sulla contrattilità. La concentrazione di 0,01 μM corrisponde al valore EC50 di U46619, stimato nelle precedenti misurazioni concentrazione-contrazione (non pubblicate). - Utilizzare un altro PCLS per eseguire esperimenti di controllo con MEM a gas normossico invece che ipossico e miscela di gas normossico nello spazio aereo della camera di perfusione.
- Iniziare ogni esperimento con una "fase di adattamento" in cui la camera è perfusa con mezzo gassato normossico (portata: 0,7 ml/min; 10 min). Successivamente, testare la vitalità del vaso: Analizzare la contrattilità dell'arteria con l'aggiunta di 12 μl di 10 μM U46619 (concentrazione finale 0,1 μM; 10 min; nessun flusso).
5. Analisi della vasoreattività e presentazione grafica
- Utilizzando un software adatto scatta foto dall'arteria sesata trasversale ogni minuto durante l'intero esperimento.
- Utilizzando un software adatto valutare i cambiamenti dell'area luminare dei vasi allineando i confini interni a mano utilizzando immagini a schermo intero.
Nota: è sufficiente analizzare ogni seconda immagine per ottenere grafici chiari. Tuttavia, quando una condizione nella camera di superfusione flow-through viene cambiata in un'altra, analizzare ogni immagine. Le immagini rimanenti fungono da backup nel caso in cui una fotografia non possa essere analizzata.
Sfortunatamente, questo passo che richiede tempo deve essere fatto a mano e non con programmi appropriati poiché a volte le cellule del sangue sono attaccate alla parete vascolare che si muovono durante la misurazione o non è una sezione trasversale perfetta del vaso ma una sezione tangenziale in cui una localizzazione affidabile dei confini interni può essere eseguita solo sotto controllo visivo. - Definire il valore ottenuto per l'area del lume del recipiente all'inizio dell'esperimento come 100% e la vasocostrizione o la dilatazione espressa come diminuzione o aumento relativo di questo valore.
- Per ogni esperimento tracciare l'area luminare relativa rispetto al tempo utilizzando un software adatto.
- Per riassumere diversi esperimenti, tracciare i mezzi delle aree luminali relative +/- errore standard della media (SEM) rispetto al tempo.
Nota: Per una chiara presentazione degli effetti di varie sostanze sull'ipossia o sulla vasocostrizione polmonare indotta da U46619 o della risposta ipossica dei ceppi di topo knockout, la fase iniziale degli esperimenti, in cui viene testata la vitalità del vaso, può essere omessa dal grafico. In questo caso, i valori ottenuti all'inizio dell'esposizione all'ossigeno ridotto sono definiti al 100%.
6. Analisi statistica
- Analizzare le differenze tra i gruppi sperimentali con il Kruskal-Wallis- e il mann-whitney-test, con p≤0.05 considerato significativo, e p≤0.01 altamente significativo.
Nota: Per ulteriori informazioni sulla preparazione e l'uso operativo del PCLS vedere anche20,21.
Risultati
Nella figura 1 sono riportati i risultati della misurazione dell'HPV di una grande arteria pre-acinare e nella figura 2 delle piccole arterie intra-acinari. Nelle immagini di contrasto di fase (Figure 1A e 2A) risulta chiaro che è possibile discriminare queste 2 classi di arterie in base alla loro posizione all'interno del tessuto polmonare: le arterie pre-acinari corrono in stretto vicinato a bronchi e bronchioli (Figura 1A), mentre le arterie intra-acinari si trovano a soffici di setti alveolari e circondate da alveolae(Figura 2A). Con un po ' di pratica è possibile vedere i cambiamenti nell'area luminare in risposta a U46619 sulle immagini di contrasto di fase(figure 1A e 2A). Tuttavia, la vasocostrizione polmonare ipossica spesso non è così pronunciata e diventa chiara solo dopo una valutazione completa dei cambiamenti delle aree luminali(figure 1B, 1C, 2B e, 2C). Per motivi didattici abbiamo dato un esempio di arteria pre-acinare che mostra una vasocostrizione insolitamente pronunciata. In media, l'HPV si traduce in una riduzione del 20-30% dell'area luminare.
Nella figura 2 vengono mostrate le registrazioni di piccole arterie intra-acinari incubate con mezzo ipossico-gassato con o senza pinacidile da 50 μM (un apripista di canali di potassio mitocondriali sensibili all'ATP) e l'effetto inibitorio del farmaco diventa chiaramente visibile. La parte finale dell'esperimento dimostra la selettività dell'azione del farmaco su HPV: Vasocostrizione indotta dall'analogico tromboboxano U46619 non viene modificata con l'aggiunta di pinacidil. Infatti, la curva per l'arteria esposta il pinacidile corre nettamente più bassa delle altre due, ma l'estensione di riduzione dell'area luminare solo di U46619 è paragonabile. In questo caso è stata la deviazione incompleta dell'HPV a causare la differenza tra le curve. In questo grafico è inclusa anche un'arteria esposta al mezzo gassato normossico come controllo aggiuntivo. In questa condizione, non sono rilevabili cambiamenti dell'area luminare.
Nella figura 3 sono riportati i dati della serie completa di misurazioni sull'influenza del pinacidil sull'HPV. Per il confronto dei due gruppi per le differenze statistiche, i set di dati dei punti di tempo indicati sono stati analizzati con il Kruskal-Wallis- e il test di Mann-Whitney. L'HPV è stato chiaramente abolito in presenza di pinacidil mentre la contrazione indotta da U46619 è rimasta invariata.
In alternativa, è possibile identificare le differenze tra i gruppi rispetto all'area sotto la curva descritta in Müller-Redetzky et al. 22 di cui: La commissione per i
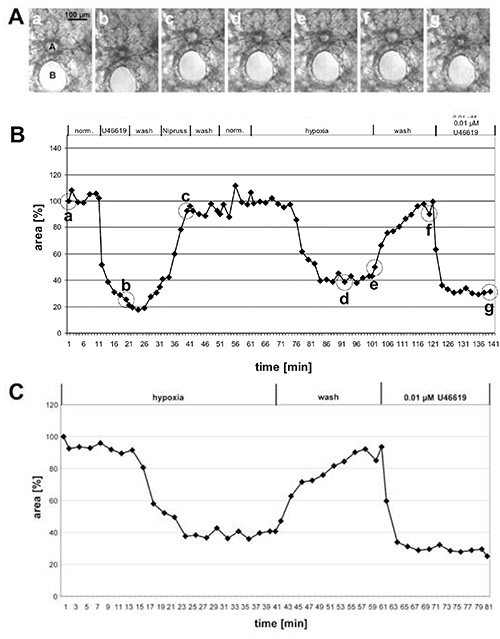
Figura 1. Misurazione dell'HPV di una grande arteria pre-acinare. (A) Immagini a contrasto di fase di un'arteria pre-acinare sesata (a) che corre in un quartiere vicino a un bronco seccato(B). Le immagini sono scattate nei punti di tempo indicati in (B) da cerchi: all'inizio della misurazione (a), al termine del trattamento con U46619 (b), al termine dell'esposizione a Nipruss (c), dopo 30 o 40 min in mezzo gassato ipossico (d, e), dopo il lavaggio con mezzo gassato normossico (f), e dopo l'applicazione finale di U46619 (g). Nel grafico (B) le variazioni dell'area luminare sono tracciate rispetto al tempo, mentre l'area luminare all'inizio dell'esperimento è definita come 100% e la vasocostrizione/dilatazione sono date come valori relativi. In questo caso l'ipossia induce una riduzione del 60% dell'area luminare. (C) Per una presentazione più chiara della risposta ipossia, la fase iniziale dell'esperimento in cui è stata sperimentata la vasoreattività non è inclusa, ma il valore ottenuto immediatamente prima dell'esposizione all'ossigeno ridotto è fissato al 100% (cfr. anche figura 2). Clicca qui per visualizzare l'immagine più grande.
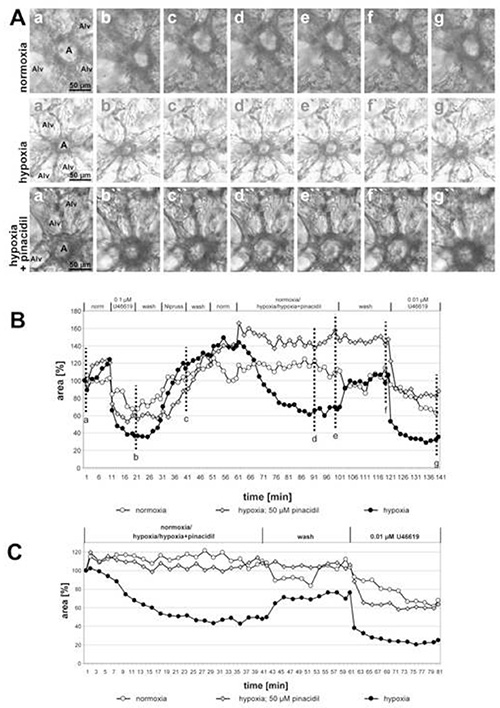
Figura 2. Impatto del pinacidil (un aprisele nonselective dei canali mitocondriali di potassio sensibili all'ATP; mitoKATP) sull'HPV di piccole arterie intra-acinari. (A) Le arterie intra-acinari (a) si trovano a soffici di setti alveolari. Alv = alveolo. La sequenza delle singole condizioni applicate in questi esperimenti è fornita nel titolo del grafico (B). L'esposizione ipossica viene eseguita in presenza o assenza di 50 μM pinacidil. Le incubazioni di controllo vengono fatte con mezzo gassato normossico. Le immagini mostrate in (A) sono scattate all'inizio della misurazione (a, a', a"), al termine del trattamento con U46619 (b, b', b"), al termine dell'esposizione a Nipruss (c, c', c"), dopo 30 o 40 min in mezzo gassato ipossico o normossico (d, d', d"; e, e', e"), dopo il lavaggio con mezzo gassato normossico (f, f', f"), e dopo l'applicazione finale di U46619 (g, g', g"). Per una presentazione più chiara della risposta alla normoxia/ipossia/ipossia+pinacidile, i valori ottenuti immediatamente prima dell'esposizione al mezzo normossico-/ipossico-gassato sono fissati al 100% (C). Clicca qui per visualizzare l'immagine più grande.
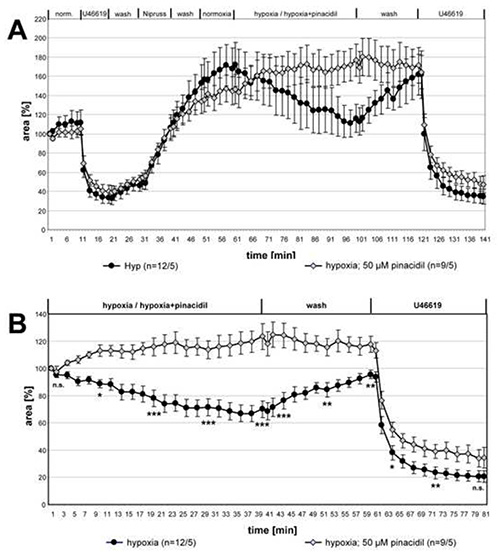
Figura 3. Inibizione dell'HPV da parte del pinacidile. Le registrazioni di piccole arterie intra-acinari esposte a mezzo gassato ipossico con o senza pinacidile 50 μM sono riassunte e presentate come mezzi ± SEM. In (A) le registrazioni complete sono riportate, in (B) vengono mostrati i dati relativi in relazione al valore all'inizio dell'incubazione ipossia. Nessuna vasoreattività è rilevabile nel PCLS che sono esposti a mezzi ipossici gassati contenenti pinacidil. La vasocostrizione indotta da U46619 non è influenzata dal farmaco. "n" tra parentesi si riferisce al numero di arterie/numero di animali da cui è stato effettuato il PCLS. In altre parole, il primo numero descrive il conteggio delle sezioni polmonari analizzate e il secondo numero fornisce il conteggio dei topi da cui sono state preparate queste sezioni. Nei punti di tempo indicati le differenze tra i due gruppi sono testate per la significatività. n.s.: non significativo, *: p≤0.05, **: p≤0.01, ***: p≤0.001. Clicca qui per visualizzare l'immagine più grande.
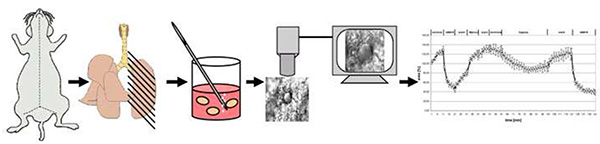
Figura 4. Panoramica schematica del metodo. In breve, i topi vengono uccisi dalla lussazione cervicale. Dopo l'apertura del torace, i polmoni vengono riempiti con agarosio a basso punto di fusione e dopo il raffreddamento tagliato a fette polmonari tagliate con precisione spessa 200 μm (PCLS). Dopo aver rimosso l'agarosio a 37 °C un PCLS viene trasferito nella camera di superfusione flow-through in cui è esposto a mezzo normossico o a gas medio con 1% O2. La vasoreattività è registrata come cambiamenti nell'area luminare. Clicca qui per visualizzare l'immagine più grande.
Discussione
Il polmone di topo isolato ventilato e perfuso è un ottimo modello per l'analisi della risposta fisiologica del sistema vascolare polmonare sui cambiamenti nell'apporto di ossigeno e consente, tra l'altro, la misurazione continua della pressione arteriosa polmonare1. Tuttavia, questo modello non consente l'identificazione e l'analisi di quei segmenti vascolari che mostrano la risposta più forte all'ipossia. Questo è il vantaggio della nostra analisi videomorfometrica di PCLS che facilita la misurazione dell'HPV delle singole arterie con diametri interni di 20-100 μm. A differenza dei sistemi di coltura cellulare, tutti i tipi di cellule sono presenti nella loro configurazione originale della matrice tissutale. Inoltre, un polmone è sufficiente per la preparazione di molti PCLS, in modo che almeno parzialmente gli esperimenti possano essere standardizzati con l'uso di sezioni dello stesso mouse. Secondo il concetto 3R (riduzione, affinamento e sostituzione degli animali da laboratorio nelle scienze della vita) di Russell e Burch23 questo fatto sostiene anche l'uso del PCLS.
Tuttavia, bisogna tenere a mente che il tessuto è danneggiato tagliando con un vibratoma e una segnalazione longitudinale, ad esempio attraverso le cellule endoteliali come postulato da Kübler et al. 14 non è più possibile.
Inizialmente, i PCLS sono stati applicati principalmente per studi biochimici, farmacologici e tossicologici, ma nel frattempo sono utilizzati anche per la misurazione della contrattilità bronchiale, della funzione mucociliare e delle risposte vascolari (per le recensioni vedi Sanderson20 e Davies21). Held et al. hanno effettuato uno studio in cui hanno confrontato i modelli di polmone di topo isolato perfuso e ventilato e di PCLS24. Dall'analisi delle risposte delle vie aeree e dei vasi polmonari a una varietà di mediatori endogeni hanno scoperto che importanti caratteristiche dell'intero polmone sono state mantenute nel PCLS.
Nel PCLS, le condizioni ipossiche non sono stabilite attraverso le vie aeree come nel polmone intatto ma mediante incubazione della sezione polmonare nel mezzo ipossico-gassato. Abbiamo analizzato la pressione parziale dell'ossigeno (pO2)del mezzo prepartita con 1% O2,5,3% CO2,93,7% N2 e con 21% O2,5,3% CO2, 73,7% N2,rispettivamente, utilizzando un analizzatore di gas ematico. Immediatamente prima di alimentarlo nella camera di perfusione, il pO2 del MEM gassato ipossico era di 40 mmHg e quello del mezzo normossico gassato 160 mmHg6. Nel polmone intatto l'HPV viene indotto quando la pO alveolare2 scende al di sotto di 50 mmHg25, una situazione che può essere ovviamente mimicked per applicazione di mezzo ipossico-gassato. I nostri dati sull'estensione dell'HPV corrispondono bene ai risultati ottenuti con un diverso approccio sperimentale. Yamaguchi et al. hanno applicato polmoni a ratto isolati per esaminare microvessel con diametro di 20-30 μm mediante microscopia a scansione laser confocale in tempo reale accoppiata a una fotocamera ad alta sensibilità con un intensificatore di immagini10. Hanno osservato una riduzione media del diametro di 2,7 μm dopo l'esposizione dei polmoni all'ipossia. Si può calcolare che una riduzione del 20% dell'area luminare mentre la misuriamo nel nostro sistema corrisponde a una diminuzione di circa il 15% del diametro.
Nei nostri esperimenti abbiamo classificato le arterie come vasi pre e intra-acinari, rispettivamente, con diametri interni di 40-100 μm e 20-40 μm. Negli esseri umani la transizione dalle arterie muscolari a non muscolari avviene nell'intervallo di diametro di 70-100 μm. Nei topi, le cellule muscolari lisce sono presenti fino a un diametro esterno di 20 μm26. Per questo motivo non è possibile analizzare le arterie con diametri inferiori a 20 μm poiché non possono essere identificate in modo affidabile in base all'immagine di contrasto di fase. All'altra estremità della scala, i vasi con diametri superiori a 100 μm difficilmente si trovano nel PCLS e comunemente spogliati dal tessuto circostante.
In realtà, un certo numero di candidati molecolari sono discussi come sensori di ossigeno molecolare o come componente della cascata di segnalazione risultante in HPV (per una revisione vedi Sylvester et al. 4). Una volta disponibili topi knockout appropriati, la videomorfometria può essere utilizzata per l'analisi della vasoreattività delle arterie pre e intra-acinari rispetto agli animali di tipo selvatico. Tuttavia, i PCLS sono stati utilizzati anche per altri problemi: Faro et al. li ha impiegati per caratterizzare lo sviluppo della dilatazione dipendente dall'endotelio nelpolmone dopo la nascita 29 e PCLS preparato da cavie esposte al fumo o all'aria ogni giorno per 2 settimane sono stati utilizzati per dimostrare l'impatto del fumo di sigaretta sulla vasoreattività attraverso l'induzione della disfunzione endoteliale30.
Passaggi critici all'interno del protocollo
Nei nostri esperimenti abbiamo classificato le arterie come pre-acinari (diametri interni di 40-100 μm) e intra-acinare (diametri interni di 20-40 μm). Soprattutto per la preparazione di sezioni polmonari che dovrebbero essere utilizzate per l'analisi di vasi più grandi è importante aggiungere nitroprusside di sodio al tampone perfusione. Questo farmaco previene la contrazione dei vasi durante la preparazione del campione e quindi la loro fregatura dal tessuto circostante portando a vasodilatazione incompleta. Il nitroprusside di sodio nel tampone perfusione non è così importante per la preparazione della sezione polmonare che dovrebbe essere utilizzata per l'analisi di piccole arterie perché sono fortemente ancorate al setto alveolare.
Tutti gli esperimenti devono essere avviati con incubazioni in cui viene testata la reattività delle arterie. Raramente, abbiamo ottenuto preparati polmonari in cui non era rilevabile alcuna risposta delle navi agli appaltatori o ai dilatatori. Non conosciamo il motivo: potrebbe essere che il volume dell'agarosio riempito nei polmoni era troppo grande o troppo basso in modo che il taglio dell'organo nel PCLS non fosse ottimale. In alternativa, è immaginabile che l'agarosio si sia raffreddato troppo velocemente durante la procedura di instillazione con conseguente dannoso stress da taglio. Nel caso in cui in un singolo PCLS non sia rilevabile alcuna arteria praticabile, la sezione deve essere scartata e sostituita da un'altra.
La decisione sulla fattibilità di un'arteria è stata presa sulla base della risposta all'U46619. L'applicazione di U46619 ad una concentrazione di 0,1 μM induce una vasocostrizione che - dopo qualche esercizio - è visibile direttamente nella sequenza di immagini sullo schermo. Poiché ci sono alcune variazioni nella vasoreattività, studiamo l'impatto di un farmaco sull'HPV misurando la vasoriscrizione in sezioni polmonari esposte al farmaco o al solo mezzo a turno.
L'HPV di una singola arteria è spesso difficilmente rilevabile al microscopio e in media si traduce in una riduzione dell'area luminare di circa il 20-30%. Tuttavia, piccoli cambiamenti nel diametro di un'arteria hanno un input distinto sulla resistenza al flusso. Secondo l'equazione "R = 1/r4" con R=resistenza e r=raggio, la resistenza al flusso è inversamente proporzionale alla quarta potenza del raggio. Faccio un esempio: un'arteria "ideale" che mostra una sezione trasversale circolare con un diametro di 40 μm (r =20 μm) ha un'area luminare di circa 1.260 μm2. Quando l'area luminare viene ridotta del 20%, possiamo calcolare che il diametro del vaso è ridotto del 10,5% a 35,8 μm (r = 17,9 μm). Secondo l'equazione sopra fornita, la resistenza al flusso di questo vaso aumenterebbe da 6,25 x 10-6 a 9,71 x 10-6 che è di circa il 55%. In caso di riduzione dell'area luminare del 30% il raggio diminuirebbe di circa il 16%, ma la resistenza al flusso aumenterebbe di circa il 100%. Sebbene questi calcoli siano una semplificazione eccessiva in cui si presume un flusso sanguigno laminare e una forma vaso di un tubo rigido, è suggestivo dell'impatto di cambiamenti già minori del diametro sulla resistenza al flusso.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questa ricerca è sponsorizzata dall'Excellence Cluster Cardio-Pulmonary System.
Materiali
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
Riferimenti
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon