Method Article
マウス精密切り出肺スライスを用いた低酸素肺血管収縮のビデオモルフォメトリクス解析
要約
低酸素肺血管収縮(HPV)は、肺胞低酸素肺灌流で換気に一致する重要な生理学的現象である。HPVに寄与する主要な血管セグメントは、口腔内動脈である。ここでは、直径20~100μmのマウス肺血管のHPVの分析プロトコルについて説明します。
要約
急性肺胞性低酸素症は、肺灌流を換気に一致させる肺血管収縮(HPV)(フォン・オイラー・リリェストランド機構とも呼ばれる)を引き起こす。これまで、基礎となるメカニズムは完全には理解されていません。HPVに寄与する主要な血管セグメントは、口腔内動脈である。この血管部は、末端気管支に肺遠位の部分として定義される個々のアキヌスの血液供給を担当する。口腔内動脈は、主に肺のその部分にあり、孤立した浸透性肺の肺動脈圧の測定や解剖された近位肺動脈セグメントからの強制記録など、多くの一般的に使用される技術によって選択的に到達することができない1,2の部分である。リアルタイム共焦点レーザー走査発光顕微鏡による胸下血管の分析は、直径3で最大50μmの血管に限定される。
内径20~100μmの範囲でマウス肺内動脈のHPVを研究する技術を提供します。これは、精密切断肺スライス(PCLS)における断面動脈のビデオモルフォメトリクス分析に基づいています。この方法により、肺胞管の隣の肺胞中隔のガセットと、気管支と気管支に隣接する40〜100μmの間の内径を有する大きな口腔前動脈に位置する内径20〜40μmの小さな口腔内動脈の血管活性を定量的に測定することができる。麻酔および換気されたマウスにおける胸下血管のリアルタイムイメージングとは対照的に、PCLSのビデオモルフォメトリクス分析はせん断ストレスのない条件下で起こる。我々の実験モデルでは、両動脈セグメントは、1%O2でガスを媒質に曝露すると単相性HPVを示し、低酸素症で30〜40分後に応答が薄れる。
概要
ほとんどの全身血管床では、低酸素症は、肺血管系の低酸素症によって引き起こされる血管収縮と比較して、血管拡張を誘発する。酸素張力低下に対するこの肺特異的応答は低酸素肺血管収縮(HPV)と呼ばれ、数秒以内に発徴し、ノルモキシ性換気に切り替えた後すぐに逆転する。HPVは60年以上前から知られているが、細胞酸素センサーとシグナル伝達カスケードは血管収縮をもたらし、まだ議論中である。HPVおよび肺高血圧症の発症には、低酸素誘発酸化還元およびROSの変化が不可欠であるという相対的な広範なコンセンサスがある(シルベスター ら.4 と シューマッカー ら5)当社独自のデータは、HPV6,7におけるミトコンドリア呼吸鎖の複合体IIの中心的役割をサポートする。最近、王 ら.酸素センシングとHPVの全く新しい概念を提示:そのデータに基づいて、肺胞低酸素症が隣接する毛細血管によって感知され、内皮細胞の膜脱分極を引き起こすことを提案した。応答は、上流の動脈8の平滑筋細胞の収縮につながる内皮細胞の結合40ギャップ接合部を介して伝搬される。
肺の動脈は気道と一緒に走り、それらと一緒に分岐し、継続的に直径が減少し、最終的に肺胞壁に位置する毛細血管系に血液を供給する。この動脈循環は、解剖学的および機能的に異なるセグメントで構成される。近位導管動脈は、壁に豊富な弾性線維を特徴とし、その後に肺血管抵抗を大部分制御する完全に筋肉化された肺内動脈が続く。ステップバイステップで、これらの動脈は筋肉層が不完全になるセグメントに通過し、最終的に血管は平滑筋アクチン免疫反応細胞を含まない。個々の肺のアシナスに血液を送る口腔内動脈は、部分的に筋肉のセグメント6を表す。同様に、肺動脈系は低酸素応答に関して均一な構造を表すものではなく、地域の多様性9,10を示す。例えば、ラット肺から分離された近位肺動脈では、低酸素症は二度的な応答を誘発し、短い持続期間の初期の急速な収縮を示し、これは、不完全な弛緩の後に、第2の遅いが持続的な収縮11が続く。ラット肺パレンチマから分離された抵抗動脈では、肺動脈の第4および第5分裂(外径<300μm)として、低酸素症は単発性狭窄を引き起こす。すでに1971年にGlazierとマレーは、低酸素性ガス混合物で換気された犬の肺における毛細血管赤血球濃度の変化の測定から結論付け、低酸素誘導血管抵抗の増加は主に毛細血管12の上流で起こった。今日では、麻酔および機械的に換気されたマウスの無傷の肺の生体内顕微鏡検査は、肺微小血管系13,14の分析のための強力なツールを表す。胸壁の円形窓の切除は肺の表面への顕微鏡的なアクセスを与え、直径50 μmまでの下胸肺の血管の分析を可能にする。この技術をFITC-dextranの注入と組み合わせることで、Tabuchi ら.直径30~50μmの中型動脈のみが、30分後にわずかな減衰で60分の期間にわたって持続した低酸素症に対して顕著な応答を示すことを実証した。対照的に、直径20〜30μmの小動脈は低酸素症3に対してわずかな応答しか示さなかった。しかし、この技術は、これらの血管が肺組織の深すぎるので、直径50μmの大きい動脈の分析を可能にしません。
マウス肺の大小および非常に小さい肺動脈(例えば、胸下血管)の分析におけるギャップを埋めるために、Martin らによって記述された方法を採用した。気道15の反応性の分析のため.アガロースゲルの植え付け技術に基づいて、この比較的柔らかく、弾性器官からの精密切断肺スライス(PCLS)の調製を容易にする。PCLS内で20〜100μmの間の内径を有する横断的な動脈の血管反応性は、ビデオ顕微鏡で直接観察することができる。PCLSの低酸素インキュベーション中の薬物の適用は、HPVに対するそれらの影響の分析を可能にする。この技術は遺伝子操作マウスにも応用できることが特に重要です。肺内の位置に基づいて、我々は、それぞれ20-40 μmと40-100 μmの内径を持つ前および内線血管として動脈を分類します。機能的な観点の下で、口腔内動脈は個々の肺静脈に血液を供給し、前の静脈動脈は前の血管セクションである。デジタルカメラでの画像の記録は、その後の血管反応の定量化を可能にする。このPCLSモデルの明らかな属性は、内皮に作用するせん断ストレスの欠如である。これに対して、穿ファフューズされた血管では急性HPVはせん断ストレスの上昇を招き、NO放出16などの二次的なメカニズムを誘導する。さらに、 PCLS の使用は、肺外神経またはホルモンの影響を受けることなく HPV の測定を可能にします。細胞培養系とは対照的に、例えば、イヌ肺動脈平滑筋細胞17から調製され、血管壁の組織学的アーキテクチャはほぼ完全に保存される。
要約すると、このプロトコルは、せん断ストレスのない条件下で、20〜100μmの間の内径を有する肺内動脈のHPVを担う潜在的な分子酸素センサおよび/または細胞経路の分析に役立つ方法を提供する。
プロトコル
1. 混合ガス、機器、機器、およびソリューションの製造
このセクションでは、プロトコルに必要な装置とセットアップについて説明します。追加の詳細と製造元の情報については、付属の表を参照してください。
- 以下の混合ガスを入手または準備します。
- 21%O2、5.3%CO2、73.7%N2からなるノルモキシガス混合物を含む2本のボトル。
- 1%O2、5.3%CO2、93.7%N2から構成される低酸素ガス混合物を含む1本のボトル。
- 以下の機器を集める:
- 電子レンジ、アガロースを溶かします。
- 肺切片からアガロースを洗い流す加熱キャビネット(下記参照)。ノルモキシ性ガス混合物を含むボトルに接続されたチューブをキャビネットに挿入します。
- 200 μm の厚さのスライスに肺を切断するための適切なカミソリの刃とビブラートメ。ビブラートメのバッファーをビブラート盆地で冷却するために、冷蔵セットが備え付けられている場合に有利です。
- 肺動脈のHPVの分析のために、逆顕微鏡に取り付けられたフロースルーの多重注入室。
- チャンバーの底部への肺切片の固定を容易にするために、白金リング(自己構築)にナイロンの糸を接続する。灌流チャンバを、流量がそれぞれ0.7 ml/minと6 ml/minに調整された蠕動ポンプに加わります。
- 実験中に媒体が37°Cの水浴に貯蔵され、21 G x 4 3/4カヌラを使用してノルモキシ性または低酸素ガスで泡立たされるように装置を組み立てます。さらに、ガスボトルからの第2の接続を使用して、ノルモキシ/低酸素ガス混合物を灌流チャンバの空域に供給できるようにします。このシステムのすべてのチューブがガスタイトであることを確認します。
- 分析した動脈の画像を記録するために直立反転顕微鏡に取り付けられたCCDカメラ。
- 次の機器を準備します。
- 肺の準備のために:粗いはさみと2組の鉗子を含む無菌解剖セット、胸部を開くための細かいはさみ、アガロースを充填するための気管に穴を開けるマイクロシザー、およびアガロースの流出を防ぐために気管の結紮のための綿(約20cm)を縫製する。
- アガロースで気道を充填する場合:IVの留置カニューレ(20 G x 1 1/4)の柔軟なプラスチックパイプに2mlの注射器を接続します。
- バッファを持つ肺の灌流のために:マウスの準備のための作業場所の上に約40cmの緩衝液貯留として50mlシリンジを固定する。
- バッファーの流出の場合:25 G x 1 カニューレが取り付けられているチューブにシリンジを接続します。チューブのクランプを使用して、流出を約1ドロップ/秒(約0.3〜0.4 ml/分)に調整します。
- 次のバッファとメディアを準備します。
- 1,000 ml HEPES-Ringer バッファー (10 mM HEPES, 136.4 mM NaCl, 5.6 mM KCl, 1 mM MgCl2•6H2O, 2.2 mM CaCl2•2H2O, 11 mM グルコース, pH 7.4)滅菌濾液(フィルターの細孔サイズ:0.2 μm)を4°Cに保存します。
- 肺の隔離を開始する約30分前に、次の解決策を準備します。
- HEPES-Ringerバッファー(総体積10ml)に1.5%w/v低融点アガロースを溶解し、電子レンジで調理して溶かします。その後、加熱キャビネットに保管して37°Cまで冷却します。肺気道にアガロースを充填するための2mlシリンジを前温め。
- HEPES-Ringerバッファーを20mlとし、ヘパリンを250 I.U.mlの最終濃度に加え、バッファーを37°Cに加熱します。 使用直前に、ニトロトルシドナトリウムを最終濃度75μMに加えます。これは、肺血管系から血液を流し落とす灌流バッファーです。
- ガラスビーカーに200mlのHEPES-Ringerバッファーを入れ、氷の上に保管します。このバッファーはアガロースで満たされた孤立した肺を冷却するために必要とされる。
- ガラスビーカーに1%ペニシリン/ストレプトマイシンを補った約200mlのMEMを充填し、加熱キャビネットの37°Cで保管してください。培地をノルモキシ性ガス混合物で泡立てろ。これは、肺の切片からアガロースの除去に使用されます.
- MEMのプレウォーム2ボトルは、37°Cに水浴中の1%ペニシリン/ストレプトマイシンを補い、ビデオモルフォメトリック測定を開始する前に少なくとも2時間、ノルモキシ性および低酸素性ガス混合物でそれらを泡立てる。測定ごとに約250mlのMEMが必要です。
- 以下の追加資料を収集します。
- 70% 消毒のためのEtOH.
- ヘパリンのストック溶液(25.000 I.U./5 ml)を4°C(上記参照)で保存。
- NOドナーニトロプルシドナトリウム(ニプルス)のストック溶液:10 mMをH2Oで、氷上に保存する(上記参照)。
- トロンボキサンアナログU46619のストック溶液:エタノール中の10 μM、氷の上に保存。
- スーパーグルー。
- アガロースで充填した後の気管の結紮のための綿を縫う。
2. 動物
10-25週齢で両方の性別のマウス(例えばC57Bl6株)を使用する。HPVは、ノックアウト株および対応する野生型株でも分析することができる。
すべての実験は、実験動物のケアと使用のためのNIHガイドラインに従って行われ、地元の機関理事会によって承認されました。
3. ネズミの肺の分離と精密切断肺スライスの調製(PCLS)
- 頸部脱臼でマウスを殺す。殺した直後に、70%のEtOHで腹側体表面を殺菌し、粗いはさみを使用して顎から骨盤に腹側正中線に沿って皮膚を切断する。
注:イオブルランなどの吸入麻酔薬は血管のトーン18,19に影響を与えるのが知られているので、揮発性麻酔薬を使用しないでください。 - 腹腔の開口後、腸管ループを脇に置き、出血のために大きな腹部の血管を切断する。細かいはさみで横隔膜を貫通した後、胸膜腔への空気の侵入の結果として肺が崩壊する。はさみを使用して、下胸部開口から横隔膜を取り外します。肋骨と鎖骨を横に切り、裂け目ケージの腹側部分を取り除きます。
注:そうでなければアガロースで肺の膨満感が不可能になるので、このステップでは肺が損傷しないことが重要です!滅菌器具と実験室用ガラス製品のみを使用してください。 - 肺血管系の灌流を開始する前に、緩衝液の排出のために心臓の左心室に小さな穴を切断する。ヘパリンとニトロトルシドナトリウム(灌流バッファー)を含む暖かい(37°C)HEPESリンガーバッファーでシリンジ貯留層を充填し、右心室を介して肺血管系をゆっくりと浸透させる。
注:肺が色を変え、白い外観を得るとき、灌流は効率的です。このステップでは、灌流バッファーにニトロトルシドナトリウムを追加することが重要です;これにより、周囲の組織から前の静脈動脈が剥がれ落ちるのを防ぎます。 - 唾液腺、小さな筋肉、および気管から結合組織を取り除きます。周囲の結合組織から気管を切り離し、後で結紮のために食道と気管の間で綿を縫う糸。
- マイクロシザーを使用して、隣接する2つの気管軟骨の間の気管の上部に小さな穴を切り込みます。今、気管に小さな穴を介してIV内留カニューレの柔軟なプラスチックパイプを挿入し、慎重に縫製綿でそれを修正します。ゆっくりと暖かい(37°C)低融点アガロースで気道を満たします。肺を観察する:最初は右肺が拡大し始め、次いで左肺が続く。両方の肺が 生体内 の状況に匹敵する体積(性別、年齢、体重に応じて約1.2〜2.0 ml)に膨らむと、充填が完了します。
注: 1つの肺しか膨張しないと、プラスチックパイプが深く挿入されすぎて気管支に届くことがあります。この場合、少し引き出す必要があります。アガロースは徐々に冷え込むと固化します。 - 肺が満杯になったら、同時にプラスチックパイプを引き出し、縫製綿で気管を揚げ、アガロースの流出を防ぎます。その後、合字の上の気管を切断し、胸から ブロック上の 肺と心臓を取り外します。
注: 初心者の方は、同僚にライゲーションステップでサポートを依頼すると役に立つ場合があります。 - 臓器パケットを氷冷HEPES-リンガーバッファーに移してアガロースを固める。これは数分以内に発生します。
- 個々の肺ローブを分離し、ビブラートの標本ホルダーにスーパーグルーで1つのローブを固定します。
注:弾性肺組織の切断中にスキューバックとして機能するホルダーにシャンパンコルクの一部を貼り付けるのが役立ちます。使用される肺のローブに応じて、そして、試料ホルダーのその向きに、得られたPCLSは、小さいか大きい血管の分析に適しているかもしれません。主に、PCLSの調製には左葉と右頭蓋葉を使用します。架隔された小さな口腔内動脈を得るためには、頭蓋右葉をひもでホルダーに接着し、周囲からスライスします。交差した前のアシナル動脈を得るためには、右葉のヒラムをシャンパンコルクに合わせます。 - 新鮮なカミソリの刃を装備したビブラートを使用して、肺の葉を200μmの厚さのスライス(速度:12 = 1.2 mm/sec;周波数:100;振幅:1.0)に切ります。4 °Cの冷たいHEPES-リンガーバッファーで満たされたビブラーム盆地でPCLSを収集します。
注: HEPES リンガーの冷却は推奨されますが、必須ではないです。 - アガロースを除去するために、約200 ml 37°Cの温かいMEMで満たされたガラスビーカーに器官のセクションを移す。ノーモキシ性ガス混合物を含むボトルにチューブが結合した加熱キャビネットにビーカーを入れます。肺切片が培地内でゆっくりと動いるように、MEMをノルモキシ性ガスで泡立ててください。約2時間後、空域を満たす「アガロースプラーク」は肺組織から除去される。これは、セクションが媒体の上に泳がなくなり、ビーカーの底に落ち着いているという事実によって認識することができます。
4. PCLSの肺内動脈のビデオモルフォメトリクス解析
- 肺内動脈のビデオモルフォメトリクス解析では、1.2 mlノルモキシガスを充填したフロースルースーパーフュージョンチャンバーに1つのPCLSを移す。白金のリングに接続されたナイロンのひもで部屋の底にあるPCLSを固定します(外/内径:14/10ミリメートル)。
- PCLSを顕微鏡でスキャンし、内径が20~100μmの断面動脈を探します。
注:動脈の内腔は平らな内皮細胞によって並んでいます。周囲の平滑筋細胞は、位相コントラスト画像において、内腔を囲む「暗いリング」として識別することができる( 図2の位相コントラスト画像を参照)。対照的に、気道は、胸膜表面に向かう途中で単純な柱状上皮に続いて単純な立方体上皮に移る最初の擬似層状柱上皮によって同定することができる。- 各実験の開始時に内径を測定します。
注: わずかに斜めに切断された容器では、管状構造の真の内径は、内腔の最も長い軸に対して90°の角度で決定することができます。内径>40μmの大きな前口動脈は、気管支と気管支に隣接して走る。内径<40μmの小さな口腔内動脈は、肺胞管と肺胞ダクト6の隣にある歯槽セプタのガセットに位置しています。
- 各実験の開始時に内径を測定します。
- 実験設計:
- 各実験を開始し、チャンバーにノルモキシ性ガスを浸透させた「適応段階」(流量:0.7 ml/分、10分)で行います。次に、血管の生存率をテストする:10 μM U46619(最終濃度0.1 μM;10分;流れなし)の12 μlを添加して動脈の収縮性を分析します。
注:この作業では、発光領域が少なくとも30%減少すると、船舶は生存可能と定義されます(測定方法については下記参照)。 - ノルモキシ性ガス化培地(流量:6ml/分;10分)で薬剤を洗浄した後、10mMニプルス(最終濃度25μM;10分;無流量)の3μlを塗布して動脈を拡張する。
- 再度、ノルモキシ性ガス媒体(流量:6 ml/分)で10分洗浄し、その後0.7ml/分の流量で10分洗浄して、薬物を除去する。
- 低酸素性ガス媒質(流量:0.7 ml/分;40分)でPCLSをインキュベーションすることにより、低酸素肺血管収縮を誘導する。追加のチューブシステムにより、低酸素ガス混合物を灌流チャンバの空域に供給する。
- ノルモキシガスを用いた培地(流量:6ml/分)で20分洗浄して低酸素培地を取り除きます。
- 各実験の最後に、10 μM U46619 (最終濃度 0.01 μM; 20 分; 流量なし) の 1.2 μl を灌流チャンバに加えて、血管収縮を誘導します。
注: この最終ステップでは、低酸素反応の変化(例えば、低酸素相での薬物の同時適用によって誘発されるか、ノックアウトマウス株から調製されたPCLSで観察される)が低酸素誘発収縮に特異的であるか、または収縮に対する一般的な影響を反映しているのかを決定することができます。0.01 μMの濃度は、以前の濃度収縮測定で推定されたU46619のEC50値に相当します(公表されていません)。 - 灌流室の空域で低酸素ガスMEMとノルモキシ性ガス混合物の代わりにノルモキシ性の制御実験を行うために別のPCLSを使用してください。
- 各実験を開始し、チャンバーにノルモキシ性ガスを浸透させた「適応段階」(流量:0.7 ml/分、10分)で行います。次に、血管の生存率をテストする:10 μM U46619(最終濃度0.1 μM;10分;流れなし)の12 μlを添加して動脈の収縮性を分析します。
5. 血管反応性とグラフィック表示の分析
- 適切なソフトウェアを使用して、全体の実験中に毎分断面動脈から写真を撮ります。
- 適切なソフトウェアを使用して、全画面写真を使用して手で内側の境界を裏打ちすることによって、血管の発光領域の変化を評価します。
注:明確なグラフを得るために、毎秒画像を分析するだけで十分です。しかし、フロースルースーパーフュージョンチャンバー内の1つの条件が別の条件に変更された場合は、すべての画像を分析します。残りの写真は、1枚の写真が分析できない場合のバックアップとして機能します。
残念ながら、この時間のかかるステップは、時には血液細胞が測定中に移動している血管壁に取り付けられているか、血管の完全な断面ではなく、内側の境界の信頼できる局在化が視覚的な制御下でのみ行うことができる接線セクションであるため、適切なプログラムによってではなく、手作業で行われなくてはなりません。 - 実験開始時に血管管腔の面積に対して得られた値を100%と定義し、この値の相対的な減少または増加として血管収縮または拡張を発現する。
- 各実験のために、適切なソフトウェアを使用して時間に対して相対的な明るさ領域をプロットする。
- いくつかの実験を要約すると、時間に対する平均(SEM)の相対発光領域+/-標準誤差の平均をプロットします。
注:低酸素症またはU46619誘発性肺血管収縮またはノックアウトマウス株の低酸素応答に対する様々な物質の影響の明確な提示のために、実験の初期段階は、血管の生存率が試験される、グラフから省略することができる。この場合、還元された酸素への曝露の開始時に得られた値は100%と定義される。
6. 統計分析
- Kruskal-Wallis-とMann-Whitney検定を用いた実験群の違いを分析し、p≤0.05は有意であると考えられ、p≤0.01は非常に有意であると考えられる。
注: PCLS の準備および操作上の使用に関する追加情報は、20,21も参照してください。
結果
図1では、大きな前回静脈動脈のHPVおよび小さなアチナー動脈のHPVの測定結果が示されている。位相コントラスト画像(図1Aおよび2A)では、肺組織内の位置に基づいてこれらの2つのクラスの動脈を判別することが可能であることが明らかになる:気管支と気管支に近い近傍で走る前体動脈(図1A)、一方、口腔内動脈は肺胞セプタのガセットに位置し、alveolaeに囲まれている(少し練習すれば、位相コントラストの写真のU46619に応答して、発光領域の変化を見ることができます(図1Aおよび2A)。しかし、低酸素肺血管収縮は、しばしばそれほど顕著ではなく、発光領域の変化を完全に評価した後にのみ明らかになる(図1B、1C、2B、および、2C)。教訓的な理由から、異常に顕著な血管収縮を示す経嚢前動脈の例を挙げてきた。平均して、HPVは、発光領域の20〜30%の減少をもたらす。
図2では、50μMのピンアシチル(ミトコンドリアATP感受性カリウムチャネルの非選択的オープナー)の有無にかかわらず低酸素ガス培地でインキュベートされた小さな口腔内動脈の記録が示されており、薬物の抑制効果がはっきりと見えるようになります。実験の最後の部分は、HPV上の薬物の作用の選択性を示している:トロンボキサンアナログU46619によって誘導される血管収縮は、ピンアシチルの添加によって変化しない。実際、ピナシチルを露出した動脈の曲線は他の2つよりも明らかに低いが、U46619単独による発光領域の減少の程度は同等である。この場合、それは曲線間の違いを引き起こすHPVの不完全な復帰でした。このグラフでは、ノルモキシ性ガス化培地に曝露された動脈も追加の制御として含まれる。この条件下では、光領域の変化は検出できない。
図3に、HPVに対するピンアシチルの影響に関する一連の測定の全データを示す。統計的な差異に対する2つのグループの比較のために、示された時点のデータセットを、クルスカル・ウォリス検定とマン・ホイットニー検定で分析した。HPVは、ピンアシチルの存在下で明らかに廃止されたのに対し、U46619誘発収縮は変わらなかった。
あるいは、ミュラー・レデツキーらで説明したように曲線下の面積を比較することによってグループ間の違いを識別することができる 。22
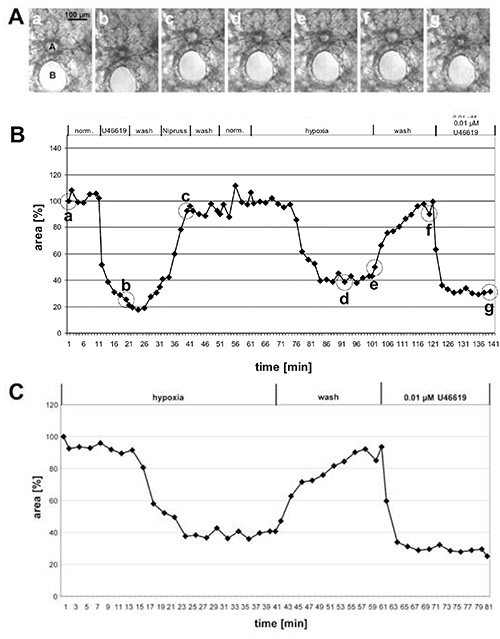
図 1. 大きな前回動脈のHPVの測定 (A) 断断面気管支の近傍で走る断面前のアシナル動脈(a)の位相コントラスト画像 (B)写真は、(B)で示された時点で円で撮影されます:測定の開始時(a)、U46619(b)での治療の終わりに、ニプルス(c)への暴露の終わりに、低酸素ガス培地(d、e)で30または40分後、ノルムキシガス培地(f)で洗浄した後、およびU96(f)の最終適用後に行う。グラフ(B)では、明るさの領域の変化は時間に対してプロットされますが、実験の開始時の明度領域は 100% と定義され、血管収縮/拡張は相対値として与えられます。この場合、低酸素は、発光領域の60%の減少を誘導する。(C)低酸素反応のより明確な提示のために、血管反応性を試験した実験の初期段階は含まれないが、還元された酸素への暴露の直前に得られた値は100%に設定される( 図2も参照)。 ここをクリックすると、より大きな画像が表示されます。
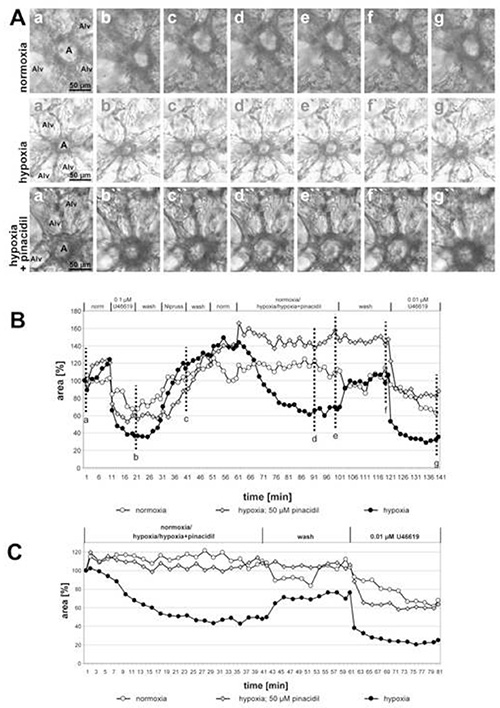
図 2.小さな口腔内動脈のHPVに対するピンアシジル(ミトコンドリアATP感受性カリウムチャネルの非選択的オープナー;ミトKATP)の影響。(A) アインアチナー動脈(a)は、歯槽中隔のガセットに位置する。アルブ=アルベロールス。これらの実験で適用される個々の条件の順序は、グラフの見出し(B)に示されています。低酸素暴露は、50 μMピンアシチルの存在下または不存在下で行われる。制御インキュベーションは、ノルモキシ性ガス媒体で行われます。(A)に示す写真は、測定の開始時(a,a',a")で撮影され、治療の最後にU46619(b、 b', b"), ニプルスへの暴露の終わりに (c, c', c"), 低酸素またはノルモキシ性ガス培地で30または40分後 (d, d'd'; e, e', e'"), ノルモキシガス培地で洗浄した後 (f, f', f"), U46619の最終適用後ノルモキシア/低酸素/低酸素+ピンアシチルへの応答のより明確な提示のために、ノルモキシ性/低酸素ガス培地への暴露の直前に得られた値は100%(C)に設定される。ここをクリックすると、より大きな画像が表示されます。
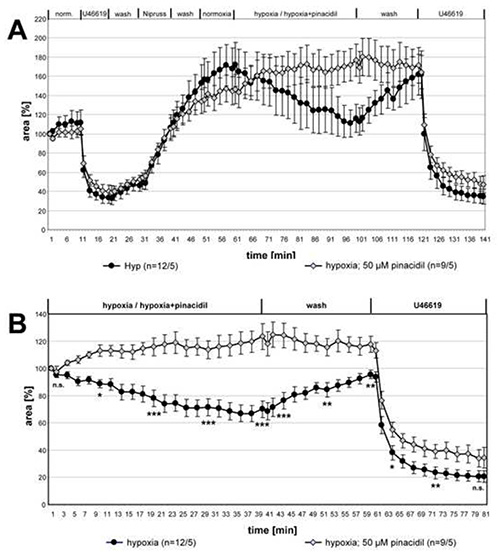
図 3.ピンアシチルによるHPVの阻害 50 μM ピンアシチルを使用するか、またはない低酸素性の気体に曝露された小さなアシナル内動脈の記録を要約し、SEM±手段として提示します。(A)では、完全な記録が与えられ、低酸素インキュベーションの開始時の値に対する相対データが(B)で示される。ピナシチルを含む低酸素ガス培地に曝露されるPCLSでは血管反応性が検出できない。U46619によって誘発される血管収縮は薬物によって影響を受けない。括弧内の「n」は、PCLSが作られた動物の数/動脈数を指します。言い換えれば、最初の数は分析された肺セクションの数を記述し、2番目の数はこれらのセクションが準備されたマウスの数を示す。指定された時点で、両方のグループ間の差が有意性についてテストされます。n.s.: 重要ではない、 *: p≤0.05, **: p≤0.01, ***: p≤0.001. ここをクリックすると、より大きな画像が表示されます。
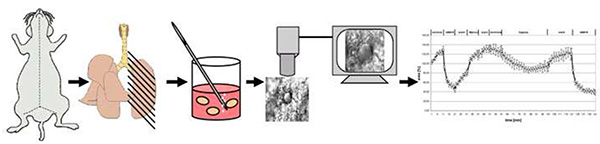
図 4.メソッドの概略図。簡単に言えば、マウスは子宮頸部脱臼によって殺される。胸部を開いた後、肺は低融点アガロースで満たされ、冷却後200μm厚い精密カット肺スライス(PCLS)にカット。37°Cでアガロースを除去した後、1個のPCLSは、ノルモキシ性媒体に曝露されるフロースルー多重注入室に移管される、または1%O2でガスを媒体にする。血管反応性は、光領域の変化として記録される。ここをクリックすると、より大きな画像が表示されます。
ディスカッション
孤立した換気および浸透したマウス肺は、酸素供給の変化に対する肺血管系の生理学的応答の分析のための優れたモデルであり、とりわけ肺動脈圧1の連続的な測定を可能にする。しかし、このモデルでは、低酸素症に対する最も強い応答を示す血管セグメントの同定と分析はできません。これは、20-100 μmの内径を持つ個々の動脈のHPVの測定を容易にするPCLSのビデオモルフォメトリクス分析の利点です。 細胞培養系とは対照的に、すべての細胞タイプは、元の組織マトリックス構成に存在する。さらに、1つの肺は多くのPCLSの調製に十分であり、同じマウスからの切片の使用によって少なくとも部分的に実験を標準化することができる。ラッセルとバーチ23の3Rの概念(生命科学における実験動物の改良と置換)によると、この事実はまた、PCLSの使用について主張している。
しかし、1つは、組織が例えばKüblerらによって仮定される内皮細胞を介してビブラードームおよび縦方向シグナル伝達で切断することによって損傷を受けることを心に留めてお く必要があります。14 は、もはや不可能である。
当初、PCLSは主に生化学的、薬理学的、毒物学的研究に適用されたが、その間、気管支収縮、粘膜機能および血管応答の測定にも使用される(レビューについてはサンダーソン20 およびデイヴィス21を参照)。開催 ら.彼らは孤立した浸透および換気されたマウス肺およびPCLS24のモデルを比較した研究を行った。その結果、肺全体の重要な特徴がPCLSに維持されている様々な内因性メディエーターに対する気道および肺血管の応答を分析した。
PCLSでは、低酸素状態は、無傷の肺のように気道を介して確立されるのではなく、低酸素ガス媒体における肺セクションのインキュベーションによって確立される。血液ガス分析装置を用いて、1%O2、5.3%CO2、93.7%N2、21%O2、5.3%CO2、73.7%N2をそれぞれ用いて、1%O2、5.3%N2で予気した培地の酸素分圧(pO2)を分析しました。 灌流チャンバに送り込む直前に、低酸素ガスMEMのpO2は40mmHgであり、ノルモキシ性ガス媒体160mmHg6のpO2であった。 無傷の肺HPVでは、肺胞pO2が50mmHg25を下回ると誘導され、低酸素ガス培地の適用によって明らかに模倣され得る状況である。HPVの程度に関する我々のデータは、異なる実験的アプローチで得られた結果によく一致する。山口ら.画像増強器10を有する高感度カメラに結合したリアルタイム共焦点レーザー走査発光顕微鏡による直径20〜30μmのマイクロ血管を検査するために単離されたラット肺を適用した。彼らは、低酸素症への肺の暴露後、直径2.7μmの平均減少を観察した。1つは、我々のシステムでそれを測定する発光領域の20%の減少が直径の約15%の減少に対応することを計算することができます。
我々の実験では、それぞれ40-100 μmおよび20-40 μmの内径を有する前および内線血管として動脈を分類した。ヒトでは、筋肉から非筋肉動脈への移行は、70〜100μmの直径範囲で起こる。マウスでは、平滑筋細胞は20μm26の外径まで存在する。このため、位相コントラスト画像に基づいて識別できないので、直径20μm未満の動脈を解析することはできません。スケールのもう一方の端では、直径が100μmを超える血管はPCLSではほとんど見つからならず、一般的に周囲の組織から剥がされます。
実際には、分子候補の数は、分子酸素センサーとして、またはHPVをもたらすシグナル伝達カスケードの成分として議論されている(レビューのためにシルベスターら参照)。4).適当なノックアウトマウスが利用可能になったら、ビデオモーホメトリーは、野生動物型動物と比較して、前および内のアシナル動脈の血管反応性の分析に使用することができる。しかし、PCLSは他の問題にも使用されています: Faro ら.生後の 肺における内皮依存拡張の発達を特徴付けるためにそれらを用い、毎日2週間煙や空気にさらされたモルモットから調製されたPCLSを使用して、内皮機能不全30の誘導を介してタバコの煙が血管反応性に及ぼす影響を実証した。
プロトコル内の重要なステップ
実験では、動脈を前アシナル(内径40~100μm)とイントラアシナル(内径20~40μm)に分類しました。特に、より大きな血管の分析に使用されるべき肺切片の調製のためには、灌流緩衝液にニトロトルシドナトリウムを添加することが重要である。この薬剤は、サンプル調製中に血管の収縮を防ぎ、それによって不完全な血管拡張につながる周囲の組織から裂け出す。灌流緩衝液中のニトロトルシドナトリウムは、肺胞性隔膜に強く固定されているため、小動脈の分析に使用されるべき肺セクションの調製にとってそれほど重要ではない。
すべての実験は、動脈の反応性をテストするインキュベーションで開始する必要があります。稀に、請負業者や拡張器に対する血管の応答が検出できない肺製剤を得ることはまれである。私たちは、この理由を知らない:肺に充填されたアガロースの体積が大きすぎるか、またはPCLSへの臓器の切断が最適ではなかったことが可能性があります。あるいは、吸い込み手順中にアガロースが急激に冷却されすぎて、せん断応力が損なわれたことが想像できます。個々のPCLSで生存可能な動脈が検出できない場合、セクションを破棄し、別のセクションに置き換える必要があります。
動脈の生存率に関する決定は、U46619への応答に基づいて行われた。U46619の濃度0.1μMでの適用は、いくつかの運動の後に、画面の画像シーケンスで直接見える血管収縮を誘発する。血管反応性にはいくつかの差異があるため、薬物に曝露された肺切片または培地単独での血管反応を測定することによって、HPVに対する薬物の影響を調べる。
個々の動脈のHPVは、顕微鏡でほとんど検出できないことが多く、平均して約20〜30%の発光領域の減少をもたらす。しかし、動脈の直径の小さな変化は、流れ抵抗に明確な入力を有する。R=抵抗とr=半径を持つ方程式"R = 1/r4"によれば、流れ抵抗は半径の4乗に反比例します。例を挙げてみましょう:直径40μm(r=20 μm)の円形断面を示す「理想的な動脈」は、約1,260μm2の発光面積を有する。ルミナル面積を20%削減すると、容器の直径が10.5%から35.8μm(r=17.9 μm)に減少すると計算できます。上記の式によれば、この容器の流れ抵抗は6.25 x10-6から9.71 x10-6に増加し、約55%増加する。光面積を30%減少させると半径は約16%減少しますが、流れ抵抗は約100%増加します。これらの計算は、層流血流と硬質パイプの血管形態が、すでに小さな直径の変化が流れ抵抗に及ぼす影響を示唆していると仮定する過度の単純化であるが。
開示事項
著者は開示するものは何もありません。
謝辞
この研究は、エクセレンスクラスター心肺システムが主催しています。
資料
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
参考文献
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved