Method Article
Análisis Videomorfométrico De La Vasoconstricción Pulmonar Hipóxica De Las Arterias Intrapulmonares Usando Cortes Murinos De Precisión Pulmonar Slices
En este artículo
Resumen
La vasoconstricción pulmonar hipóxica (HPV) es un fenómeno fisiológico importante por el cual en la perfusión alveolar del pulmón de la hipoxia es emparejada a la ventilación. El segmento vascular principal que contribuye al HPV es la arteria intra-acinar. Aquí, describimos nuestro protocolo para el análisis del VPH de vasos pulmonares murinos con diámetros de 20-100 μm.
Resumen
La hipoxia alveolar aguda causa vasoconstricción pulmonar (VPH), también conocida como mecanismo de von Euler-Liljestrand, que sirve para hacer coincidir la perfusión pulmonar con la ventilación. Hasta ahora, los mecanismos subyacentes no se entienden completamente. El segmento vascular principal que contribuye al HPV es la arteria intra-acinar. Esta sección del vaso es responsable de la fuente de sangre de un acinus individual, que se define como la porción del pulmón distal a un bronquiolo terminal. Las arterias intraacinares se localizan principalmente en aquella parte del pulmón que no puede ser alcanzada selectivamente por una serie de técnicas comúnmente utilizadas, como la medición de la presión de la arteria pulmonar en pulmones perfundidos aislados o los registros de fuerza de segmentos disecados de la arteria pulmonar proximal disecada1,2. El análisis de vasos subpleurales mediante microscopía de luminiscencia de barrido confocal con láser en tiempo real se limita a vasos con hasta 50 μm de diámetro3.
Proporcionamos una técnica para estudiar el VPH de las arterias intrapulmonares murinas en el rango de 20-100 μm diámetros internos. Se basa en el análisis videomorfométrico de arterias transversales en cortes pulmonares de precisión (PCLS). Este método permite la medición cuantitativa de la vasoreactividad de pequeñas arterias intraacinares con diámetro interno entre 20-40 μm que se encuentran en chorros de septos alveolares junto a conductos alveolares y de arterias pre-acinares más grandes con diámetros internos entre 40-100 μm que discurren adyacentes a bronquios y bronquiolos. En contraste con la proyección de imagen en tiempo real de recipientes subpleurales en ratones anestesiados y ventilados, el análisis videomorfométrico de PCLS ocurre bajo condiciones libres de la tensión del esquilar. En nuestro modelo experimental ambos segmentos arteriales exhiben un VPH monofásico cuando se exponen al medio gaseado con 1%O2 y la respuesta se desvanece después de 30-40 min en la hipoxia.
Introducción
En la mayoría de los lechos vasculares sistémicos la hipoxia induce vasodilatación, en comparación con la vasoconstricción causada por la hipoxia en la vasculatura pulmonar. Esta respuesta pulmón-específica a la tensión bajada del oxígeno se llama vasoconstricción pulmonar hipóxica (HPV), inicios en cuestión de segundos y reversa rápidamente después del cambio a la ventilación normóxica. Aunque el VPH se conoce desde hace más de 60 años, los sensores celulares de oxígeno y las cascadas de señalización que resultan en vasoconstricción todavía están bajo debate. Existe un amplio consenso relativo de que los cambios redox y ROS evocados por la hipoxia son esenciales para el VPH y el desarrollo de hipertensión pulmonar (revisado en Sylvester et al. 4 y Schumacker et al. 5).Nuestros propios datos apoyan un papel central del complejo II de la cadena respiratoria mitocondrial en el VPH6,7. Recientemente, Wang et al. presentaron un concepto completamente nuevo para la detección de oxígeno y el VPH: En base a sus datos proponen que la hipoxia alveolar es detectada por los capilares adyacentes causando la despolarización de la membrana de las células endoteliales. La respuesta se propaga a través de la conexión 40 uniones gap de las células endoteliales que conducen a la constricción de las células musculares lisas de las arteriolas aguas arriba8.
Las arterias del pulmón corren junto a las vías respiratorias, se ramifican con ellas, disminuyen continuamente de diámetro y, finalmente, suministran sangre al sistema capilar ubicado en las paredes alveolares. Esta circulación arterial se compone de segmentos anatómica y funcionalmente distintos. Las arterias del conducto próximo, caracterizadas por una abundancia de fibras elásticas en las paredes, son seguidas por las arterias intrapulmonares completamente muscularizadas que controlan en gran parte la resistencia vascular pulmonar. Paso a paso, estas arterias transitan en segmentos donde la capa muscular se vuelve incompleta, y finalmente los vasos están libres de células inmunorreactivas de actina del músculo liso. La arteria intra-acinar que alimenta un acinus pulmonar individual con sangre representa un segmento parcialmente muscular6. Asimismo, el sistema arterial pulmonar no representa una estructura uniforme en cuanto a la respuesta hipóxica, pero exhibe una marcada diversidad regional9,10. Por ejemplo, en las arterias pulmonares proximales aisladas de pulmones de rata la hipoxia induce una respuesta bifásica, mostrando una rápida contracción inicial de corta duración que - después de una relajación incompleta - es seguida por una segunda contracción lenta pero sostenida11. En arterias de resistencia aisladas del parénquima pulmonar de rata como cuarta y quinta división de arterias pulmonares (diámetro externo <300 μm), la hipoxia provoca constricción monofásica9. Ya en 1971 Glazier y Murray concluyeron a partir de las mediciones de cambios en la concentración de glóbulos rojos capilares en pulmones de perros ventilados con mezclas de gases hipóxicos que el aumento de la resistencia vascular inducido por la hipoxia se produjo principalmente aguas arriba de los capilares12. Hoy en día, la microscopía intravital de pulmones intactos de ratones anestesiados y ventilados mecánicamente representa una poderosa herramienta para el análisis de la microvasculatura pulmonar13,14. La escisión de una ventana circular en la pared torácica da acceso microscópico a la superficie del pulmón y permite el análisis de vasos pulmonares subpleurales con hasta 50 μm de diámetro. Combinando esta técnica con la infusión de FITC-dextrano, Tabuchi et al. demostró que sólo las arteriolas de tamaño mediano con diámetros de 30-50 μm exhiben una marcada respuesta a la hipoxia que se mantuvo durante un período de 60 min con una atenuación menor después de 30 min. En cambio, las pequeñas arteriolas con diámetros de 20-30 μm mostraron sólo una respuesta menor a la hipoxia3. Sin embargo, esta técnica no permite el análisis de arterias con diámetro superior a 50 μm ya que estos vasos se localizan demasiado profundos en el tejido pulmonar.
Con el fin de cerrar la brecha en el análisis de arterias pulmonares grandes y muy pequeñas (como los vasos subpleurales) de los pulmones murinos, adoptamos un método que fue descrito por Martin et al. para el análisis de la reactividad de las vías respiratorias15. Basado en una técnica de infundir gel de agarosa, facilita la preparación de rebanadas pulmonares cortadas con precisión (PCLS) de este órgano relativamente suave y elástico. Dentro del PCLS la vasoreactividad de arterias transversales con diámetro interior entre 20-100 μm se puede observar directamente por videomicroscopia. La aplicación de fármacos durante la incubación hipóxica del PCLS permite el análisis de sus efectos sobre el VPH. Es de particular importancia que esta técnica también se pueda aplicar a los ratones modificados genéticamente. En función de su ubicación dentro del pulmón, clasificamos las arterias como vasos pre e intra-acinares, con diámetros internos de 20-40 μm y 40-100 μm, respectivamente. Bajo una visión funcional la arteria intra-acinar suministra sangre a un acinus pulmonar individual y la arteria pre-acinar son las secciones precedentes del vaso. La grabación de imágenes en una cámara digital permite la posterior cuantificación de la vasorreacción. Un atributo obvio de este modelo PCLS es la falta de cizalladura que actúa sobre el endotelio. Por el contrario, en los vasos perfundidos el VPH agudo conduce a un aumento de la cizalladura-estrés, lo que induce mecanismos secundarios como la liberación de NO16. Además, el uso de PCLS permite mediciones del VPH sin influencias neuronales u hormonales extrapulmonares. En contraste con los sistemas de cultivo celular, por ejemplo preparados a partir de células musculares lisas arteriales pulmonares caninas17,la arquitectura histológica de la pared del vaso se conserva casi por completo.
En resumen, este protocolo proporciona un método útil para el análisis de posibles sensores moleculares de oxígeno y/o vías celulares responsables del VPH de arterias intrapulmonares con diámetros internos entre 20-100 μm en condiciones libres de estrés cizallallado.
Protocolo
1. Preparación de mezclas de gases, equipos, instrumentos y soluciones
Esta sección describe el equipo y la configuración necesarios para el protocolo. Los detalles adicionales y la información del fabricante se pueden encontrar en la tabla adjunta.
- Obtener o preparar las siguientes mezclas de gases:
- Dos botellas con mezcla de gases normóxicos compuesta por 21%O2,5,3%CO2,73,7%N2.
- Una botella con mezcla de gases hipóxicos compuesta por 1%O2,5,3%CO2,93,7%N2.
- Reúna el siguiente equipo:
- Un horno microondas, para fundir la agarosa.
- Un armario de calefacción, para lavar la agarosa de las secciones pulmonares (ver más abajo). Inserte un tubo conectado a una botella con mezcla de gases normóxicos en el gabinete.
- Un vibratome con cuchillas de afeitar adecuadas, para cortar los pulmones en rodajas de 200 μm de espesor. Es ventajoso si el vibratome está equipado con un conjunto de refrigeración para enfriar el tampón en la cuenca del vibratome.
- Una cámara de superfusión de flujo a través montada en un microscopio invertido, para el análisis de HPV de arterias intrapulmonares.
- Para facilitar la fijación de las secciones pulmonares a la parte inferior de la cámara, conecte las cuerdas de nylon a un anillo de platino (autoconstruido). Unir la cámara de perfusión a una bomba peristáltica con caudales ajustados a 0,7 ml/min y 6 ml/min, respectivamente.
- Montar el equipo de modo que durante los experimentos los medios se almacenen en un baño de agua a 37 °C y se burbujeen con gas normóxico o hipóxico utilizando cánulas de 21 G x 4 3/4. Además, utilice una segunda conexión de la botella de gas para permitir que las mezclas de gases normóxicos / hipóxicos se introduzcan en el espacio aéreo de la cámara de perfusión. Asegúrese de que todos los tubos de este sistema estén herméticos al gas.
- Una cámara CCD montada en un microscopio invertido vertical para registrar imágenes de la arteria analizada.
- Preparar los siguientes instrumentos:
- Para la preparación de los pulmones: un conjunto de disección estéril que incluye una tijera áspera y dos pares de fórceps, una tijera fina para la apertura del pecho, un microscisor para cortar un agujero en la tráquea para rellenar la agarosa, y coser algodón (unos 20 cm) para la ligadura de la tráquea para evitar la salida de la agarosa.
- Para el llenado de las vías respiratorias con agarosa: conecte una jeringa de 2 ml a la tubería de plástico flexible de una cánula residente IV (20 G x 1 1/4).
- Para la perfusión de los pulmones con tampón: fijar una jeringa de 50 ml como un depósito tampón a unos 40 cm por encima del lugar de trabajo para la preparación del ratón.
- Para la salida del tampón: conecte la jeringa a un tubo al que se une una cánula de 25 G x 1. Use una abrazadera en el tubo para ajustar el flujo de salida a aproximadamente 1 gota/seg (aproximadamente 0.3-0.4 ml/min).
- Prepare los siguientes búferes y medios:
- Hacer 1.000 ml de tampón HEPES-Ringer (10 mM HEPES, 136,4 mM NaCl, 5,6 mM KCl, 1 mM MgCl2•6H2O, 2,2 mM CaCl2•2H2O, 11 mM glucosa, pH 7,4). Almacene el tampón filtrado estéril (tamaño de poro del filtro: 0,2 μm) a 4 °C.
- Unos 30 min antes de comenzar el aislamiento de los pulmones preparan las siguientes soluciones:
- Disuelva la agarosa de bajo punto de fusión al 1,5% p/v en tampón HEPES-Ringer (volumen total 10 ml) y derrita cocinándola en un horno microondas. Posteriormente, enfríe a 37 °C por almacenamiento en un armario de calefacción. Preguerra la jeringa de 2 ml para llenar la agarosa en las vías respiratorias pulmonares.
- Tome 20 ml del tampón HEPES-Ringer, agregue heparina a una concentración final de 250 U.I./ml y caliente el tampón a 37 °C. Inmediatamente antes de su uso añadir nitroprusiato de sodio a una concentración final de 75 μM. Este es el tampón de perfusión para escurr la sangre de la vasculatura pulmonar.
- Ponga el tampón HEPES-Ringer de 200 ml en un vaso de precipitados de vidrio y guárdelo en hielo. Este tampón será necesario para enfriar los pulmones aislados llenos de agarosa.
- Llene unos 200 ml de MEM suplementados con penicilina/estreptomicina al 1% en un vaso de precipitados de vidrio y guárdelo a 37 °C en el armario de calefacción. Burbujee el medio con mezcla de gases normóxicos. Esto se utilizará para la eliminación de la agarosa de las secciones pulmonares.
- Preguerra de 2 botellas de MEM suplementadas con penicilina/estreptomicina al 1% en un baño de agua a 37 °C y burbujearlas con mezcla de gases normóxicos e hipóxicos, respectivamente, durante al menos 2 horas antes de iniciar las mediciones videomorfométricas. Se requerirán aproximadamente 250 ml de MEM por medición.
- Reúna los siguientes materiales adicionales:
- 70% EtOH para desinfección.
- Solución común de heparina (25.000 U.I./5 ml), almacenada a 4 °C (véase más arriba).
- Solución común del nitroprusiato de sodio no donante (Nipruss): 10 mM en H2O, almacenado en hielo (ver arriba).
- Solución común de tromboxano análogo U46619: 10 μM en etanol, almacenado sobre hielo.
- Superglue.
- Coser algodón para la ligadura de la tráquea después de rellenar con agarosa.
2. Animales
Utilice ratones (por ejemplo, de la cepa C57Bl6) de ambos sexos a una edad de 10-25 semanas. El VPH también se puede analizar en cepas knockout y las cepas de tipo salvaje correspondientes.
Todos los experimentos se realizaron de acuerdo con las directrices de los NIH para el cuidado y uso de animales de experimentación, y fueron aprobados por las juntas institucionales locales.
3. Aislamiento de pulmones murinos y preparación de rebanadas de pulmón cortadas de precisión (PCLS)
- Matar al ratón por dislocación cervical. Inmediatamente después de matar, esterilice la superficie del cuerpo ventral con 70% de EtOH y use la tijera áspera para cortar la piel a lo largo de la línea media ventral desde la barbilla hasta la pelvis.
Nota: Dado que se sabe que los anestésicos inhalativos como el isoflurano tienen un impacto en el tono vascular18,19,no utilice anestésicos volátiles. - Después de la apertura de la cavidad abdominal, ponga los asas intestinales a un lado y cortar los vasos abdominales grandes para el sangrado. Después de penetrar el diafragma con la tijera fina, los pulmones colapsarán como resultado de la entrada de aire en la cavidad pleural. Utilice la tijera para separar el diafragma de la abertura torácica inferior. Corte las costillas y la clavícula lateralmente para quitar la parte ventral de la jaula de la rasgadura.
Nota: ¡Es importante que los pulmones no se dañen en este paso ya que de lo contrario la hinchazón de los pulmones con agarosa será imposible! Utilice sólo instrumentos estériles y cristalería de laboratorio. - Antes de comenzar la perfusión de la vasculatura pulmonar, corte un pequeño agujero en el ventrículo izquierdo del corazón para la descarga del tampón. Llene el depósito de la jeringa con un tampón HEPES-Ringer caliente (37 °C) que contenga heparina y nitroprusiato de sodio (tampón de perfusión) y perfunda la vasculatura pulmonar lentamente a través del ventrículo derecho.
Nota: La perfusión es eficiente cuando los pulmones cambian su color y obtienen una apariencia blanca. En este paso es importante añadir nitroprusiato de sodio en el tampón de perfusión; esto evita que las arterias pre-acinares se desprenda del tejido circundante. - Retire las glándulas salivales, los músculos pequeños y el tejido conectivo de la tráquea. Desconecte la tráquea del tejido conectivo circundante e hilo cosiendo algodón entre el esófago y la tráquea para su posterior ligadura.
- Use el microscisor para cortar un pequeño agujero en la parte superior de la tráquea entre dos cartílagos traqueales vecinos. Ahora inserte el tubo de plástico flexible de una cánula residente iv a través del pequeño agujero en la tráquea y fijarlo cuidadosamente con el algodón de costura. Llene lentamente las vías respiratorias con la agarosa caliente (37 °C) de bajo punto de fusión. Observar los pulmones: Al principio el pulmón derecho comienza a expandirse seguido por el pulmón izquierdo. El llenado se completa cuando ambos pulmones están inflados a un volumen comparable a la situación in vivo (aproximadamente 1.2-2.0 ml dependiendo del sexo, la edad y el peso).
Nota: Si solo se expande un pulmón, es posible que el tubo de plástico se haya insertado demasiado profundo para que haya alcanzado el bronquio. En este caso, hay que sacarlo un poco. Tenga en cuenta que la agarosa se solidificará cuando se enfríe gradualmente. - Cuando los pulmones estén llenos, saque simultáneamente la tubería de plástico y liga la tráquea con el algodón de coser para evitar la salida de la agarosa. Posteriormente, cortar la tráquea por encima de la ligadura y separar los pulmones y el corazón en bloque del pecho.
Nota: Para los principiantes, puede ser útil pedir apoyo a un colega en el paso de ligadura. - Transfiera el paquete de órganos al tampón HEPES-Ringer helado para solidificar la agarosa. Esto sucede en pocos minutos.
- Separe los lóbulos pulmonares individuales y fije un lóbulo con superglue en el soporte de la muestra del vibratome.
Nota: Es útil pegar un trozo de un corcho de champán en el soporte que sirve como sesgado durante el corte del tejido pulmonar elástico. Dependiendo del lóbulo pulmonar utilizado y de su orientación en el soporte de la muestra, el PCLS obtenido puede ser más adecuado para el análisis de vasos pequeños o grandes. En su mayoría utilizamos el lóbulo izquierdo y el lóbulo craneal derecho para la preparación del PCLS. Para obtener pequeñas arterias intraacinares secundadas transversalmente, pegue el lóbulo derecho craneal con el hilio al soporte y corte desde la periferia. Para obtener arterias pre-acinares seccionados transversalmente, alinee el hilio del lóbulo derecho con el corcho de champán. - Utilice un vibratome equipado con una cuchilla de afeitar fresca para cortar el lóbulo pulmonar en rodajas de 200 μm de espesor (velocidad: 12 = 1,2 mm/seg; frecuencia: 100; amplitud: 1,0). Recoja el PCLS en la cuenca de vibratome llena de tampón HEPES-Ringer frío de 4 °C.
Nota: El refrescarse del HEPES-Timbre se recomienda pero no esencial. - Para la eliminación de la agarosa, transferir las secciones del órgano en un vaso de precipitados de vidrio lleno de aproximadamente 200 ml 37 °C de MEM caliente. Coloque el casto en el armario de calefacción en el que se inserta un tubo unido a una botella con mezcla de gas normóxico. Burbujee el MEM con el gas normóxico para que las secciones pulmonares se muevan lentamente en el medio. Después de aproximadamente 2 horas, las "placas de agarosa" que llenan los espacios aéreos se eliminarán del tejido pulmonar. Esto se puede reconocer por el hecho de que las secciones ya no están nadando en la parte superior del medio, sino que se asientan en la parte inferior del casto.
4. Análisis videomorfométrico de arterias intrapulmonares de PCLS
- Para el análisis videomorfométrico de arterias intrapulmonares, transfiera un PCLS a la cámara de superfusión de flujo directo llena de MEM gaseado normóxico de 1,2 ml. Fije el PCLS en la parte inferior de la cámara con cuerdas de nylon conectadas a un anillo de platino (diámetro exterior / interior: 14/10 mm).
- Escanee el PCLS microscópicamente para las arterias seccionados transversalmente con diámetros internos entre 20-100 μm.
Nota: La luz de las arterias está revestida por células endoteliales planas. Las células circundantes de los músculos lisos se pueden identificar en la imagen de contraste de fase como un "anillo oscuro" que rodea la luz (ver imágenes de contraste de fase en la Figura 2). En cambio, las vías aéreas se pueden identificar por el epitelio acolumnado inicialmente pseudostratified que transita en la manera a la superficie pleural en un epitelio acolumnado simple seguido por un epitelio cuboide simple.- Mida el diámetro interior al principio de cada experimento.
Nota: En recipientes ligeramente cortados oblicuamente, el verdadero diámetro interior de la estructura tubular se puede determinar en un ángulo de 90° con respecto al eje más largo de la luz. Las grandes arterias pre-acinares con diámetros internos >40 μm corren adyacentes a bronquios y bronquiolos. Pequeñas arterias intra-acinares con diámetro interno <40 μm se localizan en gussets de septos alveolares junto a conductos alveolares y alveolares6.
- Mida el diámetro interior al principio de cada experimento.
- Diseño experimental:
- Comience cada experimento con una "fase de adaptación" en la que la cámara se perfunde con medio gaseado normóxico (caudal: 0,7 ml/min; 10 min). A continuación, pruebe la viabilidad del vaso: Analizar la contractilidad de la arteria mediante la adición de 12 μl de 10 μM U46619 (concentración final 0,1 μM; 10 min; sin flujo).
Nota: Para este trabajo, un recipiente se define como viable cuando el área luminal se reduce en al menos un 30% (para el método de medición, consulte a continuación). - Después de lavar la medicina con el medio gaseado normoxic (caudal: 6 ml/min; 10 minutos) dilatar la arteria por la aplicación de 3 μl de 10 mM Nipruss (concentración final 25 μM; 10 minutos; ningún flujo).
- Una vez más, retire el medicamento con un lavado de 10 min con medio gaseado normóxico (caudal: 6 ml/min) seguido de 10 min a un flujo de 0,7 ml/min.
- Inducir vasoconstricción pulmonar hipóxica por incubación del PCLS con medio gaseado hipóxico (caudal: 0,7 ml/min; 40 min). Mediante un sistema de tubo adicional, alimente la mezcla de gases hipóxicos en el espacio aéreo de la cámara de perfusión.
- Retirar el medio hipóxico mediante un lavado de 20 min con medio gaseado normóxico (caudal: 6 ml/min).
- Al final de cada experimento, añadir 1,2 μl de 10 μM U46619 (concentración final 0,01 μM; 20 min; sin flujo) a la cámara de perfusión para inducir la vasoconstricción.
Nota: Este paso final permite determinar si un cambio en la respuesta hipóxica (por ejemplo, inducido por la aplicación simultánea de un fármaco en la fase hipóxica o observado en un PCLS preparado a partir de una cepa de ratón knockout) es específico para la constricción inducida por hipoxia o si refleja un impacto general en la contractilidad. La concentración de 0,01 μM corresponde al valor EC50 de U46619 que se estimó en mediciones anteriores de concentración-contracción (no publicadas). - Utilice otro PCLS para realizar experimentos de control con normóxico en lugar de MEM gaseado hipóxico y mezcla de gases normóxicos en el espacio aéreo de la cámara de perfusión.
- Comience cada experimento con una "fase de adaptación" en la que la cámara se perfunde con medio gaseado normóxico (caudal: 0,7 ml/min; 10 min). A continuación, pruebe la viabilidad del vaso: Analizar la contractilidad de la arteria mediante la adición de 12 μl de 10 μM U46619 (concentración final 0,1 μM; 10 min; sin flujo).
5. Análisis de vasoreactividad y presentación gráfica
- Usando un software adecuado, tome fotografías de la arteria sec seccionado transversalmente cada minuto durante todo el experimento.
- Utilizando el software adecuado, evalúe los cambios en el área luminal de los vasos alineando los límites internos a mano utilizando imágenes de pantalla completa.
Nota: Es suficiente analizar cada segundo cuadro para obtener gráficos claros. Sin embargo, cuando una condición en la cámara de superfusión de flujo pasante por otra, analice cada imagen. Las imágenes restantes sirven como respaldo en caso de que una fotografía no pueda ser analizada.
Desafortunadamente, este paso que consume mucho tiempo tiene que hacerse a mano y no mediante programas apropiados, ya que a veces las células sanguíneas se unen a la pared vascular que se mueven durante la medición o no es una sección transversal perfecta del vaso, sino una sección tangencial en la que una localización confiable de los límites internos solo se puede hacer bajo control visual. - Definir el valor obtenido para el área de la luz del vaso al inicio del experimento como 100% y expresar vasoconstricción o dilatación como disminución relativa o aumento de este valor.
- Para cada experimento, trace el área luminal relativa contra el tiempo utilizando el software adecuado.
- Para resumir varios experimentos, trace las medias de las áreas luminales relativas +/- error estándar de la media (SEM) contra el tiempo.
Nota: Para una presentación clara de los efectos de diversas sustancias sobre la vasoconstricción pulmonar inducida por hipoxia o U46619 o de la respuesta hipóxica de las cepas de ratón knockout, la fase inicial de los experimentos, en la que se prueba la viabilidad del vaso, se puede omitir del gráfico. En este caso, los valores obtenidos al inicio de la exposición al oxígeno reducido se definen como 100%.
6. Análisis estadístico
- Analizar las diferencias entre los grupos experimentales con la prueba de Kruskal-Wallis y la prueba de Mann-Whitney, considerando significativa p≤0,05 y p≤0,01 altamente significativa.
Nota: Para obtener información adicional sobre la preparación y el uso operativo del PCLS, véase también20,21.
Resultados
En la Figura 1 se dan los resultados de la medición del VPH de una arteria pre-acinar grande y en la Figura 2 de pequeñas arterias intra-acinares. En las imágenes de contraste de fase(Figuras 1A y 2A)queda claro que es posible discriminar estas 2 clases de arterias en función de su ubicación dentro del tejido pulmonar: Las arterias pre-acinares discurren en vecindad cercana a bronquios y bronquiolos(Figura 1A),mientras que las arterias intra-acinares están localizadas en chorros de septos alveolares y rodeadas de alveolas(Figura 2A). Con un poco de práctica es posible ver los cambios en el área luminal en respuesta a U46619 en las imágenes de contraste de fase (Figuras 1A y 2A). Sin embargo, la vasoconstricción pulmonar hipóxica a menudo no es tan pronunciada y se hace evidente sólo después de la evaluación completa de los cambios de las áreas luminales (Figuras 1B, 1C, 2B, y, 2C). Por razones didácticas hemos dado un ejemplo de una arteria pre-acinar que muestra una vasoconstricción inusualmente pronunciada. En promedio, el VPH resulta en una reducción del 20-30% del área luminal.
En la Figura 2 se muestran los registros de pequeñas arterias intra-acinares incubadas con medio hipóxico-gaseado con o sin pinacidil de 50 μM (un abridor no selectivo de canales de potasio sensibles al ATP mitocondrial) y el efecto inhibitorio del fármaco se hace claramente visible. La parte final del experimento demuestra la selectividad de la acción del fármaco sobre el VPH: La vasoconstricción inducida por el análogo de tromboxano U46619 no se cambia por la adición de pinacidil. De hecho, la curva para la arteria expuesta el pinacidil corre claramente más bajo que los otros dos, pero el grado de reducción del área luminal por U46619 solamente es comparable. En este caso fue la reversión incompleta del VPH la que provoca la diferencia entre las curvas. En este gráfico también se incluye como control adicional una arteria expuesta a medio gaseado normóxico. Bajo esta condición, no se pueden detectar cambios en el área luminal.
En la Figura 3 se muestran los datos de la serie completa de mediciones sobre la influencia del pinacidil en el VPH. Para la comparación de los dos grupos para las diferencias estadísticas, los conjuntos de datos de los puntos de tiempo indicados fueron analizados con la prueba de Kruskal-Wallis- y la prueba de Mann-Whitney. HPV fue suprimido claramente en presencia de pinacidil mientras que la contracción de U46619-induced era sin cambios.
Alternativamente, es posible identificar diferencias entre los grupos mediante la comparación del área bajo la curva como se describe en Müller-Redetzky et al. 22
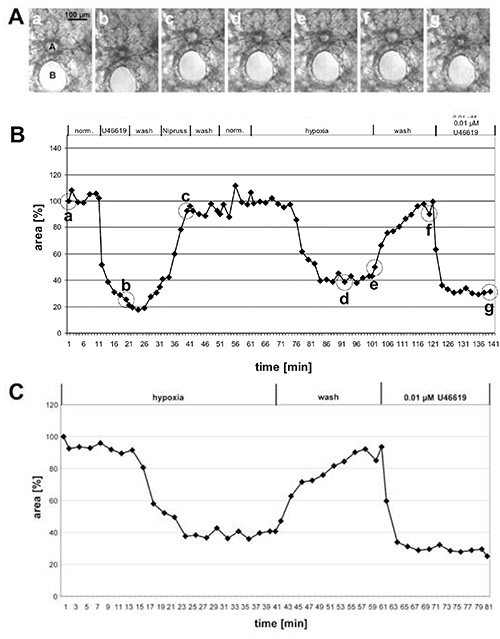
Figura 1. Medida del VPH de una arteria pre-acinar grande. (A)Imágenes de contraste de fase de una arteria pre-acinar seccionado transversalmente (a) que corre en vecindad cercana a un bronquio seccionado transversalmente(B). Las imágenes se toman en los puntos de tiempo indicados en(B)por círculos: al principio de la medición (a), al final del tratamiento con U46619 (b), al final de la exposición a Nipruss (c), después de 30 o 40 min en medio gaseado hipóxico (d, e), después del lavado con medio gaseado normóxico (f), y después de la aplicación final de U46619 (g). En el gráfico(B)los cambios del área luminal se trazan contra el tiempo, mientras que el área luminal al comienzo del experimento se define como 100% y la vasoconstricción /dilatación se dan como valores relativos. En este caso la hipoxia induce una reducción del 60% del área luminal. (C)Para una presentación más clara de la respuesta hipóxica, no se incluye la fase inicial del experimento en la que se probó la vasoreactividad, pero el valor obtenido inmediatamente antes de la exposición al oxígeno reducido se establece en el 100% (ver también la Figura 2). Haga clic aquí para ver la imagen más grande.
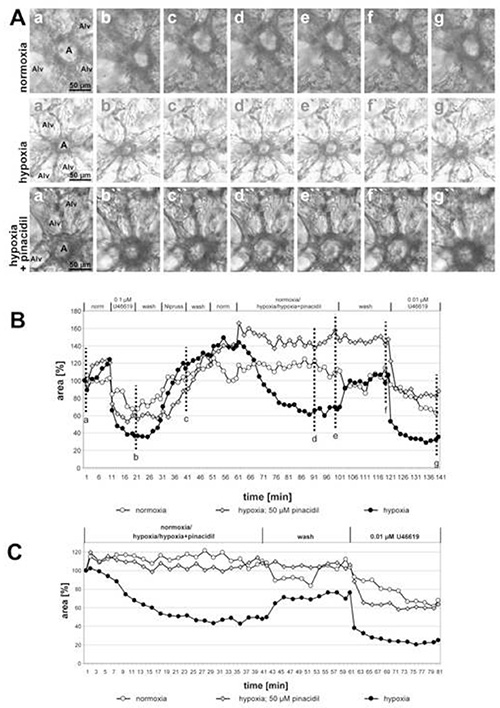
Figura 2. Impacto del pinacidil (un abridor no selectivo de los canales atp-sensibles mitocondriales del potasio; mitoKATP) en HPV de pequeñas arterias intra-acinar. (A) Las arterias intraacinares (a) se encuentran en los chorros de los septos alveolares. Alv = alvéolo. La secuencia de las condiciones individuales aplicadas en estos experimentos se da en el título del gráfico (B). La exposición hipóxica se realiza en presencia o ausencia de pinacidil de 50 μM. Las incubaciones de control se realizan con medio gaseado normóxico. Las imágenes mostradas en (A) se toman al principio de la medición (a, a', a"), al final del tratamiento con U46619 (b, b', b"), al final de la exposición a Nipruss (c, c', c"), después de 30 o 40 min en medio gaseado hipóxico o normóxico (d, d', d"; e, e', e"), después del lavado con medio gaseado normóxico (f, f', f"), y después de la aplicación final de U46619 (g, g', g"). Para una presentación más clara de la respuesta a normoxia/hipoxia/hipoxia+pinacidil, los valores obtenidos inmediatamente antes de la exposición al medio normóxico/hipóxico-gaseado se establecen como 100%(C). Haga clic aquí para ver la imagen más grande.
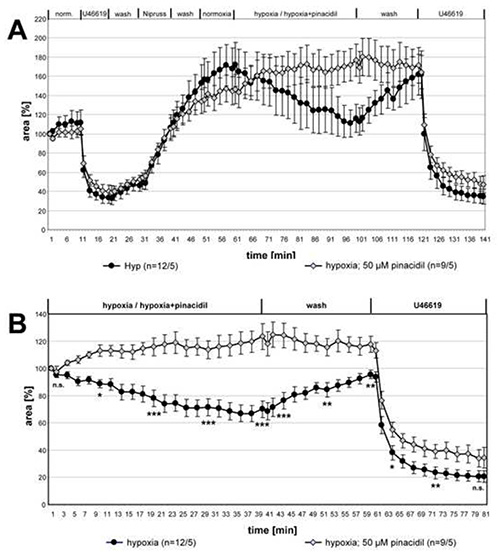
Figura 3. Inhibición de HPV por pinacidil. Los registros de pequeñas arterias intra-acinares expuestas a medio gaseado hipóxico con o sin pinacidil de 50 μM se resumen y presentan como medios ± SEM. En (A) se dan los registros completos, en (B) se muestran los datos relativos en relación con el valor al comienzo de la incubación hipóxica. No se detecta ninguna vasoreactividad en pcls que se exponen al medio hipóxico-gaseado que contiene el pinacidil. La vasoconstricción inducida por U46619 no se ve afectada por el fármaco. "n" entre paréntesis se refiere al número de arterias/número de animales a partir de los cuales se hizo PCLS. En otras palabras, el primer número describe el recuento de secciones pulmonares analizadas y el segundo número da el recuento de ratones a partir de los cuales se prepararon estas secciones. En los puntos de tiempo dados, las diferencias entre ambos grupos se prueban para la significación. n.s.p.: no significativo, *: p≤0.05, **: p≤0.01, ***: p≤0.001. Haga clic aquí para ver la imagen más grande.
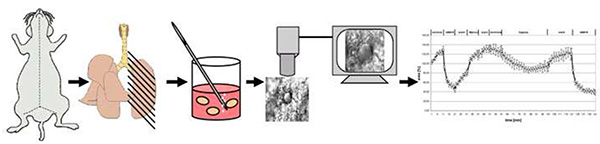
Figura 4. Descripción general esquemática del método. Brevemente, los ratones son asesinados por la dislocación cervical. Después de la apertura del tórax, los pulmones se llenan de agarosa de bajo punto de fusión y después de enfriarse cortan en rebanadas pulmonares de corte de precisión de 200 μm de espesor (PCLS). Después de retirar la agarosa a 37 °C, un PCLS se transfiere a la cámara de superfusión de flujo pasante en la que se expone al medio normóxico o al medio gaseado con 1%O2. La vasoreactividad se registra como cambios en el área luminal. Haga clic aquí para ver la imagen más grande.
Discusión
El pulmón de ratón ventilado y perfundido aislado es un excelente modelo para el análisis de la respuesta fisiológica del sistema vascular pulmonar sobre los cambios en el suministro de oxígeno y entre otros permite la medición continua de la presión arterial pulmonar1. Sin embargo, este modelo no permite la identificación y el análisis de aquellos segmentos vasculares que muestran la respuesta más fuerte a la hipoxia. Esta es la ventaja de nuestro análisis videomorfométrico de PCLS que facilita la medición del VPH de arterias individuales con diámetros internos de 20-100 μm. Los PCLS representan un modelo in vitro atractivo ya que se asemejan mucho al órgano a partir del cual se preparan. En contraste con los sistemas de cultivo celular, todos los tipos de células están presentes en su configuración original de matriz de tejido. Además, un pulmón es suficiente para la preparación de muchos PCLS, de modo que al menos parcialmente los experimentos se puedan estandarizar mediante el uso de secciones del mismo ratón. De acuerdo con el concepto 3R (reducción, refinamiento y reemplazo de animales de laboratorio en las ciencias de la vida) de Russell y Burch23 este hecho también aboga por el uso de PCLS.
Sin embargo, uno tiene que tener en cuenta, que el tejido se daña por el corte con un vibratome y señalización longitudinal, por ejemplo, a través de las células endoteliales según lo postulado por Kübler et al. 14 ya no es posible.
Inicialmente, los PCLS se aplicaron principalmente para estudios bioquímicos, farmacológicos y toxicológicos, pero mientras tanto también se utilizan para la medición de la contractilidad bronquial, la función mucociliar y las respuestas vasculares (para las revisiones, consulte Sanderson20 y Davies21). Held et al. Se ha realizado un estudio en el que se compararon los modelos de pulmón de ratón perfundido y ventilado aislado y de PCLS24. Encontraron mediante el análisis de las respuestas de las vías respiratorias y los vasos pulmonares a una variedad de mediadores endógenos que las características importantes de todo el pulmón se mantuvieron en pcls.
En PCLS, las condiciones hipóxicas no se establecen vía las vías aéreas como en el pulmón intacto sino por la incubación de la sección del pulmón en medio hipóxico-gaseado. Se ha analizado la presión parcial de oxígeno (pO2)del medio pregasado con 1%O2,5,3%CO2,93,7%N2 y con 21%O2,5,3%CO2,73,7%N2,respectivamente, utilizando un analizador de gases en sangre. Inmediatamente antes de alimentarlo en la cámara de perfusión, el pO2 del MEM gaseado hipóxico fue de 40 mmHg y el del medio gaseado normóxico de 160 mmHg6. En el pulmón intacto el VPH se induce cuando el pO alveolar2 cae por debajo de 50 mmHg25,una situación que obviamente puede ser imitada por la aplicación de medio hipóxico-gaseado. Nuestros datos sobre la extensión del VPH coinciden bien con los resultados obtenidos con un enfoque experimental diferente. Yamaguchi et al. se han aplicado pulmones aislados de rata para examinar microvasos con diámetro de 20-30 μm mediante microscopía de luminiscencia de barrido láser confocal en tiempo real acoplada a una cámara de alta sensibilidad con un intensificador de imagen10. Observaron una reducción media del diámetro de 2,7 μm después de la exposición de los pulmones a la hipoxia. Se puede calcular que una reducción del 20% del área luminal tal como la medimos en nuestro sistema corresponde a una disminución de aproximadamente el 15% en el diámetro.
En nuestros experimentos hemos clasificado las arterias como vasos pre- e intra-acinares, respectivamente, con diámetros internos de 40-100 μm y 20-40 μm. En los seres humanos la transición de arterias musculares a nomusculares se produce en el rango de diámetro de 70-100 μm. En ratones, las células musculares lisas están presentes hasta un diámetro externo de 20 μm26. Por esta razón no es posible analizar arterias con diámetros inferiores a 20 μm ya que no pueden ser identificadas de manera confiable en base a la imagen de contraste de fase. En el otro extremo de la escala, los vasos con diámetros superiores a 100 μm difícilmente se encuentran en pcls y comúnmente despojados del tejido circundante.
En realidad, un número de candidatos moleculares se discuten como sensores de oxígeno molecular o como componente de la cascada de señalización que resulta en el VPH (para una revisión ver Sylvester et al. 4). Una vez que los ratones knockout apropiados están disponibles, la videomorfometría se puede utilizar para el análisis de la vasoreactividad de las arterias pre e intra-acinares en comparación con los animales de tipo salvaje. Sin embargo, PCLS también se han utilizado para otros problemas: Faro et al. los empleó para caracterizar el desarrollo de la dilatación dependiente del endotelio en pulmón después del nacimiento29 y pcls preparados de conejillos de Indias expuestos al humo o al aire diariamente por 2 semanas fueron utilizados para demostrar el impacto del humo del cigarrillo en vasoreactivity vía la inducción de la disfunción endotelial30.
Pasos críticos dentro del protocolo
En nuestros experimentos clasificamos las arterias como pre-acinar (diámetros internos de 40-100 μm) e intra-acinar (diámetros internos de 20-40 μm). Especialmente para la preparación de secciones pulmonares que deben utilizarse para el análisis de vasos más grandes, es importante agregar nitroprusiato de sodio al tampón de perfusión. Este medicamento previene la contracción de los vasos durante la preparación de la muestra y, por lo tanto, su estafa del tejido circundante que conduce a la vasodilatación incompleta. El nitroprusiato de sodio en el tampón de perfusión no es tan importante para la preparación de la sección pulmonar que debe utilizarse para el análisis de pequeñas arterias porque están fuertemente ancladas a los septos alveolares.
Todos los experimentos deben iniciarse con incubaciones en las que se pruebe la reactividad de las arterias. Raramente, obtuvimos las preparaciones del pulmón en las cuales no hay respuesta de recipientes a los contratistas o a los dilatadores perceptible. No sabemos la razón de esto: Puede ser que el volumen de la agarosa llenada en los pulmones era demasiado grande o demasiado bajo de modo que el corte del órgano en PCLS no fuera óptimo. Alternativamente, es imaginable que la agarosa se enfriaba demasiado rápido durante el procedimiento de instilación, lo que resultaba en una tensión de cizalladura perjudicial. En caso de que en un PCLS individual ninguna arteria viable sea detectable, la sección tiene que ser desechada y reemplazada por otra.
La decisión sobre la viabilidad de una arteria se tomó en base a la respuesta a U46619. La aplicación de U46619 a una concentración de 0,1 μM induce una vasoconstricción que - después de algún ejercicio - es visible directamente en la secuencia de imágenes en la pantalla. Puesto que hay algunas varianzas en la vasoreactividad investigamos el impacto de una droga en HPV midiendo el vasoresponse en las secciones del pulmón expuestas a la droga o al medio solamente a su vez.
El VPH de una arteria individual a menudo es difícilmente detectable en el microscopio, y en promedio resulta en una reducción del área luminal de aproximadamente 20-30%. Sin embargo, los pequeños cambios en el diámetro de una arteria tienen una entrada distinta en la resistencia al flujo. Según la ecuación "R = 1/r4"con R=resistencia y r=radio, la resistencia del flujo es inversamente proporcional a la cuarta potencia del radio. Permítanme dar un ejemplo: Una "arteria ideal" que exhibe una sección transversal circular con un diámetro de 40 μm (r = 20 μm) tiene un área luminal de aproximadamente 1,260 μm2. Cuando el área luminal se reduce en un 20%, podemos calcular que el diámetro del vaso se reduce en un 10,5% a 35,8 μm (r=17,9 μm). De acuerdo con la ecuación dada anteriormente, la resistencia al flujo de este recipiente aumentaría de 6.25 x 10-6 a 9.71 x 10-6, es decir, en aproximadamente un 55%. En caso de una reducción del área luminal en un 30% el radio disminuiría en aproximadamente un 16%, pero la resistencia al flujo aumentaría en aproximadamente un 100%. Aunque estos cálculos son una simplificación excesiva en la que se supone un flujo sanguíneo laminar y una forma de vaso de una tubería rígida, es sugestivo del impacto de cambios ya menores del diámetro en la resistencia al flujo.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Esta investigación está patrocinada por el Clúster excelencia del Sistema Cardiopulmonar.
Materiales
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
Referencias
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados