Method Article
Видеоморфометрический анализ гипоксической легочной сосудоборства внутриположных артерий с использованием Murine Precision Cut Lung Slices
В этой статье
Резюме
Гипоксическая легочная сосудоконтрика (ВПЧ) является важным физиологическим явлением, при котором при альвеолярной гипоксии перфузия легких сопрягается с вентиляцией легких. Основным сосудистым сегментом, способствующим ВПЧ, является внутриацинарная артерия. Здесь мы описываем наш протокол для анализа ВПЧ мурин легочных сосудов диаметром 20-100 мкм.
Аннотация
Острая альвеолярная гипоксия вызывает легочную сосудоконтрикацию (ВПЧ) - также известный как механизм фон Эйлер-Лильестранда - который служит для соответствия перфузии легких вентиляции. До сих пор основные механизмы не до конца поняты. Основным сосудистым сегментом, способствующим ВПЧ, является внутриацинарная артерия. Этот участок сосуда отвечает за кровоснабжение отдельного ацинуса, который определяется как часть дистального легких до терминального бронхиола. Внутриацинарные артерии в основном расположены в этой части легких, которые не могут быть выборочно достигнуты ряд широко используемых методов, таких как измерение давления легочной артерии в изолированных перфлитированных легких или силовые записи из вскрытых сегментовпроксимальной легочной артерии 1,2. Анализ субплевральных сосудов с помощью конфокальной лазерной микроскопии, сканирующей люминесценцию, в режиме реального времени ограничивается сосудами диаметром до50 мкм.
Мы предоставляем методику изучения ВПЧ мурин внутри легких артерий в диапазоне 20-100 мкм внутреннего диаметра. Он основан на видеоморфометрическом анализе поперечных артерий в точности разрезанных ломтиков легких (PCLS). Этот метод позволяет количественно измерять вазореактивность малых внутриацинарных артерий с внутренним диаметром от 20 до 40 мкм, которые расположены на gussets альвеолярной септы рядом с альвеолярными протоками и более крупных предацинарных артерий с внутренним диаметром между 40-100 мкм, которые проходят рядом с бронхами и бронхиолами. В отличие от изображений субплевральных сосудов в реальном времени у анестезированные и вентилируемые мыши, видеоморфометрический анализ PCLS происходит в условиях, свободных от стресса стрижки. В нашей экспериментальной модели оба артериальных сегмента демонстрируют монофазный ВПЧ при воздействии среднего газа с 1% O2 и ответ исчезает после 30-40 мин при гипоксии.
Введение
В большинстве системных сосудистых кроватей гипоксия вызывает вазодилатацию, по сравнению с сосудосуживанием, вызванной гипоксией в легочной сосудоположе. Этот легких конкретных ответ на снижение кислородного напряжения называется гипоксической легочной сосудоконстрикции (ВПЧ), начала в течение нескольких секунд и быстро меняется после переключения на нормоксической вентиляции легких. Хотя ВПЧ известен уже более 60 лет, клеточный датчик кислорода (ы) и сигнальный каскад (ы), приводящий к сосудосуживающих все еще находятся в стадии обсуждения. Существует относительно широкий консенсус, что гипоксия вызванных редокс и ROS изменения имеют важное значение для ВПЧ и развития легочной гипертензии (обзор в Сильвестр и др. 4 и Шумакер и др. 5). Наши собственные данные поддерживают центральную роль комплекса II митохондриальной дыхательной цепи в ВПЧ6,7. В последнее время Ван и др. представил совершенно новую концепцию зондирования кислорода и ВПЧ: На основе своих данных они предполагают, что альвеолярная гипоксия чувствуется соседними капиллярами, вызывающими мембранную деполяризацию эндотелиальных клеток. Ответ распространяется через соединение 40 разрыв соединений эндотелиальных клеток, ведущих к сужению гладких мышечных клеток вверх по течениюартериолы 8.
Артерии легких проходят рядом с дыхательными путями, ветвятся вместе с ними, непрерывно уменьшаются в диаметре и, наконец, поставляют кровь в капиллярную систему, расположенную в альвеолярных стенках. Эта артериальная циркуляция состоит из анатомически и функционально различных сегментов. Проксимальные артерии канала, характеризующиеся обилием эластичных волокон в стенках, следуют полностью мускулистые внутри легкие артерии, которые в значительной степени контролируют сопротивление легочных сосудов. Шаг за шагом эти артерии перейти в сегменты, где мышечный слой становится неполным, и, наконец, сосуды свободны от гладкой мышцы актин-иммунореактивных клеток. Внутриацинарная артерия, питая индивидуальную легочную ацинус кровью, представляет собой частично мышечный сегмент6. Аналогичным образом, легочная артериальная система не представляет собой единую структуру в отношении гипоксической реакции, но экспонаты отмеченырегионального разнообразия 9,10. Например, в проксимальных легочных артерий, изолированных от гипоксии легких крысы вызывает бифазную реакцию, показывая первоначальное быстрое сокращение короткой продолжительности, которая - после неполного расслабления - сопровождается второй медленно, ноустойчивый сокращение 11. В резистентных артериях, изолированных от паронхимы легких крысы как четвертого и пятого деления легочных артерий (внешний диаметр <300 мкм), гипоксия вызывает монофазноесужение 9. Уже в 1971 году Глейзер и Мюррей пришли к выводу из измерений изменений в капиллярной концентрации красных кровяных телец в легких собак, проветриваемых гипоксическими газовыми смесями, что гипоксия индуцированного увеличение сосудистой устойчивости в основном произошло вверх по течениюкапилляров 12. В настоящее время интравитальная микроскопия нетронутых легких обезболиваемых и механически проветриваемых мышей представляет собой мощный инструмент дляанализа микроваскуляра легких 13,14. Иссечение кругового окна в грудной стенке дает микроскопический доступ к поверхности легких и позволяет проводить анализ субплеуральных легочных сосудов диаметром до 50 мкм. Комбинируя этот метод с вливанием FITC-декстрана, Табучи и др. показали, что только средние артериолы диаметром 30-50 мкм обладают заметной реакцией на гипоксию, которая поддерживается в течение 60 минут с незначительным затуханием через 30 минут. В отличие от этого, небольшие артериолы диаметром 20-30 мкм показали лишь незначительную реакцию на гипоксию3. Тем не менее, этот метод не позволяет анализ артерий диаметром больше, чем 50 мкм, поскольку эти сосуды расположены слишком глубоко в легочной ткани.
Для того, чтобы преодолеть разрыв в анализе больших и очень маленьких легочных артерий (таких как субплеуральные сосуды) из легких мурина, мы приняли метод, который был описан Мартин и др. для анализа реактивности дыхательных путей15. Основываясь на методе привития агарозного геля, он облегчает подготовку точных порезов легких (PCLS) из этого относительно мягкого и эластичного органа. В рамках PCLS вазореактивность поперечных артерий с внутренним диаметром от 20-100 мкм может быть непосредственно наблюдается с помощью видеомикроскопии. Применение препаратов во время гипоксической инкубации ПХЛС позволяет анализ их воздействия на ВПЧ. Особенно важно, что этот метод может быть применен и к генетически модифицированным мышам. Основываясь на их расположении в легких, мы классифицируем артерии как пред- и внутриацинарные сосуды, с внутренним диаметром 20-40 мкм и 40-100 мкм, соответственно. Под функциональным взглядом внутриацинарная артерия поставляет индивидуальный легочный ацинус с кровью и pre-acinar артерия предшествующие разделы сосуда. Запись снимков на цифровую камеру позволяет последующей количественной оценки вазореакции. Очевидным атрибутом этой модели PCLS является отсутствие стрижки-стресс, действующих на эндотелий. В отличие от этого, в перфокнутых сосудах острый ВПЧ приводит к росту слайра стресса тем самым вызывая вторичные механизмы, такие как NO релиз16. Кроме того, использование PCLS позволяет измерения ВПЧ без внелегочных нервных или гормональных воздействий. В отличие от систем клеточной культуры, например, подготовленных из собак легочных артериальныхгладких мышечных клеток 17,гистологическая архитектура стенки сосуда почти полностью сохранилась.
Таким образом, этот протокол предоставляет полезный метод для анализа потенциальных молекулярных датчиков кислорода и / или клеточных путей, ответственных за ВПЧ внутрибольных артерий с внутренним диаметром между 20-100 мкм в условиях, свободных от стресса с ножницами.
протокол
1. Подготовка газовых смесей, оборудования, инструментов и решений
В этом разделе описывается необходимое оборудование и настройка протокола. Дополнительные сведения и сведения о производителе можно найти в сопроводительной таблице.
- Получить или подготовить следующие газовые смеси:
- Две бутылки с нормоксической газовой смесью состоят из 21% O2,5,3% CO2, 73,7% N2.
- Одна бутылка с гипоксической газовой смесью состоит из 1% O2, 5,3% CO2, 93,7% N2.
- Соберите следующее оборудование:
- Микроволновая печь, для плавления агарозы.
- Отопительный шкаф для промывания агарозы из секций легких (см. ниже). Вставьте в шкаф трубку, соединенную с бутылкой с нормоксической газовой смесью.
- Вибром с соответствующими лезвиями бритвы, для разрезания легких на 200 мкм толщиной ломтиками. Это выгодно, если виброма оснащен холодильным набором для охлаждения буфера в вибромном бассейне.
- Перетекаемая сверхтопливная камера, установленная на перевернутом микроскопе, для анализа ВПЧ внутрилегких артерий.
- Для облегчения фиксации секций легких в нижней части камеры, подключить нейлоновые струны к платиновому кольцу (самоконструированы). Присоединяйтесь к перфузионной камере к перистральтическому насосу с скорректированными скоростью потока до 0,7 мл/мин и 6 мл/мин соответственно.
- Соберите оборудование так, чтобы во время экспериментов средства массовой информации хранились в водяной бане 37 градусов по Цельсию и пузырились нормоксическим или гипоксическим газом с использованием канюли 21 G x 4 3/4. Кроме того, используйте второе соединение из газового баллона, чтобы нормаксические/гипоксические газовые смеси полились в воздушное пространство перфузионой камеры. Убедитесь, что все трубы этой системы являются газовыми плотно.
- CCD-камера, установленная на вертикальном перевернутом микроскопе для записи изображений анализируемой артерии.
- Подготовь следующие инструменты:
- Для подготовки легких: стерильный набор для вскрытия, включая грубые ножницы и две пары типсов, тонкие ножницы для вскрытия грудной клетки, микросхистор, чтобы вырезать отверстие в трахее для заполнения агарозы, и швейный хлопок (около 20 см) для перевязки трахеи, чтобы предотвратить отток агарозы.
- Для заполнения дыхательных путей агарозой: подключите шприц 2 мл к гибкой пластиковой трубе iv indwelling cannula (20 G x 1 1/4).
- Для перфузии легких с буфером: зафиксните 50 мл шприца в качестве буферного резервуара примерно на 40 см над рабочим местом для приготовления мыши.
- Для оттока буфера: подключите шприц к трубке, к которой прикреплена канюля 25 G x 1. Используйте зажим в трубке, чтобы настроить отток примерно до 1 капли/сек (около 0,3-0,4 мл/мин).
- Подготовь следующие буферы и средства массовой информации:
- Сделать 1000 мл hePES-Ringer буфер (10 мМ HEPES, 136,4 мМ НаКл, 5,6 мМ ККл, 1 мМ МгКл26H 2O, 2,2 мМ. CaCl22H 2O, 11 мМ. глюкоза, рН 7,4). Храните стерильный фильтрованный буфер (размер поры фильтра: 0,2 мкм) при 4 градусах Цельсия.
- Примерно за 30 минут до начала изоляции легких подготовят следующие решения:
- Растворите 1,5% ж/в низкой точки плавления агарозы в буфере HEPES-Ringer (общий объем 10 мл) и растопите его, варя в микроволновой печи. Впоследствии, охладить его до 37 градусов по Цельсию путем хранения в отопительном шкафу. Довоить 2 мл шприца для заполнения агарозы в легочные дыхательные пути.
- Возьмите 20 мл буфера HEPES-Ringer, добавьте гепарин в окончательную концентрацию 250 I.U./ml и нагрейте буфер до 37 градусов по Цельсию. Непосредственно перед использованием добавьте нитропрузсид натрия к окончательной концентрации 75 МКМ. Это буфер перфузии для бегства крови из легочной сосуда.
- Положите 200 мл буфера HEPES-Ringer в стеклянный стакан и храните его на льду. Этот буфер будет необходим для охлаждения заполненных агарозой изолированных легких.
- Заполните около 200 мл MEM, дополненного 1% пенициллина/стрептомицина в стеклянном стакане и храните его при 37 градусах цельсия в отопительном шкафу. Пузырь среды с нормоксической газовой смеси. Это будет использоваться для удаления агарозы из легких разделов.
- Довоенные 2 бутылки MEM дополнены 1% пенициллина / стрептомицина в водяной бане до 37 градусов по Цельсию и пузырь их с нормоксической и гипоксической газовой смеси, соответственно, по крайней мере 2 часа до начала видеоморфометрических измерений. Приблизительно 250 мл MEM потребуется для измерения.
- Соберите следующие дополнительные материалы:
- 70% EtOH для дезинфекции.
- Стоковое раствор гепарина (25.000 I.U./5 мл), хранящийся при 4 градусах по Цельсию (см. выше).
- Стоковое решение НИ ДОНОР натрия нитропрузида (Nipruss): 10 мм в H 2 O,хранящихсяна льду (см. выше).
- Стоковый раствор тромбокана аналог U46619: 10 МКм в этаноле, хранящемся на льду.
- Суперклей.
- Швейный хлопок для перевязки трахеи после заполнения агарозой.
2. Звери
Используйте мышей (например, штамм C57Bl6) обоих полов в возрасте 10-25 недель. ВПЧ также может быть проанализирован в нокаут штаммов и соответствующих штаммов дикого типа.
Все эксперименты проводились в соответствии с руководящими принципами НИЗ по уходу и использованию экспериментальных животных и были одобрены местными институциональными советами.
3. Изоляция легких Мурина и подготовка точного разреза ломтиков легких (PCLS)
- Убейте мышь при вывихе шейки матки. Сразу после убийства, стерилизовать брюшной поверхности тела с 70% EtOH и использовать грубые ножницы, чтобы сократить кожу вдоль брюшной средней линии от подбородка до таза.
Примечание: Поскольку известно, что ингаляционные анестетики, такие как изофлюран оказывают влияниена тонус сосудов 18,19, не используйте летучие анестетики. - После открытия брюшной полости, положить кишечные петли в сторону и разорвать большие брюшные сосуды для кровотечения. После проникновения диафрагмы с тонкой ножницой, легкие рухнут в результате входа воздуха в плевральной полости. Используйте ножницы, чтобы отделить диафрагму от нижней грудной диафрагмы. Вырезать ребра и ключицу боковой удалить брюшной части рип клетки.
Примечание: Важно, чтобы легкие не повреждены в этом шаге, так как в противном случае вздутие легких с агарозой будет невозможно! Используйте только стерильные инструменты и лабораторную стеклянную посуду. - Перед началом перфузии легочной сосуда, вырезать небольшое отверстие в левом желудочковом сердце для выделения буфера. Заполните шприц резервуар с теплым (37 кк) HEPES-Ringer буфер, содержащий гепарин и нитропруссид натрия (перфузии буфера) и perfuse легочной сосудов медленно через правый желудочек.
Примечание: Perfusion эффективен, когда легкие меняют свой цвет и получают белый вид. На этом этапе важно добавить нитропрузсид натрия в буфер перфузии; это предотвращает предварительно ацинарных артерий от срыва от окружающих тканей. - Удалить слюнные железы, мелкие мышцы и соединительной ткани из трахеи. Отключите трахею от окружающих соединительной ткани и нити швейного хлопка между пищеводом и трахеей для более поздней перевязки.
- Используйте микросцисор, чтобы вырезать небольшое отверстие в верхней части трахеи между двумя соседними трахеями хрящей. Теперь вставьте гибкую пластиковую трубу IV indwelling канюли через небольшое отверстие в трахею и тщательно исправить его с швейным хлопком. Медленно заполните дыхательные пути теплой (37 градусов по Цельсию) низкой точки плавления агарозы. Наблюдайте за легкими: Сначала правое легкое начинает расширяться, а затем левое легкое. Заполнение завершается, когда оба легких надуваются до объема, сопоставимого с ситуацией in vivo (около 1,2-2,0 мл в зависимости от пола, возраста и веса).
Примечание: Если только одно легкое расширяется, пластиковая труба, возможно, были вставлены слишком глубоко, так что он достиг бронхов. В этом случае, он должен быть вытащил немного. Имейте в виду, что агароза затвердеет, когда она постепенно остынет. - Когда легкие заполнены, одновременно вытащить пластиковую трубу и ligate трахеи с швейным хлопком, чтобы предотвратить отток агарозы. Впоследствии, сократить трахеи выше лигатуры и отделить легкие и сердце на блоке от груди.
Примечание: Для начинающих может быть полезно обратиться к коллеге за поддержкой на этапе перевязки. - Перенесите пакет органов в ледяной буфер HEPES-Ringer, чтобы укрепить агарозу. Это происходит в течение нескольких минут.
- Раздельте отдельные доли легких и зафиксировать одну долей с суперклеем на держатель образца вибромы.
Примечание: Полезно придерживаться кусок пробки шампанского на держатель, который служит в качестве перекоса во время резки эластичной ткани легких. В зависимости от используемой доли легких и ее ориентации на держатель образца, полученные PCLS могут быть более подходящими для анализа малых или крупных сосудов. В основном мы используем левую долей и правой черепной долей для подготовки PCLS. Чтобы получить поперечные небольшие внутриацинарные артерии, приклейте черепную правую долей к держателю и нарежьте с периферии. Чтобы получить поперечные предацинарные артерии, выровнять рукоятку правой доли с пробкой шампанского. - Используйте виброму, оснащенную свежим лезвием бритвы, чтобы разрезать легочную долей на 200 мкм толщиной ломтиками (скорость: 12 и 1,2 мм/сек; частота: 100 и амплитуда: 1,0). Соберите PCLS в вибромном бассейне, наполненном буфером HEPES-Ringer на 4 градуса Цельсия.
Примечание: Охлаждение HEPES-Ringer рекомендуется, но несущественным. - Для удаления агарозы перенесите секции органов в стеклянный стакан, наполненный около 200 мл 37 градусов тепла MEM. Положите стакан в отопительный шкаф, в который вставляется трубка, соединенная с бутылкой с нормоксической газовой смесью. Пузырь MEM с нормоксическим газом, так что легкие разделы медленно движется в среде. Примерно через 2 часа "агорозные бляшки", заполняя воздушное пространство, будут удалены из легочной ткани. Это можно признать тем, что секции больше не плавают на верхней части среды, а оседают на дне стакана.
4. Видеоморфометрический анализ внутрилегочных артерий PCLS
- Для видеоморфометрического анализа внутриполопрочные артерии, передача одного PCLS в поток через суперфузиольную камеру заполнены 1,2 мл нормоксических газированных MEM. Зафиксните PCLS в нижней части камеры нейлоновыми струнами, подключенными к платиновому кольцу (внешний/внутренний диаметр: 14/10 мм).
- Сканируйте PCLS микроскопически для поперечных артерий с внутренним диаметром от 20-100 мкм.
Примечание: Люмен артерий выстилается плоскими эндотелиальными клетками. Окружающие гладкие мышечные клетки могут быть определены в фазовом контрастном изображении как «темное кольцо», окружающее люмен (см. фазовое контрастное изображение на рисунке 2). В отличие от этого, дыхательные пути могут быть определены первоначально псевдостратифицированной колонкой эпителия, который транзитом на пути к плевральной поверхности в простой столбец эпителия следуют простой кубоидный эпителий.- Измерьте внутренний диаметр в начале каждого эксперимента.
Примечание: В слегка косо вырезать сосуды, истинный внутренний диаметр трубчатой структуры может быть определена в 90 "угол к самой длинной оси люмена. Крупные предацинарные артерии с внутренними диаметрами >40 мкм проходят рядом с бронхами и бронхиолами. Небольшие внутриацинарные артерии с внутренним диаметром <40 мкм расположены на gussets альвеолярной септы рядом с альвеола и альвеолярныхпротоков 6.
- Измерьте внутренний диаметр в начале каждого эксперимента.
- Экспериментальный дизайн:
- Начните каждый эксперимент с «фазы адаптации», в которой камера пронизана нормоксической газовой средой (скорость потока: 0,7 мл/мин; 10 мин). Далее, проверьте жизнеспособность сосуда: Проанализируйте контрактность артерии путем добавления 12 мкл из 10 МКМ U46619 (окончательная концентрация 0,1 МКМ; 10 мин; нет потока).
Примечание: Для этой работы сосуд определяется как жизнеспособный, когда светимая область уменьшается по крайней мере на 30% (для метода измерения см. ниже). - После промывания препарата с нормоксическим газом среды (скорость потока: 6 мл/мин; 10 мин) расширяют артерию путем применения 3 мл 10 мМ Nipruss (окончательная концентрация 25 МКМ; 10 мин; нет потока).
- Опять же, удалить препарат 10 мин мыть с нормоксическим газом среды (скорость потока: 6 мл/мин), а затем 10 мин при потоке 0,7 мл/мин.
- Индуцировать гипоксическую легочную сосудоуборку путем инкубации ПХЛС с гипоксической газой средой (скорость потока: 0,7 мл/мин; 40 мин). Дополнительной трубчатой системой подкармливуем гипоксическую газовую смесь в воздушное пространство перфузионой камеры.
- Удалите гипоксическую среду на 20 минут мыть с нормоксической газовой среды (скорость потока: 6 мл/мин).
- В конце каждого эксперимента добавьте 1,2 мкл из 10 МКМ U46619 (окончательная концентрация 0,01 МКМ; 20 мин; нет потока) в перфузиоционную камеру, чтобы вызвать сосудосуживание.
Примечание: Этот последний шаг позволяет определить, является ли изменение в гипоксической реакции (например, вызванные одновременным применением препарата в гипоксической фазе или наблюдается в PCLS, подготовленных из штамма нокаут мыши) специфичен для гипоксии индуцированного сужения или же она отражает общее влияние на контрактность. Концентрация 0,01 МКМ соответствует значению EC50 U46619, которое оценивалось в предыдущих измерениях сокращения концентрации (не опубликовано). - Используйте другой PCLS для выполнения контрольных экспериментов с нормоксическим вместо гипоксического газового MEM и нормоксической газовой смеси в воздушном пространстве перфузионой камеры.
- Начните каждый эксперимент с «фазы адаптации», в которой камера пронизана нормоксической газовой средой (скорость потока: 0,7 мл/мин; 10 мин). Далее, проверьте жизнеспособность сосуда: Проанализируйте контрактность артерии путем добавления 12 мкл из 10 МКМ U46619 (окончательная концентрация 0,1 МКМ; 10 мин; нет потока).
5. Анализ вазореактивности и графической презентации
- Используя подходящее программное обеспечение, фотографирует из поперечной секционной артерии каждую минуту в течение всего эксперимента.
- С помощью подходящего программного обеспечения оцените изменения светимой области сосудов, выстилая внутренние границы вручную с помощью полноэкранных изображений.
Примечание: Достаточно проанализировать каждую вторую картинку, чтобы получить четкие графики. Однако, когда одно условие в сквозной камере суперфузии изменено на другое, проанализируйте каждую картину. Остальные фотографии служат в качестве резервного в случае, если одна фотография не может быть проанализирована.
К сожалению, этот трудоемкий шаг должен быть сделан вручную, а не по соответствующим программам, так как иногда клетки крови прикрепляются к сосудистой стенке, которые движутся во время измерения или это не идеальный поперечный сечение сосуда, а касательный раздел, в котором надежная локализация внутренних границ может быть сделана только под визуальным контролем. - Определите значение, полученное для области люмена сосуда в начале эксперимента, как 100% и выразить сосудосуживание или дилатации как относительное снижение или увеличение этого значения.
- Для каждого эксперимента участок относительной светимой области на время с использованием подходящего программного обеспечения.
- Подводя итоги нескольких экспериментов, смойте средства относительных светящихся областей на стандартной погрешности среднего (SEM) со временем.
Примечание: Для четкого представления о воздействии различных веществ на гипоксию- или U46619-индуцированной легочной сосудоуборки или гипоксической реакции штаммов нокаутом мыши, начальная фаза экспериментов, в которых жизнеспособность сосуда проверяется, может быть опущена из графика. В этом случае значения, полученные в начале воздействия пониженного уровня кислорода, определяются как 100%.
6. Статистический анализ
- Анализируйте различия между экспериментальными группами с тестом Крускаль-Уоллис и Манн-Уитни, при этом p≤0.05 считается значительным, а p≤0.01 весьма значительным.
Примечание: Для получения дополнительной информации о подготовке и оперативном использовании PCLSсм. также 20,21.
Результаты
На рисунке 1 даются результаты измерения ВПЧ большой предацинарной артерии и на рисунке 2 малых внутриацинарных артерий. В фазе контрастных изображений(рисунки 1A и 2A) становится ясно, что можно различать эти 2 класса артерий в зависимости от их расположения в легочной ткани: Предацинарные артерии работают в непосредственной близости от бронхов и бронхиол(рисунок 1A), в то времякак внутриацинарные артерии расположенына gussets альвеолярной септы и окружены альвеола . С небольшой практикой можно увидеть изменения в области светимости в ответ на U46619 на фазе контрастных изображений(рисунки 1A и 2A). Однако гипоксическая легочная сосудоуборка часто не столь выражена и становится ясной только после полной оценки изменений светящихся областей(рисунки 1B, 1C, 2B и, 2C). По дидактической причине мы привели пример предацинарной артерии, которая показывает необычно выраженную сосудосуживаемость. В среднем ВПЧ приводит к 20-30% сокращению светимой области.
На рисунке 2 показаны записи малых внутриацинарных артерий, инкубированных гипоксическим газом среды с или без 50 МКМ пинацидил (неселективный нож митохондриальных АТФ чувствительных калийных каналов) показаны и ингибирующее действие препарата становится ясно видимым. Заключительная часть эксперимента демонстрирует избирательность действия препарата на ВПЧ: сосудосуживаемость, вызванная тромбоканом аналогом U46619, не меняется добавлением пинацидила. Действительно, кривая артерии подвергается пинацидил работает отчетливо ниже, чем два других, но степень сокращения светимой области U46619 только сопоставимы. В этом случае именно неполная реверсия ВПЧ вызывает разницу между кривыми. На этом графике также в качестве дополнительного контроля включена артерия, подвергаемая воздействию нормоксической газовой среды. При этом условии никаких изменений в области светимости не обнаруживается.
На рисунке 3 показаны данные полной серии измерений влияния пинацида на ВПЧ. Для сравнения этих двух групп по статистическим различиям были проанализированы наборы данных о указанных точках времени с помощью теста Крускал-Уоллиса и Манна-Уитни. ВПЧ был явно отменен при наличии пинацидила, в то время как U46619-индуцированное сокращение не изменилось.
Кроме того, можно определить различия между группами путем сопоставления области под кривой, как описано в Мюллер-Редецки и др. 22 Года
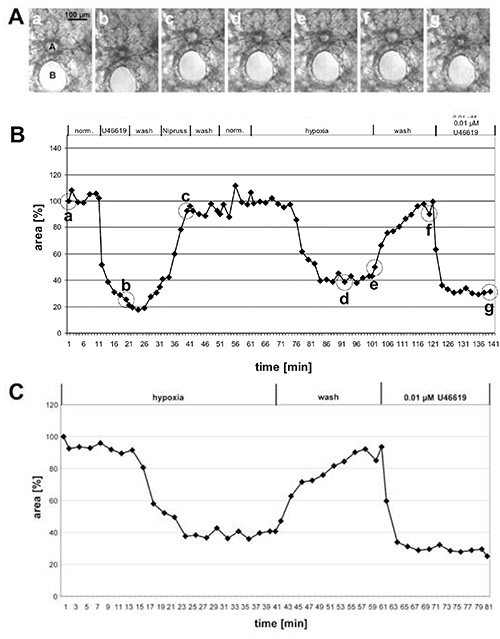
Рисунок 1. Измерение ВПЧ большой предацинарной артерии. (A) Фазовая контрастность изображений поперечной предварительной ацинарной артерии (a), которая проходит в непосредственной близости от поперечного бронха(B). Фотографии сделаны в точках времени, указанных в (B) кругами: в начале измерения (a), в конце лечения U46619 (b), в конце воздействия Nipruss (c), после 30 или 40 мин в гипоксической газовой среде (d, e), после мытья с нормоксической газой средой (f), и после окончательного применения U46619 (g). На графике(B) изменения светимой области построены со временем, в то время как светимая область в начале эксперимента определяется как 100%, а сосудосуживание/-дилатация дается как относительные значения. В этом случае гипоксия вызывает 60% уменьшение светимой области. C) Для более четкого представления гипоксической реакции начальная фаза эксперимента, в ходе которого была протестирована вазореактивность, не включена, но значение, полученное непосредственно перед воздействием пониженного кислорода, устанавливается в размере 100% (см. также рисунок 2). Нажмите здесь, чтобы просмотреть изображение большего размера.
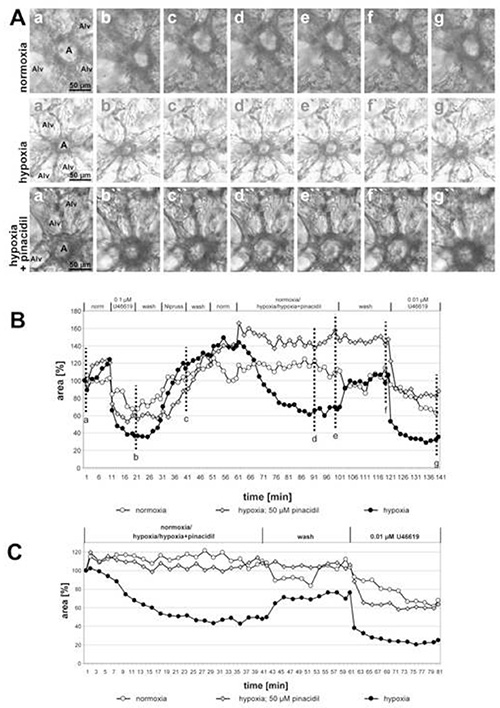
Рисунок 2. Воздействие пинацидила (неселективного открывателя митохондриальных АТФ-чувствительных калийных каналов; митокаТП) на ВПЧ мелких внутриацинарных артерий. (A)Внутриацинарные артерии (а) расположены на gussets альвеолярной септы. Альв и альвеол. Последовательность отдельных условий, применяемых в этих экспериментах, приведена в заголовке графика(B). Гипоксическое воздействие выполняется при наличии или отсутствии 50 МК пинацидил. Контрольные инкубации сделаны с помощью нормоксического газоразмерного носителя. Фотографии,показанные в ( A) сделаны в начале измерения (a, a', a), в конце лечения U46619 (b, b', b"), в конце воздействия Нипруса (c, c', c', c), после 30 или 40 мин в гипоксической или нормоксической газовой среде (d, d', d"; e', e', e"), после мытья с нормоксическим газом среды (f, f', f'), а также после окончательного применения U46619 (g, g', g). Для более четкого представления реакции на нормоксию/гипоксию/гипоксию пинацидил значения, полученные непосредственно перед воздействием нормоксической/гипоксической газовой среды, устанавливаются в размере 100% (C). Нажмите здесь, чтобы просмотреть изображение большего размера.
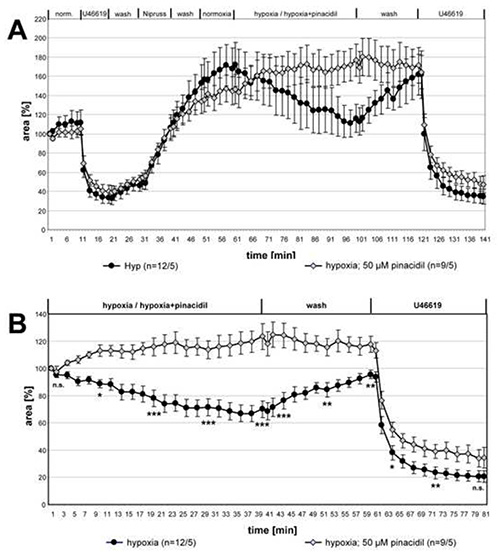
Рисунок 3. Ингибирование ВПЧ пинацидилом. Записи малых внутриацинарных артерий, подвергшихся воздействию гипоксической газовой среды с пинацидом или без него, суммируются и представляются в качестве средств ± СЭМ. В( A) полные записи даны, в (B) относительные данные по отношению к значению в начале гипоксической инкубации показаны. Нет вазореактивности обнаруживается в PCLS, которые подвергаются гипоксической газы среды, содержащей пинацидил. Сосуды индуцированной U46619 не зависит от препарата. "n" в скобках относится к количеству артерий/количество животных, из которых были сделаны PCLS. Другими словами, первое число описывает количество анализируемых участков легких, а второе число дает подсчет мышей, из которых были подготовлены эти секции. В данный момент времени различия между обеими группами проверяются на значимость. n.s.: Не существенно, к: p≤0.05, к: p≤0.01, к: p≤0.001. Нажмите здесь, чтобы просмотреть изображение большего размера.
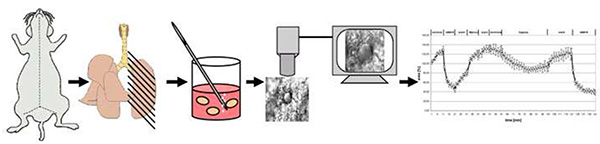
Рисунок 4. Схематический обзор метода. Короче говоря, мыши погибают от вывиха шейки матки. После открытия грудной клетки, легкие заполняются низкой точки плавления агарозы и после охлаждения разрезать на 200 мкм толщиной точность сократить легких ломтиками (PCLS). После удаления агарозы при 37 градусов по Цельсию один PCLS передается в поток через сверхтопливную камеру, в которой он подвергается воздействию нормоксической среды или среднего газуса с 1% O2. Вазореактивность регистрируется как изменения в области светимости. Нажмите здесь, чтобы просмотреть изображение большего размера.
Обсуждение
Изолированное вентилируемое и пролитое легкое мыши является отличной моделью для анализа физиологической реакции легочной сосудистой системы на изменения в поставках кислорода и, среди прочего, позволяет непрерывно измерять артериальное давлениелегких 1. Однако эта модель не позволяет выясовыть и провести анализ этих сосудистых сегментов, показывающих сильнейший ответ на гипоксию. В этом преимущество нашего видеоморфометрического анализа PCLS, который облегчает измерение ВПЧ отдельных артерий с внутренним диаметром 20-100 мкм. PCLS представляют собой привлекательную модель in vitro, так как они очень похожи на орган, из которого они подготовлены. В отличие от систем клеточной культуры, все типы клеток присутствуют в их первоначальной конфигурации ткани-матрицы. Кроме того, одного легкого достаточно для подготовки многих PCLS, так что по крайней мере частично эксперименты могут быть стандартизированы с помощью разделов из той же мыши. Согласно концепции 3R (сокращение, уточнение и замена лабораторных животных в биологических науках)Рассела и Берча 23 этот факт также утверждает, для использования PCLS.
Тем не менее, нужно иметь в виду, что ткань повреждена путем резки с вибромой и продольной сигнализации, например, через эндотелиальные клетки, постулированные Кюблер и др. 14 больше не возможно.
Первоначально PCLS в основном применялись для биохимических, фармакологических и токсикологических исследований, но в то же время они также используются для измерения бронхиальной контрактности, мукоцилиарной функции и сосудистых реакций (для обзоровсм. Сандерсон 20 и Дэвис21). Проводится и др. провели исследование, в котором они сравнили модели изолированных проникнуты и вентилируемых легких мыши и PCLS24. Они обнаружили, путем анализа реакции дыхательных путей и легочных сосудов на различные эндогенные посредники, что важные характеристики всего легкого были сохранены в PCLS.
В PCLS, гипоксические условия не устанавливаются через дыхательные пути, как в нетронутых легких, но инкубации легочной секции в гипоксической газовой среде. Мы проанализировали кислородное частичное давление (PO2) среднегопрегазового с 1% O2, 5,3% CO2, 93,7% N2 и с 21% O2, 5,3% CO2, 73,7% N2, соответственно, с помощью анализа газа крови. Непосредственно перед кормлением его в перфузиольную камеру, PO2 гипоксического газированного MEM был 40 мм рт. ст., а нормаоксический газ среду 160 мм рт.ст. В нетронутых легких ВПЧ индуцируется, когда альвеолярный pO2 падает ниже 50 ммрт. ст. 25, ситуация, которая может быть явно передразнил путем применения гипоксических газов среды. Наши данные о масштабах ВПЧ хорошо соносят результаты, полученные с помощью другого экспериментального подхода. Ямагути и др. применили изолированные легкие крысы для изучения микросхем диаметром 20-30 мкм в режиме реального времени конфокального лазерного сканирования люминесценции микроскопии в сочетании с высокой чувствительностью камеры с изображением инсенсивер10. Они наблюдали среднее снижение диаметра на 2,7 мкм после воздействия гипоксии легких. Можно подсчитать, что 20% сокращение светимой области, как мы измеряем его в нашей системе соответствует около 15% снижение диаметра.
В наших экспериментах мы классифицировали артерии как пред- и внутриацинарные сосуды, соответственно, с внутренним диаметром 40-100 мкм и 20-40 мкм. У человека переход от мышечных к немышечных артериям происходит в диапазоне диаметра 70-100 мкм. У мышей, гладкие мышечные клетки присутствуют до внешнего диаметра 20мкм 26. По этой причине невозможно проанализировать артерии диаметром ниже 20 мкм, так как они не могут быть надежными быть идентифицированы на основе фазового контрастного изображения. На другом конце шкалы, сосуды диаметром выше 100 мкм вряд ли можно найти в PCLS и обычно лишены из окружающих тканей.
На самом деле, ряд молекулярных кандидатов обсуждаются как молекулярный датчик кислорода (ы) или как компонент сигнального каскада в результате ВПЧ (для обзора см Сильвестр и др. 4). После того, как соответствующие нокаут мышей доступны видеоморфометрии могут быть использованы для анализа вазореактивности до- и внутриацинарных артерий по сравнению с дикими животными типа. Тем не менее, PCLS также были использованы для других вопросов: Фару и др. использовали их для характеристики развития эндотелия зависимого расширения в легкихпосле рождения 29 и PCLS подготовлены из морских свинок подвергаются воздействию дыма или воздуха ежедневно в течение 2 недель были использованы для демонстрации влияния сигаретного дыма на вазореактивность через индукции эндотелиальнойдисфункции 30.
Критические шаги в протоколе
В наших экспериментах мы классифицировали артерии как предацинарные (внутренние диаметры 40-100 мкм) и внутриацинарные (внутренние диаметры 20-40 мкм). Специально для подготовки участков легких, которые следует использовать для анализа крупных сосудов, важно добавить нитропрузид натрия в буфер перфузии. Этот препарат предотвращает сжатие сосудов во время подготовки образца и тем самым их разрыв с окружающими тканями приводит к неполному вазодилатации. Нитропрузсид натрия в буфере перфузии не так важен для подготовки легочной секции, которая должна использоваться для анализа мелких артерий, потому что они прочно закреплены на альвеолярной септе.
Все эксперименты следует начать с инкубаций, в которых проверяется реактивность артерий. Редко мы получили препараты легких, в которых не было обнаружено реакции судов подрядчикам или расширители. Мы не знаем причину этого: может быть, что объем агарозы заполнены в легкие был слишком велик или слишком низок, так что резки органа в PCLS не был оптимальным. Кроме того, можно себе представить, что агароза была охлаждения слишком быстро во время процедуры закапывания в результате повреждения стрижки стресса. В случае, если в отдельном PCLS не обнаруживается жизнеспособная артерия, секция должна быть отброшена и заменена другой.
Решение о жизнеспособности артерии было принято на основе ответа на U46619. Применение U46619 при концентрации 0,1 МК вызывает сосудосуживаемость, которая - после некоторого упражнения - видна непосредственно в последовательности изображения на экране. Поскольку Есть некоторые отклонения в вазореактивности мы исследуем влияние препарата на ВПЧ путем измерения вазореспонса в легких разделов подвергаются препарату или только для среды в свою очередь.
ВПЧ отдельной артерии часто практически не обнаруживается в микроскопе, и в среднем это приводит к уменьшению светимой области примерно на 20-30%. Тем не менее, небольшие изменения в диаметре артерии имеют явный вклад в сопротивление потока. Согласно уравнению "R No 1/r4"с сопротивлением R'resistance и радиусом, сопротивление потока обратно пропорционально четвертой силе радиуса. Позвольте мне привести пример: «идеальная артерия», экспонирование кругового поперечного сечения диаметром 40 мкм (р 20 мкм) имеет светимую область около 1260мкм 2. Когда область светимости уменьшается на 20%, мы можем подсчитать, что диаметр сосуда уменьшается на 10,5% до 35,8 мкм (r'17.9 мкм). Согласно вышеуказанной уравнению, сопротивление потока этого судна увеличится с 6,25 х 10-6 до 9,71 х 10-6, что примерно на 55%. В случае сокращения светимой области на 30% радиус уменьшится примерно на 16%, но сопротивление потока увеличится примерно на 100%. Хотя эти расчеты являются упрощением, при котором предполагается, что ламинарный кровоток и сосудная форма жесткой трубы свидетельствуют о воздействии и без того незначительных изменений диаметра на сопротивление потокам.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Это исследование спонсируется Передовой кластер сердечно-легочной системы.
Материалы
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
Ссылки
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены