Method Article
Murine 정밀 절단 폐 슬라이스를 사용하여 폐 내 동맥의 저산소 폐 혈관 수축의 비디오 형태 측정 분석
요약
저산소 폐 혈관 수축 (HPV)은 폐포 저산소증 폐 관류가 환기와 일치하는 중요한 생리학적 현상이다. HPV에 기여하는 주요 혈관 세그먼트는 인트라 아시나르 동맥입니다. 여기서, 우리는 직경 20-100 μm의 뮤린 폐 혈관의 HPV의 분석을 위한 우리의 프로토콜을 기술합니다.
초록
급성 폐포 저산소증은 폐 혈관 수축 (HPV)을 유발합니다 - 또한 폰 오일러 릴제스트랜드 메커니즘으로 알려진 - 환기에 폐 관류와 일치하는 역할을. 지금까지 기본 메커니즘은 완전히 이해되지 않습니다. HPV에 기여하는 주요 혈관 세그먼트는 인트라 아시나르 동맥입니다. 이 혈관 단면도는 말단 기관지에 폐 단면의 부분으로 정의된 개별 acinus의 혈액 공급에 책임 있습니다. 아시나르 내 동맥은 주로 폐의 그 부분에 위치하여 고립된 폐에서 폐 동맥 압력의 측정과 같은 다수의 일반적으로 사용되는 기술에 의해 선택적으로 도달할 수 없거나 해부된 근접 폐 동맥세그먼트1,2에서의힘 기록한다. 실시간 공초점 레이저 스캐닝 발광 현미경에 의한 부공선 분석은 직경3에서최대 50μm의 선박으로 제한됩니다.
우리는 20-100 μm 내경 범위에서 폐 내 동맥의 HPV를 연구하는 기술을 제공합니다. 정밀 절단 폐 슬라이스(PCLS)에서 단면 동맥의 비디오 형태 측정 분석을 기반으로 합니다. 이 방법을 사용하면 폐포 덕트 옆에 있는 폐포 격막의 거셋과 브론치와 브론지 에 인접한 40-100 μm 사이의 내직경이 있는 더 큰 사전 아시나르 동맥에 위치한 20-40 μm 사이의 내직경이 있는 작은 아시나르 동맥의 혈관 반응활성을 정량적 측정할 수 있습니다. 마취 및 환기 마우스에서 심공 혈관의 실시간 이미징과는 달리 PCLS의 비디오 형태 측정 분석은 전단 스트레스가없는 조건에서 발생합니다. 우리의 실험 모델에서 두 동맥 세그먼트는 1% O2로 가스가 있는 중간 가스에 노출될 때 단면 HPV를 나타내고 저산소증에서 30-40 분 후에 반응이 퇴색합니다.
서문
대부분의 전신 혈관 침대에서 저산소증은 혈관 확장을 유도, 폐 혈관에 저산소증에 의해 유발 혈관 수축에 비해. 낮은 산소 장력에 대한 이 폐 특이적 반응은 저산소 폐 혈관 수축 (HPV)이라고 불리며, 몇 초 안에 개시되고 노목환기로 전환 한 후 신속하게 반전됩니다. HPV는 60 년 이상 알려져 있지만, 세포 산소 센서 (들)와 혈관 수축의 결과로 신호 캐스케이드 (들)는 여전히 논쟁의 여지가있다. 저산소증에서 발생된 레독스와 ROS 변경이 HPV와 폐 고혈압의 발달을 위해 필수적이다는 것을 상대적으로 광범위한 합의가 있습니다 (실베스터 외에서 검토됨). 4 및 슈매커 외. 5).우리 자신의 데이터는 HPV6,7에서미토콘드리아 호흡기 사슬의 복잡한 II의 중심 역할을 지원합니다. 최근, 왕 외. 산소 감지 및 HPV에 대한 완전히 새로운 개념을 제시: 그들의 데이터에 기초하여 그들은 폐포 저산소증이 내피 세포의 막 탈극을 일으키는 인접 모세 혈관에 의해 감지된다는 것을 제안한다. 반응은 상류 동맥의 원활한 근육 세포의 수축으로 이어지는 내피 세포의 40 갭 접합체를 통해 전파된다8.
폐의 동맥은 기도와 함께 실행, 그들과 함께 분기, 지속적으로 직경감소, 마지막으로 폐포 벽에있는 모세관 시스템에 혈액을 공급. 이 동맥 순환은 해부학적으로 그리고 기능적으로 뚜렷한 세그먼트로 구성됩니다. 벽에 탄성 섬유의 풍부한 특징 근위 도관 동맥, 크게 폐 혈관 저항을 제어 하는 완전히 근육 폐 동맥 뒤에. 단계별로, 이 동맥은 근육 층이 불완전해지는 세그먼트로 통과하고, 마지막으로 혈관은 매끄러운 근육 액틴 면역 반응성 세포가 없습니다. 혈액을 가진 개별 폐 acinus를 공급하는 인트라 아시나르 동맥은 부분적으로 근육 세그먼트6을나타냅니다. 마찬가지로, 폐동맥제는 저산소반응에 관한 통일된 구조를 나타내지 않지만 지역다양성9,10을나타낸다. 예를 들어, 쥐 폐 저산소증으로부터 분리된 근위 폐 동맥은 이중화 반응을 유도하여 불완전한 이완 후 두 번째 느리지만 지속적인수축(11)이뒤따르는 짧은 기간의 초기 급속한 수축을 표시한다. 쥐 폐 와 제5 분과 (외부 직경 <300 μm)로 쥐 폐 parenchyma에서 분리 된 저항 동맥에서 저산소증은 단면 수축9을일으킨다. 이미 1971년 글레이지어와 머레이는 저산소가스 혼합물로 환기된 개들의 폐에서 모세관 적혈구 농도의 변화 측정에서 결론을 내렸으며, 저산소가스 혼합물로 인해 저산소증유발증가가 주로 모세혈관12의상류에서 발생했다. 요즘, 마취및 기계적으로 환기된 마우스의 전소 폐의 생체 내 현미경 검사는 폐 미세혈관13,14의분석을 위한 강력한 도구를 나타낸다. 흉부 벽에 있는 원형 창의 절제는 폐의 표면에 현미경 접근을 제공하고 직경이 50 μm까지 있는 부적 폐 혈관의 분석을 허용합니다. 이 기술을 FITC-dextran의 주입과 결합하여, 타부치 외. 직경 30-50 μm의 중간 크기의 동맥만이 30분 후에 경미한 감쇠로 60분 동안 지속된 저산소증에 대한 현저한 반응을 나타낸다는 것을 입증했습니다. 대조적으로, 직경 20-30 μm의 작은 동맥은 저산소증3에단지 사소한 반응을 보였다. 그러나, 이 기술은 이 혈관이 폐 조직에 너무 깊이 있기 때문에 50 μm가 더 큰 직경을 가진 동맥의 분석을 허용하지 않습니다.
뮤린 폐의 크고 아주 작은 폐 동맥(예: 부공혈관)의 분석에서 격차를 해소하기 위해, 마틴 등에서설명한 방법을 채택하였다. 기도(15)의반응성 분석을 위해 . 아가로즈 젤 주입 기술을 기반으로, 그것은 이 상대적으로 부드럽고 탄성 기관에서 정밀 절단 폐 슬라이스 (PCLS)의 준비를 용이하게합니다. 20-100 μm 사이의 내경을 가진 단면 동맥의 PCLS 혈관 반응성 내에서 비디오 현미경검사법에 의해 직접 관찰될 수 있다. PCLS의 저산소 인큐베이션 동안 약물의 적용은 HPV에 미치는 영향의 분석을 허용한다. 이 기술은 또한 유전자 조작 마우스에 적용될 수 있다는 것을 특히 중요합니다. 폐 내의 위치를 기준으로, 우리는 동맥을 각각 20-40 μm 및 40-100 μm의 내지름과 함께 사전 및 인트라 아시나르 혈관으로 분류합니다. 기능적 관점에서 아시나르 내 동맥은 혈액과 개별 폐 아시누스를 공급하고 사전 아시나르 동맥은 이전 혈관 섹션입니다. 디지털 카메라에서 사진을 녹화하면 혈관 반응의 후속 정량화를 할 수 있습니다. 이 PCLS 모델의 명백한 속성은 내피에 작용하는 전단 응력이 부족하다는 것입니다. 대조적으로, 침투된 혈관에서 급성 HPV는 전단 응력의 상승으로 이어져 NO방출(16)과같은 이차 메커니즘을 유도한다. 또한 PCLS를 사용하면 폐내 신경이나 호르몬영향 없이 HPV를 측정할 수 있습니다. 세포 배양 시스템과 는 달리, 예를 들어 개 폐 동맥 평활근세포로부터제조된 혈관 벽의 조직학적 구조는 거의 완전히 보존된다.
요약하자면, 이 프로토콜은 전단 응력이 없는 조건에서 20-100 μm 사이의 내직경을 가진 폐 동맥의 HPV를 담당하는 잠재적인 분자 산소 센서 및/또는 세포 경로를 분석하는 데 유용한 방법을 제공합니다.
프로토콜
1. 가스 혼합물, 장비, 기기 및 솔루션 준비
이 섹션에서는 프로토콜에 필요한 장비 및 설정에 대해 설명합니다. 추가 세부 정보 및 제조업체 정보는 함께 제공되는 표에서 찾을 수 있습니다.
- 다음 가스 혼합물을 구하거나 준비합니다.
- 21% O2,5.3% CO2,73.7%N2로구성된 노목가스 혼합물2병.
- 1병O2,5.3%CO2,93.7%N2로구성된 저산소가스 혼합물 1병.
- 다음 장비를 수집합니다.
- 아가로즈를 녹이는 전자 레인지.
- 가열 캐비닛, 폐 섹션에서 아가로즈를 씻어 (아래 참조). 캐비닛에 노목 가스 혼합물이 있는 병에 연결된 튜브를 삽입합니다.
- 폐를 200 μm 두께의 슬라이스로 절단하기 위한 적절한 면도날의 진동체입니다. 진동체가 진동기 분지의 버퍼를 식히기 위해 냉장 세트로 꾸며진 경우 유리합니다.
- 반전 된 현미경에 장착 된 유동 을 통해 과류 챔버, 함정 동맥의 HPV의 분석을 위해.
- 폐 단면을 챔버 의 바닥에 고정을 용이하게하려면 나일론 현을 백금 링 (자체 구성)에 연결합니다. 각각 0.7 ml/min 및 6 ml/min로 조정된 연동 펌프에 관혈 챔버에 가입하십시오.
- 실험 중에 미디어가 37°C 수조에 저장되고 21 G x 4 3/4 캐뉼라를 사용하여 노목성 또는 저산소 가스로 버블링되도록 장비를 조립합니다. 또한 가스 병에서 두 번째 연결을 사용하여 노목/ 저산소 가스 혼합물을 관류 챔버의 공공간으로 공급할 수 있도록 합니다. 이 시스템의 모든 튜브가 가스가 단단해지도록 하십시오.
- 분석된 동맥의 이미지를 기록하기 위해 수직 반전 현미경에 장착된 CCD 카메라.
- 다음 계측기 준비:
- 폐의 준비를 위해: 거친 가위와 두 쌍의 집게를 포함한 멸균 해부 세트, 가슴의 개구부를위한 미세 가위, 아가로즈를 채우기위한 기관으로 구멍을 잘라내는 미세 가위, 기관지의 결찰을 위한 바느질 면 (약 20cm)
- 아가로즈로 기도를 채우기 위해: IV 인링 캐뉼라(20 G x 1/4)의 유연한 플라스틱 파이프에 2ml 주사기를 연결합니다.
- 완충액이 있는 폐의 관류를 위해: 마우스 준비를 위해 작업장소 에서 약 40cm 높이의 완충 저수지로서 50ml 주사기를 고정합니다.
- 버퍼의 유출: 주사기를 25 G x 1 캐뉼라가 부착된 튜브에 연결합니다. 튜브의 클램프를 사용하여 유출흐름을 약 1 방울/초(약 0.3-0.4 ml/분)로 조정합니다.
- 다음 버퍼 및 미디어를 준비합니다.
- 1,000ml HEPES-Ringer 버퍼(10mM HEPES, 136.4m NaCl, 5.6mM KCl, 1 mM MgCl2•6H2O, 2.2 mM CaCl2•2H2O, 11mM 포도당, pH 7.4)를 만듭니다. 멸균 여과 버퍼(필터의 모공 크기: 0.2 μm)를 4°C에 저장합니다.
- 폐의 격리를 시작하기 전에 약 30 분은 다음과 같은 해결책을 준비합니다.
- HEPES 링거 버퍼(총 부피 10ml)에 1.5% x v 낮은 융점 아가로즈를 녹여 전자레인지에서 조리하여 녹입니다. 그 후, 가열 캐비닛에 보관하여 37 °C로 냉각하십시오. 폐기도에 아가로즈를 채우기 위해 2ml 주사기를 미리 데웁니다.
- HEPES-Ringer 버퍼 20ml를 복용하고, 헤파린을 250 I.U./ml의 최종 농도에 추가하고 버퍼를 37°C로 가열합니다. 사용하기 직전에 75 μM의 최종 농도에 니트로프러스사이드 나트륨을 추가하십시오. 이것은 폐 혈관에서 혈액을 실행하기위한 관혈 버퍼입니다.
- 유리 비커에 200ml HEPES 링거 버퍼를 넣고 얼음에 보관하십시오. 이 버퍼는 아가로즈로 채워진 고립된 폐를 냉각하기 위해 필요합니다.
- 약 200ml MEM을 유리 비커에 1% 페니실린/연쇄 절제술으로 보충하여 가열 캐비닛에 37°C로 보관하십시오. 노목가스 혼합물로 배지를 거품. 이것은 폐 단면도에서 아가로즈의 제거를 위해 이용될 것입니다.
- MEM의 Prewarm 2 병은 37°C에 수조에 1% 페니실린/연쇄 절제술을 보충하고, 노목및 저산소 가스 혼합물로 각각 2시간 이상 을 발동한 후 비디오 모피메트릭 측정을 시작한다. 측정당 약 250ml MEM이 필요합니다.
- 다음 추가 자료를 수집합니다.
- 소독에 대한 70 % EtOH.
- 헤파린의 스톡 용액 (25.000 I.U./5 ml), 4 °C에 저장 (위 참조).
- NO 기증자 인 니트로 위 (Nipruss) 나트륨의 스톡 솔루션 : H2O에서 10 mM, 얼음에 저장 (위 참조).
- 혈소판 아날로그 U46619의 스톡 용액: 에탄올10 μM, 얼음에 저장.
- 슈퍼 접착제.
- 아가로즈를 채운 후 기관지의 결찰을 위해 면봉.
2. 동물
10-25주의 나이에 두 성별의 마우스(예를 들어 변형 C57Bl6)를 사용하십시오. HPV는 또한 녹아웃 균주와 해당 야생 형 균주에서 분석 될 수있다.
모든 실험은 실험 동물의 치료 및 사용에 대한 NIH 지침에 따라 수행되었으며 지역 기관 위원회의 승인을 받았습니다.
3. 뮤린 폐의 격리 및 정밀 절단 폐 슬라이스의 준비 (PCLS)
- 자궁 경부 탈구로 마우스를 처치하십시오. 살해 직후, 70% EtOH로 복부 체면을 살균하고 거친 가위를 사용하여 턱에서 골반까지 복부 중간선을 따라 피부를 자른다.
참고: 이소플루란과 같은 흡입 성 마취제는 혈관 톤18,19에영향을 미치는 것으로 알려져 있기 때문에 휘발성 마취제를 사용하지 마십시오. - 복강이 개통 된 후 장 고리를 제쳐두고 출혈을 위해 큰 복부 혈관을 절단하십시오. 미세 한 가위로 다이어프램을 관통 한 후, 폐는 흉막 구멍에 공기 입력의 결과로 붕괴됩니다. 가위를 사용하여 열등한 흉부 조리개에서 다이어프램을 분리합니다. 갈비뼈와 쇄골을 측면으로 잘라 립 케이지의 복부 부분을 제거합니다.
참고 : 그렇지 않으면 아가로즈와 폐의 bloating이 불가능하기 때문에 폐가이 단계에서 손상되지 않는 것이 중요합니다! 멸균 기기와 실험실 유리 제품만 사용하십시오. - 폐 혈관의 관류를 시작하기 전에, 버퍼의 배출을 위해 심장의 왼쪽 심실로 작은 구멍을 잘라. 주사기 저장소를 따뜻한 (37 °C) 헤파린 과 니트로 피스트러스 사이드 (관혈 버퍼)를 함유 한 HEPES 링거 버퍼를 채우고 오른쪽 심실을 통해 폐 혈관을 천천히 견딜 수 있습니다.
참고: 폐가 색상을 변경하고 흰색 모양을 얻을 때 관류는 효율적입니다. 이 단계에서는 관류 완충제에 니트로트러스사이드 나트륨을 추가하는 것이 중요합니다. 이것은 주변 조직에서 떨어져 찢어에서 사전 acinar 동맥을 방지. - 기관지에서 타액 선, 작은 근육 및 결합 조직을 제거합니다. 식도와 기관 사이에 주변 결합 조직과 나사 바느질 면에서 기관체를 분리하여 나중에 결찰합니다.
- 두 개의 이웃 기관 연골 사이의 기관의 상부에 작은 구멍을 잘라 미세 가시를 사용합니다. 이제 작은 구멍을 통해 IV 인주거 캐뉼라의 유연한 플라스틱 파이프를 기관지에 삽입하고 바느질 면으로 조심스럽게 고정하십시오. 따뜻한 (37 °C) 낮은 융점 아가로즈로 천천히 기도를 채웁니다. 폐 관찰: 처음에는 오른쪽 폐가 왼쪽 폐로 확장되기 시작합니다. 충전은 두 폐가 생체 내 상황에 필적하는 부피로 팽창할 때 완료됩니다(성별, 연령 및 체중에 따라 약 1.2-2.0 ml).
참고: 폐가 하나만 확장되면 플라스틱 파이프가 너무 깊게 삽입되어 기관지에 도달할 수 있습니다. 이 경우, 그것은 조금 뽑아야한다. 아가로즈가 서서히 식으면 굳어질 것입니다. - 폐가 가득 차면 동시에 플라스틱 파이프를 꺼내 서 아가로즈의 유출을 방지하기 위해 바느질 면으로 기관을 리게이트합니다. 그 후, 기관지 위의 기관체를 잘라 가슴에서 블록에 폐와 심장을 분리.
참고: 초보자의 경우 동료에게 결찰 단계에서 지원을 요청하는 것이 유용할 수 있습니다. - 기관 패킷을 얼음차가운 HEPES-링거 버퍼로 옮겨 아가로즈를 고화시합니다. 이것은 몇 분 이내에 발생합니다.
- 개별 폐 엽을 분리하고 진동의 표본 홀더에 슈퍼 접착제로 한 엽을 고정합니다.
참고: 탄성 폐 조직을 절단하는 동안 꼬치 역할을하는 홀더에 샴페인 코르크 조각을 붙이는 것이 좋습니다. 사용되는 폐 엽과 시편 홀더의 방향에 따라, 얻어진 PCLS는 작거나 큰 혈관의 분석에 더 적합할 수 있다. 대부분 우리는 PCLS의 준비를 위해 왼쪽 엽과 오른쪽 두개골 엽을 사용합니다. 작은 아시나르 동맥을 단면으로 배열하려면 두개골 오른쪽 엽을 힐럼으로 접착제로 홀더에 붙이고 주변에서 슬라이스합니다. 절면 사전 아시나르 동맥을 얻으려면 오른쪽 로브의 힐럼을 샴페인 코르크와 정렬합니다. - 신선한 면도날을 장착한 진동기를 사용하여 폐 엽을 200 μm 두께의 슬라이스로 자른다(속도: 12 = 1.2mm/초; 주파수: 100; 진폭: 1.0). 4°C 냉간 HEPES-링거 버퍼로 채워진 진동기 분지에서 PCLS를 수집합니다.
참고: HEPES 링거 냉각은 권장되지만 필수적이지 않습니다. - 아가로즈를 제거하기 위해 오르간 섹션을 약 200ml 37°C의 따뜻한 MEM으로 채워진 유리 비커로 옮기다. 비커를 가열 캐비닛에 넣고 노목가스 혼합물이 있는 병에 결합된 튜브가 삽입됩니다. 폐 단면도가 매체에서 천천히 움직이게 되도록 노목가스로 MEM을 거품. 약 2 시간 후, 영공을 채우는 "아가로즈 플라크"는 폐 조직에서 제거됩니다. 이것은 섹션이 더 이상 매체의 상단에 수영하지만 비커의 바닥에 정착한다는 사실에 의해 인식 될 수있다.
4. PCLS의 함정 동맥의 비디오 형태 분석
- 폐 동맥의 비디오 형태 측정 분석을 위해 1 개의 PCLS를 1.2 ml 노목 가스 MEM으로 채워진 유동 위 슈퍼 퓨전 챔버로 옮으릅니다. 플래티넘 링(외부/내경: 14/10mm)에 연결된 나일론 끈으로 챔버 하단의 PCLS를 수정합니다.
- 20-100 μm 사이의 내지름을 가진 단면 동맥을 위해 PCLS를 현미경으로 스캔합니다.
참고: 동맥의 루멘은 평평한 내피 세포로 줄지어 있습니다. 주변의 부드러운 근육 세포는 루멘을 둘러싼 "어두운 반지"로 위상 대비 이미지에서 식별될 수 있다(도 2의위상 대비 이미지 참조). 대조적으로, 기도는 간단한 입체 상피다음에 흉막 표면으로 가는 길에 통과하는 초기 의사 층상 상피에 의해 확인될 수 있습니다.- 각 실험의 시작 부분에서 내경을 측정합니다.
참고: 약간 경사로 절단된 용기에서 관 구조의 진정한 내경을 90° 각도에서 루멘의 가장 긴 축으로 결정할 수 있습니다. 내지름>40 μm런스런을 가진 대형 사전 아시나르 동맥은 기관지와 기관지에 인접해 있습니다. 40 μm <내경을 가진 작은 아시나르 동맥은 폐포라와 폐포 덕트6옆에 있는 폐포 라 셉타의 거셋에 위치하고 있습니다.
- 각 실험의 시작 부분에서 내경을 측정합니다.
- 실험 설계:
- 챔버가 노목가스 가속 매체(유량: 0.7 ml/분, 10분)로 침투되는 "적응 단계"로 각 실험을 시작합니다. 다음으로, 선박의 생존가능성을 테스트한다: 10 μM U46619의 12 μl(최종 농도 0.1 μM; 10분, 유동 없음)을 첨가하여 동맥의 수축성을 분석한다.
참고: 이 작업의 경우, 선박은 발광 영역이 30% 이상 감소할 때 실행 가능한 것으로 정의됩니다(아래 측정 방법은 아래 참조). - 노목가스가 있는 매체(유량: 6ml/min; 10분)로 약물을 세척한 후 10mM 니러스(최종 농도 25 μM; 10분, 유동 없음)의 3μl을 적용하여 동맥을 팽창시다.
- 다시, 노목 가스 매체 (유량 : 6 ml /분)로 10 분 세척에 의해 약물을 제거하고 0.7 ml / 분의 흐름에서 10 분.
- 저산소 가스 배지를 가진 PCLS의 배양에 의한 저산소 폐 혈관 수축을 유도합니다(유량: 0.7 ml/min; 40분). 추가 튜브 시스템에 의해, 관혈 챔버의 공기 공간에 저산소 가스 혼합물을 공급한다.
- 저산소 배지를 노목가스 가스 매체로 20분 세척하여 제거합니다(유량: 6ml/분).
- 각 실험의 끝에서, 혈관 수축을 유도하기 위해 관혈 챔버에 10 μM U46619 (최종 농도 0.01 μM; 20 분, 유동 없음)의 1.2 μl을 추가합니다.
참고: 이 최종 단계는 저산소 반응의 변화가 저산소 상에서 약물의 동시 적용에 의해 유도되거나 녹아웃 마우스 변형으로부터 제조된 PCLS에서 관찰되는지 여부를 결정할 수 있으며 저산소증 유도 수축또는 수축에 대한 일반적인 영향을 반영하는지 여부를 결정할 수 있습니다. 0.01 μM의 농도는 이전 농도 수축 측정(게시되지 않음)에서 추정된 U46619의 EC50 값에 해당합니다. - 다른 PCLS를 사용하여 관류 챔버의 공공간에서 저산소 가스 MEM 및 노목가스 혼합물 대신 노목증으로 제어 실험을 수행하십시오.
- 챔버가 노목가스 가속 매체(유량: 0.7 ml/분, 10분)로 침투되는 "적응 단계"로 각 실험을 시작합니다. 다음으로, 선박의 생존가능성을 테스트한다: 10 μM U46619의 12 μl(최종 농도 0.1 μM; 10분, 유동 없음)을 첨가하여 동맥의 수축성을 분석한다.
5. 혈관 반응성 및 그래픽 프리젠 테이션 분석
- 적절한 소프트웨어를 사용하여 전체 실험 동안 매 분마다 단면 동맥에서 사진을 찍습니다.
- 적합한 소프트웨어를 사용하여 전체 화면 사진을 사용하여 손으로 내부 경계를 일렬로 세이징하여 선박의 발광 영역의 변화를 평가합니다.
참고: 모든 초사진을 분석하여 명확한 그래프를 얻는 것으로 충분합니다. 그러나, 유량-초혈 챔버의 한 조건이 다른 것으로 변경되면 모든 그림을 분석한다. 나머지 사진은 한 장의 사진을 분석할 수 없는 경우 백업 역할을 합니다.
불행하게도, 이 시간 소모단계는 때때로 혈액 세포가 측정 중에 움직이는 혈관 벽에 부착되기 때문에 적절한 프로그램에 의해 수행되어야하며, 혈관의 완벽한 단면이 아니라 내부 경계의 신뢰할 수있는 국소화가 시각적 제어하에 만 수행 할 수있는 접선 섹션입니다. - 실험 초기에 선박 루멘 의 영역에 대해 얻은 값을 100%로 정의하고 이 값의 상대적 감소 또는 증가로 혈관 수축 또는 팽창을 표현한다.
- 각 실험에 대해 적절한 소프트웨어를 사용하여 시간에 대해 상대광 영역을 플롯합니다.
- 여러 실험을 요약하려면 시간에 대한 평균(SEM)의 상대발광 영역 +/- 표준 오차의 수단을 플롯합니다.
참고: 저산소증 또는 U46619 유도폐 혈관 수축 또는 녹아웃 마우스 균주의 저산소 반응에 대한 다양한 물질의 효과를 명확히 제시하기 위해, 용기의 생존가능성을 테스트하는 실험의 초기 단계는 그래프에서 생략될 수 있다. 이 경우, 감소된 산소에 대한 노출의 시작 시 얻은 값은 100%로 정의된다.
6. 통계 분석
- 크루스칼-월리스와 만-휘트니-테스트와 실험 그룹 간의 차이를 분석하였으며, p≤0.05는 중요한 것으로 간주되고 p≤0.01이 매우 중요합니다.
참고: PCLS의 준비 및 운영 사용에 대한 자세한 내용은20,21을참조하십시오.
결과
도 1에서는 큰 사전 아시나르 동맥의 HPV 의 측정 결과와 작은 아시나르 동맥의 도 2에서 주어진다. 상 대비 이미지(그림1A 및 2A)에서는폐 조직 내의 위치를 기준으로 이 2종의 동맥을 구별할 수 있음이 분명해지며, 사전 아시나르 동맥은 브론치와 기관지(그림1A)에가까운 동네에서 달리는 반면, 아시나르 내 동맥은 알베올라라 라 사(alveolara)의 거셋에 위치하고 있다. 약간의 연습으로 위상 대비사진(그림 1A 및 2A)에서U46619에 대응하여 발광 영역의 변화를 볼 수 있다. 그러나, 저산소폐 혈관수축은 종종 그렇게 발음되지 않으며 발광 영역의 변화에 대한 완전한 평가 후에만 분명해진다(그림1B, 1C, 2B, 및,2C). 교훈적인 이유로 우리는 비정상적으로 발음 된 혈관 수축을 보여주는 사전 아시나르 동맥의 예를 주었다. 평균적으로, HPV는 발광 영역의 20-30% 감소의 결과.
도 2에서 50 μM 핀산탈데일(미토콘드리아 ATP 에민감한 칼륨 채널의 비선택적 오프너)의 유저산소 가스 배지로 배양된 작은 아시나르 동맥의 기록이 표시되고 약물의 억제 효과가 명확하게 드러나게 된다. 실험의 마지막 부분은 HPV에 대한 약물의 작용의 선택성을 입증한다: 혈소판 아날로그 U46619에 의해 유도된 혈관수축은 핀산탈틸의 첨가에 의해 변경되지 않는다. 실제로, 핀산탈탈을 노출한 동맥의 곡선은 다른 두 개보다 뚜렷하게 낮게 실행되지만, U46619에 의한 광등 면적의 감소 정도는 비교할 수 있다. 이 경우 곡선 의 차이를 일으키는 HPV의 불완전한 복귀였다. 이 그래프에서 또한 노목가스 가스에 노출된 동맥은 추가 제어로 포함된다. 이 조건하에서, 발광 영역의 변경은 검출할 수 없습니다.
도 3에서 HPV에 핀산틸의 영향에 대한 전체 계열측정의 데이터가 도시된다. 통계적 차이에 대한 두 그룹의 비교를 위해 표시된 시간 포인트의 데이터 집합은 크루스칼-월리스 및 Mann-Whitney 테스트로 분석되었습니다. HPV는 핀산탈탈의 존재에서 명확하게 폐지된 반면 U46619 유도 수축은 변경되지 않았습니다.
대안적으로, 뮐러-레데츠키 등에서 설명한 바와 같이 곡선 아래의 영역을 비교하여 그룹 간의 차이를 식별할 수 있다. 22
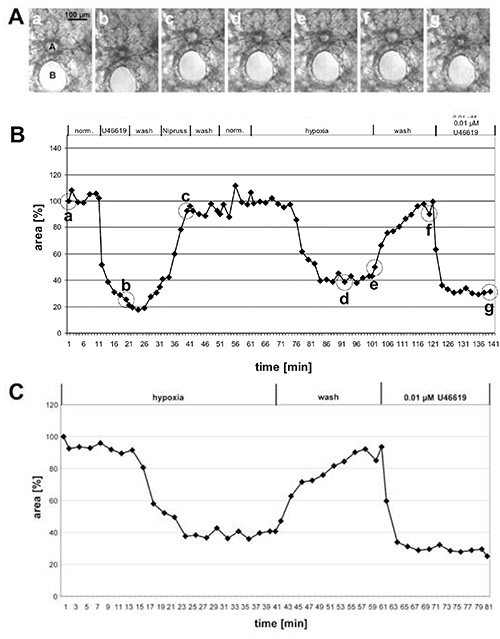
그림 1. 큰 사전 아시나르 동맥의 HPV의 측정. (A)단면 기관지(B)에 가까운 동네에서 실행되는 단면 사전 아시나르 동맥(a)의 위상대비 이미지. 사진은(B)에표시된 시점에서 원별로 촬영된다: 측정의 시작 부분에서 (a), U46619 (b)로 처리의 끝에서, 니프러스 (c)에 노출의 끝에, 후 30 또는 40 뉴럭스 가스 매체 (d, 전자), 노폭 가스 매체 (f)로 세척 한 후 (f), 및 U6의 최종 적용 후 (f). 그래프(B)에서 발광 영역의 변화는 시간에 대해 플롯되는 반면 실험 의 시작 부분에 있는 발광 영역은 100%로 정의되고 혈관 수축/팽창은 상대값으로 주어집니다. 이 경우 저산소증은 발광 영역의 60% 감소를 유도한다. (C)저산소 반응의 명확한 프리젠테이션을 위해, 혈관 반응성이 시험된 실험의 초기 단계는 포함되지 않지만, 감소된 산소에 노출되기 직전에 얻은 값은 100%로 설정된다(도 2참조). 큰 이미지를 보려면 여기를 클릭하십시오.
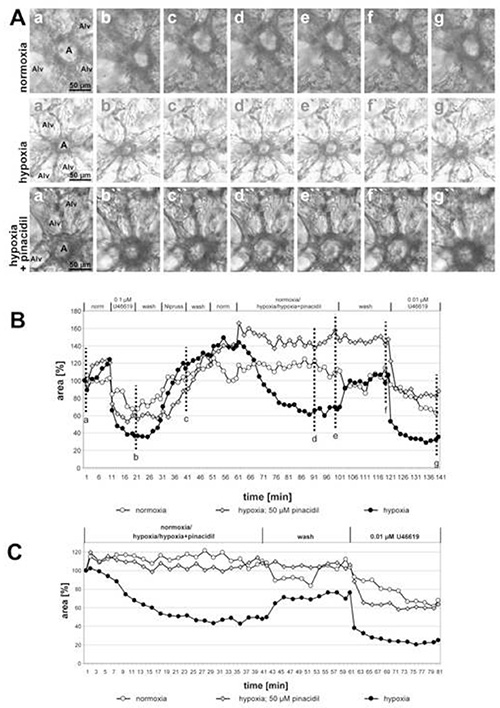
그림 2. 핀산탈데일의 영향 (미토콘드리아 ATP 에 민감한 칼륨 채널의 비선택적 오프너; 미토KATP) 작은 내 아시나르 동맥의 HPV에. (A)내 아시나르 동맥 (a)은 폐포 셉타의 거셋에 위치하고 있습니다. Alv = 알베올루스. 이러한 실험에 적용된 개별 조건의 시퀀스는그래프(B)의헤드라인에 부여된다. 저산소 노출은 50 μM 핀산틸의 존재 또는 부재에서 수행됩니다. 제어 잠복기는 노목가스 가속 매체로 수행됩니다. (A)에도시된 사진은 U46619(b)로 처리의 끝에 측정(a,a', a")의 시작 부분에 촬영된다. b', b"), 니러스 (c, c', c")에 노출의 끝에서, 후 30 또는 40 저산소 또는 노목 성 가스 매체 (d,d', d"; e,e', e', e"), 노목 가스 매체로 세척 한 후 (f, f', f", f"), 그리고 U466g의 최종 응용 프로그램 후 (f,f', f", g'g.의 최종 적용 후 노목시아/저산소증/저산소증+핀산탈에 대한 반응의 명확한 프리젠테이션을 위해, 노목산소-/저산소 가스-가스 배지에 노출되기 직전에 얻은 값은 100%(C)로설정된다. 큰 이미지를 보려면 여기를 클릭하십시오.
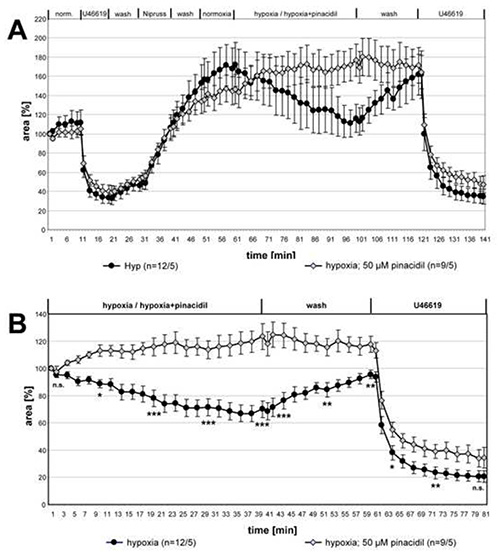
그림 3. 핀산탈탈에 의한 HPV억제. 50 μM 핀산틸il의 유무에 관계없이 저산소 가스 매체에 노출된 작은 아시나르 동맥의 기록은 요약되고 ± SEM의 수단으로 제시된다. (A)전체 기록이 주어지며,(B)저산소 배큐베이션의 시작 시 값과 관련하여 상대적인 데이터가 나타난다. 핀산탈제를 함유한 저산소 가스 배지에 노출된 PCLS에서는 혈관 반응성이 검출되지 않습니다. U46619에 의해 유도된 혈관 수축은 약물에 의해 영향을 받지 않습니다. 괄호의 "n"은 PCLS가 만들어진 동맥/동물의 수를 말합니다. 즉, 첫 번째 숫자는 분석 된 폐 섹션의 수를 설명하고 두 번째 숫자는 이 섹션이 준비된 마우스의 수를 제공합니다. 주어진 시점에서 두 그룹 간의 차이는 중요성을 테스트합니다. n.s.: 중요하지 않음, *: p≤0.05, **: p≤0.01, ***: p≤0.001. 큰 이미지를 보려면 여기를 클릭하십시오.
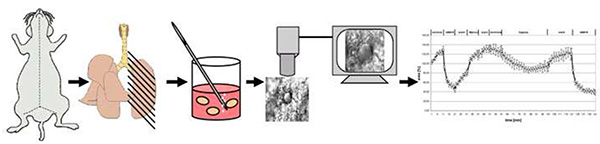
그림 4. 메서드의 회로도 개요입니다. 간단히 말해서, 마우스는 자궁 경부 탈구에 의해 죽습니다. 가슴의 개구부 후, 폐는 낮은 융점 아가로로 채워지고 냉각 후 200 μm 두께의 정밀 절단 폐 슬라이스 (PCLS)로 절단합니다. 37°C에서 아가로즈를 제거한 후 1PCLS는 1%O2로노목매또는 중질가스에 노출되는 유동-관통 중과융합 챔버로 이송된다. 혈관 반응성은 발광 영역의 변화로 기록됩니다. 큰 이미지를 보려면 여기를 클릭하십시오.
토론
상기 고립된 환기 및 침투마우스 폐는 산소 공급의 변화에 대한 폐 혈관 시스템의 생리적 반응의 분석을 위한 우수한 모델이며, 그 중에서도 폐동맥압력1의지속적인 측정을 허용한다. 그러나, 이 모델은 저산소증에 대한 가장 강한 반응을 보여주는 혈관 세그먼트의 식별 및 분석을 허용하지 않습니다. 이것은 20-100 μm의 내지름을 가진 개별 동맥의 HPV의 측정을 용이하게 하는 PCLS의 우리의 비디오 형태측정 분석의 이점입니다. 세포 배양 시스템과 는 달리, 모든 세포 모형은 그들의 원래 조직 매트릭스 구성에 존재합니다. 더욱이, 하나의 폐는 많은 PCLS의 제조를 위해 충분하므로 적어도 부분적으로 실험은 동일한 마우스에서 단면도의 사용에 의해 표준화될 수 있다. 러셀과 버치의 3R 개념 (생명 과학에서 실험실 동물의 감소, 개선 및 교체)에 따르면23이 사실은 또한 PCLS의 사용을 주장한다.
그러나, 하나는 유명해야, 조직은 Kübler 외에의해 가정으로 내피 세포를 통해 예를 들어 진동및 세로 신호로 절단하여 손상된다. 14는 더 이상 불가능합니다.
처음에 PCLS는 주로 생화학, 약리학 및 독성 연구에 적용되었지만 그 동안 기관지 수축, 점액 기능 및 혈관 반응의 측정에도 사용됩니다 (리뷰의 경우 샌더슨20 및 데이비스21참조). 개최 외. 그들은 고립 된 perfused 및 환기 마우스 폐와 PCLS 24의 모델을 비교하는 연구를수행했다. 그(것)들은 전체 폐의 중요한 특성이 PCLS에서 유지되었다는 것을 내인성 중재자의 각종기도 및 폐 혈관의 반응의 분석에 의해 찾아냈습니다.
PCLS에서 저산소 상태는 그대로 폐에서와 같이 기도를 통해 서있지만 저산소 가스 배지의 폐 섹션의 잠복에 의해 확립되지 않습니다. 혈액가스 분석기를 이용하여 각각1% O 2, 5.3%CO2,93.7%N2, 21%O2,5.3% CO2,73.7%N2로분석하였다. 관혈 챔버로 공급하기 직전에 저산소 가스 MEM의 pO2는 40mmHg이고 노목가스 가스 가속 매체 160 mmHg6의pO 2였다. 그대로 폐HPV에서 폐포 pO2가 50mmHg25이하로 떨어질 때 유도되며, 저산소 가스 배지의 적용에 의해 명백하게 모방될 수 있는 실정이다. HPV의 범위에 대한 우리의 데이터는 다른 실험적인 접근으로 얻은 결과에 잘 일치합니다. 야마구치 외. 분리된 쥐 폐를 적용하여 지름이 20-30 μm인 마이크로혈관을 실시간 공초점 레이저 스캐닝 발광 현미경검사법에 의해 심상강화기(10)를갖는 고감도 카메라에 결합되었다. 그(것)들은 저산소증에 폐의 노출 후에 2.7 μm의 직경에 있는 평균 감소를 관찰했습니다. 우리가 우리의 시스템에서 그것을 측정할 때 발광 영역의 20 % 감소가 직경의 약 15 % 감소에 해당한다는 것을 계산할 수 있습니다.
우리의 실험에서 우리는 40-100 μm및 20-40 μm의 내지름으로, 각각 사전 및 내 아시나르 혈관으로 동맥을 분류했습니다. 인간에서 근육에서 비 근육 동맥으로의 전환은 70-100 μm의 직경 범위에서 발생합니다. 마우스에서, 매끄러운 근육 세포는 20 μm26의외부 직경으로 존재한다. 이러한 이유로 위상 대비 영상을 기반으로 식별할 수 없기 때문에 직경이 20 μm 미만인 동맥을 분석할 수 없습니다. 규모의 다른 쪽 끝에서, 100 μm 이상의 직경을 가진 혈관은 PCLS에서 찾아거의 찾아내고 일반적으로 주변 조직에서 박탈됩니다.
실제로, 다수의 분자 후보는 분자 산소 센서(들)로 또는 HPV의 결과로 신호 캐스케이드의 구성 요소로 논의된다 (검토를 위해 실베스터 외를 참조하십시오. 4).적절한 녹아웃 마우스가 사용 가능한 경우 비디오 모홈트리는 야생 형 동물에 비해 사전 및 아시나르 동맥의 혈관 반응성 분석에 사용할 수 있습니다. 그러나, PCLS는 또한 다른 문제에 대 한 사용 되었습니다.: Faro 외. 출생 후 폐내피 의존 팽창의 발달을 특징으로 하기 위해채택29 및 PCLS는 2 주 동안 매일 연기 또는 공기에 노출 기니 피그에서 제조 내피 기능 장애(30)의유도를 통해 혈관 반응성에 담배 연기의 영향을 입증하는 데 사용되었다.
프로토콜 내의 중요한 단계
우리의 실험에서 우리는 동맥을 사전 아시나르 (40-100 μm의 내부 직경)와 인트라 아시나르 (20-40 μm의 내부 직경)로 분류했습니다. 특히 더 큰 혈관의 분석에 사용해야 하는 폐 단면의 제조를 위해 관류 완충제에 니트로트러스사이드 나트륨을 첨가하는 것이 중요하다. 이 약은 견본 준비 도중 혈관의 수축을 방지하고 그로 불완전한 혈관 확장으로 이끌어 내는 주변 조직에서 그들의 찢어짐을 방지합니다. 관류 완충제의 니트로프사이드 나트륨은 폐포 세막에 강하게 고정되어 있기 때문에 작은 동맥 의 분석에 사용해야 하는 폐 단면의 제조에 그렇게 중요하지 않다.
모든 실험은 동맥의 반응성을 테스트하는 인큐베이션으로 시작되어야 합니다. 드물게, 우리는 계약자 또는 확장기에 대한 선박의 반응이 감지되지 않는 폐 준비를 얻었습니다. 우리는 이것에 대한 이유를 모른다: 폐로 채워진 아가로즈의 부피가 너무 크거나 너무 낮아서 장기를 PCLS로 절단하는 것이 최적이 아닐 수 있습니다. 또는, 아가로즈가 주입 절차 중에 너무 빨리 냉각되어 전단 응력에 손상을 입혔다는 것은 상상할 수 있습니다. 개별 PCLS에서 실행 가능한 동맥을 감지할 수 없는 경우 섹션을 버리고 다른 동맥으로 교체해야 합니다.
동맥의 생존 가능성에 대한 결정은 U46619에 대한 응답을 기반으로 이루어졌습니다. 0.1 μM의 농도에서 U46619를 적용하면 일부 운동 후 화면의 이미지 시퀀스에서 직접 볼 수 있는 혈관 수축을 유도한다. 혈관 반응성에 약간의 차이가 있기 때문에 우리는 약물에 노출 된 폐 섹션이나 단독으로 배지에 대한 혈관 반응을 측정하여 HPV에 대한 약물의 영향을 조사합니다.
개별 동맥의 HPV는 수시로 현미경에서 거의 검출할 수 없으며, 평균적으로 대략 20-30%의 광장 영역의 감소에 초래됩니다. 그러나 동맥 직경의 작은 변화는 유동 저항에 대한 뚜렷한 입력을 갖습니다. R=저항 및 r=반지름이 있는 방정식 "R = 1/r4"에따르면, 유동 저항은 반경의 네 번째 힘에 반비례합니다. 예를 들어 보겠습니다: 직경 40 μm(r=20 μm)의 원형 단면을 나타내는 "이상적인 동맥"은 약 1,260 μm2의광광면적을 갖는다. 발광 면적이 20% 감소하면 선박의 직경이 10.5%에서 35.8 μm(r=17.9 μm)로 감소한다고 계산할 수 있습니다. 위에 주어진 방정식에 따르면,이 선박의 흐름 저항은 약 55 %인 6.25 x 10-6에서 9.71 x 10-6으로 증가할 것입니다. 발광 면적이 30% 감소하면 반경이 약 16% 감소하되 유동 저항은 약 100% 증가합니다. 이러한 계산은 라미나르 혈류와 경질 파이프의 혈관 형태가 이미 직경이 유동 저항에 미치는 영향의 암시인 것으로 가정되는 과단순화이지만.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 우수 클러스터 심장 - 폐 시스템에 의해 후원된다.
자료
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
참고문헌
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유