Method Article
Análise videomorfométrica da vasoconstrição pulmonar hipoxica de artérias intra-pulmonares usando fatias pulmonares cortadas por precisão de murina
Neste Artigo
Resumo
A vasoconstrição pulmonar hipóxica (HPV) é um importante fenômeno fisiológico pelo qual a perfusão pulmonar de hipóxia alveolar é compatível com a ventilação. O principal segmento vascular que contribui para o HPV é a artéria intra-acinar. Aqui, descrevemos nosso protocolo para a análise do HPV de vasos pulmonares murinas com diâmetros de 20-100 μm.
Resumo
A hipóxia alveolar aguda causa vasoconstrição pulmonar (HPV) - também conhecida como mecanismo von Euler-Liljestrand - que serve para combinar perfusão pulmonar à ventilação. Até agora, os mecanismos subjacentes não são totalmente compreendidos. O principal segmento vascular que contribui para o HPV é a artéria intra-acinar. Esta seção de vasos é responsável pelo suprimento sanguíneo de um acinus individual, que é definido como a porção de distal pulmonar para um brônquio terminal. As artérias intra-acinar estão localizadas principalmente naquela parte do pulmão que não pode ser seletivamente atingida por uma série de técnicas comumente utilizadas, como a medição da pressão arterial pulmonar em pulmões isolados perfumados ou registros de força de segmentos de artéria pulmonar proximal dissecados1,2. A análise dos vasos subpleurais por microscopia de luminescência de luminescência confocal em tempo real é limitada a vasos com até 50 μm de diâmetro3.
Fornecemos uma técnica para estudar o HPV de artérias intra-pulmonares murinas na faixa de 20-100 μm de diâmetro interno. Baseia-se na análise videomorfométrica de artérias transversais em fatias pulmonares cortadas com precisão (PCLS). Este método permite a medição quantitativa da vasoreatividade de pequenas artérias intra-acinar com diâmetro interno entre 20-40 μm que estão localizadas em gussets de septa alveolar ao lado de dutos alveolares e de artérias pré-acinar maiores com diâmetros internos entre 40-100 μm que correm adjacentes a brônquios e bronquiolos. Em contraste com a imagem em tempo real de vasos subpleurais em camundongos anestesiados e ventilados, a análise videomorfométrica do PCLS ocorre sob condições livres de estresse de tesoura. Em nosso modelo experimental, ambos os segmentos arteriais exibem um HPV monofásico quando expostos a gases médios com 1% de O2 e a resposta desaparece após 30-40 min na hipóxia.
Introdução
Na maioria dos leitos vasculares sistêmicos a hipóxia induz a vasodilatação, em comparação com a vasoconstrição causada pela hipóxia na vasculatura pulmonar. Esta resposta específica do pulmão à redução da tensão de oxigênio é chamada de vasoconstrição pulmonar hipóxica (HPV), inícios em segundos e reverte rapidamente após a mudança para ventilação normoxic. Embora o HPV seja conhecido há mais de 60 anos, os sensores de oxigênio celular e a cascata de sinalização que resultam em vasoconstrição ainda estão em debate. Há um consenso relativo e amplo de que as alterações de redox e ROS evocadas por hipóxia são essenciais para o HPV e para o desenvolvimento da hipertensão pulmonar (revisada em Sylvester et al. 4 e Schumacker et al. 5). Nossos próprios dados suportam um papel central do complexo II da cadeia respiratória mitocondrial no HPV6,7. Recentemente, Wang et al. apresentou um conceito completamente novo para sensoriamento de oxigênio e HPV: Com base em seus dados eles propõem que a hipóxia alveolar é sentida pelos capilares adjacentes que causam despolarização da membrana das células endoteliais. A resposta é propagada através de junções de 40 lacunas das células endoteliais que levam à constrição de células musculares lisas de arterioles a montante8.
As artérias do pulmão correm ao lado das vias aéreas, ramificam-se com elas, diminuem continuamente o diâmetro e, finalmente, fornecem sangue ao sistema capilar localizado nas paredes alveolares. Esta circulação arterial é composta de segmentos anatomicamente e funcionalmente distintos. As artérias condutoras proximais, caracterizadas por uma abundância de fibras elásticas nas paredes, são seguidas por artérias intra-pulmonares totalmente musculosas que controlam em grande parte a resistência vascular pulmonar. Passo a passo, essas artérias transitam em segmentos onde a camada muscular fica incompleta, e finalmente os vasos estão livres de células de actina-imunoreactive musculares lisas. A artéria intra-acinar alimentando um acinus pulmonar individual com sangue representa um segmento parcialmente muscular6. Da mesma forma, o sistema arterial pulmonar não representa uma estrutura uniforme em relação à resposta hipóxica, mas exibe diversidade regional marcante9,10. Por exemplo, em artérias pulmonares proximais isoladas de pulmões de ratos, a hipóxia induz uma resposta bifásica, exibindo uma contração rápida inicial de curta duração que - após relaxamento incompleto - é seguida por uma segunda contração lenta, mas sustentada11. Nas artérias de resistência isoladas do parenchyma pulmonar de rato como quarta e quinta divisão de artérias pulmonares (diâmetro externo <300 μm), a hipóxia causa constrição monofásica9. Já em 1971 Glazier e Murray concluíram a partir de medições de mudanças na concentração capilar de glóbulos vermelhos nos pulmões de cães ventilados com misturas de gás hipóxico que o aumento induzido pela hipóxia na resistência vascular ocorreu principalmente a montante dos capilares12. Atualmente, a microscopia intravital de pulmões intactos de camundongos anestesiados e mecanicamente ventilados representa uma poderosa ferramenta para a análise da microvasculatura pulmonar13,14. A excisão de uma janela circular na parede torácica dá acesso microscópico à superfície do pulmão e permite a análise de vasos pulmonares subpleurais com até 50 μm de diâmetro. Combinando essa técnica com a infusão do FITC-dextran, Tabuchi et al. demonstraram que apenas as artérias de tamanho médio com diâmetros de 30-50 μm apresentam uma resposta acentuada à hipóxia que sustentou durante um período de 60 minutos com atenuação menor após 30 min. Em contraste, pequenas artérias com diâmetros de 20-30 μm apresentaram apenas uma pequena resposta à hipóxia3. No entanto, essa técnica não permite a análise de artérias com diâmetro maior que 50 μm já que esses vasos estão localizados muito profundos no tecido pulmonar.
A fim de preencher a lacuna na análise de artérias pulmonares grandes e muito pequenas (como os vasos subpleurais) dos pulmões murinos, adotamos um método descrito por Martin et al. para análise da reatividade das vias aéreas15. Com base em uma técnica de intilação de gel de agarose, facilita a preparação de fatias pulmonares cortadas com precisão (PCLS) a partir deste órgão relativamente macio e elástico. Dentro da vasoreatividade PCLS de artérias transversais com diâmetro interno entre 20-100 μm pode ser observada diretamente por videomicroscopia. A aplicação de medicamentos durante a incubação hipóxica do PCLS permite a análise de seus efeitos sobre o HPV. É de particular importância que essa técnica também possa ser aplicada ao rato geneticamente modificado. Com base em sua localização dentro do pulmão, classificamos as artérias como vasos pré e intra-acinar, com diâmetros internos de 20-40 μm e 40-100 μm, respectivamente. Sob uma visão funcional, a artéria intra-acinar fornece um acinus pulmonar individual com sangue e a artéria pré-acinar é as seções anteriores do vaso. A gravação de imagens em uma câmera digital permite a quantificação subsequente da reação vasorecionária. Um atributo óbvio deste modelo PCLS é a falta de estresse de tesoura agindo sobre o endotélio. Em contraste, em vasos perfumados o HPV agudo leva a um aumento do estresse de tesoura, induzindo mecanismos secundários como o NO release16. Além disso, o uso de PCLS permite medições do HPV sem influências neurais ou hormonais extrapulmonares. Em contraste com os sistemas de cultura celular, por exemplo, preparados a partir de células musculares lisos pulmonares caninas17, a arquitetura histológica da parede do vaso é quase completamente preservada.
Em resumo, este protocolo fornece um método útil para a análise de potenciais sensores de oxigênio molecular e/ou vias celulares responsáveis pelo HPV de artérias intra-pulmonares com diâmetros internos entre 20-100 μm em condições livres de estresse de tesoura.
Protocolo
1. Preparação de Misturas de Gás, Equipamentos, Instrumentos e Soluções
Esta seção descreve os equipamentos necessários e a configuração para o protocolo. Podem ser encontrados detalhes adicionais e informações do fabricante na tabela de acompanhamento.
- Obtenha ou prepare as seguintes misturas de gás:
- Duas garrafas com mistura de gás normoxic composta por 21% O2, 5,3% CO2, 73,7% N2.
- Uma garrafa com mistura de gás hipóxico composta por 1% O2, 5,3% CO2, 93,7% N2.
- Reúna os seguintes equipamentos:
- Um forno de micro-ondas, para derreter a agarose.
- Um armário de aquecimento, para lavar a ágarose das seções pulmonares (veja abaixo). Insira um tubo conectado a uma garrafa com mistura de gás normoxic no armário.
- Um vibratome com lâminas de barbear apropriadas, para cortar os pulmões em fatias de 200 μm de espessura. É vantajoso se o vibratome for mobiliado com um conjunto refrigerador para esfriar o tampão na bacia vibratome.
- Uma câmara de superfusão de fluxo montada em um microscópio invertido, para análise do HPV de artérias intrapulmonares.
- Para facilitar a fixação das seções pulmonares na parte inferior da câmara, conecte as cordas de nylon a um anel de platina (auto-construído). Junte a câmara de perfusão a uma bomba peristáltica com taxas de fluxo ajustadas para 0,7 ml/min e 6 ml/min, respectivamente.
- Monte o equipamento para que durante os experimentos a mídia seja armazenada em um banho de água de 37 °C e borbulhada com gás normóxico ou hipóxico usando 21 G x 4 3/4 cânulas. Além disso, use uma segunda conexão do botijão de gás para permitir que as misturas de gás normoxic/hipóxico sejam alimentadas no espaço aéreo da câmara de perfusão. Certifique-se de que todos os tubos deste sistema estão apertados a gás.
- Uma câmera CCD montada em um microscópio invertido vertical para gravar imagens da artéria analisada.
- Prepare os seguintes instrumentos:
- Para a preparação dos pulmões: um conjunto de dissecação estéril, incluindo uma tesoura áspera e dois pares de fórceps, uma tesoura fina para abertura do peito, um microscissor para cortar um buraco na traqueia para o enchimento da agarose, e algodão de costura (cerca de 20 cm) para ligadura da traqueia para evitar o escoamento da agarose.
- Para o enchimento das vias aéreas com agarose: conecte uma seringa de 2 ml ao tubo plástico flexível de uma cânula de indwelling iv (20 G x 1 1/4).
- Para perfusão dos pulmões com tampão: fixar uma seringa de 50 ml como um reservatório tampão cerca de 40 cm acima do local de trabalho para a preparação do rato.
- Para saída do buffer: conecte a seringa a um tubo ao qual uma cânula de 25 G x 1 esteja presa. Use um grampo no tubo para ajustar a vazão a cerca de 1 gota/seg (cerca de 0,3-0,4 ml/min).
- Prepare os seguintes buffers e mídia:
- Faça 1.000 ml de tampão HEPES-Ringer (10 mM HEPES, 136,4 mM NaCl, 5,6 mM KCl, 1 mM MgCl2•6H2O, 2,2 mM CaCl2•2H2O, 11 mM de glicose, pH 7.4). Armazene o tampão filtrado estéril (tamanho de poros do filtro: 0,2 μm) a 4 °C.
- Cerca de 30 minutos antes de iniciar o isolamento dos pulmões preparar as seguintes soluções:
- Dissolver 1,5% w/v ponto de fusão baixo agarose no tampão HEPES-Ringer (volume total de 10 ml) e derretê-lo cozinhando em um forno de micro-ondas. Posteriormente, esfrie-o até 37 °C por armazenamento em um armário de aquecimento. Pré-aquecimento a seringa de 2 ml para encher a agarose nas vias aéreas pulmonares.
- Pegue 20 ml do buffer HEPES-Ringer, adicione heparina a uma concentração final de 250 I.U./ml, e aqueça o buffer a 37 °C. Imediatamente antes do uso adicione nitroprusside de sódio a uma concentração final de 75 μM. Este é o tampão de perfusão para fugir do sangue da vasculatura pulmonar.
- Coloque 200 ml de tampão HEPES-Ringer em um copo de vidro e armazene-o no gelo. Este buffer será necessário para resfriar os pulmões isolados cheios de agarose.
- Encha cerca de 200 ml de MEM suplementado com penicilina/estreptomicina de 1% em um copo de vidro e armazene-o a 37 °C no armário de aquecimento. Bolha o meio com mistura de gás normoxic. Isto será usado para a remoção da agarose das seções pulmonares.
- Pré-aquecimento 2 garrafas de MEM suplementadas com penicilina/estreptomicina em banho-maria a 37 °C e borbulham-nas com mistura de gás normóxico e hipóxico, respectivamente, por pelo menos 2 horas antes de iniciar as medições videomorfométricas. Aproximadamente 250 ml MEM serão necessários por medição.
- Reúna os seguintes materiais adicionais:
- 70% etoh para desinfecção.
- Solução de estoque de heparina (25.000 I.U./5 ml), armazenada a 4 °C (ver acima).
- Solução de estoque do nirifado de sódio no doador (Nipruss): 10 mM em H2O, armazenado no gelo (ver acima).
- Solução de estoque de tromboxano analógico U46619: 10 μM em etanol, armazenado no gelo.
- Supercola.
- Costurar algodão para ligadura da traqueia após o enchimento com agarose.
2. Animais
Use camundongos (por exemplo, da cepa C57Bl6) de ambos os sexos com idades entre 10 e 25 semanas. O HPV também pode ser analisado em cepas de nocaute e as cepas de tipo selvagem correspondentes.
Todos os experimentos foram realizados de acordo com as diretrizes do NIH para o cuidado e uso de animais experimentais, e foram aprovados pelos conselhos institucionais locais.
3. Isolamento dos Pulmões Murinos e Preparação de Fatias pulmonares cortadas de precisão (PCLS)
- Mate o rato por luxação cervical. Imediatamente após a morte, esterilize a superfície do corpo ventral com 70% de EtOH e use a tesoura áspera para cortar a pele ao longo da linha média ventral do queixo até a pelve.
Nota: Uma vez que se sabe que anestésicos inalatórios como isoflurano têm impacto no tom vascular18,19, não usam anestésicos voláteis. - Após a abertura da cavidade abdominal, coloque as alças intestinais de lado e corte os vasos abdominais grandes para sangramento. Depois de penetrar o diafragma com a tesoura fina, os pulmões entrarão em colapso como resultado da entrada de ar na cavidade pleural. Use a tesoura para separar o diafragma da abertura torácica inferior. Corte as costelas e a clavícula lateralmente para remover a parte ventral da gaiola de rasgo.
Nota: É importante que os pulmões não sejam danificados nesta etapa, pois de outra forma o inchaço dos pulmões com agarose será impossível! Utilize apenas instrumentos estéreis e vidros de laboratório. - Antes de iniciar a perfusão da vasculatura pulmonar, corte um pequeno buraco no ventrículo esquerdo do coração para descarga do tampão. Encha o reservatório de seringa com tampão HEPES-Ringer quente (37 °C) contendo heparina e nitroprusside de sódio (tampão de perfusão) e perfusa a vasculatura pulmonar lentamente através do ventrículo direito.
Nota: A perfusão é eficiente quando os pulmões mudam de cor e têm uma aparência branca. Nesta etapa é importante adicionar nitroprusside de sódio no tampão de perfusão; isso impede que as artérias pré-acinar se retirem do tecido circundante. - Remova as glândulas salivares, os músculos pequenos e o tecido conjuntivo da traqueia. Desconecte a traqueia do tecido conjuntivo circundante e o algodão de costura entre esôfago e traqueia para ligadura posterior.
- Use o microscissor para cortar um pequeno buraco na parte superior da traqueia entre duas cartilagens traqueais vizinhas. Agora insira o tubo de plástico flexível de uma cânula de indwelling iv através do pequeno orifício na traqueia e fixe-o cuidadosamente com o algodão de costura. Encha lentamente as vias aéreas com o ponto de fusão baixo (37 °C) quente. Observe os pulmões: A princípio, o pulmão direito começa a se expandir seguido pelo pulmão esquerdo. O preenchimento é concluído quando ambos os pulmões são inflados a um volume comparável à situação in vivo (cerca de 1,2-2,0 ml, dependendo do sexo, idade e peso).
Nota: Se apenas um pulmão se expandir, o tubo plástico pode ter sido inserido muito profundo para que tenha atingido o brônquio. Neste caso, tem que ser puxado um pouco para fora. Tenha em mente que a agarose se solidificará quando esfriar gradualmente. - Quando os pulmões estiverem cheios, puxe simultaneamente o tubo plástico e liga a traqueia com o algodão de costura para evitar o escoamento da agarose. Posteriormente, corte a traqueia acima da ligadura e despreze os pulmões e o coração no bloco do peito.
Nota: Para iniciantes, pode ser útil pedir apoio a um colega na etapa de ligadura. - Transfira o pacote de órgãos para o amortecedor HEPES-Ringer gelado para solidificar a agarose. Isso acontece em poucos minutos.
- Separe os lóbulos pulmonares individuais e conserte um lobo com supercola no porta-espécimes do vibratome.
Nota: É útil colocar um pedaço de uma rolha de champanhe no suporte que serve como espeto durante o corte do tecido pulmonar elástico. Dependendo do lobo pulmonar utilizado e de sua orientação sobre o porta-espécimes, o PCLS obtido pode ser mais adequado para análise de vasos pequenos ou grandes. Na maioria das vezes usamos o lobo esquerdo e o lobo craniano direito para a preparação do PCLS. Para obter pequenas artérias intra-acinar transversais, cole o lobo direito craniano com o hilum no suporte e corte da periferia. Para obter artérias pré-acinar transversais, alinhe o hilum do lobo direito com a rolha de champanhe. - Use um vibratome equipado com uma lâmina de barbear fresca para cortar o lobo pulmonar em fatias de 200 μm de espessura (velocidade: 12 = 1,2 mm/seg; frequência: 100; amplitude: 1,0). Colete o PCLS na bacia do vibratome preenchido com um tampão HEPES-Ringer frio de 4 °C.
Nota: Recomenda-se o resfriamento do HEPES-Ringer, mas não essencial. - Para a remoção da agarose, transfira as seções do órgão para um copo de vidro cheio de cerca de 200 ml 37 °C de MEM quente. Coloque o béquer no armário de aquecimento no qual um tubo unido a uma garrafa com mistura de gás normoxic é inserido. Bolha do MEM com o gás normóxico de modo que as seções pulmonares estão lentamente se movendo no meio. Após cerca de 2 horas, as "placas de agarose" que enchem os espaços aéreos serão removidas do tecido pulmonar. Isso pode ser reconhecido pelo fato de que as seções não estão mais nadando no topo do meio, mas se acomodam na parte inferior do béquer.
4. Análise videomorfométrica das artérias intrapulmonares de PCLS
- Para análise videomorfométrica das artérias intra-pulmonares, transfira um PCLS para a câmara de superfusão de fluxo preenchida com MEM de 1,2 ml de gás normoxico. Fixar o PCLS na parte inferior da câmara com cordas de nylon conectadas a um anel de platina (diâmetro externo/interno: 14/10 mm).
- Escaneie o PCLS microscopicamente para ver artérias transversais com diâmetros internos entre 20-100 μm.
Nota: O lúmen das artérias é forrado por células endoteliais planas. As células musculares lisas circundantes podem ser identificadas na imagem de contraste de fase como um "anel escuro" em torno do lúmen (ver imagens de contraste de fase na Figura 2). Em contraste, as vias aéreas podem ser identificadas pelo epitélio colunador inicialmente pseudoestratificado que transita no caminho para a superfície pleural em um simples epitélio colunar seguido por um simples epitélio cuboidal.- Meça o diâmetro interno no início de cada experimento.
Nota: Em vasos ligeiramente obliquamente cortados, o verdadeiro diâmetro interno da estrutura tubular pode ser determinado em um ângulo de 90° para o eixo mais longo do lúmen. Grandes artérias pré-acinar com diâmetros internos > 40 μm de funcionamento adjacentes a brônquios e bronquiolos. Pequenas artérias intra-acinar com diâmetro interno <40 μm estão localizadas em gussets de septa alveolar ao lado de alveolae e dutos alveolares6.
- Meça o diâmetro interno no início de cada experimento.
- Design experimental:
- Comece cada experimento com uma "fase de adaptação" na qual a câmara é perfundida com meio gás normóxico (taxa de fluxo: 0,7 ml/min; 10 min). Em seguida, teste a viabilidade do vaso: Analisar a contratilidade da artéria pela adição de 12 μl de 10 μM U46619 (concentração final 0,1 μM; 10 min; sem fluxo).
Nota: Para este trabalho, um vaso é definido como viável quando a área luminal é reduzida em pelo menos 30% (para o método de medição ver abaixo). - Após lavar a droga com meio gasoso normóxico (taxa de fluxo: 6 ml/min; 10 min) dilatar a artéria por aplicação de 3 μl de Nipruss de 10 mM (concentração final 25 μM; 10 min; sem fluxo).
- Novamente, remova a droga por uma lavagem de 10 minutos com meio gassado normóxico (taxa de fluxo: 6 ml/min) seguido de 10 min a um fluxo de 0,7 ml/min.
- Induzir vasoconstrição pulmonar hipóxica por incubação do PCLS com meio gassado hipóxico (taxa de fluxo: 0,7 ml/min; 40 min). Por um sistema de tubo adicional, alimente a mistura de gás hipóxico no espaço aéreo da câmara de perfusão.
- Remova o meio hipóxico por uma lavagem de 20 minutos com meio gassado normóxico (taxa de fluxo: 6 ml/min).
- Ao final de cada experimento, adicione 1,2 μl de 10 μM U46619 (concentração final 0,01 μM; 20 min; sem fluxo) à câmara de perfusão para induzir a vasoconstrição.
Nota: Esta etapa final permite determinar se uma mudança na resposta hipóxica (por exemplo, induzida pela aplicação simultânea de uma droga na fase hipóxica ou observada em um PCLS preparado a partir de uma cepa de camundongos eliminados) é específica para a constrição induzida por hipóxia ou se reflete um impacto geral na contratude. A concentração de 0,01 μM corresponde ao valor EC50 de U46619, estimado em medições anteriores de contração de concentração (não publicadas). - Use outro PCLS para realizar experimentos de controle com normoxic em vez de MEM a gás hipóxico e mistura de gás normoxic no espaço aéreo da câmara de perfusão.
- Comece cada experimento com uma "fase de adaptação" na qual a câmara é perfundida com meio gás normóxico (taxa de fluxo: 0,7 ml/min; 10 min). Em seguida, teste a viabilidade do vaso: Analisar a contratilidade da artéria pela adição de 12 μl de 10 μM U46619 (concentração final 0,1 μM; 10 min; sem fluxo).
5. Análise da Vasoreatividade e Apresentação Gráfica
- Usando um software adequado, tire fotos da artéria transversal a cada minuto durante todo o experimento.
- Usando software adequado avalia mudanças na área luminal dos vasos, forrando os limites internos à mão usando imagens em tela cheia.
Nota: Basta analisar cada segunda imagem para obter gráficos claros. No entanto, quando uma condição na câmara de superfusão de fluxo é alterada para outra, analise cada quadro. As imagens restantes servem como backup caso uma fotografia não possa ser analisada.
Infelizmente, este passo demorado tem que ser feito manualmente e não por programas apropriados, uma vez que às vezes as células sanguíneas estão presas à parede vascular que estão se movendo durante a medição ou não é uma seção transversal perfeita do vaso, mas uma seção tangencial na qual uma localização confiável dos limites internos só pode ser feita sob controle visual. - Defina o valor obtido para a área do lúmen de vaso no início do experimento como 100% e expresse vasoconstrição ou dilatação como diminuição ou aumento relativo desse valor.
- Para cada experimento, plote a área luminal relativa contra o tempo usando um software adequado.
- Para resumir vários experimentos, plote os meios das áreas luminais relativas +/- erro padrão da média (SEM) contra o tempo.
Nota: Para uma apresentação clara dos efeitos de várias substâncias sobre a hipóxia ou u46619-induzida vasoconstrição pulmonar ou da resposta hipóxica de cepas de camundongos nocauteados, a fase inicial dos experimentos, em que a viabilidade do vaso é testada, pode ser omitida do gráfico. Neste caso, os valores obtidos no início da exposição ao oxigênio reduzido são definidos como 100%.
6. Análise Estatística
- Analisar as diferenças entre os grupos experimentais com o teste Kruskal-Wallis e o Mann-Whitney, sendo p≤0,05 considerado significativo, e p≤0,01 altamente significativo.
Nota: Para obter informações adicionais sobre a preparação e uso operacional do PCLS consulte também20,21.
Resultados
Na Figura 1 são dados os resultados da medição do HPV de uma artéria pré-acinar grande e na Figura 2 de pequenas artérias intra-acinar. Nas imagens de contraste de fase (Figuras 1A e 2A) fica claro que é possível discriminar essas duas classes de artérias com base em sua localização dentro do tecido pulmonar: As artérias pré-acinar correm no bairro próximo aos brônquios e bronquiolis(Figura 1A),enquanto as artérias intra-acinar estão localizadas em gussets de septa alveolar e cercadas por alveolas (Figura 2A). Com um pouco de prática é possível ver as mudanças na área luminal em resposta ao U46619 nas imagens de contraste de fase(Figuras 1A e 2A). No entanto, a vasoconstrição pulmonar hipóxica muitas vezes não é tão pronunciada e torna-se clara somente após avaliação completa das mudanças das áreas luminais (Figuras 1B, 1C, 2B e, 2C). Por razões didáticas, demos um exemplo de uma artéria pré-acinar que mostra uma vasoconstrição extraordinariamente pronunciada. Em média, o HPV resulta em uma redução de 20 a 30% da área luminal.
Na Figura 2 são mostradas as gravações de pequenas artérias intra-acinar incubadas com meio hipoxico-gassado com ou sem pinácido de 50 μM (um abridor não seletivo de canais mitocondrial de potássio sensíveis ao ATP) e o efeito inibidor da droga torna-se claramente visível. A parte final do experimento demonstra a seletividade da ação da droga no HPV: Vasoconstrição induzida pelo análogo tromboxano U46619 não é alterada pela adição de pinácido. De fato, a curva para a artéria exposta o pinácido corre distintamente menor do que os outros dois, mas a extensão da redução da área luminal apenas por U46619 é comparável. Neste caso foi a reversão incompleta do HPV que causa a diferença entre as curvas. Neste gráfico também uma artéria exposta ao meio gás normóxico é incluída como controle adicional. Nesta condição, não são detectadas alterações na área luminal.
Na Figura 3 são mostrados os dados da série completa de medições sobre a influência do pinácido no HPV. Para comparação dos dois grupos para diferenças estatísticas, os conjuntos de dados dos pontos de tempo indicados foram analisados com o teste de Kruskal-Wallis e Mann-Whitney. O HPV foi claramente abolido na presença de pinácido, enquanto a contração induzida pelo U46619 não foi alterada.
Alternativamente, é possível identificar diferenças entre os grupos por comparação da área sob a curva, conforme descrito em Müller-Redetzky et al. 22
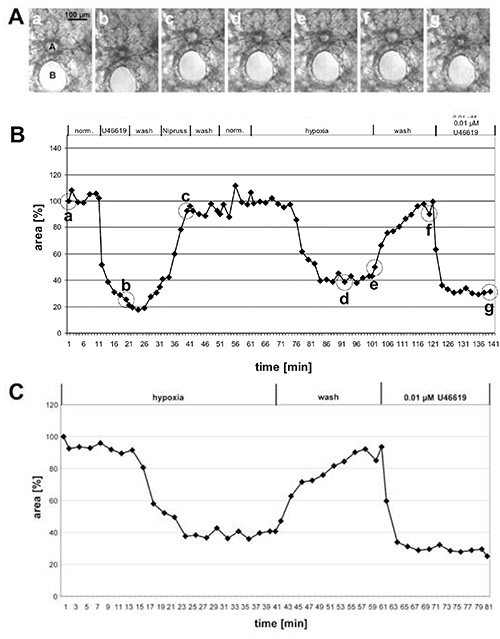
Figura 1. Medição do HPV de uma artéria pré-acinar grande. (A) Imagens de contraste de fase de uma artéria pré-acinar transversal (a) que corre no bairro próximo a um brônquio transversal(B). As fotos são tiradas nos pontos de tempo indicados em (B) por círculos: no início da medição (a), no final do tratamento com U46619 (b), no final da exposição a Nipruss (c), após 30 ou 40 min em meio gás hipóxico (d, e), após lavagem com meio gás normóxico (f), e após a aplicação final de U46619 (g). No gráfico (B) as mudanças da área luminal são traçadas contra o tempo, enquanto a área luminal no início do experimento é definida como 100% e a vasoconstrição/dilatação são dadas como valores relativos. Neste caso, a hipóxia induz uma redução de 60% da área luminal. (C) Para uma apresentação mais clara da resposta hipóxica, a fase inicial do experimento em que a vasoreatividade foi testada não está incluída, mas o valor obtido imediatamente antes da exposição ao oxigênio reduzido é definido como 100% (ver também Figura 2). Clique aqui para ver imagem maior.
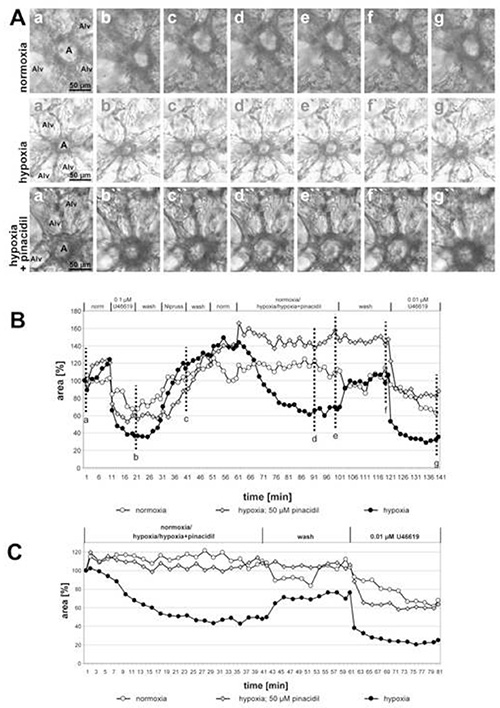
Figura 2. Impacto do pinácido (um abridor não seletivo de canais de potássio sensíveis ao ATP mitocondrial; mitoKATP) no HPV de pequenas artérias intra-acinar. (A) As artérias intra-acinar (a) estão localizadas em gussets de septa alveolar. Alv = alvéolo. A sequência das condições individuais aplicadas nesses experimentos é dada na manchete do gráfico (B). A exposição hipóxica é realizada na presença ou ausência de pinácido de 50 μM. As incubações de controle são feitas com meio de gás normóxico. As imagens mostradas em (A) são tiradas no início da medição (a, a', a"), no final do tratamento com U46619 (b, b', b"), no final da exposição a Nipruss (c, c', c"), após 30 ou 40 min em meio a gás hipóxico ou normóxico (d, d', d"; e, e', e"), após lavagem com meio gassado normoxico (f, f', f"), e após a aplicação final de U46619 (g, g', g"). Para uma apresentação mais clara da resposta à normoxia/hipóxia/hipóxia+pinácido, os valores obtidos imediatamente antes da exposição ao meio normóxico/hipóxico-gassado são definidos como 100% (C). Clique aqui para ver imagem maior.
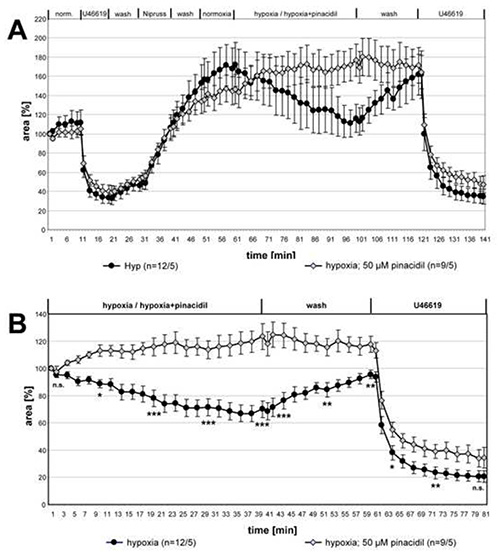
Figura 3. Inibição do HPV por pinácido. As gravações de pequenas artérias intra-acinar expostas ao meio a gás hipóxico com ou sem pinácido de 50 μM são resumidas e apresentadas como meios ± SEM. Em (A) são mostrados os registros completos, em (B) os dados relativos em relação ao valor no início da incubação hipóxica. Nenhuma vasoreatividade é detectável em PCLS que são expostos a meios de gás hipóxico contendo pinácido. A vasoconstrição induzida pelo U46619 não é afetada pela droga. "n" entre parênteses refere-se ao número de artérias/número de animais dos quais foram feitas PCLS. Em outras palavras, o primeiro número descreve a contagem de seções pulmonares analisadas e o segundo número dá a contagem de camundongos de onde essas seções foram preparadas. No momento em que os pontos de tempo são testadas para significância. n.s.: não significativo, *: p≤0,05, **: p≤0,01, ***: p≤0.001. Clique aqui para ver imagem maior.
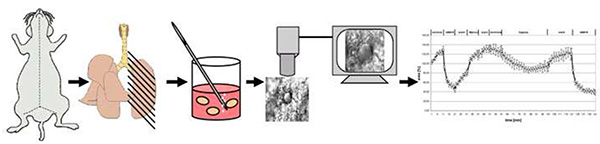
Figura 4. Visão geral esquemática do método. Resumidamente, ratos são mortos por luxação cervical. Após a abertura do peito, os pulmões são preenchidos com baixo ponto de fusão agarose e depois de esfriar cortado em 200 μm de espessura corte de precisão fatias pulmonares (PCLS). Após a remoção da agarose a 37 °C, um PCLS é transferido para a câmara de superfusão de fluxo na qual é exposto a médio normóxico ou a gás médio com 1% O2. A vasoreatividade é registrada como mudanças na área luminal. Clique aqui para ver imagem maior.
Discussão
O pulmão isolado do camundongo ventilado e perfusado é um excelente modelo para a análise da resposta fisiológica do sistema vascular pulmonar sobre alterações no fornecimento de oxigênio e entre outros permite a medição contínua da pressão arterial pulmonar1. No entanto, esse modelo não permite a identificação e análise desses segmentos vasculares mostrando a resposta mais forte à hipóxia. Esta é a vantagem da nossa análise videomorfométrica do PCLS que facilita a medição do HPV de artérias individuais com diâmetros internos de 20-100 μm. O PCLS representa um modelo in vitro atraente, uma vez que se assemelham muito ao órgão do qual são preparados. Em contraste com os sistemas de cultura celular, todos os tipos de células estão presentes em sua configuração original de matriz tecidual. Além disso, um pulmão é suficiente para a preparação de muitos PCLS, de modo que pelo menos parcialmente experimentos podem ser padronizados pelo uso de seções do mesmo rato. De acordo com o conceito 3R (redução, refinamento e substituição de animais de laboratório nas ciências da vida) de Russell e Burch23 este fato também defende o uso de PCLS.
No entanto, é preciso ter em mente que o tecido é danificado pelo corte com vibratome e sinalização longitudinal, por exemplo, através das células endoteliais, conforme postulado por Kübler et al. 14 não é mais possível.
Inicialmente, o PCLS foi aplicado principalmente para estudos bioquímicos, farmacológicos e toxicológicos, mas, entretanto, também são utilizados para medição de contratilidade brônquica, função mucociliaria e respostas vasculares (para revisões ver Sanderson20 e Davies21). Held et al. realizaram um estudo no qual compararam os modelos de pulmão isolado do rato perfusado e ventilado e de PCLS24. Eles descobriram pela análise das respostas das vias aéreas e vasos pulmonares a uma variedade de mediadores endógenos que características importantes de todo o pulmão foram mantidas em PCLS.
No PCLS, as condições hipóxiis não são estabelecidas através das vias aéreas como no pulmão intacto, mas pela incubação da seção pulmonar em meio hipoxico-gassado. Analisamos a pressão parcial de oxigênio (pO2) de média pré-pregada com 1% O2, 5,3% CO2,93,7% N2 e com 21% O2, 5,3% CO2, 73,7% N2, respectivamente, utilizando um analisador de gás sanguíneo. Imediatamente antes de alimentá-lo na câmara de perfusão, o pO2 do MEM a gás hipóxico era de 40 mmHg e o do médio gasso normóxico de 160 mmHg6. No pulmão intacto o HPV é induzido quando o alveolar pO2 cai abaixo de 50 mmHg25, uma situação que pode ser obviamente imitada pela aplicação de meio de gás hipóxico. Nossos dados sobre a extensão do HPV correspondem bem aos resultados obtidos com uma abordagem experimental diferente. Yamaguchi et al. aplicaram pulmões de ratos isolados para examinar microvexilhões com diâmetro de 20-30 μm por microscopia de luminescência de luminescência confocal em tempo real acoplada a uma câmera de alta sensibilidade com um intensificador de imagem10. Observaram uma redução média do diâmetro de 2,7 μm após a exposição dos pulmões à hipóxia. Pode-se calcular que uma redução de 20% da área luminal à medida que a medimos em nosso sistema corresponde a uma redução de cerca de 15% no diâmetro.
Em nossos experimentos classificamos as artérias como vasos pré e intra-acinar, respectivamente, com diâmetros internos de 40-100 μm e 20-40 μm. Em humanos, a transição de artérias musculares para não musculares ocorre na faixa de diâmetro de 70-100 μm. Em camundongos, as células musculares lisas estão presentes até um diâmetro externo de 20 μm26. Por essa razão não é possível analisar artérias com diâmetros abaixo de 20 μm, uma vez que não podem ser identificadas com base na imagem de contraste de fase. Na outra extremidade da escala, vasos com diâmetros acima de 100 μm dificilmente são encontrados em PCLS e comumente retirados do tecido circundante.
Na verdade, vários candidatos moleculares são discutidos como sensores de oxigênio molecular ou como componente da cascata de sinalização resultando em HPV (para uma revisão ver Sylvester et al. 4). Uma vez que os camundongos eliminatórios apropriados estejam disponíveis, a videomorfometria pode ser usada para análise da vasoreatividade das artérias pré e intra-acinar em comparação com animais do tipo selvagem. No entanto, o PCLS também tem sido usado para outras questões: Faro et al. empregaram-nos para caracterizar o desenvolvimento da dilatação dependente do endotélio no pulmão após o nascimento29 e o PCLS preparado a partir de cobaias expostos à fumaça ou ao ar diariamente durante 2 semanas foram utilizados para demonstrar o impacto da fumaça do cigarro na vasoreatividade via indução da disfunção endotelial30.
Passos críticos dentro do protocolo
Em nossos experimentos classificamos as artérias como pré-acinar (diâmetros internos de 40-100 μm) e intra-acinar (diâmetros internos de 20-40 μm). Especialmente para a preparação de seções pulmonares que devem ser utilizadas para a análise de vasos maiores é importante adicionar nitroprusside de sódio ao tampão de perfusão. Esta droga previne a contração dos vasos durante a preparação da amostra e, assim, seu rasgo do tecido circundante levando à vasodilatação incompleta. Nitroprusside de sódio no tampão de perfusão não é tão importante para a preparação da seção pulmonar que deve ser usada para análise de pequenas artérias porque estão fortemente ancoradas no septo alveolar.
Todos os experimentos devem ser iniciados com incubações nas quais a reatividade das artérias é testada. Raramente, obtivemos preparações pulmonares nas quais nenhuma resposta de vasos a empreiteiros ou dilatadores era detectável. Não sabemos a razão para isso: Pode ser que o volume da agarose preenchida nos pulmões era muito grande ou muito baixo para que o corte do órgão em PCLS não fosse o ideal. Alternativamente, é imaginável que a agarose estava esfriando muito rápido durante o procedimento de instilação resultando em estresse de cisalhamento prejudicial. Caso em um PCLS individual nenhuma artéria viável seja detectável, a seção deve ser descartada e substituída por outra.
A decisão sobre a viabilidade de uma artéria foi tomada com base na resposta ao U46619. A aplicação de U46619 a uma concentração de 0,1 μM induz uma vasoconstrição que - após algum exercício - é visível diretamente na sequência de imagem na tela. Uma vez que há algumas variâncias na vasoreatividade investigamos o impacto de uma droga no HPV medindo a vasoresponse em seções pulmonares expostas à droga ou apenas ao meio por sua vez.
O HPV de uma artéria individual é muitas vezes pouco detectável no microscópio, e em média resulta em uma redução da área luminal de cerca de 20-30%. No entanto, pequenas alterações no diâmetro de uma artéria têm uma entrada distinta na resistência ao fluxo. De acordo com a equação "R = 1/r4" com R=resistência e r=radius, a resistência ao fluxo é inversamente proporcional à quarta potência do raio. Deixe-me dar um exemplo: Uma "artéria ideal" exibindo uma seção transversal circular com diâmetro de 40 μm (r=20 μm) tem uma área luminal de cerca de 1.260 μm2. Quando a área luminal é reduzida em 20%, podemos calcular que o diâmetro do vaso é reduzido em 10,5% para 35,8 μm (r=17,9 μm). De acordo com a equação dada acima, a resistência ao fluxo deste navio aumentaria de 6,25 x 10-6 para 9,71 x 10-6 que é de cerca de 55%. No caso de uma redução da área luminal em 30% o raio diminuiria em cerca de 16%, mas a resistência ao fluxo aumentaria em cerca de 100%. Embora esses cálculos sejam uma simplificação excessiva na qual um fluxo sanguíneo laminar e uma forma de vaso de um tubo rígido são assumidos que é sugestivo do impacto de já pequenas alterações do diâmetro na resistência ao fluxo.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa é patrocinada pelo Sistema Cardio-Pulmonar de Cluster de Excelência.
Materiais
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
Referências
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados