Method Article
Videomorphometrische Analyse der hypoxischen Lungenvasokonstriktion der intrapulmonalen Arterien mit Murine Precision Cut Lung Slices
In diesem Artikel
Zusammenfassung
Hypoxische Lungenvasokonstriktion (HPV) ist ein wichtiges physiologisches Phänomen, durch das bei alveolarer Hypoxie-Lungenperfusion auf die Beatmung abgestimmt wird. Das wichtigste Gefäßsegment, das zu HPV beiträgt, ist die Intra-Acinar-Arterie. Hier beschreiben wir unser Protokoll zur Analyse von HPV von murinen Lungengefäßen mit Durchmessern von 20-100 m.
Zusammenfassung
Akute alveolare Hypoxie verursacht eine pulmonale Vasokonstriktion (HPV) - auch bekannt als von Euler-Liljestrand-Mechanismus -, der dazu dient, die Lungenperfusion mit der Beatmung abzugleichen. Bisher sind die zugrunde liegenden Mechanismen nicht vollständig verstanden. Das wichtigste Gefäßsegment, das zu HPV beiträgt, ist die Intra-Acinar-Arterie. Dieser Gefäßabschnitt ist verantwortlich für die Blutversorgung eines einzelnen Acinus, der als der Teil der Lungendistal zu einem terminalen Bronchiol definiert ist. Intra-acinar Arterien befinden sich meist in jenem Teil der Lunge, der durch eine Reihe von häufig verwendeten Techniken wie die Messung des Lungenarteriendrucks in isolierten perfundierten Lungen oder Kraftaufnahmen aus sezierten proximalen Lungenarteriensegmenten1,2selektiv erreicht werden kann. Die Analyse subpleuraler Gefäße durch konfokale Laserscanning-Lumineszenzmikroskopie in Echtzeit ist auf Gefäße mit einem Durchmesser von bis zu 50 m3beschränkt.
Wir bieten eine Technik zur Untersuchung der HPV von murinen intrapulmonalen Arterien im Bereich von 20-100 m Innendurchmessern. Es basiert auf der videomorphometrischen Analyse von Querschnittsarterien in präzisionsgeschnittenen Lungenscheiben (PCLS). Diese Methode ermöglicht die quantitative Messung der Vasoreaktivität kleiner intra-acinararterienarterien mit innendurchmesserzwischen 20-40 m, die sich an Denkbögen von Alveolarsepta neben Alveolarkanälen und von größeren präacinaren Arterien mit Innendurchmessern zwischen 40-100 m befinden, die neben Bronchien und Bronchiolen verlaufen. Im Gegensatz zur Echtzeit-Bildgebung subpleuraler Gefäße in anästhesierten und belüfteten Mäusen erfolgt die videomorphometrische Analyse von PCLS unter Bedingungen, die frei von Scherspannung sind. In unserem experimentellen Modell weisen beide arteriellen Segmente eine monophasische HPV auf, wenn sie einer mittleren Vergasung mit 1%O2 ausgesetzt sind, und das Ansprechverhalten verblasst nach 30-40 min bei Hypoxie.
Einleitung
In den meisten systemischen Gefäßbetten induziert Hypoxie Eine Vasodilatation, im Vergleich zur Vasokonstriktion, die durch Hypoxie in der Lungenvaskulatur verursacht wird. Diese lungenspezifische Reaktion auf die verringerte Sauerstoffspannung wird hypoxische Pulmonamonakonstriktion (HPV) genannt, beginnt innerhalb von Sekunden und kehrt sich schnell nach der Umstellung auf normoxische Beatmung um. Obwohl HPV seit mehr als 60 Jahren bekannt ist, sind der zelluläre Sauerstoffsensor(e) und die Signalkaskade(n), die zu Vasokonstriktionen führt, noch in der Debatte. Es besteht ein relativ breiter Konsens darüber, dass Hypoxie-evozierte Redox- und ROS-Änderungen für HPV und die Entwicklung von pulmonaler Hypertonie (in Sylvester et al. 4 und Schumacker et al. 5). Unsere eigenen Daten unterstützen eine zentrale Rolle des Komplexes II der mitochondrialen Atemkette in HPV6,7. Kürzlich, Wang et al. präsentiert ein völlig neues Konzept für Sauerstoffsensorik und HPV: Basierend auf ihren Daten schlagen sie vor, dass alveolare Hypoxie durch die angrenzenden Kapillaren wahrgenommen wird, was zu einer Membrandepolarisation der Endothelzellen führt. Die Reaktion wird über Verbindung 40 Spalt-Kreuzungen der Endothelzellen propagiert, was zu einer Verengung der glatten Muskelzellen der vorgelagerten Arteriolen8führt.
Die Arterien der Lunge verlaufen entlang der Atemwege, zweigen mit ihnen, verringern kontinuierlich den Durchmesser und versorgen schließlich das Kapillarsystem in den Alveolarwänden mit Blut. Diese arterielle Zirkulation besteht aus anatomisch und funktional unterschiedlichen Segmenten. Auf die proximalen Leitungsarterien, die sich durch eine Fülle elastischer Fasern in den Wänden auszeichnen, folgen voll muskuläre intrapulmonale Arterien, die den pulmonalen Gefäßwiderstand weitgehend steuern. Schritt für Schritt werden diese Arterien in Segmente überführt, in denen die Muskelschicht unvollständig wird, und schließlich sind die Gefäße frei von glatten Muskel-Aktivin-Immunreaktiven Zellen. Die intra-acinararterienversorgung, die einen individuellen Lungenader mit Blut füttert, stellt ein teilweise muskulöses Segment6dar. Ebenso stellt das pulmonale arterielle System keine einheitliche Struktur in Bezug auf die hypoxische Reaktion dar, sondern weist eine ausgeprägte regionale Vielfaltauf 9,10. Zum Beispiel induziert in proximalen Lungenarterien, die aus der Lungenlunge der Ratte isoliert sind, eine biphasische Reaktion, die eine anfängliche schnelle Kontraktion von kurzer Dauer zeigt, die - nach unvollständiger Entspannung - von einer zweiten langsamen, aber anhaltenden Kontraktion gefolgt wird11. In Resistenzarterien, die aus Rattenlungenparenchym als vierte und fünfte Teilung der Lungenarterien isoliert sind (Außendurchmesser <300 m), verursacht Hypoxie monophasische Verengung9. Bereits 1971 kamen Glazier und Murray aus Messungen der Kapillarkonzentration roter Blutkörperchen in der Lunge von hunden, die mit hypoxischen Gasgemischen belüftet wurden, zu dem Schluss, dass die hypoxieinduzierte Erhöhung der Gefäßresistenz hauptsächlich vor den Kapillaren12auftrat. Heutzutage stellt die intravitale Mikroskopie intakter Lungen von anästhesierten und mechanisch belüfteten Mäusen ein leistungsfähiges Werkzeug für die Analyse der Lungenmikrovaskulatur13,14dar. Die Exzision eines kreisförmigen Fensters in der Brustwand ermöglicht einen mikroskopischen Zugang zur Lungenoberfläche und ermöglicht die Analyse subpleuraler Lungengefäße mit einem Durchmesser von bis zu 50 m. Durch die Kombination dieser Technik mit der Infusion von FITC-Dextran, Tabuchi et al. zeigte, dass nur mittelgroße Arteriolen mit Durchmessern von 30-50 m eine deutliche Reaktion auf Hypoxie aufweisen, die über einen Zeitraum von 60 min mit einer geringfügigen Dämpfung nach 30 min anhielt. Im Gegensatz dazu zeigten kleine Arteriolen mit Durchmessern von 20-30 m nur eine geringe Reaktion auf Hypoxie3. Diese Technik erlaubt jedoch nicht die Analyse von Arterien mit einem Durchmesser von mehr als 50 m, da sich diese Gefäße zu tief im Lungengewebe befinden.
Um die Lücke in der Analyse von großen und sehr kleinen Lungenarterien (wie die subpleuralen Gefäße) der murinen Lunge zu überbrücken, haben wir eine Methode gewählt, die von Martin et al.beschrieben wurde. zur Analyse der Reaktivität der Atemwege15. Basierend auf einer Agarose-Gel-Instillationstechnik erleichtert es die Herstellung von präzisionsgeschnittenen Lungenscheiben (PCLS) aus diesem relativ weichen und elastischen Organ. Innerhalb der PCLS-Vasoreaktivität von Querschnittsarterien mit Innendurchmesser zwischen 20-100 m kann direkt per Videomikroskopie beobachtet werden. Die Anwendung von Medikamenten während der hypoxischen Inkubation des PCLS ermöglicht die Analyse ihrer Auswirkungen auf HPV. Es ist von besonderer Bedeutung, dass diese Technik auch auf gentechnisch veränderte Mäuse angewendet werden kann. Basierend auf ihrer Lage innerhalb der Lunge klassifizieren wir die Arterien als Prä- und Intra-Acinargefäße mit Innendurchmessern von 20-40 m bzw. 40-100 m. Unter funktioneller Sicht liefert die Intra-Acinar-Arterie einen individuellen Lungenader mit Blut und die Präacinararterie ist die vorhergehende Gefäßsektion. Die Aufnahme von Bildern auf einer Digitalkamera ermöglicht die anschließende Quantifizierung der Vasoreaktion. Ein offensichtliches Attribut dieses PCLS-Modells ist der Mangel an Scherspannung, die auf das Endothel wirkt. Im Gegensatz dazu führt akute HPV in durchbluteten Gefäßen zu einem Anstieg der Scherspannung und führt so zu sekundären Mechanismen wie NO-Freisetzung16. Darüber hinaus ermöglicht die Verwendung von PCLS Messungen von HPV ohne extrapulmonale neuronale oder hormonelle Einflüsse. Im Gegensatz zu Zellkultursystemen, die beispielsweise aus den lästigen pulmonalen gelenkglatten Muskelzellen17hergestellt werden, ist die histologische Architektur der Gefäßwand nahezu vollständig erhalten.
Zusammenfassend bietet dieses Protokoll eine hilfreiche Methode zur Analyse potenzieller molekularer Sauerstoffsensoren und/oder zellulärer Bahnen, die für HPV von intrapulmonalen Arterien mit Innendurchmessern zwischen 20-100 m unter Bedingungen ohne Scherspannung verantwortlich sind.
Protokoll
1. Herstellung von Gasmischungen, Ausrüstungen, Instrumenten und Lösungen
In diesem Abschnitt werden die für das Protokoll erforderlichen Geräte und Einstellungen beschrieben. Weitere Details und Herstellerinformationen finden Sie in der beigefügten Tabelle.
- Besorgen oder bereiten Sie folgende Gasgemische vor:
- Zwei Flaschen mit normoxischem Gasgemisch bestehend aus 21%O2, 5,3%CO2, 73,7% N2.
- Eine Flasche mit hypoxischem Gasgemisch bestehend aus 1%O2, 5,3%CO2, 93,7% N2.
- Sammeln Sie die folgenden Geräte:
- Eine Mikrowelle, zum Schmelzen der Agarose.
- Ein Heizschrank zum Auswaschen der Agarose aus den Lungenabschnitten (siehe unten). Legen Sie ein Rohr, das mit einer Flasche mit normoxischem Gasgemisch verbunden ist, in den Schrank ein.
- Ein Vibratom mit geeigneten Rasierklingen, um die Lunge in 200 m dicke Scheiben zu schneiden. Es ist vorteilhaft, wenn das Vibratome mit einem Kühlset ausgestattet ist, um den Puffer im Vibrambecken abzukühlen.
- Eine durchlaufende Superfusionskammer, die auf einem invertierten Mikroskop montiert ist, zur Analyse der HPV von intrapulmonären Arterien.
- Um die Fixierung der Lungenabschnitte an der Unterseite der Kammer zu erleichtern, verbinden Sie Nylonsaiten mit einem Platinring (selbstkonstruiert). Verbinden Sie die Perfusionskammer mit einer peristaltischen Pumpe mit durchlässigen Durchflussraten von 0,7 ml/min bzw. 6 ml/min.
- Montieren Sie die Geräte so, dass während der Experimente die Medien in einem 37 °C-Wasserbad gelagert und mit normoxischem oder hypoxischem Gas mit 21 G x 4 3/4 Kanülen geblasen werden. Zusätzlich verwenden Sie eine zweite Verbindung aus der Gasflasche, um die normoxischen/hypoxischen Gasgemische in den Luftraum der Perfusionskammer einzuspeist. Stellen Sie sicher, dass alle Rohre dieses Systems gasdicht sind.
- Eine CCD-Kamera, die auf einem aufrechten invertierten Mikroskop montiert ist, um Bilder der analysierten Arterie aufzuzeichnen.
- Bereiten Sie die folgenden Instrumente vor:
- Zur Vorbereitung der Lunge: ein steriles Sezieren set mit einer rauen Schere und zwei PaarZangen, eine feine Schere zum Öffnen der Brust, eine Mikroschere, um ein Loch in die Luftröhre zum Füllen der Agarose zu schneiden, und Nähen von Baumwolle (ca. 20 cm) für ligation der Luftröhre, um den Abfluss der Agarose zu verhindern.
- Zum Befüllen der Atemwege mit Agarose: Verbinden Sie eine 2 ml Spritze mit dem flexiblen Kunststoffrohr einer IV-Indwelling-Kanüle (20 G x 1 1/4).
- Für die Perfusion der Lunge mit Puffer: Fixieren Sie eine 50 ml Spritze als Pufferbehälter ca. 40 cm über dem Arbeitsplatz für die Mausvorbereitung.
- Für den Abfluss des Puffers: Schließen Sie die Spritze an ein Rohr an, an dem eine 25 G x 1 Kanüle befestigt ist. Verwenden Sie eine Klemme am Rohr, um den Abfluss auf ca. 1 Tropfen/Sek. (ca. 0,3-0,4 ml/min) einzustellen.
- Bereiten Sie die folgenden Puffer und Medien vor:
- 1.000 ml HEPES-Ringer Puffer (10 mM HEPES, 136,4 mM NaCl, 5,6 mM KCl, 1 mM MgCl2•6H2O, 2,2 mM CaCl2•2H2O, 11 mM Glukose, pH 7,4). Bewahren Sie den sterilen filtrierten Puffer (Porengröße des Filters: 0,2 m) bei 4 °C auf.
- Etwa 30 min vor Beginn der Isolierung der Lunge bereiten die folgenden Lösungen vor:
- 1,5% w/v Niedrigschmelzpunkt-Agarose im HEPES-Ringer-Puffer (Gesamtvolumen 10 ml) auflösen und durch Kochen in einer Mikrowelle schmelzen. Anschließend auf 37 °C abkühlen, indem sie in einem Heizschrank gelagert werden. Die 2 ml Spritze zum Füllen der Agarose in die Lungenwege vorwärmen.
- 20 ml des HEPES-Ringer-Puffers nehmen, Heparin zu einer Endkonzentration von 250 I.U./ml hinzufügen und den Puffer auf 37 °C erhitzen. Unmittelbar vor der Anwendung Natriumnitroprussid zu einer Endkonzentration von 75 m hinzufügen. Dies ist der Perfusionspuffer für das Abfließen des Blutes aus der Lungenvaskulatur.
- 200 ml HEPES-Ringer-Puffer in einen Glasbecher geben und auf Eis aufbewahren. Dieser Puffer wird benötigt, um die mit Agarose gefüllte isolierte Lunge abzukühlen.
- Ca. 200 ml MEM, ergänzt mit 1% Penicillin/Streptomycin, in einen Glasbecher füllen und bei 37 °C im Heizschrank aufbewahren. Blasen Sie das Medium mit normoxischem Gasgemisch. Dies wird zur Entfernung der Agarose aus den Lungenabschnitten verwendet.
- Vorwarme 2 Flaschen MEM mit 1% Penicillin/Streptomycin in einem Wasserbad auf 37 °C ergänzt und mit normoxischem und hypoxischem Gasgemisch für mindestens 2 Stunden blasen, bevor die videomorphometrischen Messungen beginnen. Pro Messung werden ca. 250 ml MEM benötigt.
- Sammeln Sie die folgenden zusätzlichen Materialien:
- 70% EtOH zur Desinfektion.
- Stammlösung von Heparin (25.000 I.U./5 ml), gelagert bei 4 °C (siehe oben).
- Lagerlösung des NO-Spenders Natriumnitroprussid (Nipruss): 10 mM in H2O, auf Eis gelagert (siehe oben).
- Lagerlösung von Thromboxan analog U46619: 10 'M in Ethanol, auf Eis gelagert.
- Sekundenkleber.
- Nähen von Baumwolle für ligation der Luftröhre nach dem Füllen mit Agarose.
2. Tiere
Verwenden Sie Mäuse (z. B. den Stamm C57Bl6) beider Geschlechter im Alter von 10-25 Wochen. HPV kann auch in Knockout-Stämmen und den entsprechenden Wildtyp-Stämmen analysiert werden.
Alle Experimente wurden gemäß den NIH-Richtlinien für die Pflege und Verwendung von Versuchstieren durchgeführt und von den örtlichen institutionellen Gremien genehmigt.
3. Isolierung der murinen Lunge und Vorbereitung von Präzision geschnitten Enlung Scheiben (PCLS)
- Töten Sie die Maus durch Zervix-Dislokation. Sofort nach dem Töten, sterilisieren Sie die ventrale Körperoberfläche mit 70% EtOH und verwenden Sie die grobe Schere, um die Haut entlang der ventralen Mittellinie vom Kinn bis zum Becken zu schneiden.
Anmerkung: Da bekannt ist, dass inhalative Anästhetika wie Isofluran einen Einfluss auf den Gefäßton18,19haben, verwenden Sie keine flüchtige Anästhetika. - Nach dem Öffnen der Bauchhöhle, legen Sie die Darmschlaufen beiseite und trennen Sie die großen Bauchgefäße für Blutungen. Nach dem Eindringen in das Zwerchfell mit der feinen Schere bricht die Lunge durch Lufteintritt in die Pleurahöhle zusammen. Verwenden Sie die Schere, um das Zwerchfell von der unteren Brustöffnung zu lösen. Schneiden Sie die Rippen und das Schlüsselbein seitlich, um den ventralen Teil des Rip-Käfigs zu entfernen.
Hinweis: Es ist wichtig, dass die Lunge in diesem Schritt nicht geschädigt wird, da sonst eine Blähung der Lunge mit Agarose unmöglich ist! Verwenden Sie nur sterile Instrumente und Laborglas. - Vor Beginn der Perfusion der Lungenvaskulatur, schneiden Sie ein kleines Loch in die linke Herzkammer für die Entladung des Puffers. Füllen Sie das Spritzenreservoir mit einem warmen (37 °C) HEPES-Ringer-Puffer, der Heparin und Natriumnitroprussid (Perfusionspuffer) enthält, und durchdringen Sie die Lungenvaskulatur langsam über den rechten Ventrikel.
Hinweis: Perfusion ist effizient, wenn die Lunge ihre Farbe ändert und ein weißes Aussehen erhält. In diesem Schritt ist es wichtig, Natriumnitroprussid in den Perfusionspuffer einzutragen; Dadurch wird verhindert, dass die Präacinararterien aus dem umgebenden Gewebe abreißen. - Entfernen Sie die Speicheldrüsen, kleine Muskeln und Bindegewebe aus der Luftröhre. Trennen Sie die Luftröhre vom umgebenden Bindegewebe und Faden nähen Baumwolle zwischen Speiseröhre und Luftröhre für spätere Ligation.
- Verwenden Sie die Mikroschere, um ein kleines Loch in den oberen Teil der Luftröhre zwischen zwei benachbarten Trachealknorpeln zu schneiden. Nun das flexible Kunststoffrohr einer IV-Indwelling-Kanüle über das kleine Loch in die Luftröhre einlegen und mit der Nähbaumwolle sorgfältig fixieren. Füllen Sie die Atemwege langsam mit der warmen (37 °C) niedrigen Schmelzpunkt-Agarose. Beobachten Sie die Lunge: Zuerst beginnt sich die rechte Lunge zu dehnen, gefolgt von der linken Lunge. Die Füllung wird abgeschlossen, wenn beide Lungen auf ein Volumen aufgeblasen werden, das mit der In-vivo-Situation vergleichbar ist (ca. 1,2-2,0 ml je nach Geschlecht, Alter und Gewicht).
Hinweis: Wenn sich nur eine Lunge ausdehnt, ist das Kunststoffrohr möglicherweise zu tief eingelegt, so dass es den Bronchus erreicht hat. In diesem Fall muss es ein wenig herausgezogen werden. Denken Sie daran, dass die Agarose sich verfestigt, wenn sie allmählich abkühlt. - Wenn die Lunge voll ist, ziehen Sie gleichzeitig das Kunststoffrohr heraus und ligan die Luftröhre mit der Nähbaumwolle, um einen Abfluss der Agarose zu verhindern. Anschließend schneiden Sie die Luftröhre über der Ligatur und lösen Lunge und Herz auf Block von der Brust.
Hinweis: Für Anfänger kann es hilfreich sein, einen Kollegen um Unterstützung im Ligationsschritt zu bitten. - Übertragen Sie das Organpaket in einen eiskalten HEPES-Ringer-Puffer, um die Agarose zu erstarren. Dies geschieht innerhalb weniger Minuten.
- Trennen Sie die einzelnen Lungenlappen und fixieren Sie einen Lappen mit Superkleber auf dem Probenhalter des Vibratom.
Hinweis: Es ist hilfreich, ein Stück eines Champagnerkorkens auf den Halter zu kleben, der beim Schneiden des elastischen Lungengewebes als Schiefe dient. Je nach verwendetem Lungenlappen und seiner Ausrichtung auf dem Probenhalter kann der erhaltene PCLS besser für die Analyse kleiner oder großer Gefäße geeignet sein. Meistens verwenden wir den linken und den rechten Schädellappen für die Herstellung des PCLS. Um querschnittsige kleine Intra-Acinar-Arterien zu erhalten, kleben Sie den Schädel-Rechtslappen mit dem Hilum auf den Halter und schneiden Sie ihn von der Peripherie. Um querschnittsige Vor-Acinar-Arterien zu erhalten, richten Sie den Hilum des rechten Lappens mit dem Champagnerkorken aus. - Verwenden Sie ein Vibratom, das mit einer frischen Rasierklinge ausgestattet ist, um den Lungenlappen in 200 m dicke Scheiben zu schneiden (Geschwindigkeit: 12 = 1,2 mm/sec; Frequenz: 100; Amplitude: 1,0). Sammeln Sie die PCLS im Vibrambecken, gefüllt mit 4 °C kaltem HEPES-Ringer-Puffer.
Hinweis: Die Kühlung des HEPES-Ringers wird empfohlen, ist aber nicht unbedingt erforderlich. - Zur Entfernung der Agarose die Organpartien in einen glasbecher gefüllten Glasbecher mit ca. 200 ml 37 °C warmem MEM übertragen. Legen Sie den Becher in den Heizschrank, in den ein Mitrohr mit normoxischem Gasgemisch mit einer Flasche verbunden ist. Blasen Sie das MEM mit dem normoxischen Gas, so dass sich die Lungenabschnitte langsam im Medium bewegen. Nach ca. 2 Stunden werden die "Agarose-Plaques", die die Lufträume füllen, aus dem Lungengewebe entfernt. Dies lässt sich daran erkennen, dass die Abschnitte nicht mehr auf der Oberseite des Mediums schwimmen, sondern sich auf der Unterseite des Bechers niederlassen.
4. Videomorphometrische Analyse der intrapulmonären Arterien von PCLS
- Zur videomorphometrischen Analyse von intrapulmonalen Arterien, übertragen Sie ein PCLS in die durchströmende Superfusionskammer gefüllt mit 1,2 ml normoxisch vergastem MEM. Befestigen Sie die PCLS an der Unterseite der Kammer mit Nylonsaiten, die mit einem Platinring verbunden sind (Außen-/Innendurchmesser: 14/10 mm).
- Scannen Sie die PCLS mikroskopisch auf Querschnittsarterien mit Innendurchmessern zwischen 20-100 m.
Hinweis: Das Lumen der Arterien wird von flachen Endothelzellen gefüttert. Die umgebenden glatten Muskelzellen können im Phasenkontrastbild als "dunkler Ring" identifiziert werden, der das Lumen umgibt (siehe Phasenkontrastbilder in Abbildung 2). Im Gegensatz dazu können die Atemwege durch das zunächst pseudostratifizierte Säulenepithel identifiziert werden, das sich auf dem Weg zur Pleuraoberfläche in ein einfaches säulenförmiges Epithel, gefolgt von einem einfachen quaderten Epithel, durchläuft.- Messen Sie den Innendurchmesser zu Beginn jedes Experiments.
Anmerkung: In leicht schräg geschnittenen Gefäßen kann der wahre Innendurchmesser der Rohrstruktur in einem 90°-Winkel zur längsten Achse des Lumens bestimmt werden. Große Präacinararterien mit Innendurchmessern >40 m laufen neben Bronchien und Bronchiolen. Kleine intraacinararterienarterien mit innendurchmesser <40 m befinden sich an Denkbögen von Alveolarsepta neben Alveolaund und Alveolenkanälen6.
- Messen Sie den Innendurchmesser zu Beginn jedes Experiments.
- Experimentelles Design:
- Beginnen Sie jedes Experiment mit einer "Anpassungsphase", in der die Kammer mit normoxischem Vergasten medium durchdrungen ist (Durchflussrate: 0,7 ml/min; 10 min). Als nächstes testen Sie die Lebensfähigkeit des Gefäßes: Analysieren Sie die Kontraktilität der Arterie durch Zugabe von 12 l von 10 'M U46619 (Endkonzentration 0,1 m; 10 min; kein Durchfluss).
Anmerkung: Bei dieser Arbeit wird ein Behälter als lebensfähig definiert, wenn die Luminalfläche um mindestens 30 % reduziert wird (für die Art der Messung siehe unten). - Nach dem Auswaschen des Arzneimittels mit normoxischem Vergasten Medium (Durchflussrate: 6 ml/min; 10 min) die Arterie durch Anwendung von 3 l von 10 mM Nipruss (Endkonzentration 25 m; 10 min; kein Durchfluss) zu delaten.
- Entfernen Sie das Medikament erneut durch eine 10 min Waschen mit normoxisch vergastem Medium (Durchfluss: 6 ml/min) gefolgt von 10 min bei einem Durchfluss von 0,7 ml/min.
- Induzieren Hypoxische pulmonale Vasokonstriktion durch Inkubation des PCLS mit hypoxisch vergastem Medium (Durchflussrate: 0,7 ml/min; 40 min). Durch ein zusätzliches Rohrsystem das hypoxische Gasgemisch in den Luftraum der Perfusionskammer einspeisen.
- Entfernen Sie das hypoxische Medium durch eine 20 min Waschen mit normoxisch vergastem Medium (Durchflussrate: 6 ml/min).
- Am Ende jedes Experiments fügen Sie der Perfusionskammer 1,2 l von 10 M U46619 (Endkonzentration 0,01 m; 20 min; kein Durchfluss) hinzu, um eine Vasokonstriktion zu induzieren.
Anmerkung: Dieser letzte Schritt ermöglicht die Bestimmung, ob eine Änderung der hypoxischen Reaktion (z. B. durch gleichzeitige Anwendung eines Arzneimittels in der hypoxischen Phase oder beobachtet in einem PCLS, der aus einem Knockout-Mausstamm hergestellt wird) spezifisch für die Hypoxie-induzierte Verengung ist oder ob sie einen allgemeinen Einfluss auf die Kontraktilität widerspiegelt. Die Konzentration von 0,01 m entspricht dem EC50-Wert von U46619, der bei früheren (nicht veröffentlichten) Konzentrationskontraktionsmessungen geschätzt wurde. - Verwenden Sie ein anderes PCLS, um Kontrollexperimente mit normoxischen anstelle von hypoxisch vergastem MEM und normoxischem Gasgemisch im Luftraum der Perfusionskammer durchzuführen.
- Beginnen Sie jedes Experiment mit einer "Anpassungsphase", in der die Kammer mit normoxischem Vergasten medium durchdrungen ist (Durchflussrate: 0,7 ml/min; 10 min). Als nächstes testen Sie die Lebensfähigkeit des Gefäßes: Analysieren Sie die Kontraktilität der Arterie durch Zugabe von 12 l von 10 'M U46619 (Endkonzentration 0,1 m; 10 min; kein Durchfluss).
5. Analyse der Vasoreaktivität und grafische Darstellung
- Mit geeigneter Software fotografieren Sie während des gesamten Experiments jede Minute von der Querschnittsarterie.
- Mit geeigneter Software können Sie Veränderungen des Luminalbereichs der Gefäße auswerten, indem Sie die inneren Grenzen mit Vollbildbildern von Hand aussäen.
Hinweis: Es reicht aus, jedes zweite Bild zu analysieren, um übersichtliche Diagramme zu erhalten. Wenn jedoch eine Bedingung in der Durchfluss-Superfusionskammer in eine andere geändert wird, analysieren Sie jedes Bild. Die übrigen Bilder dienen als Back-up für den Fall, dass ein Foto nicht analysiert werden kann.
Leider muss dieser zeitaufwändige Schritt von Hand und nicht von entsprechenden Programmen durchgeführt werden, da manchmal Blutzellen an der Gefäßwand befestigt sind, die sich während der Messung bewegen, oder es ist kein perfekter Querschnitt des Gefäßes, sondern ein tangentialer Abschnitt, in dem eine zuverlässige Lokalisierung der inneren Grenzen nur unter visueller Kontrolle erfolgen kann. - Definieren Sie den wert, der zu Beginn des Experiments für die Fläche des Gefäßlumens erhalten wurde, als 100% und drücken Sie Diekonstriktion oder Dilatation als relative Abnahme oder Erhöhung dieses Wertes aus.
- Für jedes Experimentplot wird der relative Luminalbereich gegen die Zeit mit geeigneter Software erstellt.
- Um mehrere Experimente zusammenzufassen, zeichnen Sie die Mittelderweisen der relativen Luminalbereiche +/- Standardfehler des Mittelwerts (SEM) gegen die Zeit.
Anmerkung: Für eine klare Darstellung der Auswirkungen verschiedener Substanzen auf hypoxia- oder U46619-induzierte Lungenvasokonstriktion oder der hypoxischen Reaktion von Knockout-Mausstämmen kann die Anfangsphase der Experimente, in der die Lebensfähigkeit des Gefäßes getestet wird, aus dem Diagramm weggelassen werden. In diesem Fall werden die Werte, die zu Beginn der Exposition gegenüber reduziertem Sauerstoff ermittelt wurden, als 100% definiert.
6. Statistische Analyse
- Analysieren Sie Unterschiede zwischen experimentellen Gruppen mit dem Kruskal-Wallis- und dem Mann-Whitney-Test, wobei p≤0,05 als signifikant und p≤0,01 als hoch signifikant angesehen wird.
Hinweis: Weitere Informationen zur Vorbereitung und Betriebsverwendung von PCLS finden Sie auch20,21.
Ergebnisse
In Abbildung 1 sind die Ergebnisse der Messung der HPV einer großen Präacinararterie und in Abbildung 2 der kleinen intraacinaren Arterien angegeben. In den Phasenkontrastbildern (Abbildungen 1A und 2A) wird deutlich, dass es möglich ist, diese beiden Arterienklassen aufgrund ihrer Lage im Lungengewebe zu unterscheiden: Präacinararterien verlaufen in unmittelbarer Nähe zu Bronchien und Bronchioli (Abbildung 1A), während sich die intraacinaren Arterien an Denkbögen von Alveolarsepten befinden und von Alveola umgeben sind (Abbildung 2A). Mit ein wenig Übung ist es möglich, die Veränderungen im Luminalbereich als Reaktion auf U46619 auf den Phasenkontrastbildern(Abbildungen 1A und 2A) zu sehen. Allerdings ist die hypoxische Lungenvasokonstriktion oft nicht so ausgeprägt und wird erst nach vollständiger Bewertung der Veränderungen der Leuchtkörperbereiche deutlich (Abbildungen 1B, 1C, 2B und, 2C). Aus didaktischem Grund haben wir ein Beispiel für eine Prä-Acinar-Arterie gegeben, die eine ungewöhnlich ausgeprägte Vasokonstriktion zeigt. Im Durchschnitt führt HPV zu einer Reduzierung der Leuchtdichte um 20-30%.
In Abbildung 2 werden die Aufnahmen kleiner intra-acinararterienarterien, die mit hypoxisch-vergastem Medium mit oder ohne 50 M Pinacidil (einem nichtselektiven Öffner von mitochondrialen ATP-empfindlichen Kaliumkanälen) inkubiert werden, gezeigt und die hemmende Wirkung des Arzneimittels deutlich sichtbar. Der letzte Teil des Experiments zeigt die Selektivität der Wirkung des Arzneimittels auf HPV: Vasokonstriktion, die durch das Thromboxan-Analog U46619 induziert wird, wird durch die Zugabe von Pinacidil nicht verändert. Tatsächlich verläuft die Kurve für die Arterie, die das Pinacidil freilegte, deutlich niedriger als die beiden anderen, aber das Ausmaß der Reduktion der Leuchtdichtefläche um U46619 allein ist vergleichbar. In diesem Fall war es die unvollständige Umkehrung von HPV, die den Unterschied zwischen den Kurven verursacht. In diesem Diagramm ist auch eine Arterie, die normoxischen vergasten Medien ausgesetzt ist, als zusätzliche Kontrolle enthalten. Unter dieser Bedingung sind keine Änderungen des Luminalbereichs nachweisbar.
In Abbildung 3 sind die Daten der vollständigen Messreihe über den Einfluss von Pinacidil auf HPV dargestellt. Zum Vergleich der beiden Gruppen für statistische Unterschiede wurden die Datensätze der angegebenen Zeitpunkte mit dem Kruskal-Wallis- und dem Mann-Whitney-Test analysiert. HPV wurde in Gegenwart von Pinacidil klar abgeschafft, während die U46619-induzierte Kontraktion unverändert blieb.
Alternativ ist es möglich, Unterschiede zwischen Gruppen durch Vergleich der Unterregion zu identifizieren, wie in Müller-Redetzky et al. beschrieben. 22
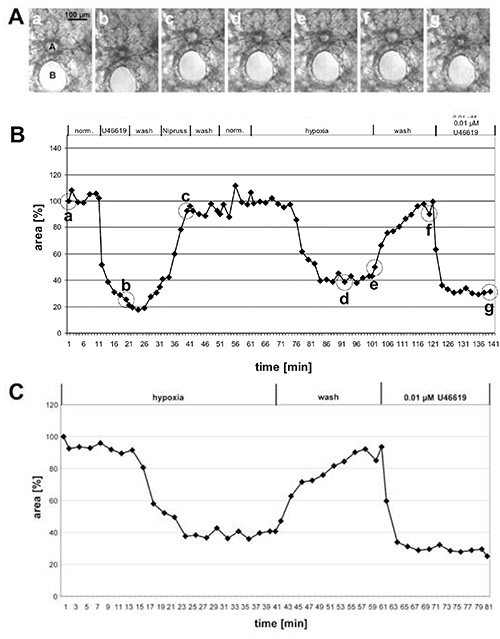
Abbildung 1. Messung der HPV einer großen Vor-Acinar-Arterie. (A) Phasenkontrastbilder einer querschnitts-Präacinararterie (a), die in unmittelbarer Nähe zu einem querschnittsigen Bronchus verläuft (B). Die Bilder werden zu den in (B) angegebenen Zeitpunkten durch Kreise aufgenommen: zu Beginn der Messung (a), am Ende der Behandlung mit U46619 (b), am Ende der Exposition gegenüber Nipruss (c), nach 30 oder 40 min im hypoxisch vergasten Medium (d, e), nach dem Waschen mit normoxischem Vergasten Medium (f) und nach der endgültigen Anwendung von U46619 (g). Im Graphen (B) werden Änderungen des Luminalbereichs gegen die Zeit dargestellt, während die Luminalfläche zu Beginn des Experiments als 100% definiert ist und Vasokonstriktion/-dilatation als relative Werte angegeben werden. In diesem Fall induziert Hypoxie eine 60%ige Reduktion der Luminalfläche. (C) Für eine klarere Darstellung der hypoxischen Reaktion ist die Anfangsphase des Experiments, in dem die Vasoreaktivität getestet wurde, nicht enthalten, aber der unmittelbar vor der Exposition gegenüber reduziertem Sauerstoff ermittelte Wert wird auf 100 % festgelegt (siehe auch Abbildung 2). Klicken Sie hier, um ein größeres Bild anzuzeigen.
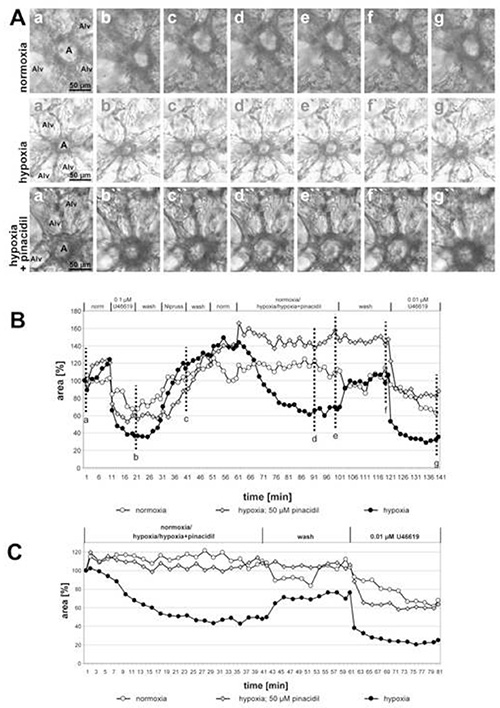
Abbildung 2. Auswirkungen von Pinacidil (ein nichtselektiver Öffner von mitochondrialen ATP-empfindlichen Kaliumkanälen; MitoKATP) auf HPV kleiner intra-acinararterien. (A) Intra-acinar arterien (a) befinden sich an Denkbögen von Alveolarsepta. Alv = alveolus. Die Reihenfolge der einzelnen Bedingungen, die in diesen Experimenten angewendet werden, ist in der Überschrift des Graphen (B) angegeben. Hypoxische Exposition wird in Gegenwart oder Abwesenheit von 50 'M Pinacidil durchgeführt. Kontrollinkubationen werden mit normoxisch vergastem Medium durchgeführt. Die in (A) gezeigten Bilder werden zu Beginn der Messung (a, a', a") am Ende der Behandlung mit U46619 (b, b', b"), am Ende der Exposition gegenüber Nipruss (c, c', c"), nach 30 oder 40 min in hypoxischem oder normoxischem Vergastenmedium (d, d', d"; e, e', e"), nach dem Waschen mit normoxischem Vergastenmedium (f, f', f"), und nach der endgültigen Anwendung von U46619 (g, g', g"). Für eine klarere Darstellung der Reaktion auf Normoxia/Hypoxie/Hypoxia+Pinacidil werden die Unmittelbar vor der Exposition gegenüber normoxisch-/hypoxisch-vergastem Medium auf 100% (C) festgelegt. Klicken Sie hier, um ein größeres Bild anzuzeigen.
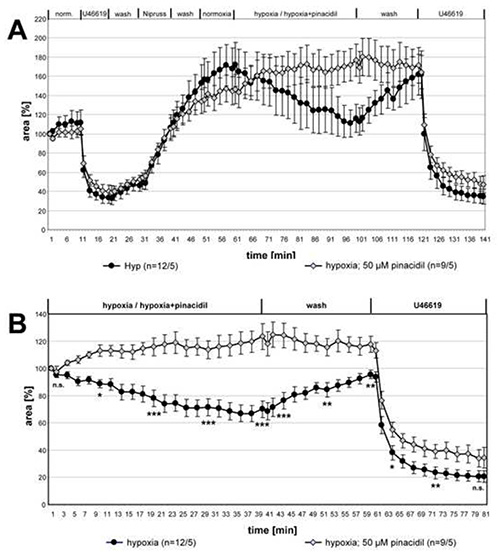
Abbildung 3. Hemmung von HPV durch Pinacidil. Die Aufnahmen von kleinen intra-acinar Arterien, die hypoxischen vergastem Medium mit oder ohne 50 M Pinacidil ausgesetzt sind, werden zusammengefasst und als Mittel ± SEM dargestellt. In (A) werden die vollständigen Aufzeichnungen in (B) die relativen Daten in Bezug auf den Wert zu Beginn der hypoxischen Inkubation angezeigt. In PCLS, die hypoxisch-vergastem Medium mit Pinacidil ausgesetzt sind, ist keine Vasoreaktivität nachweisbar. Vasokonstriktion durch U46619 induziert wird nicht von dem Medikament betroffen. "n" in Klammern bezieht sich auf die Anzahl der Arterien/Anzahl der Tiere, aus denen PCLS hergestellt wurden. Mit anderen Worten, die erste Zahl beschreibt die Anzahl der analysierten Lungenabschnitte und die zweite Zahl gibt die Anzahl der Mäuse an, aus denen diese Abschnitte hergestellt wurden. Zu den gegebenen Zeitpunkten werden die Unterschiede zwischen beiden Gruppen auf Signifikanz getestet. n.s.: nicht signifikant, *: p≤0.05, **: p≤0.01, ***: p≤0.001. Klicken Sie hier, um ein größeres Bild anzuzeigen.
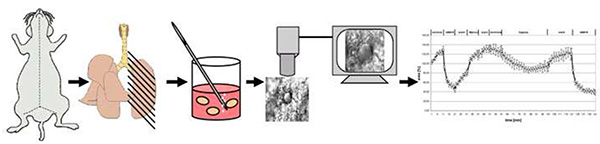
Abbildung 4. Schematische Übersicht über die Methode. Kurz gesagt, Mäuse werden durch zervikale Dislokation getötet. Nach dem Öffnen der Brust werden die Lungen mit niedrigem Schmelzpunkt Agarose gefüllt und nach dem Abkühlen in 200 m dicke Präzisionsschnitt-Lungenscheiben (PCLS) geschnitten. Nach dem Entfernen der Agarose bei 37 °C wird ein PCLS in die Durchfluss-Superfusionskammer übertragen, in der sie normoxischen Oder mittelvergasten Mittel mit 1%O2ausgesetzt ist. Vasoreaktivität wird als Veränderungen im Luminalbereich aufgezeichnet. Klicken Sie hier, um ein größeres Bild anzuzeigen.
Diskussion
Die isoliert eatierte und durchblutete Mauslunge ist ein hervorragendes Modell für die Analyse der physiologischen Reaktion des Lungengefäßsystems auf Veränderungen der Sauerstoffversorgung und ermöglicht unter anderem die kontinuierliche Messung des Lungenarteriendrucks1. Dieses Modell erlaubt jedoch nicht die Identifizierung und Analyse dieser Vaskulärensegmente, die die stärkste Reaktion auf Hypoxie zeigen. Dies ist der Vorteil unserer videomorphometrischen PCLS-Analyse, die die Messung von HPV einzelner Arterien mit Innendurchmessern von 20-100 m erleichtert. PCLS stellen ein attraktives In-vitro-Modell dar, da sie dem Organ, aus dem sie hergestellt werden, sehr ähnlich sind. Im Gegensatz zu Zellkultursystemen sind alle Zelltypen in ihrer ursprünglichen Gewebe-Matrix-Konfiguration vorhanden. Darüber hinaus reicht eine Lunge für die Vorbereitung vieler PCLS aus, so dass zumindest teilweise Experimente durch die Verwendung von Abschnitten aus derselben Maus standardisiert werden können. Nach dem 3R-Konzept (Reduktion, Verfeinerung und Ersatz von Labortieren in den Biowissenschaften) von Russell und Burch23 spricht diese Tatsache auch für den Einsatz von PCLS.
Allerdings muss man bedenken, dass das Gewebe durch Schneiden mit einem Vibratome und Längssignalsignalztion zum Beispiel über die Endothelzellen, wie von Kübler et alpostuliert, geschädigt wird. 14 ist nicht mehr möglich.
Ursprünglich wurden PCLS hauptsächlich für biochemische, pharmakologische und toxikologische Studien eingesetzt, aber in der Zwischenzeit werden sie auch zur Messung der Bronchialkontraktilität, der Mukocilia- und Gefäßreaktionen verwendet (für Bewertungen siehe Sanderson20 und Davies21). Held et al. haben eine Studie durchgeführt, in der sie die Modelle der isolierten perfundierten und belüfteten Mauslunge und von PCLS24verglichen haben. Sie stellten durch die Analyse der Reaktionen von Atemwegen und Lungengefäßen auf eine Vielzahl von endogenen Mediatoren fest, dass wichtige Eigenschaften der gesamten Lunge in PCLS beibehalten wurden.
Bei PCLS werden hypoxische Erkrankungen nicht über die Atemwege wie in der intakten Lunge festgestellt, sondern durch Inkubation des Lungenabschnitts im hypoxisch-vergasten Medium. Wir haben den Sauerstoffpartialdruck (pO2) des Mediums vorgasiert mit 1%O2, 5,3%CO2, 93,7% N2 und mit 21%O2, 5,3%CO2, 73,7%N2, mit einem Blutgasanalysator analysiert. Unmittelbar vor der Einspeisung in die Perfusionskammer betrug der pO2 des hypoxisch vergasten MEM 40 mmHg und das des normoxisch vergasten Mediums 160 mmHg6. In der intakten Lunge wird HPV induziert, wenn alveolares pO2 unter 50 mmHg25fällt, eine Situation, die offensichtlich durch die Anwendung von hypoxisch-vergastem Medium nachgeahmt werden kann. Unsere Daten über das Ausmaß der HPV entsprechen gut den Ergebnissen, die mit einem anderen experimentellen Ansatz erzielt wurden. Yamaguchi et al. haben isolierte Rattenlungen aufgetragen, um Mikrogefäße mit einem Durchmesser von 20-30 m durch konfokale Laserscanning-Lumineszenzmikroskopie in Echtzeit zu untersuchen, gekoppelt mit einer hochempfindlichen Kamera mit einem Bildverstärker10. Sie beobachteten eine mittlere Reduktion des Durchmessers um 2,7 m nach Exposition der Lunge gegenüber Hypoxie. Man kann berechnen, dass eine 20%ige Reduzierung der Leuchtdichtefläche, wie wir sie in unserem System messen, einer etwa 15%igen Verringerung des Durchmessers entspricht.
In unseren Experimenten haben wir die Arterien als Vor- bzw. Intra-Acinargefäße mit Innendurchmessern von 40-100 m bzw. 20-40 m klassifiziert. Beim Menschen erfolgt der Übergang von muskulären zu nichtmuskulären Arterien im Durchmesserbereich von 70-100 m. Bei Mäusen sind glatte Muskelzellen bis zu einem Außendurchmesser von 20 m26vorhanden. Aus diesem Grund ist es nicht möglich, Arterien mit Durchmessern unter 20 m zu analysieren, da sie auf der Grundlage des Phasenkontrastbildes nicht zuverlässig identifiziert werden können. Am anderen Ende der Skala sind Gefäße mit Durchmessern von mehr als 100 m in PCLS kaum zu finden und werden häufig aus dem umgebenden Gewebe entfernt.
Tatsächlich werden eine Reihe molekularer Kandidaten als molekularer Sauerstoffsensor(n) oder als Bestandteil der Signalkaskade diskutiert, was zu HPV führt (für eine Überprüfung siehe Sylvester et al. 4). Sobald geeignete Knockout-Mäuse verfügbar sind, kann die Videomorphometrie zur Analyse der Vasoreaktivität von Prä- und Intra-Acinar-Arterien im Vergleich zu Wildtieren verwendet werden. Jedoch, PCLS wurden auch für andere Probleme verwendet: Faro et al. verwendet, um die Entwicklung der Endothel-abhängigen Dilatation in der Lunge nach der Geburt zu charakterisieren29 und PCLS von Meerschweinchen, die täglich Rauch oder Luft ausgesetzt 2 Wochen wurden verwendet, um die Auswirkungen von Zigarettenrauch auf Vasoreaktivität durch Induktion der endothelialen Dysfunktion30zu demonstrieren.
Kritische Schritte innerhalb des Protokolls
In unseren Experimenten klassifizierten wir die Arterien als Pre-Acinar (Innendurchmesser von 40-100 m) und Intra-Acinar (Innendurchmesser von 20-40 m). Insbesondere für die Herstellung von Lungenabschnitten, die für die Analyse größerer Gefäße verwendet werden sollten, ist es wichtig, dem Perfusionspuffer Natriumnitroprussid hinzuzufügen. Dieses Medikament verhindert die Kontraktion der Gefäße während der Probenvorbereitung und damit ihre Abzocke aus dem umgebenden Gewebe, was zu einer unvollständigen Vasodilatation führt. Natriumnitroprussid im Perfusionspuffer ist nicht so wichtig für die Herstellung von Lungenabschnitten, die für die Analyse von kleinen Arterien verwendet werden sollten, weil sie stark in der Alveolar-Septa verankert sind.
Alle Experimente sollten mit Inkubationen begonnen werden, bei denen die Reaktivität der Arterien getestet wird. Selten erhielten wir Lungenpräparate, bei denen keine Reaktion von Gefäßen auf Auftragnehmer oder Dilatoren nachweisbar war. Wir wissen nicht, warum dies: Vielleicht war das Volumen der in die Lunge gefüllten Agarose zu groß oder zu niedrig, so dass das Schneiden des Organs in PCLS nicht optimal war. Alternativ ist vorstellbar, dass die Agarose während des Instillations zu schnell abkühlt, was zu einer schädlichen Scherspannung führt. Für den Fall, dass in einem einzelnen PCLS keine tragfähige Arterie nachweisbar ist, muss der Abschnitt verworfen und durch einen anderen ersetzt werden.
Die Entscheidung über die Lebensfähigkeit einer Verkehrsader wurde auf der Grundlage der Antwort auf U46619 getroffen. Die Anwendung von U46619 bei einer Konzentration von 0,1 m induziert eine Vasokonstriktion, die nach einer Übung direkt in der Bildsequenz auf dem Bildschirm sichtbar ist. Da es einige Abweichungen in der Vasoreaktivität gibt, untersuchen wir die Auswirkungen eines Medikaments auf HPV, indem wir die Vasoreaktion in Lungenabschnitten messen, die dem Medikament oder dem Medium allein ausgesetzt sind.
HPV einer einzelnen Arterie ist im Mikroskop oft kaum nachweisbar und führt im Durchschnitt zu einer Reduktion der Luminalfläche um etwa 20-30%. Kleine Veränderungen des Durchmessers einer Arterie haben jedoch einen deutlichen Input für den Strömungswiderstand. Gemäß der Gleichung "R = 1/r4"mit R=Widerstand und r=Radius ist der Strömungswiderstand umgekehrt proportional zur vierten Kraft des Radius. Lassen Sie mich ein Beispiel nennen: Eine "ideale Arterie", die einen kreisförmigen Querschnitt mit einem Durchmesser von 40 m (r=20 m) aufweist, hat eine Luminalfläche von ca. 1.260m2. Wenn die Luminalfläche um 20 % reduziert wird, können wir berechnen, dass der Durchmesser des Behälters um 10,5 % auf 35,8 m (r=17,9 m) reduziert wird. Nach der oben genannten Gleichung würde der Strömungswiderstand dieses Gefäßes von 6,25 x 10-6 auf 9,71 x 10-6, d. h. um etwa 55 % steigen. Im Falle einer Verkleinerung der Luminalfläche um 30 % würde der Radius um etwa 16 % abnehmen, aber der Strömungswiderstand würde um etwa 100 % zunehmen. Obwohl diese Berechnungen eine übersimplifizierungsgemäß ezipierte, bei der ein laminarer Blutfluss und eine Gefäßform eines starren Rohres angenommen werden, ist es ein Hinweis auf die Auswirkungen bereits geringfügiger Veränderungen des Durchmessers auf den Strömungswiderstand.
Offenlegungen
Autoren haben nichts zu verraten.
Danksagungen
Diese Forschung wird vom Exzellenzcluster Cardio-Pulmonary System gefördert.
Materialien
| Name | Company | Catalog Number | Comments |
| Vibratome "Microm HM 650 V" | Microm/Thermo Fisher Scientific, Schwerte, Germany | ||
| Microwave oven | Bosch, Frankfurt, Germany | HMT 702C | |
| Heating cabinet | Heraeus/Thermo Fisher Scientific, Schwerte, Germany | ||
| Flow-through superfusion chamber | Hugo Sachs Elektronik, March, Germany | PCLS-Bath Type: 847 SN:4017 | |
| Upright inverted microscope equipped with 4X, 10X, 20X, and 40X objectives | Leica, Wetzlar, Germany | ||
| CCD-camera | Stemmer Imaging, Puchheim, Germany | ||
| Peristaltic pump Minipuls 3 | Gilson, Limburg-Offheim, Germany | ||
| Water bath “Universal Wasserbad Isotem 205” | Thermo Fisher Scientific, Schwerte, Germany | 9452450 | |
| Gas tight tubes Tygon R3603-13 Øi: 3/32 in, Øa: 5/32 in, wall: 1/32 in | VWR, Darmstadt, Germany | ||
| Various scissors and forceps | |||
| Sewing cotton | |||
| 2 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| 50 ml Syringe | Braun-Melsungen AG, Melsungen, Germany | ||
| Flexible plastic pipe of an IV indwelling cannula “IntrocanR-W” (cannula 20 G x 1 ¼ in, 1.1 x 32 mm) | Braun-Melsungen AG, Melsungen, Germany | 4254112B | For instillation of the agarose into the lung |
| Cannula 21 G x 4 ¾ in; 0.8 x 120 mm | Braun-Melsungen AG, Melsungen, Germany | 4665643 | For bubbling of the medium |
| Cannula Nr. 17, 24 G x 1, 0.55 x 25 mm | Terumo, Eschborn, Germany | NN 2425 88DSF18 | For lung perfusion |
| Normoxic gas mixture (21% O2, 5.3% CO2, 73.7% N2) | Linde, Hildesheim, Germany | ||
| Hypoxic gas mixture (1% O2, 5.3% CO2, 93.7% N2) | Linde, Hildesheim, Germany | ||
| HEPES | Sigma, Deisenhofen, Germany | H 4034 | |
| NaCl | Roth, Karlsruhe, Germany | 3957.1 | |
| KCl | Merck, Darmstadt, Germany | 1.04936.0500 | |
| MgCl2•6H2O | Merck, Darmstadt, Germany | 1.05833.0250 | |
| CaCl2•2H2O | Merck, Darmstadt, Germany | 1.02382.0500 | |
| Glucose D-(+) | Sigma, Deisenhofen, Germany | G 7021 | |
| Low melting point agarose | Bio-Rad, Munich, Germany | 161-3111 | |
| Heparin-sodium | Ratiopharm, Ulm, Germany | 5120046 | |
| Phenolred-free minimal essential medium (MEM) | Invitrogen, Darmstadt, Germany | 5120046 | |
| 70% EtOH for desinfection | Stockmeier Chemie, Dillenburg, Germany | ||
| Superglue | UHU, Bühl/Baden, Germany or from a supermarket | ||
| U46619 (a thromboxane analog) | Calbiochem/Merck, Darmstadt, Germany | 538944 | |
| Sodium nitroprusside (Nipruss) | Schwarz Pharma, Monheim, Germany | 5332804 | |
| Optimas 6.5 software | Stemmer, Puchheim, Germany | ||
| SPSS 19 | AskNet, Karlsruhe, Germany |
Referenzen
- Weissmann, N., Akkayagil, E., et al. Basic features of hypoxic pulmonary vasoconstriction in mice. Respir. Physiol. Neurobiol. 139, 191-202 (2004).
- Leach, R. M., Hill, H. M., Snetkov, V. A., Robertson, T. P., Ward, J. P. T. Divergent roles of glycolysis and the mitochondrial electron transport chain in hypoxic pulmonary vasoconstriction of the rat: identity of the hypoxic sensor. J. Physiol. 536, 211-224 (2001).
- Tabuchi, A., Mertens, M., Kuppe, H., Pries, A. R., Kuebler, W. M. Intravital microscopy of the murine pulmonary microcirculation. J. Appl. Physiol. 104 (2), 338-3346 (2008).
- Sylvester, J. T., Shimoda, L. A., Aaronson, P. I., Ward, J. P. Hypoxic pulmonary vasoconstriction. Physiol. Rev. 92 (1), 367-520 (2012).
- Schumacker, P. T. Lung cell hypoxia: role of mitochondrial reactive oxygen species signaling in triggering responses. Proc. Am. Thorac. Soc. 8 (6), 477-4784 (2011).
- Paddenberg, R., König, P., Faulhammer, P., Goldenberg, A., Pfeil, U., Kummer, W. Hypoxic vasoconstriction of partial muscular intra-acinar pulmonary arteries in murine precision cut lung slices. Respir. Res. 29 (7), 93-109 (2006).
- Paddenberg, R., et al. Mitochondrial complex II is essential for hypoxia-induced pulmonary vasoconstriction of intra- but not of pre-acinar arteries. Cardiovasc. Res. 93 (4), 702-710 (2012).
- Wang, L., Yin, J., et al. Hypoxic pulmonary vasoconstriction requires connexin 40-mediated endothelial signal conduction. J. Clin. Invest. 122 (11), 4218-4230 (2012).
- Archer, S. L., Huang, J. M., et al. Differential distribution of electrophysiologically distinct myocytes in conduit and resistance arteries determines their response to nitric oxide and. 78, 431-442 (1996).
- Yamaguchi, K., Suzuki, K., et al. Response of intra-acinar pulmonary microvessels to hypoxia, hypercapnic acidosis, and isocapnic acidosis. Circ. Res. 82, 722-728 (1998).
- Bennie, R. E., Packer, C. S., Powell, D. R., Jin, N., Rhoades, R. A. Biphasic contractile response of pulmonary artery to hypoxia. Am. J. Physiol. 261(2 Pt. 1, 156-163 (1991).
- Glazier, J. B., Murray, J. F. Sites of pulmonary vasomotor reactivity in the dog during alveolar hypoxia and serotonin and histamine infusion). J. Clin. Invest. 50 (12), 2550-2558 (1971).
- Bhattacharya, J., Staub, N. C. Direct measurement of microvascular pressures in the isolated perfused dog lung. Science. 210, 327-328 (1980).
- Kuebler, W. M. Real-time imaging assessment of pulmonary vascular responses. Proc. Am. Thorac. Soc. 8 (6), 458-4565 (2011).
- Martin, C., Uhlig, S., Ullrich, V. Videomicroscopy of methacholine-induced contraction of individual airways in precision-cut lung slices. Eur. Respir. J. 9 (12), 2479-2487 (1996).
- Grimminger, F., Spriestersbach, R., Weissmann, N., Walmrath, D., Seeger, W. Nitric oxide generation and hypoxic vasoconstriction in buffer-perfused rabbit lungs. J. Appl. Physiol. 78, 1509-1515 (1995).
- Ng, L. C., Kyle, B. D., Lennox, A. R., Shen, X. M., Hatton, W. J., Hume, J. R. Cell culture alters Ca2+ entry pathways activated by store-depletion or hypoxia in canine pulmonary arterial smooth muscle cells. Am. J. Physiol. Cell Physiol. 294 (1), 313-323 (2008).
- Fehr, D. M., Larach, D. R., Zangari, K. A., Schuler, H. G. Halothane constricts bovine pulmonary arteries by release of intracellular calcium. J. Pharmacol. Exp. Ther. 277 (2), 706-713 (1996).
- Oshima, Y., Ishibe, Y., Okazaki, N., Sato, T. Isoflurane inhibits endothelium-mediated nitric oxide relaxing pathways in the isolated perfused rabbit lung. Can. J. Anaesth. 44 (10), 1108-1114 (1997).
- Sanderson, M. J. Exploring lung physiology in health and disease with lung slices. Pulm. Pharmacol. Ther. 24 (5), 452-465 (2011).
- Davies, J. . Replacing Animal Models: A Practical Guide to Creating and Using Culture-based Biomimetic Alternatives (Google eBook. , 57-68 (2012).
- Müller-Redetzky, H. C., Kummer, W., et al. Intermedin stabilized endothelial barrier function and attenuated ventilator-induced lung injury in mice). PLoS One. 7 (5), (2012).
- Russell, W. M. S., Burch, R. L. The Principles of Humane Experimental Technique. Universities Federation for Animal Welfare. , (1959).
- Held, H. D., Martin, C., Uhlig, S. Characterization of airway and vascular responses in murine lungs. Br. J. Pharmacol. 126 (5), 1191-1199 (1999).
- Köhler, D., Schönhofer, B., Voshaar, T. Pneumologie: Ein Leitfaden für rationales Handeln in Klinik und Praxis. Thieme Verlag. , 198-19 (2009).
- Will, J. The Pulmonary Circulation. in Health and Disease. Elsevier Science, p49. , (1987).
- Faro, R., Moreno, L., Hislop, A. A., Sturton, G., Mitchell, J. A. Pulmonary endothelium dependent vasodilation emerges after birth in mice. Eur. J. Pharmacol. 567 (3), 240-244 (2007).
- Wright, J. L., Churg, A. Short-term exposure to cigarette smoke induces endothelial dysfunction in small intrapulmonary arteries: analysis using guinea pig precision cut lung slices. J. Appl. Physiol. 104, 1462-1469 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten