需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
热生物催化:等温滴定量热法表征酶促反应
摘要
等温滴定量热法测量热流释放或吸收的化学反应。该方法可用于定量酶催化。在本文中,该协议有助于建立,运行试验和数据分析通常被描述,并应用于酶水解尿素由刀豆脲酶的特性。
摘要
等温滴定量热法(ITC)是一个良好描述的技术,其测量过程中的化学反应的热释放或吸收,用它作为一个内在探头几乎以表征每一个化学过程。如今,这种技术被广泛地应用,以确定生物分子的结合平衡的热力学参数。此外,ITC已经被证明是能够直接测量酶促反应的动力学和热力学参数(K 猫 ,K M,△H),即使该应用程序仍是开发不足的。作为热变化过程中酶催化自发地发生,ITC,不需要该系统的下分析的任何修改或标签,并且可以在溶液中进行。此外,该方法需要的材料少量。这些特性使得德祥一个非常宝贵的,强大的和独特的工具来研究酶动力学的几个应用,如,例如,药物发现。
K值猫和尿素由刀豆 (刀豆)脲酶酶水解的K M。进行反应的内在摩尔焓(ΔHint)的计算。由此得到的值与文献中报道的先前的数据相一致,这表明该方法的可靠性。
引言
定量测定生化反应提供了深入了解生物过程在生命的基础。量热法提供了一种无标记的方法来定量地表征溶液中的几乎所有的化学反应。这种技术测量热释放或吸收随着时间的推移,因此是一种普遍的检测系统和一个非常方便的方法来量化反应的分子( 即结合热力学),以及测量的反应速率( 即动力学)的量。特别是,等温滴定量热法(ITC)已被采纳为首选方法来表征生物分子平衡的热力学,涉及蛋白质-配体,蛋白质-蛋白质,蛋白质-金属离子与蛋白-DNA相互作用1-6。此外,国际贸易中心提供动力学信息的能力,使其成为一个非常强大的系统来衡量酶的催化作用,虽然这个应用程序的潜力仍然低估了7-9。
米氏方程10是酶反应的定量描述,因为它提供了反应速率和底物浓度之间的关系,这取决于2动力学参数:米氏常数(K M)和催化速率常数(k 猫 ) 。 第 k 猫 / K M比值被称为一种酶的催化效率。在实践中,对于特定的反应测定K M和 k 猫提供催化的完整描述。
在一个典型的酶反应( 图1),在衬底(S)相互作用的酶(E)形成的酶-底物(ES)的配合物,其随后被激活进入过渡状态(ES *)。后者被转化成酶产品(EP)的复杂的最终解离。这些步S是由以下的反应说明。
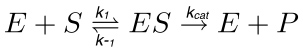 (1)
(1)
其中,k 1是速率常数为ES复合物中,k -1的形成是速率常数为ES复合物的解离,而K是猫的催化速率常数或周转数。
根据米氏方程10中 ,该反应的速率可以计算为:
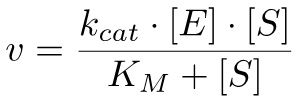 (2)
(2)
其中K M =(K-1 + K 猫 )/ k1 和 k2 的猫 = V 最大 / [E], 用 v max均当所有的酶结合到基体达到的最大速度。
等温滴定热量计是在本研究中用于表征尿素的酶水解仪器。该仪器由含有2杜撰形细胞( 图1)的绝热屏蔽的。这些被连接到外部以窄接入管中。样品池( 约 1.4ml)中装入与酶溶液,同时基准单元通常被充满水或与用于分析的溶剂。一种旋转式注射器用长针和相连的搅拌桨,通常含有约 0.3ml的底物溶液,装在样品池。一种热电装置测量温度的样品和参考单元之间的差异,采用了“小区反馈网络”,它通过增加或减少热保持这种差异为零。在实验过程中,衬底被注入到在一个恒定的温度选择的酶溶液。当ENzymatic发生反应,热释放或吸收的量是成比例的转换成产物的分子底物分子的数量。另外,热气流的速度直接相关,该反应的速率。测得的数据,表现为发热微量的( 图1)的偏差从初始基线,表示热功率(μcal/秒)供给由仪器的样品池,其正比于所述试样盒中发生的热流量随着时间的推移。
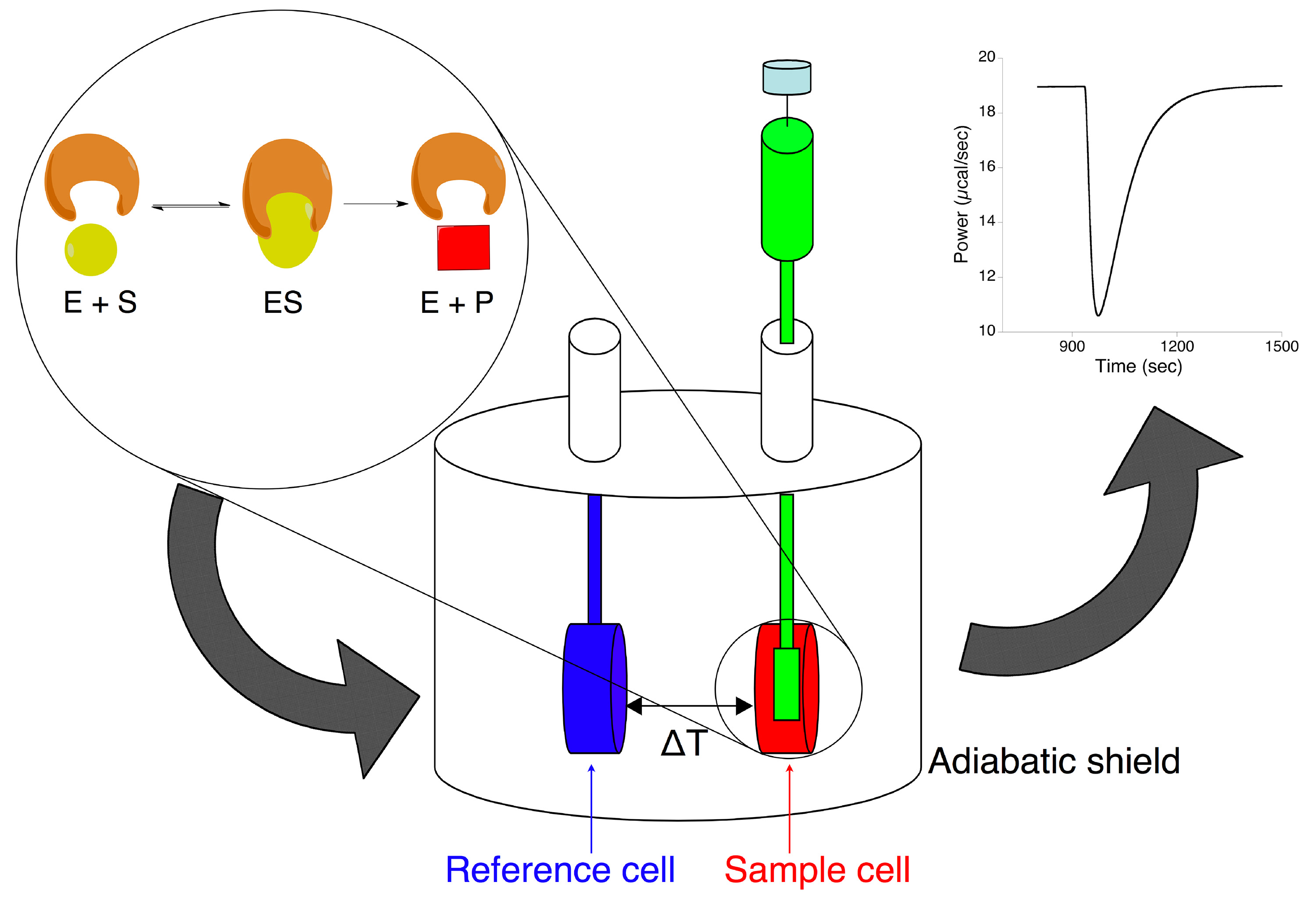
图1。的等温滴定量热仪来研究酶反应的示意图。发生后的衬底(在注射器)的滴定到酶溶液(在样品池)的结果在该疗法的一个变化的酶促反应由量热仪,需要保持样品池和参比电极常数之间的温度差正常释放动力。 点击这里查看大图。
总体上,热变化(Q)是正比于反应(ΔH)和生成(n)的,而这又是通过总体积时代赋予的浓度产物的摩尔数的摩尔焓:
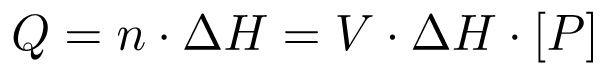 (3)
(3)
该产物的形成随时间(DP / dt)的,对应于反应速率,因此,可以与以上通过关系在同一时间(的dQ / dt)的产生的热量:
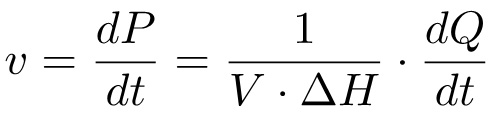 (4)
(4)
根据这个公式,以便获得一个米氏绘制它需要测量ⅰ)的总摩尔焓ΔH,以及ii)的热流动的dQ / dt的在不同的底物浓度。通常,这是在两个不同的实验进行:在第一个实验中( 方法1,M1),其中所述衬底中注入酶溶液,并加热为完整的底物转化的测量;在第二个实验( 方法2,M2),底物的多次注射执行和热产生率的测量是在不同的底物浓度。这两组数据的数据足以计算得出的动力学参数K M和 k 的猫 。
在本文章中,一般的协议来确定动力学参数,使用国际贸易中心进行酶促反应描述。我们通过刀豆尿素施用的方法,以尿素水解本身作为参照系。使用这种方法得到的结果和文献报道的数据之间的吻合证明了这种方法的可靠性。
研究方案
1。样品的准备
- 制备2毫升酶溶液和0.5ml的每个实验运行的底物溶液。在具有相同的组合物到基片加入过程中尽量减少稀释和混合的热缓冲液稀释浓缩的储备溶液酶和底物。
- 选择的缓冲液条件是足够的,以防止试验过程中pH值的变化。例如,20mM的HEPES pH值为7是足够的测量值在中性pH值。
注意:如果涉及质子交换,所使用的缓冲液的质子化焓必须考虑的,因为它们会影响该反应的测量ΔH。根据分析系统上的缓冲器或添加剂分子的可能的具体效果,必须考虑到。如果有机溶剂( 如 DMSO)中包含的酶溶液,在完全相同的浓度添加到他们的底物溶液。 - 对于M1实验,开始与酶浓度在nM范围( 例如 1 nm)和具有底物浓度的数量级至少三个数量比酶浓度和上面的K M为高。
- 对于M2的实验,开始在PM-nM范围酶浓度( 如 15分)。在注射器中底物浓度的MM范围( 如 400毫米)。
注:在单次注射M1实验,浓度应足以达到总底物转化成产物在实验时间。因此,酶的浓度取决于酶速率:如果正在研究中的酶具有低介电常数猫 ,更高的酶浓度(高达10μM)必须被使用。另一方面,在M2实验中所用的酶浓度必须保证注入的基片是仅轻微(少于5%)消耗,并且这种酶反应在稳定状态。出于这个原因,较高的酶效率,所需的酶浓度越低。在实验结束时,在样品池的底物浓度应比K M高。
- 选择的缓冲液条件是足够的,以防止试验过程中pH值的变化。例如,20mM的HEPES pH值为7是足够的测量值在中性pH值。
- 仔细检查酶和底物浓度与适当的分析程序( 如 280nm处的吸光度,比色,BCA检测11,这是需要获得热力学和动力学参数的准确和可靠的计算。
- 测量溶液的pH值,并验证该实验条件(±0.05个pH单位)在这两个酶和底物溶液的pH值不匹配是最小的。
2。进行实验
注意:相同的过程必须既为M1和M2的实验中,其中依次执行的其他应用。
- 验证样品池和进样注射器,根据制造商的被清洗说明。填装有蒸馏水的仪器装载注射器,轻轻地插入在采样单元的针,填充单元以及使用该注射器除去液体。使用这种方法,两次,用蒸馏水与缓冲洗样品池和的两倍。
- 加载样本细胞用2毫升酶溶液使用装载注射器,小心地避免形成气泡。慢慢地将溶液注入到电池直到它泄漏出来的干细胞的顶部。产生ca的冲刺0.25毫升溶液进入细胞。重复两次。这个步骤除去截留在样品池气泡。
- 放置在装载注射器的针上的细胞干细胞和细胞口之间的壁架和除去任何过量的溶液。
- 启动VP-Viewer程序,并从计算机接口,平衡国际贸易委员会对仪器的温度3°C以下所需的实验温度。这是必要的,以避免长期平衡期间在实验前,由于被动器乐的冷却装置。
- 填充基准单元用蒸馏水与上述相同的过程。当缓冲器具有高离子强度或高重量克分子渗透压浓度是在样品溶液中,在相同的缓冲液应该被用来作为一个参比溶液。
- 链接的塑料注射器注入注射器的填充口,用一个薄的硅管。填充注射器将针尖入水中并制订,直到水从顶部填充端口,表明注射器已满。然后从水中将注射器针尖和制订空气,排空注射器。与此过程中,用缓冲液冲洗注射器,并通过该系统吸入空气。随后,将注射针在含有0.5毫升底物溶液的窄管,小心规划并完全填充注射器,留下少量的溶液在试管的底部。
- 从电脑界面,按“关闭加注口”。除去硅装弹管。按“清除和重新填充”按钮,以允许注射器赶走气泡,并驱逐他们回到本体溶液。重复两次。
- 移动注射器,擦拭在两侧,以消除任何液滴,然后将注射器的针头插入样本单元。
- 在计算机上,设置相应的运行参数。实验酶和底物的浓度可以被显示出来。
- 在M1的实验中,设置至少两个加法衬底的(5-30微升),以验证重复性。设置每个喷射之间的间隔时间( 例如 1,000秒)足够大,以确保接下来的加成前的热信号返回到基线。
- 在M2的实验中,设置多个( 如 15×5-10微升)注射。设置注射( 例如 180秒)使系统秒之间的时间间隔tabilize热功率为每次注射后的新基准。
注意:在M2实验注射之间的间隔时间应足够短,以避免一个显著量底物的转化,使稳定状态的条件下进行测量。 - 在M2的实验中,对在第一次注射,其对应值的随后的数据分析过程中被丢弃使用少量( 例如 2微升)。事实上,它往往呈现通过注射器尖端由于初始衬底扩散的工件,并用于捕获在注射器针的气泡的存在。
- 设定的基准功率,近似水平,其中基线将被放置在反应开始前,在20的值。然后定义实验的酶和底物浓度,并选择一个名称实验。
- 确定实验温度,通常在25℃下ITC允许2之间的工作温度 ℃和80℃。该实验是准备好运行。按“开始”按钮,开始实验。
- 一旦实验结束后,根据制造商的说明清洁样品细胞和注射器。
- 重复实验至少一个或两个以上的时间来检查该数据的再现性。
3。数据分析
- 从分析程序,点击“读数据”按钮,然后导航到M2进行实验的。ITC的文件所在的文件夹。点击“文件类型”的滚动下拉箭头,选择“酶试验(它?)”。随后,点击并打开M2实验。ITC文件。
- 获得从根据等式5整合M1实验的曲线反应的ΔH。
“宽度=”126“/>(5)- 点击“读数据”按钮,并选择该文件。ITC的货币供应量M1进行实验。使用地,划分轨迹包含每一个峰值不同部分,每个峰值保存为。OPJ文件。打开对应于第一峰的文件,从在单次注射M1实验,结合它并划分所得到的面积值的温谱图基线偏差产生的,表示在μcal,通过在样品池的最终底物浓度,单位为μM,以及由细胞体积表示升,确定,根据方程(5),该反应的ΔH。
- 重复同样的步骤对货币供应量M1实验的第二个高峰,并获得两个ΔH测量的平均值。
- 从M2的实验测量的原始基准和新的基线每次注射之后的差额确定的dQ / dt的 。转换电子xperimental数据到反应速率根据公式4,使用在M1实验中得到的焓值和拟合数据的米氏方程。
- 从分析程序,点击“读数据”按钮,并选择该文件。ITC对M2进行实验。点击“文件类型”的滚动下拉箭头,选择“酶试验(它?)”。
- 酶测定对话框打开,允许选择四种模式之一。从窗口 - 选择“只基板方法2”。
- 在ΔH窗口,表示ΔH的在步骤4.2中得到的值。
- 点击“浓度”按钮,以检查浓度值的拟合程序中被使用。点击“平均时间(P)”按钮。该对话框提供了机会,改变或接受默认值。此值表示每个注射前的时间离子,其中,仪表平均值的功率信号,以确定在每个底物浓度的功率电平。单击确定以确认默认值。
- 点击“零Y轴”按钮。光标变成一个十字,允许双击一个点,放置在y = 0。双击刚刚第一次注射点之前。
- 点击计算费用按钮。率作图的底物浓度,除以滴定样品池体积(考虑到稀释效应)中加入底物而得。此操作提供了可安装以获得K M和 k 猫一个典型的米氏情节。
- 如果某点应予以删除,选择“截断数据”按钮。移动数据标记来排除坏的数据点和双击标记或按回车键之一。
- 使用“调整到模拟”功能,以适应曲线,并获得的动力学常数。
结果
脲酶(EC 3.5.1.5;尿素水解酶)是古细菌,细菌,单细胞真核生物和植物中发现一个多亚基含镍酶。这种蛋白作用于有机氮矿化的最后步骤,催化尿素水解为氨和氨基甲酸盐,其自发地分解,得到氨和碳酸氢钠( 公式6)12的第二分子。
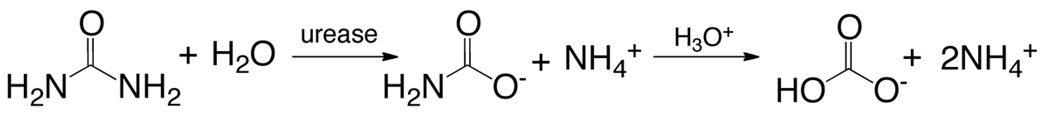 (6)
(6)
该反应导致的环境中,这是负?...
讨论
ITC的意义,研究酶的活性就现有的方法
除了其经典应用研究的结合平衡,等温滴定量热法提供了可靠的和快速的方法,使用的反应热作为探针来表征溶液中的酶反应,而不需要对系统的修改或标记。动力学参数K 猫和K M分别通过一组时间过程实验,其中的产物的形成(或底物消耗)在连续或不连续测定法进行监测,通常获得的?...
披露声明
作者什么都没有透露。
致谢
该专用肥产品公司(SFP)是公认的提供必要的资金用于这项研究。
材料
| Name | Company | Catalog Number | Comments |
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
参考文献
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research--survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。