A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
הביולוגי קטליזה חמה: Isothermal טיטרציה Calorimetry לאפיין תגובות אנזימטיות
In This Article
Summary
זרימת חום אמצעי calorimetry טיטרציה Isothermal שוחררה או נספגת בתגובות כימיות. בשיטה זו ניתן להשתמש כדי לכמת אנזים-קטליזה. במאמר זה, הפרוטוקול להתקנה אינסטרומנטלית, ניתוח ניסוי ריצה, ונתונים מתוארים בדרך כלל, ופנה לאפיון של הידרוליזה אוריאה האנזימטית של urease שעועית שקע.
Abstract
calorimetry טיטרציה Isothermal (ITC) הוא טכניקה שתוארה היטב שמודדת את החום שמשתחרר או נספג במהלך תגובה כימית, שימוש בו כבדיקה פנימית כדי לאפיין כמעט כל תהליך כימי. כיום, טכניקה זו מיושמת באופן נרחב כדי לקבוע פרמטרים תרמודינמיים של שיווי משקל מחייב biomolecular. בנוסף, ITC הודגם להיות מסוגל ישירות מדידת קינטיקה ופרמטרים תרמודינמיים (k חתול, K M, ΔH) של תגובות אנזימטיות, למרות שהיישום הזה הוא עדיין underexploited. כמו שינויים בחום באופן ספונטני להתרחש במהלך קטליזה האנזימטית, ITC אינו דורש כל שינוי או תיוג של המערכת תחת ניתוח וניתן לבצעו בתמיסה. יתר על כן, השיטה זקוקה לכמות קטנה של חומר. תכונות אלו הופכות את ITC כלי רב ערך, רב עוצמה והייחודית ללמוד קינטיקה אנזים במספר יישומים, כגון, למשל, גילוי תרופות.
ילדה = "jove_content"> בעבודה זו שיטה המבוססת על ITC ניסיוני לכמת קינטיקה ותרמודינאמיקה של תגובות אנזימטיות מתוארת ביסודיות. שיטה זו מיושמת על מנת לקבוע k חתול וK M של הידרוליזה אנזימטית של אוריאה על ידי ensiformis Canavalia urease (שעועית שקע). חישוב של אנתלפיה הפנימית טוחנת (int ΔH) של התגובה מתבצע. הערכים וכך השיגו עולים בקנה אחד עם נתונים קודמים שדווחו בספרות, הוכיחו את האמינות של המתודולוגיה.
Introduction
קביעת כמותית של תגובות ביוכימיות מספקת תובנות לגבי התהליכים הביולוגיים העומדת בבסיס של חיים. Calorimetry מציע מתודולוגיה ללא תווית לאפיין כמעט בכל תגובה כימית בפתרון כמותית. טכניקה זו מודדת את החום שמשתחרר או נספג לאורך זמן, ולכן מערכת זיהוי אוניברסלית ומתודולוגיה נוחה מאוד לכמת את כמות המולקולות מגיבים (כלומר תרמודינמיקה מחייבת), כמו גם על מנת למדוד את קצב התגובה (כלומר קינטיקה). בפרט, calorimetry טיטרציה בידוד התרמי (ITC) כבר אימץ כשיטת בחירה לאפיין את התרמודינאמיקה של שיווי משקל biomolecular, הכולל חלבון ליגנד, חלבונים, יוני חלבון מתכת ואינטראקציות החלבון-DNA 1-6. בנוסף, היכולת של ITC לספק מידע הקינטית הופכת אותו למערכת חזקה מאוד למדוד קטליזה אנזים, למרות שהפוטנציאל של יישום זה הוא עדייןלזלזל 7-9.
משוואת מיכאליס מנטן-10 היא תיאור כמותי של תגובות אנזימטיות, כפי שהוא מספק קשר בין קצב התגובה וריכוז המצע, תלוי בשני פרמטרים הקינטית: קבוע מיכאליס (K M) ושיעור קבוע קטליטי (k חתול) . K החתול / יחס K M הוא כאמור את היעילות הקטליטית של אנזים. בפועל, קביעת K M ו-k חתול לתגובה ספציפית מספק תיאור של קטליזה מלאה.
בתגובה האנזימטית טיפוסית (איור 1), מצע (S) אינטראקציה עם האנזים (E) ויוצר מורכבות אנזים-מצע (ES), שמופעל בהמשך למצב המעבר (ES *). זה האחרון הופך למורכב אנזים תוצר הלוואי (EP) שסופו של הדבר dissociates. צעד הבאיםים מתוארים על ידי התגובה הבאה.
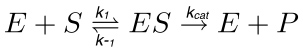 (1)
(1)
כאשר k 1 הוא השיעור קבוע להקמת קומפלקס ES, k -1 הוא שיעור קבוע לדיסוציאציה של קומפלקס ES, בעוד k החתול הוא שיעור קבוע קטליטי או מספר מחזור.
לפי משוואת מיכאליס מנטן-10, שיעור התגובה יכול להיות מחושב כ:
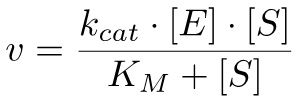 (2)
(2)
שבו חתול K = M (k -1 + K חתול) / k 1 ו-k = מקסימום v / [E], עם מקסימום v להיות המהירות המקסימלי הגיעה כאשר כל האנזים קשור למצע.
Calorimeter טיטרציה הבידוד התרמית היא הכלי המשמש במחקר זה כדי לאפיין את הידרוליזה אנזימטית של אוריאה. מכשיר זה עשוי ממגן adiabatic המכיל שני תאים בצורת שטבע (איור 1). אלה מחוברים לחלק החיצוני עם צינורות גישה צרים. התא המדגם (בערך 1.4 מיליליטר) טעון עם פתרון האנזים, ואילו תא ההתייחסות הוא בדרך כלל מלא במים או בממסים המשמשים לניתוח. מזרק מסתובב עם מחט ארוכה והנעת מערבבים המצורפות, המכיל בדרך כלל CA. 0.3 מיליליטר של תמיסת מצע, הוא רכוב על התא המדגם. מכשיר תרמואלקטרי מודד את ההבדל בטמפרטורה בין המדגם ותא ההתייחסות ו, באמצעות "רשת משוב סלולרי", הוא שומר על ההבדל הזה באפס על ידי הוספה או הפחתת חום. במהלך הניסוי, המצע מוזרק לתוך תמיסת האנזים בטמפרטורה שנבחרה קבועה. כאשר enתגובת zymatic מתרחשת, כמות החום שמשתחררת או נספגת היא פרופורציונלית למספר מולקולות מצע, שהומרו למולקולות מוצר. בנוסף, שיעור זרימת חום קשור באופן ישיר לשיעור של התגובה. נתונים שנמדדו, המופיע כסטייה של עקבות חום מנקודת ההתחלה ראשונית (איור 1), מייצגים את כוח התרמיות (μcal / sec) המסופק על ידי המכשיר הסלולרי המדגם, שהוא פרופורציונאלי לזרימת החום המתרחשת בתא המדגם לאורך זמן.
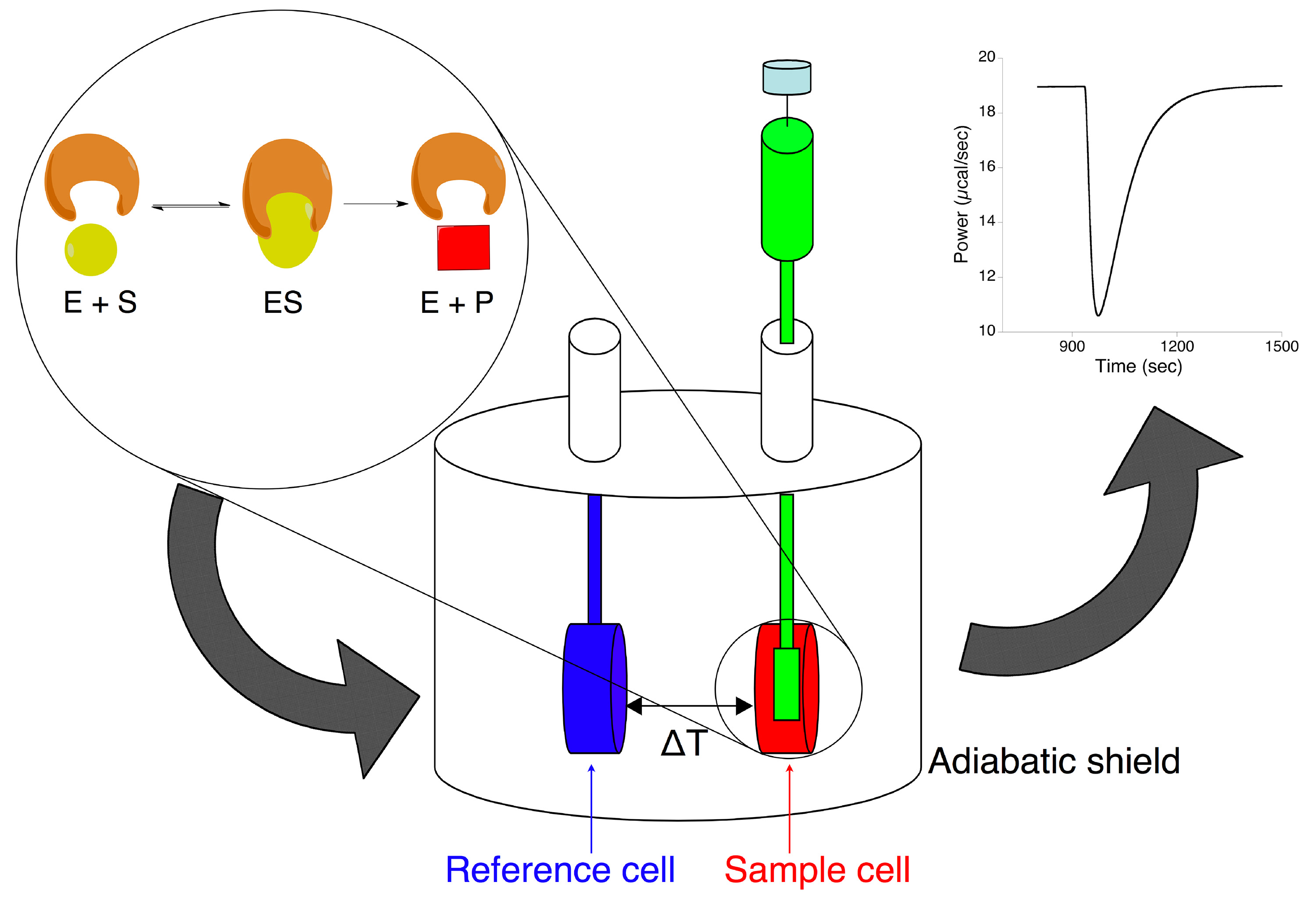
איור 1. ייצוג סכמטי של calorimeter טיטרציה בידוד התרמית ללמוד תגובות אנזימטיות. תגובה האנזימטית מתרחשת על טיטרציה של המצע (במזרק להזרקה) לתוך תמיסת האנזים (בתא המדגם) גורם לשינוי של יסכוח mal שפורסם על ידי calorimeter, דרוש כדי לשמור על הפער של טמפרטורה בין תא דגימה וקבוע תא התייחסות. לחץ כאן לצפייה בתמונה גדולה יותר.
בסך הכל, השינוי בחום (Q) הוא פרופורציונאלי לאנתלפיה הטוחנות של התגובה (ΔH) ומספר השומות של מוצר שנוצר (n), אשר בתורו ניתן על ידי בסך הכל הפעמים נפח הריכוז:
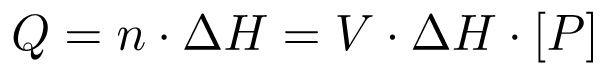 (3)
(3)
היווצרות המוצר לאורך זמן (DP / DT), אשר תואם את קצב התגובה, ולכן יכול להיות קשור לכמות החום שנוצר על אותו הזמן (DQ / dt) דרך היחס:
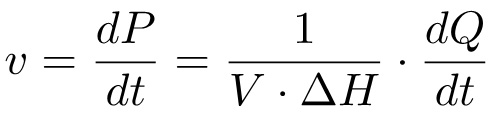 (4)
(4)
על פי משוואה זו, על מנת לקבל מיכאליס-מנטן עלילה יש צורך למדוד i) סך ΔH אנתלפיה טוחנת, וii) את זרימת DQ / dt החום בריכוזים מצע שונים. בדרך כלל, זה מתבצע בשני ניסויים שונים: בניסוי הראשון (שיטת 1, M1), המצע מוזרק לתוך תמיסת האנזים והחום לגיור מצע שלם נמדד; בניסוי השני (השיטה 2, M2), זריקות מרובות של מצע מבוצעות וקצב ייצור חום נמדד בריכוזים מצע שונים. שתי מערכות אלו של נתונים מספיקות כדי לגזור את הפרמטרים הקינטית K M ו-k חתול.
במאמר הנוכחי, פרוטוקול כללי כדי לקבוע את הפרמטרים הקינטית לתגובות אנזימטיות בוצעו באמצעות ITC מתואר. אנחנו יישמנו את השיטה להידרוליזה אוריאה על ידי האוריאה ensiformis Canavaliase, כמערכת התייחסות. ההסכם הטוב בין התוצאות שהתקבלו בשיטה זו ונתונים שדווחו בספרות מדגים את האמינות של גישה זו.
Protocol
1. דוגמאות הכנה
- להכין 2 מיליליטר של תמיסת אנזים ו0.5 מיליליטר של תמיסת מצע עבור כל ניסיון ריצה. לדלל פתרונות מניות מרוכזים של אנזים ומצע בפתרונות חיץ שהרכב זהה ללמזער את החום של דילול וערבוב בתוספת המצע.
- בחר את תנאי חיץ שמספיקים כדי למנוע שינוי pH במהלך ניסוי. לדוגמא, 20 pH HEPES מ"מ 7 הוא נאות למדידות ב-pH הניטרלי.
הערה: אם חילופי פרוטון הוא מעורבים, enthalpies protonation של המאגרים בשימוש יש לקחת בחשבון, כי הם משפיעים על ΔH הנמדד של התגובה. השפעות ספציפיות אפשריות של החיץ או מולקולות תוספים על המערכת תחת ניתוח חייבת להילקח בחשבון. אם ממסים אורגניים (למשל DMSO) נכללים בפתרון האנזים, להוסיף אותם בדיוק באותו הריכוז לתוך תמיסת המצע. - לצורך ניסוי M1, להתחילעם ריכוז אנזים בטווח ננומטר (למשל 1 ננומטר) ועם ריכוז מצע גבוה יותר לפחות שלושה סדרי גודל מריכוז האנזים ומעל K M.
- לצורך ניסוי M2, להתחיל עם ריכוז אנזים בטווח PM-ננומטר (למשל 15 PM). ריכוז מצע במזרק הוא בטווח מ"מ (למשל 400 מ"מ).
הערה: בניסוי M1 זריקה אחת, ריכוזים צריכים להיות מספיק כדי להשיג את המרת המצע הכוללת לתוך המוצר לאורך זמן הניסוי. לכן, הריכוז של האנזים תלוי בשיעור האנזים: אם אנזימים עם k חתול נמוך נמצאים תחת מחקר, ריכוזים גבוהים יותר אנזים (עד 10 מיקרומטר) חייבים להיות בשימוש. מצד השני, ריכוזי אנזים המשמשים בניסוי M2 חייבים להבטיח כי המצע שהוחדר הוא שולי בלבד (פחות מ -5%) צרך וכי תגובת האנזים ממשיכה במצב היציב. מסיבה זו, גבוהה יותריעילות אנזים, נמוך יותר ריכוז האנזים הנדרש. בסוף הניסוי, ריכוז מצע בתא המדגם צריך להיות גבוה יותר מאשר K M.
- בחר את תנאי חיץ שמספיקים כדי למנוע שינוי pH במהלך ניסוי. לדוגמא, 20 pH HEPES מ"מ 7 הוא נאות למדידות ב-pH הניטרלי.
- לבדוק היטב אנזים וריכוזי מצע עם הליך מתאים אנליטיים (למשל הספיגה ב 280 ננומטר, מבחני 11 colorimetric, BCA. זה נדרש כדי לקבל חישוב מדויק ומהימן של הפרמטרים תרמודינמיים וקינטית.
- מדוד את ה-pH של הפתרונות ולוודא שחוסר ההתאמה ה-pH של שני אנזימים ואת פתרונות שהמצע הוא מינימאלית בתנאי הניסוי (± 0.05 יחידות pH).
2. ביצוע הניסוי
הערה: באותו ההליך חייב להיות מיושם גם עבור M1 ו-M2 הניסוי, המבוצעים אחד אחרי השני.
- ודא שהתא המדגם ומזרק ההזרקה ניקו על פי היצרן שלהוראות. מלא את מזרק הטעינה מסופק עם המכשיר במים מזוקקים, בעדינות להכניס את המחט בתא המדגם, למלא את התא ולהסיר את הנוזל תוך שימוש באותו המזרק. באמצעות שיטה זו, לשטוף את התא המדגם פעמיים עם מים מזוקקים ופעמים עם החיץ.
- טען את התא המדגם עם 2 מיליליטר של תמיסת אנזים באמצעות מזרק הטעינה, הימנעות היווצרות של בועות אוויר בזהירות. לאט לאט להזריק את הפתרון לתוך התא עד שנשפך החוצה העליון של תאי הגזע. לייצר פרץ של CA. 0.25 מיליליטר של תמיסה אל תוך התא. חזור על פעולה פעמיים. צעד זה מסיר בועות אוויר שנלכדו בתא המדגם.
- מניחים את המחט של מזרק הטעינה על המדף בין תאי הגזע ונמל התא ולהסיר כל פתרון עודף.
- הפעל את תכנית VP-Viewer ו, מממשק המחשב, לאזן את מכשיר ITC לטמפרטורת 3 מעלות צלזיוס מתחת לטמפרטורת הניסוי הרצויה. זה נדרש כדי למנוע איזון ארוךתקופות שלפני הניסוי, בשל מכשיר קירור אינסטרומנטלי הפסיבי.
- למלא את תא ההתייחסות עם מים מזוקקים עם אותו ההליך מתואר לעיל. כאשר מאגרים עם כוח היוני גבוה או גבוהים osmolality נמצאים בפתרון לדוגמא, יש להשתמש באותו החיץ כפתרון התייחסות.
- קישור מזרק פלסטיק לנמל המילוי של מזרק ההזרקה, באמצעות צינור סיליקון דק. מלא את המזרק להזרקת הצבת קצה המחט לתוך מים ועריכה, עד שמים שיוצאים מנמל המילוי העליון, המציינים את המזרק להזרקה הוא מלא. לאחר מכן להעביר את קצה המזרק ממים ולמשוך את אוויר, לרוקן את המזרק להזרקה. עם הליך זה, לשטוף את המזרק להזרקה עם חיץ, ולצייר באוויר דרך המערכת. בהמשך לכך, הנח את מחט הזריקה בצינור צר המכיל 0.5 מיליליטר של תמיסת מצע, בזהירות להכין ולמלא את המזרק להזרקה לחלוטין, ומשאיר כמות קטנה של פתרון בחלק התחתון של הצינור.
- מממשק מחשב, "נמל לסגור מילוי" לעיתונות. הסר את צינור טעינת סיליקון. "טיהור ולמלא" לחץ על לחצן כדי לאפשר את המזרק להזרקה כדי לסלק בועות אוויר ולגרש אותם בחזרה לפתרון בתפזורת. חזור על פעולה פעמיים.
- הזז את מזרק ההזרקה, לנגב בצדדים כדי להסיר טיפות שום ומניח את המחט של מזרק ההזרקה לתוך התא המדגם.
- במחשב, להגדיר את הפרמטרים הריצה המתאימים. יכולים להיות מצויינים האנזים הניסיוני וריכוזי מצע.
- בניסוי M1, לקבוע לפחות שתי תוספות (5-30 μl) של מצע כדי לאמת את שחזור. קבע את הזמן המרווח בין כל הזרקה (למשל 1,000 שניות) גדולות מספיק כדי להבטיח כי תשואות אות חום לנקודת ההתחלה לפני התוספת הבאה.
- בניסוי M2, להגדיר מספר (למשל 15 x 5-10 μl) זריקות. הגדר את המרווח בין הזריקות (למשל 180 שניות) המאפשרות למערכת של לtabilize כוח התרמיות לנקודת ההתחלה החדשה אחרי כל זריקה.
הערה: בפעם המרווח בין זריקות בניסוי M2 צריכה להיות קצרה מספיק כדי למנוע את ההמרה של כמות משמעותית של מצע, המאפשר מדידות שיש לבצע בתנאי מצב יציבים. - בניסוי M2, השתמשו בנפחים קטנים (למשל 2 μl) לזריקה הראשונה, שמקבילה ערך נמחק במהלך ניתוח נתונים שלאחר מכן. אכן, לעתים קרובות מציג חפצים בשל דיפוזיה המצע הראשונית ועד קצה המזרק, ואת קיומו של בועות אוויר שנלכדו במחט המזרק.
- הגדר את כוח ההתייחסות, ברמה המשוערת שבו הבסיס יוצב לפני התגובה מתחילה, לפי שווי של 20. ואז להגדיר את האנזים הניסויי וריכוזי מצע ובחר שם עבור הניסוי.
- הגדר את הטמפרטורה הניסיונית, בדרך כלל ב25 ° C. ITC מאפשר טמפרטורות עבודה בין 2 מעלות צלזיוס ו80 ° C. הניסוי הוא מוכן להפעלה. לחץ על לחצן "התחל" כדי להתחיל את הניסוי.
- לאחר שהניסוי הסתיים, לנקות את התא המדגם והמזרק בהתאם להוראות היצרן.
- חזור על הניסוי לפחות אחד או שתיים יותר פעמים כדי לבדוק את שחזור של נתונים.
3. ניתוח נתונים
- מניתוח התכנית, לחץ על הכפתור "קראו נתונים", ולנווט לתיקייה שבה קובץ ITC. של הניסוי שבוצע M2 ממוקם. לחץ על החץ למטה גלילה של "הקבצים מסוג" ובחר "האנזים Assay (זה?)". בהמשך לכך, לחץ ולפתוח את קובץ ITC. של ניסוי M2.
- השג את ΔH של התגובה משילוב העקומה של ניסוי M1 פי משוואה 5.
"Width =" 126 "/> (5)- לחץ על הכפתור "קראו נתונים", ובחר את הקובץ. ITC של ניסוי M1 שבוצע. שימוש במקור, לחלק את העקבות בחלקים שונים המכילים שיא אחד אחד ולשמור כל שיא כקובץ opj.. פתח את הקובץ המתאים לשיא הראשון, וכתוצאה מסטייה בסיסית בthermogram של הניסוי הבודד הזרקת M1, לשלב אותו ולחלק את ערך השטח שהושג, באו לידי ביטוי בμcal, על ידי ריכוז המצע הסופי בתא המדגם, המתבטא במיקרומטר, ועל ידי נפח התא מתבטא בליטרים, קביעה, על פי משוואה 5, ΔH של התגובה.
- חזור על אותו ההליך לשיא השני של ניסוי M1 ולקבל ערך ממוצע עבור שתי מדידות ΔH.
- לקבוע DQ / dt מניסוי M2 מדידת ההבדל בין הבסיס המקורי והבסיס החדש לאחר כל זריקה. להמיר את הדוארנתוני xperimental לשיעורי תגובה לפי משוואת 4, באמצעות ערך אנתלפיה שהושג בניסוי M1 ולהתאים את הנתונים למשוואת מיכאליס-מנטן.
- מניתוח התכנית, לחץ על הכפתור "קראו נתונים", ובחר את הקובץ. ITC של ניסוי M2 שבוצע. לחץ על החץ למטה גלילה של "הקבצים מסוג" ובחר "האנזים Assay (זה?)".
- תיבת הדו שיח האנזים Assay נפתחה, המאפשרת בחירה באחת מארבעת הדגמים. בחר "שיטה 2 - מצע רק" מהחלון.
- בחלון ΔH, כדי להצביע על שווי ΔH שהושג בשלב 4.2.
- לחץ על לחצן "ריכוז" כדי לבדוק את ערכי הריכוז כדי לשמש בהליך המתאים. לחץ על הכפתור "זמן הממוצע (P)". תיבת שיח נפתחת נותנת ההזדמנות לשנות או לקבל את ערך ברירת המחדל. ערך זה מייצג את הזמן לפני כל להזריקיון שבממוצעי מכשיר אות הכוח לקבוע את רמת הכוח בכל ריכוז מצע. לחץ על אישור כדי לאשר את ערך ברירת המחדל.
- לחץ על הלחצן "אפס Y הציר". הסמן הופך לשיער צולב המאפשר להכפיל לחץ על נקודה, למקום בy = 0. לחץ לחיצה כפולה ממש לפני נקודת הזריקה הראשונה.
- לחץ על לחצן לחשב את השיעור. שיעור הוא להתוות לעומת ריכוז המצע, נגזר על ידי חלוקת המצע הוסיף במהלך טיטרציה למדגם נפח התא (תוך לקיחה בחשבון השפעות דילול). פעולה זו מעניקה לעלילת מיכאליס-מנטן טיפוסי שיכול להיות מצוידת כדי להשיג K M ו-k חתול.
- אם יש למחוק כמה נקודות, בחר בלחצן "חתוכים נתונים". הזז את סמני נתונים להוציא נקודות נתונים רעות ולחץ לחיצה כפולה על אחד מהסמנים או לחצו על Enter.
- השתמש בפונקצית "התאמה למודל" כדי להתאים את העקומה וללהשיג קבועים קינטית.
תוצאות
Urease (EC 3.5.1.5; amidohydrolase אוריאה) הוא אנזים המכיל ניקל multisubunit מצא בarchea, חיידקים, אאוקריוטים וצמחים חד תאיים. מעשי חלבון זה בשלב האחרון של מינרליזציה חנקן האורגנית, מזרזות הידרוליזה של אוריאה לאמוניה וcarbamate, אשר מתפרק באופן ספונטני לתת מולקולה שנייה של אמוניה וביקרבונט (...
Discussion
משמעות של ITC ללמוד פעילות האנזימטית ביחס לשיטות קיימות
בנוסף ליישומים הקלאסיים שלה ללמוד שיווי משקל מחייב, calorimetry טיטרציה בידוד התרמי מספק שיטה מהירה ואמינה לאפיון תגובות אנזימטיות בפתרון באמצעות החום של תגובה כמו בדיק...
Disclosures
יש המחברים אין לחשוף.
Acknowledgements
התמחות מוצרי חברת דשנים (SFP) הוא הודה למתן את הכספים הדרושים למחקר זה.
Materials
| Name | Company | Catalog Number | Comments |
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
References
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research--survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved