Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıcak Biyolojik kataliz: İzotermal Titrasyon Kalorimetre enzimatik reaksiyonların Characterize
Bu Makalede
Özet
Izotermal titrasyon kalorimetre önlemler ısı akışı serbest veya kimyasal reaksiyonlarda absorbe. Bu yöntem, enzim katalizi ölçmek için kullanılabilir. Bu yazıda, enstrümantal kurulumu için protokol, deneme çalışan ve veri analizi genel olarak anlatılmıştır, ve jack fasulye üreazla enzimatik üre hidroliz karakterizasyonu uygulanır.
Özet
Izotermal titrasyon kalorimetre (ITC) ısı hemen hemen her kimyasal süreci karakterize etmek için içsel bir prob olarak kullanarak, kimyasal bir reaksiyon esnasında salınan veya emilen ölçen iyi tanımlanmış bir tekniktir. Günümüzde, bu teknik kapsamlı bağlama biyomoleküler termodinamik denge parametreleri belirlemek için uygulanır. Buna ek olarak, bu uygulama ITC doğrudan hala yeterince faydalanılmayan olduğu halde, enzimatik reaksiyonların kinetik ve termodinamik parametreleri (k cat, K E, AH) ölçüm yapabilmek için gösterilmiştir. Isı değişiklikler kendiliğinden enzim katalizi sırasında meydana geldiğinde, ITC analiz edilen sistemin herhangi bir değişiklik ya da etiketleme gerektirmez ve çözelti içinde gerçekleştirilebilir. Ayrıca, yöntem malzemenin az miktarda ihtiyaç duyar. Bu özellikler ITC gibi çeşitli uygulamalar, örneğin, ilaç keşfi enzim kinetiğinin araştırılması için, paha biçilmez güçlü ve benzersiz bir araç yapmak.
k cat belirlemek için uygulanır ve Canavalia ensiformis (jack bean) üreaz tarafından enzimatik üre hidrolizinin K M. Reaksiyonun içsel molar entalpisi (AH int) hesaplanması gerçekleştirilir. Bu şekilde elde edilen değerler, metodolojisinin güvenilirliğini gösteren, literatürde bildirilen daha önceki veriler ile tutarlıdır.
Giriş
Biyokimyasal reaksiyonların kantitatif tayini hayatın temelinde biyolojik süreçlere bakış sağlar. Kalorimetre kantitatif çözelti içinde hemen hemen her kimyasal reaksiyon karakterize etmek için bir etiket içermeyen bir yöntem sunmaktadır. Bu teknik, ısı serbest ya da zaman içinde absorbe ölçer ve bu nedenle evrensel bir algılama sistemi ve reaksiyona moleküllerin (örneğin bağlanma termodinamik) yanı sıra, bu, reaksiyon oranını (yani kinetik) ölçmek için miktarını ölçmek için çok uygun bir yöntemdir. Özellikle, izotermal titrasyon kalorimetrisi (ITC) protein-ligand, protein-protein, protein-metal iyonları ve protein-DNA etkileşim 1-6 dahil, biyomoleküler dengenin termodinamik karakterize etmek için tercih edilen bir yöntem olarak kabul edilmiştir. Bu uygulamanın potansiyel hala olmasına rağmen ek olarak, kinetik bilgi sağlamak için ITC yeteneği, bu enzim katalizi ölçmek için çok güçlü bir sistem yapar7-9 hafife.
Michaelis sabiti (K M) ve katalitik oranı sabiti (k cat): iki kinetik parametrelere bağlı olarak, reaksiyon hızı ve alt tabaka konsantrasyonu arasında bir ilişki sağlayan olarak Michaelis-Menten denklemi 10, enzimatik reaksiyonların kantitatif açıklaması . K cat / K oranı, M, bir enzimin katalitik verimlilik olarak adlandırılır. Uygulamada, belirli bir reaksiyon için K M belirlenmesi ve k kedi kataliz tam bir açıklamasını sağlar.
Tipik bir enzimatik reaksiyon (Şekil 1) olarak, bir alt-tabaka (S) daha sonra geçiş durumuna aktif enzim-alt-tabaka (ES) kompleks oluşturucu enzim (E), (ES *) ile etkileşime girer. Ikinci sonunda ayrışmaktadır enzim ürünü (EP) kompleksi haline dönüştürülür. Bu adımin aşağıdaki reaksiyon ile açıklanmıştır.
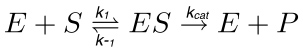 (1)
(1)
k, 1 ES kompleksi, k -1 oluşumu için oran sabit olduğu k cat katalitik oranı sabit ya da devir sayısı iken, ES kompleksinin ayrışma için oran sabitidir.
: Michaelis-Menten denklemine 10 göre, reaksiyonun oranı olarak hesaplanabilir
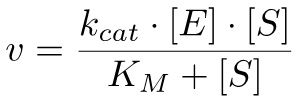 (2)
(2)
burada K M = (k + -1 k cat) / k 1 ve k cat = v max / [E], v max tüm enzim alt-tabakaya bağlı olduğunda, ulaşılan maksimum hızı olmak üzere.
Izotermal titrasyon kalorimetre üre enzimatik hidrolizi karakterize etmek için, bu çalışmada kullanılan bir araçtır. Bu cihaz iki icat şeklinde hücreleri (Şekil 1) ihtiva eden bir adiyabatik kalkanı yapılır. Bu dar giriş boruları ile dışarıdan bağlanır. Referans hücre, genellikle su ile ya da analiz için kullanılan çözücü ile dolu iken numune hücresi (yaklaşık 1.4 mi), enzim solüsyonu ile yüklenir. Genellikle alt-tabaka çözeltisi ca. 0.3 ml ihtiva eden bir uzun iğne ve bağlı bir karıştırma kürek ile dönen bir şırınga, numune hücresi üzerine monte edilir. Bir termoelektrik cihaz "hücre geribildirim ağı" kullanarak, örnek ve referans hücre arasındaki sıcaklık farkını ölçer, ısı eklenerek veya çıkarılarak sıfırdan bu farkı tutar. Deney esnasında, alt-tabaka sabit bir seçilen sıcaklıkta enzim çözeltisi içine enjekte edilir. Ne zaman trzymatic Reaksiyon serbest veya emilen ısı miktarı ürün moleküllerine dönüştürülür alt-tabaka moleküllerinin sayısı ile orantılıdır, gerçekleşir. Buna ek olarak, ısı akış oranının doğrudan reaksiyonun hızı ile ilgilidir. Ölçülen veriler, başlangıç bazal ısı iz bir sapma (Şekil 1) olarak görülen, (μcal / saniye) numune hücresinin meydana gelen ısı akışı ile orantılıdır numune hücresinin, için cihaz tarafından verilen ısı gücü temsil zaman içinde.
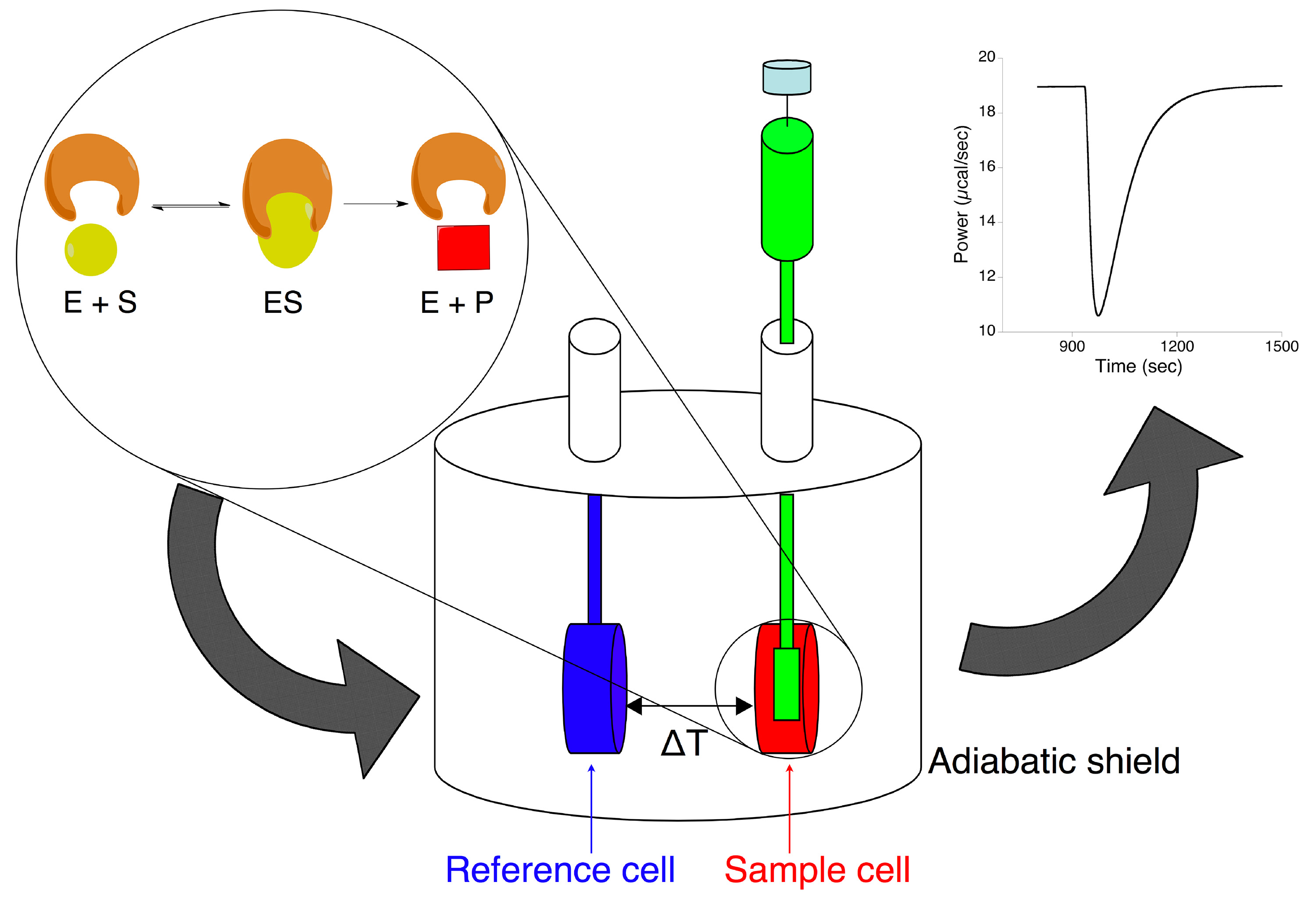
Şekil 1. Enzimatik reaksiyonları incelemek için izotermal titrasyon kalorimetre şematik temsili. (Örnek hücre olarak) Ther bir değişiklik ile sonuçlanır enzim çözeltisi içine (enjeksiyon şırınga içinde), substratın üzerine titre oluşan bir enzimatik reaksiyon,örnek hücre ve referans hücre sabiti arasındaki sıcaklık farkı tutmak için gerekli kalorimetre tarafından yayımlanan mal güç. resmi büyütmek için buraya tıklayın.
Genel olarak, ısı değişim (Q) reaksiyonu (AH) ve sırayla toplam hacim kat konsantrasyonu verilir (n), üretilen ürünün mol sayısının molar entalpisi ile orantılıdır:
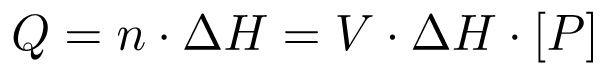 (3)
(3)
Ürün oluşumu, zaman içinde, reaksiyon hızına karşılık gelen (dP / dt), böylece, ilişki ile aynı zamanda (dQ / dt) üzerinden oluşan ısı miktarı ile ilişkili olabilir:
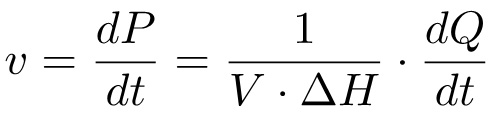 (4)
(4)
Bu denkleme göre, Michaelis-Menten elde etmek amacıyla it) toplam moler entalpisi AH i ölçmek için gerekli olan arsa ve değişik alt tabaka konsantrasyonunda ii) ısı akışı dQ / dt. Genellikle, bu, iki farklı deney yapılır: ilk deneyde (Yöntem 1, M1) olarak, alt-tabaka enzim çözeltisi içine enjekte edilir ve tam dönüşüm için alt-tabaka ısı ölçülür; İkinci deneyde (Yöntem 2, M2), alt-tabakanın birden çok enjeksiyon yapılmaktadır ve ısı üretim oranı, çeşitli substrat konsantrasyonlarında ölçülmüştür. Bu iki veri setleri kinetik parametreleri K, M ve k cat elde etmek için yeterlidir.
Bu makalede, ITC kullanılarak gerçekleştirilmiştir enzimatik reaksiyonlar için kinetik parametrelerinin belirlenmesi için genel bir protokol tarif edilmektedir. Biz Canavalia ensiformis üre üre hidroliz yöntemi uygulananse, bir referans sistemi olarak. Bu yöntem kullanılarak elde edilen sonuçları ve literatürde bildirilen veriler arasında iyi bir uyum, bu yaklaşımın güvenilirliğini gösterir.
Protokol
1.. Numune Hazırlanması
- Enzim çözeltisi 2 ml ve her bir deney işlemi için alt-tabaka çözeltisi, 0.5 ml hazırlayın. Alt-tabaka, ilave sırasında seyreltme ve karıştırma ısısının en aza indirmek için özdeş bileşime sahip olan, tampon çözeltiler içinde, enzim ve substrat konsantre stok çözeltileri seyreltin.
- Deney sırasında pH değişikliğini önlemek için yeterli tampon koşulları seçin. Örneğin, 20 mM HEPES pH 7 nötr pH değerinde yapılan ölçümler için yeterlidir.
Not: proton değişimi söz konusu ise bu reaksiyonun ölçülen AH etkiler nedeniyle, kullanılan tamponların protonasyon entalpileri, kabul edilmelidir. Analiz edilen sistem üzerinde tampon veya katkı moleküllerinin olası spesifik etkileri dikkate alınmalıdır. Organik çözücüler (örneğin DMSO) enzim çözeltisi içerdiği takdirde, alt-tabaka çözeltisi içine tam olarak aynı konsantrasyonda ekleyin. - M1 deney için, başlangıçnM aralığındaki enzim konsantrasyonunun (örneğin, 1 nM) ve enzim konsantrasyonundan ve K M yukarıda büyüklük en az üç tane yüksek olan bir alt-tabaka konsantrasyonu.
- M2 deneme için, pM-nM aralığında enzim konsantrasyonu (örneğin, 15 pM) ile başlar. Şırınga içinde substrat konsantrasyonu mM aralığında (örneğin 400 mM) bulunmaktadır.
NOT: Tek bir enjeksiyon M1 deneyde, konsantrasyonları deneysel zamanla ürünün içine toplam madde dönüşüm elde etmek için yeterli olmalıdır. Bu nedenle, enzimin konsantrasyonu, enzim hızına bağlıdır: düşük k cat sahip enzimler çalışma altında ise, daha yüksek enzim konsantrasyonları (en fazla 10 uM) kullanılmalıdır. Öte yandan, M2 deneyde kullanılan enzim konsantrasyonları enjekte edilen alt-tabaka, sadece marjinal (% 5'ten az) tüketilen ve enzim reaksiyonu kalıcı halde devam olmasıdır sağlamak gerekir. Bu nedenle, daha yüksekEnzim etkinliği, gerekli enzim konsantrasyonu, daha düşüktür. Deneyin sonunda, numune, hücre içinde alt-tabaka konsantrasyonu M K daha yüksek olmalıdır.
- Deney sırasında pH değişikliğini önlemek için yeterli tampon koşulları seçin. Örneğin, 20 mM HEPES pH 7 nötr pH değerinde yapılan ölçümler için yeterlidir.
- Dikkatle 280 nm, kolorimetrik, BCA deneyleri 11 de uygun bir analitik prosedüre (örneğin absorbans ile enzim ve alt tabaka konsantrasyonları kontrol edin. Bu termodinamik ve kinetik parametrelerinin doğru ve güvenilir bir hesabını elde etmek için gereklidir.
- Çözeltilerin pH değeri ölçülür ve enzim ve alt tabaka çözümlerin her ikisinin de pH uyumsuzluk (0.05 pH birimi ±) deney koşulları altında en az olduğundan emin olun.
2. Deney Sahne
Not: Aynı prosedür, her ikisi de birbiri ardına gerçekleştirilen M1 ve M2 deney için uygulanması gerekir.
- Numune hücresi ve enjeksiyon şırınga üreticinin talimatlarına göre temizlenir doğrulayıntalimatları. Damıtılmış su ile aleti ile temin edilen yükleme şırınga doldurun, yavaşça, örnek hücredeki iğneyi hücreyi doldurmak ve aynı şırınga kullanılarak sıvı boşaltılır. Bu yöntem kullanılarak, tampon maddesi ile iki kere damıtılmış su ile iki kez, numune hücresini yıkayın.
- Dikkatli bir hava kabarcığı oluşumunu önlemek, yükleme şırınga kullanılarak enzim solüsyonu ile 2 ml numune hücresini yerleştirin. Bu hücre kök üst dökülürler kadar yavaşça hücre içine enjekte çözüm. Ca bir hamle üretir. Çözeltisi 0.25 ml hücreye. Iki kez tekrarlayın. Bu adım, örnek hücre içinde hava kabarcığı kaldırır.
- Kök hücre ve hücre noktası arasındaki bir çıkıntı üzerinde yükleme şırınganın iğne koyun ve herhangi bir fazla uzaklaştırın.
- VP-Görüntüleyici programını başlatın ve bilgisayar arayüzü, arzu edilen deney sıcaklığının altında bir sıcaklık 3 ° C'ye kadar dengeye ITC cihazı. Bu uzun dengeye önlemek için gereklidirpasif soğutma enstrümantal cihaz nedeniyle deneyden önce dönemleri.
- Yukarıdaki ile aynı prosedür ile damıtılmış su ile referans hücre doldurun. Yüksek iyonik kuvveti ve yüksek osmolalitesi ile tampon çözelti içinde, örnek olarak, aynı tampon çözelti referans olarak kullanılmalıdır.
- Ince bir silikon tüp kullanılarak, enjeksiyon şırınga doldurma portuna plastik bir şırınga bağlayın. Su şırınga dolu olduğunu gösteren, üst dolum noktasına çıkıncaya kadar, suya iğne ucu yerleştirme ve yukarı çizim enjeksiyon şırınga doldurun. Sonra su şırınga ucu taşımak ve havayı yukarı çekmek, enjeksiyon şırınga boşaltmak için. Bu işlem ile, tampon ile enjeksiyon şırınga yıkayın ve sistem üzerinden havayı çekmek. Daha sonra, tüpün altındaki çözeltinin küçük bir miktar bırakarak, dikkatli bir şekilde çekmek ve tamamen enjeksiyon enjektörü doldurmak, alt-tabaka çözeltisi, 0.5 ml ihtiva eden dar bir tüp içinde enjeksiyon iğne yerleştirin.
- Gönderenbilgisayar arayüzü, basın "Close dolgu liman". Silikon yükleme tüpü çıkarın. Basın "Temizle ve dolum" şırınga herhangi bir hava kabarcıklarını çıkarmak ve toplu çözüm içine onları kovmak için izin düğmesi. Iki kez tekrarlayın.
- Her damla çıkarın ve örnek hücre içine enjeksiyon şırınganın iğne yerleştirmek için iki tarafta silin, enjeksiyon şırınga hareket ettirin.
- , Bilgisayarda uygun çalışma parametrelerini ayarlamak. Deney, enzim ve alt tabaka konsantrasyonu gösterilebilir.
- M1 deneyde, tekrarlanabilirliğini doğrulamak için alt tabakanın en az iki ekleme (5-30 ul) ayarlayın. Her enjeksiyon arasındaki boşluk süresi sağlamak için yeterince büyük (örneğin, 1000 sn) bir sonraki ilave edilmeden önce bazal ısı sinyali geri döner.
- M2 deneyde, (örneğin, 15 x 5-10 ul) enjeksiyonu birden ayarlayın. Sistem s izin enjeksiyonlar (örneğin 180 sn) arasındaki aralığı ayarlayınHer enjeksiyondan sonra yeni başlangıca termal güç civarında tutulması.
Not: M2 deneyde enjeksiyonlar arasındaki aralık süresi ölçümleri kararlı hal şartları altında gerçekleştirilebilir izin vererek, alt-tabaka bir önemli miktarda dönüşümünü önlemek için yeterince kısa olmalıdır. - M2 deneyde, karşılık gelen değer sonraki veri analizi sırasında atılır ilk enjeksiyon için, küçük hacimli (örneğin, 2 ul) kullanır. Gerçekten de, genellikle, şırınga ucu ile ilk alt-tabaka difüzyon nedeniyle eserler sunar ve şırınga iğnesi sıkışmış hava kabarcıklarının varlığı için.
- Referans güç ayarlama, taban reaksiyonundan önce yerleştirileceği olarak yaklaşık 20 düzeyinde bir değerde, başlar. Daha sonra deney enzim ve alt tabaka konsantrasyonları tanımlayan ve deney için bir isim seçtik.
- Tipik olarak 25 ° C'de, deney sıcaklığı tanımlar ITC sağlar 2 arasındaki çalışma sıcaklıkları ° C ile 80 ° C. Deney çalıştırmak için hazırdır. Denemeyi başlatmak için "Başla" düğmesine basın.
- Deney tamamlandıktan sonra, üreticinin talimatlarına uygun olarak örnek hücre ve şırınga temizleyin.
- En az bir veya iki kez daha verilerin tekrarlanabilirliği kontrol etmek için bir deney tekrarlayın.
3. Veri Analizi
- Analiz programı, "verileri oku" butonuna tıklayın, ve yapılan M2 deney. Itc dosyasının bulunduğu klasöre gidin. "Dosya türü" kaydırma aşağı oka tıklayın ve "Enzim Assay (it?)" Seçeneğini seçin. Daha sonra, tıklayın ve M2 deney. Itc dosyasını açın.
- Denklem 5'e göre deney M1 eğrisini entegre gelen reaksiyonun SH elde edilir.
"Width =" 126 "/> (5)- "Verisini oku" butonuna tıklayın ve yapılan M1 deney dosyası. ITC seçin. Origin kullanarak, bir tepe her içeren farklı yerlerinde iz bölmek ve bir. Opj dosyası olarak her tepe kaydedin. Tek bir enjeksiyon deney M1, entegre ve elde edilen alan değerine bölünür ve termogramında başlangıç sapmadan kaynaklanan, birinci pik değerine karşılık gelen bir dosya açma, μcal olarak ifade edilen numune hücresinin nihai substrat konsantrasyonu, uM olarak ifade edilmiştir ve hücre hacmi ile Denklem 5, reaksiyonun AH göre belirlenmesi, litre olarak ifade edilmiştir.
- M1 Deneyin ikinci zirve için aynı prosedürü tekrar ve iki SH ölçümleri için ortalama bir değer elde.
- Her bir enjeksiyonun ardından orijinal temel ve yeni taban arasındaki farkı ölçen M2 deneyden dQ / dt belirler. E dönüştürmekDenklem 4'e göre reaksiyon oranları Xperimental verileri, M1 deneyde elde edilen entalpi değeri kullanılarak ve Michaelis-Menten denklemine verileri uygun.
- Analiz programı, "verileri oku" butonuna tıklayın, ve yapılan M2 deney dosyası. ITC seçin. "Dosya türü" kaydırma aşağı oka tıklayın ve "Enzim Assay (it?)" Seçeneğini seçin.
- Enzim Testi iletişim kutusu dört modellerinden birini seçerek izin açılır. Penceresinden - "sadece Yüzey Yöntem 2" seçeneğini seçin.
- SH penceresinde, aşama 4.2 'de elde AH değerini göstermektedir.
- Uygun prosedürde kullanılmak üzere konsantrasyon değerlerini kontrol etmek için "Konsantrasyon" butonuna tıklayın. "Ortalama Süre (P)" düğmesine tıklayın. Iletişim kutusu varsayılan değeri değiştirmek veya kabul etmek için bir fırsat vererek açar. Bu değer, her enjektö önce zamanı temsiliyon hangi araç ortalamalar her bir alt-tabaka konsantrasyonunda güç seviyesini belirlemek için güç sinyalinin. Varsayılan değeri onaylamak için Tamam'a tıklayın.
- "Sıfır Y Eksen" düğmesine tıklayın. İmleç y = 0 da yerleştirmek için, bir noktayı tıklatın çift izin haç dönüşür. Sadece ilk enjeksiyon noktasından önce çift tıklayın.
- Hesapla Hızı düğmesine tıklayın. Oranı (hesap seyreltme etkiler dikkate alınarak) numune hücre hacmi için titrasyon sırasında eklenen alt-tabakanın bölünmesi ile elde edilen substrat konsantrasyonuna karşı çizilmiştir. Bu işlem, M K ve k cat elde etmek üzere takılabilir, tipik Michaelis-Menten grafiğini vermektedir.
- Bazı noktaları silinecek olursa, "Truncate Verileri" düğmesini seçin. Kötü veri noktalarını ve girmek belirteçlerin basın veya birine çift tıklayın dışlamak için veri işaretçileri hareket ettirin.
- Eğriye uyacak ve için "model Fit" işlevini kullanınkinetik sabitleri elde edilir.
Sonuçlar
Üreaz (EC 3.5.1.5, üre amidohidrolaz) archea, bakteri, tek hücreli, ökariyotlar ve bitkilerde bulunan bir multisubunit nikel ihtiva eden bir enzimdir. Kendiliğinden amonyak ve bikarbonat (denklem 6) 12, ikinci bir molekül vermek için parçalanır amonyak ve karbamata üre hidrolizini katalize organik nitrojen mineralizasyon son adımda bu protein etki eder,.
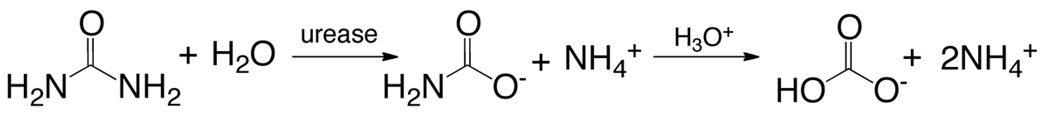 (6)
(6)
Tartışmalar
Mevcut yöntemlere göre enzimatik aktivitesini incelemek için ITC önemi
Bağlama dengeleri incelemek için klasik uygulamalara ek olarak, izotermal titrasyon kalorimetrisi sistem modifikasyon veya etiketleme gerektirmeden, bir prob olarak reaksiyon ısısının kullanılarak çözelti içinde enzimatik reaksiyonları karakterize için güvenilir ve hızlı bir yöntem sağlar. Kinetik parametreler kedi k ve K M genellikle ürün for...
Açıklamalar
Yazarlar ifşa hiçbir şey yok.
Teşekkürler
Özel Gübre Ürünleri Şirketi (SFP) Bu çalışma için gerekli fonları sağlamak için kabul edilmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| HEPES | Sigma | H3375 | dissolving in water and adjusting pH with NaOH |
| TRIZMA-Base | Sigma | T1503 | dissolving in water and adjusting pH with HCl |
| Sodium dihydrogen phosphate | Riedel-de-Haen | 4270 | dissolving in water |
| Sodium phosphate dibasic | Riedel-de-Haen | 30427 | dissolving in water |
| Urea | Sigma | U4128 | dissolving in water at 40 °C |
| Canavalia ensiformis urease (type C-3) | Sigma | U0251 | dissolving in 20 mM HEPES pH 7 and stored at -80 °C |
| VP-ITC on Origin 7.0 | MicroCal (GE Healthcare) | SYS13901 | instrument |
| VPViewer2000 1.30.00 on Origin 7.0 | MicroCal (GE Healthcare) | data acquisition software supplied with the instrument |
Referanslar
- Leavitt, S., Freire, E. Direct measurement of protein binding energetics by isothermal titration calorimetry. Curr. Opin. Struct. Biol. 11, 560-566 (2001).
- Ladbury, J. E. Application of isothermal titration calorimetry in the biological sciences: things are heating up! BioTechniques. 37, 885-887 (2004).
- Zambelli, B., Bellucci, M., Danielli, A., Scarlato, V., Ciurli, S. The Ni2+ binding properties of Helicobacter pylori NikR. Chem. Commun. , 3649-3651 (2007).
- Zambelli, B., et al. High-affinity Ni2+ binding selectively promotes binding of Helicobacter pylori NikR to its target urease promoter. J. Mol. Biol. 383, 1129-1143 (2008).
- Duff, M. R., Grubbs, J., Howell, E. E. Isothermal titration calorimetry for measuring macromolecule-ligand affinity. J. Vis. Exp. , (2011).
- Ghai, R., Falconer, R. J., Collins, B. M. Applications of isothermal titration calorimetry in pure and applied research--survey of the literature from 2010. J. Mol. Recognit. 25, 32-52 (2012).
- Todd, M. J., Gomez, J. Enzyme kinetics determined using calorimetry: a general assay for enzyme activity. Anal. Biochem. 296, 179-187 (2001).
- Bianconi, M. L. Calorimetry of enzyme-catalyzed reactions. Biophys. Chem. 126, 59-64 (2007).
- Demarse, N. A., Killian, M. C., Hansen, L. D., Quinn, C. F. Determining enzyme kinetics via isothermal titration calorimetry. Methods Mol. Biol. 978, 21-30 (2013).
- Michaelis, L., Menten, M. Die kinetik der invertinwirkung. Biochem. Z. 49, 333-369 (1913).
- Walker, J., Wilson, K., Walker, J. . Principle and techniques of practical biochemistry. , 312-356 (2000).
- Ciurli, S., Sigel, A., Sigel, H., Sigel, R. K. O. . Nickel and its surprising impact in nature. 2, 241-278 (2007).
- Zambelli, B., Musiani, F., Benini, S., Ciurli, S. Chemistry of Ni2+ in urease: sensing, trafficking, and catalysis. Acc. Chem. Res. 44, 520-530 (2011).
- Zonia, L. E., Stebbins, N. E., Polacco, J. C. Essential role of urease in germination of nitrogen-limited Arabidopsis thaliana seeds. Plant Physiol. 107, 1097-1103 (1995).
- Follmer, C. Insights into the role and structure of plant ureases. Phytochemistry. 69, 18-28 (2008).
- Sumner, J. B. The isolation and crystallization of the enzyme urease. J. Biol. Chem. 69, 435-441 (1926).
- Krajewska, B. Ureases I. Functional, catalytic and kinetic properties: A review. J. Mol. Cat. B. 59, 9-21 (2009).
- Callahan, B. P., Yuan, Y., Wolfenden, R. The burden borne by urease. J. Am. Chem. Soc. 127, 10828-10829 (2005).
- Krajewska, B., van Eldik, R., Brindell, M. Temperature- and pressure-dependent stopped-flow kinetic studies of jack bean urease. Implications for the catalytic mechanism. J. Biol. Inorg. Chem. 17, 1123-1134 (2012).
- Hausinger, R. P., Karplus, P. A., Huber, R., Poulos, T., Wieghardt, K. . Handbook of Metalloproteins. , 867-879 (2001).
- Goldberg, R., Kishore, N., Lennen, R. Thermodynamic quantities for the ionization reactions of buffers. J. Phys. Chem. Ref. Data. 31, 231-370 (2002).
- Baumann, M. J., et al. Advantages of isothermal titration calorimetry for xylanase kinetics in comparison to chemical-reducing-end assays. Anal. Biochem. 410, 19-26 (2011).
- Noske, R., Cornelius, F., Clarke, R. J. Investigation of the enzymatic activity of the Na+,K+-ATPase via isothermal titration microcalorimetry. Biochim. Biophys. Acta. 1797, 1540-1545 (2010).
- Harmon, K. M., Niemann, C. The competitive inhibition of the urease-catalyzed hydrolysis of urea by phosphate. J. Biol. Chem. 177, 601-605 (1949).
- Benini, S., Rypniewski, W. R., Wilson, K. S., Ciurli, S., Mangani, S. Structure-based rationalization of urease inhibition by phosphate: novel insights into the enzyme mechanism. J. Biol. Inorg. Chem. 6, 778-790 (2001).
- Segel, I. H. . Enzyme kinetics: behavior and analysis of rapid equilibrium and steady-state enzyme systems. , (1993).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır