需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
神经细胞类型的流式细胞仪协议的表面和细胞内抗原分析
摘要
We provide a detailed description of a protocol for flow cytometric analysis of surface antigens and/or intracellular antigens in neural cell types. Critical aspects of experimental planning, step-by-step methodological procedures, and fundamental principles of flow cytometry are explained in order to enable neurobiologists to exploit this powerful technology.
摘要
Flow cytometry has been extensively used to define cell populations in immunology, hematology and oncology. Here, we provide a detailed description of protocols for flow cytometric analysis of the cluster of differentiation (CD) surface antigens and intracellular antigens in neural cell types. Our step-by-step description of the methodological procedures include: the harvesting of neural in vitro cultures, an optional carboxyfluorescein succinimidyl ester (CFSE)-labeling step, followed by surface antigen staining with conjugated CD antibodies (e.g., CD24, CD54), and subsequent intracellar antigen detection via primary/secondary antibodies or fluorescently labeled Fab fragments (Zenon labeling). The video demonstrates the most critical steps. Moreover, principles of experimental planning, the inclusion of critical controls, and fundamentals of flow cytometric analysis (identification of target population and exclusion of debris; gating strategy; compensation for spectral overlap) are briefly explained in order to enable neurobiologists with limited prior knowledge or specific training in flow cytometry to assess its utility and to better exploit this powerful methodology.
引言
流式细胞仪已被广泛利用免疫学,血液学和肿瘤学,通过内在的散射特性,细胞表面的抗原表达,和其他荧光参数1-3定义细胞群。我们的见解血统发育和疾病有结果后,其最初的实现4,5个显著程度这一方法的不断细化。流的数量和整体分析潜在的意识提高术最近鼓励其在干细胞研究更广泛地使用,并且可以使在一个较短的时间框架6同样深刻的进展。然而,流式细胞术的应用,特别是分析和分离的神经种群早已被认为是具有挑战性的。在对比的是天然存在于悬浮液中的造血细胞,神经细胞类型通常由过度复杂的来源,其可包括神经胶质细胞和各种O收获疗法周围细胞以及过程承载神经元的一个复杂的网络。因此,神经生物学仍未实施流式细胞仪的多功能性,它在日常研究套路完整的潜力。然而,只要是可行的单细胞悬浮液可以产生(和协议已经设计和优化用于该目的7),流式细胞术和荧光激活细胞分选(FACS)可以被认为是在神经生物学分析剧目的一个有价值的元件8-11。
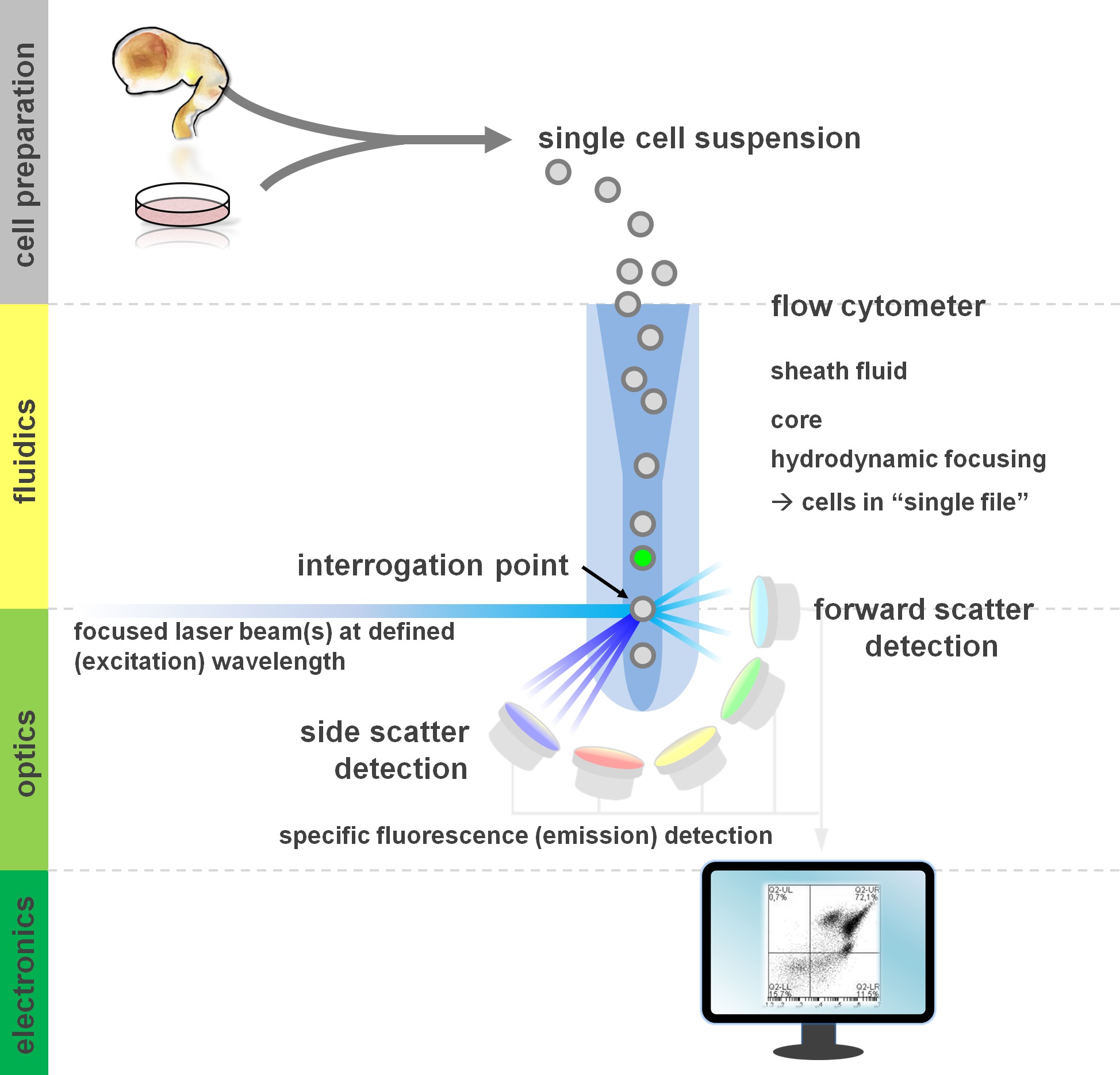
图1原理的流式细胞术分析和流量的部件仪的流式细胞仪包括三个主要系统:流体学,光学和电子学。细胞在悬浮液中简化的流被鞘flui完成(从主组织或离体培养的方法制备)通过水动力ð对焦,限制样品其中心的核心。该光学部件是由激光器照射细胞和光学过滤器,引导信号到相应的检测器的流。检测被转换成电子信号,然后由计算机处理和可视化的数据分析和门控在监视器上的光信号。 请点击此处查看该图的放大版本。
流式细胞方法利润的基本面,包括流式细胞仪的积木至少有一个基本的了解用户(审查见12,13;另参见图1)。的激光束相交一个流体动力学聚焦流体流包含该细胞悬浮液,这反过来又通过在"单一文件'相继的激光束。该intercepti上的小区(或任何其它粒子,就此而言)与激光产生的光的,从该询问点的散射。散射光可在延续激光方向(前方散射,与颗粒的大小有关),垂直以及其方向来检测(侧向散射;反射颗粒/细胞的granulosity)。这些上述的散射特性不要求特定的标签,这是为什么未标记样品(或还细胞碎片,气泡等 ),将生成的二元前向散射与侧向散射图中常用的初始门控信号(事件)。通过使用适当的激光和特异于相应的激发和发射光谱过滤器,一个细胞可以为它的阳性,强度的水平,或不存在的荧光标记进行分析。大多数流式细胞应用已经通过细胞表面抗原的集中表征。不同于造血lineag即,在神经系一直根据表面抗原的表达模式5少广泛定义。利用表面抗原的一个优点是,活细胞能够进行细胞分选范式诸如FACS。与此相反,细胞内抗原染色,需要固定和透化步骤,以介导的表位 - 抗体相互作用,排除需要活菌下游应用。值得注意的是,这样的方法仍然允许众多的定量分析14以及下游分析为RNA和蛋白质的表达15。血液学,免疫学和肿瘤学经常用来十多标记结合来定义特定亚群16。此外,质谱术或CyTOF现在可以用来分析多达30个参数同时17,18。
对神经干细胞的应用,以及原代培养14,19,20细胞在异质体外是一种常见的现象21-23。不表示感兴趣的目标人群的细胞体现为实验读数24,25一个潜在的混杂因素。方便的是,在异构细胞悬浮液存在于不同的细胞亚群承受不同的(已知的或尚待解码)抗原的表达谱,这可以被用来确定这些不同的人群。流式细胞仪可因此在解决细胞异质性起到至关重要的作用,并且由此促进生物医学应用( 体外测定法,细胞疗法),并通过集中最相关子集24,26上优化的定量读数。各种表面抗原组合已经确定,在过去几年中,以允许特定的神经细胞类型的定量和隔离。这包括CD133为神经干细胞的27中,CD15 / CD24 / CD29表面抗原的NSC的分离的组合,不同点的富集泰德神经元和神经嵴细胞28或CD15 / CD24 / CD44 / CD184 / CD271隔离神经胶质子集25,其他签名29,30之间。除了 神经元,神经胶质标记包括A2B5 31,CD44 25,NG2 32和33 GLAST。最近的出版物开发的脑floorplate前体标记CORIN 34,35,以丰富的多巴胺的前体帕金森细胞移植范式36。光盘的分子不仅是标记物,但是细胞-细胞相互作用和当中的小区的能力功能相关介体从细胞外基质分子响应线索和生长因子37。进一步提高组合的CD抗原库表征神经系的发展策略之一是使用一种称为胞内标记筛选并确定CD抗原组合感兴趣的特定细胞类型。最近,我们利用这种方法,并确定了CD4部9f - / CD200 高组合的表达模式作为一种新的方法用于富集从neurally分化诱导多能干细胞培养系统38的神经元亚群。在这里,我们包括与讨论后者协议(和可选的变体),其中表面染色和细胞内染色,可同时用于通过流式细胞术确定的神经细胞亚群。
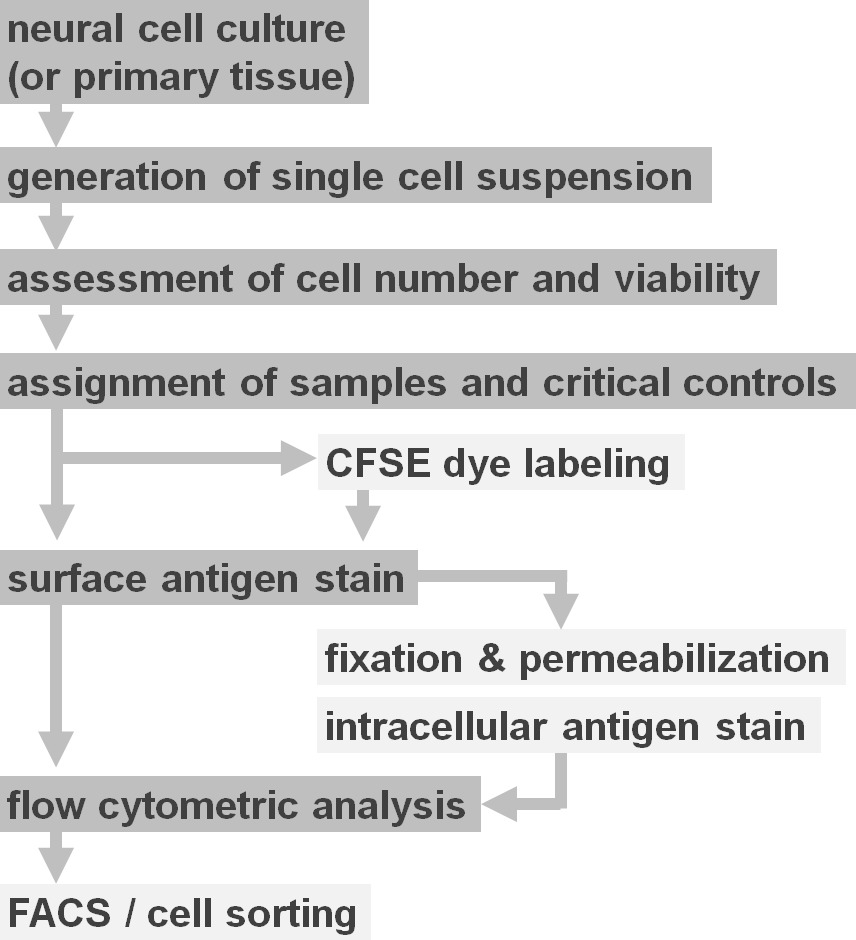
实验协议选项图2的流程图。该图描述中涉及的协议的主要步骤的示意性表示。可选步骤(CFSE染料或细胞内的抗原标记)被浅灰色方框表示。收获后,有必要进行评估之前的细胞表面染色的神经细胞悬浮液的活力和细胞数目。积极作为以及阴性对照需要包含除所关注的样品。样品可以通过流式细胞仪进行分析和/或细胞分选范例使用。 请点击此处查看该图的放大版本。
虽然我们以前使用与二次抗体结合第一抗体细胞内染色38,我们现在通过荧光Fab片段(泽农标签),为轻微的变化引进第一抗体的非共价标记,从而减少了细胞操作39的步骤。此外,作为协议的通用性的又一个例子中,我们通过羧基琥珀酰亚胺酯(CFSE)表面抗原染色前使用的一个实验性的子集的可选标记。这样的CFSE预标记使两个细胞系或实验条件下立即直接比较(CFSE标记的VS。未标记的)单一样品管,减少变异或孵化时间的细微差异,节约抗体内。 CFSE是通常用于细胞跟踪40,在增殖41,42和条形编码实验43,44既定荧光染料。最后,虽然实际的分拣步骤(FACS,免疫细胞分离或immunopanning)不是该协议的一部分,在原则上,此处描述的收集和标识程序做,可以进行表面抗原或细胞内标记为基础分类应用收率样品15 25,28。
在本文中,我们的目标是:总结出可行的表面抗原染色协议25,28,总结了检测细胞内目标的协议,以及结合表面和细胞内的抗原分析38,出现细胞内CFSE染料标记步骤41,45作为实验选项COMparative分析神经细胞群,总结方法流式细胞仪分析(适当控制13,46,门控策略和数据呈现47)。
Access restricted. Please log in or start a trial to view this content.
研究方案
1.神经细胞收获
- 评估通过显微镜:
- 在此之前启动一个实验,请与明场或相衬显微镜文化的地位。
注意:尽管从解剖得到初级神经组织是,在原则上,同样适合于流式细胞仪分析14,28,请注意,该协议的重点是从体外神经细胞系统获得的细胞。
- 在此之前启动一个实验,请与明场或相衬显微镜文化的地位。
- 收获细胞7:
- 轻轻洗涤贴壁细胞用Mg 2+的盘/烧瓶/ 钙自由磷酸盐缓冲的盐水(PBS)在室温下( 如 5毫升的T75烧瓶中,每井3毫升6孔板或10毫升10cm皿)。
注:PBS用于整个协议是Mg 2+ / 钙免费的。- 用于视频例如,使用的SH-SY5Y成神经细胞瘤细胞的T75烧瓶中,在80%的汇合。适用的情况下的附加的洗涤步骤大量的碎片存在于盘中。
- 考虑洗血清PBS含48白蛋白,珀,或聚蔗糖49梯度离心和/或市售珠50,51。去除髓鞘和其它脂质或其他污染物是至关重要的,特别是当正在使用成人原发性组织来源。
- 添加预热(37℃)胰蛋白酶替换在覆盖组织培养皿的整个表面上适当的音量。
注:另外,考虑的Accutase或其他酶消化选项。这关键的一步,可能表面抗原的表达产生负面影响(见7)。 - 孵化菜/烧瓶,在37℃进行2 - 5分钟(取决于细胞类型),以使细胞分离。轻轻拍打组织培养皿或冲洗用血清学吸管打跑的细胞。避免过度消化(因为这可能会导致电池损耗和凝固在后面的步骤)。
- Quench胰蛋白酶置换,加入两倍的流动缓冲液(在PBS中的2%FBS)的体积和收集细胞在15ml锥形管中。
- 轻轻磨碎使用微升吸管将细胞悬浮液(100 - 1,000微升)或5ml的血清吸管以制备单细胞悬浮液。
- 离心细胞,在220×g离心5分钟,在25℃下。小心吸出上清液留下沉淀的后面。
- 重悬浮沉淀的流动缓冲器的适当体积,取决于粒料(尺寸例如为SH-SY5Y细胞中的一个汇合的T75烧瓶中的典型产率为至少10×10 6个细胞,在这种情况下,将细胞重新悬浮于5毫升的流动缓冲液)。
注意:如果较大的块或凝血观察,筛选过30 - 100微米的网格。
- 轻轻洗涤贴壁细胞用Mg 2+的盘/烧瓶/ 钙自由磷酸盐缓冲的盐水(PBS)在室温下( 如 5毫升的T75烧瓶中,每井3毫升6孔板或10毫升10cm皿)。
- 细胞计数52:
- 在TR的一个体积调小等分的细胞悬浮液到一个离心管中,并稀释在限定的比率ypan蓝色或转移至血细胞计数器或自动细胞计数系统之前的替代生存能力染料。
- 通过加入流动缓冲液或PBS中适当体积用0.1%BSA(如果继续用CFSE标记)稀释细胞悬浮液以1×10 6个活细胞/ ml的浓度。
注:碘化丙锭,7氨基放线菌素D,膜联蛋白V和市售可定影活力检测试剂盒代表,以评估细胞的生存力的替代方案。此外,使用胱天蛋白酶-3的荧光凋亡测定法如先前描述的53可以被使用。这些试剂如果包括所有样品中,可能会限制后续步骤中选择荧光通道将被"占用"。
2.细胞内染料标记用CFSE(图3)
- 稀释CFSE至所需原料浓度可以很容易地使用。
注:对于这些实验股票浓度0.01毫米中。确定的CFSE的最佳工作浓度凭经验。 - 添加10微升每ml细胞的0.01毫CFSE溶液(1.3.2节,在PBS + 0.1%BSA的1×10 6个细胞/ ml的浓度)为0.1微米的最终浓度。简要涡旋拌匀。
注意:这里使用CFSE浓度约10倍比那些在增殖实验常用的降低,因此电池中染料的毒性是最小的。我们没有观察到对细胞活力的不利影响。 - 孵育5分钟,在RT下持续振荡(200转)。避光。
- 通过加入5倍体积的缓冲液流动到管淬灭染料。离心在94×g离心5分钟,在室温。
- 弃去上清液留下沉淀后面。重新悬浮细胞以5倍体积的缓冲液流动。
- 离心在94×g离心5分钟,在室温。弃去上清液并重新悬浮的细胞在流缓冲器以1×10 6个细胞的浓度/毫升。
- 添加相同数量的感兴趣的染色细胞悬浮液未染色细胞。进行表面抗原染色协议( 第3节 )。

图3.检测通过CFSE染料标记。的SH-SY5Y成神经细胞瘤细 胞两种细胞系之间的差分的CD表面抗原表达的是预先标记相比,未标记的BJ成纤维细胞用CFSE用于随后鉴定。共染色混合样品(右图)与表面标志物CD24或CD54(两者结合到APC)的证明,细胞系很容易分辨由于CFSE染色(箭头= SH-SY5Y;箭头= BJ成纤维细胞)。大多数的SH-SY5Y细胞表达CD24但不CD54(ICAM-1)。相比之下,BJ成纤维细胞(CFSE阴性)是CD54阳性,但主要是负面的CD24。"https://www.jove.com/files/ftp_upload/52241/52241fig3highres.jpg"目标="_空白">点击此处查看该图的放大版本。
3.细胞表面染色
- 标签管包括样品和关键控制( 见表1)。
| 管没有。 | 样品名称 | 抗原荧光 | 稀释 |
| 1 | 未染色细胞 | - | |
| 2 | 单染 | CD24-APC | 1时50 |
| 3 | 单染 | TUJ1-的Alexa Fluor 488nm的 | 1:2000 |
| 4 | 双染 | CD24-APC | 1:50 |
| TUJ1-的Alexa Fluor 488nm的 | 1:2000 | ||
| 五 | 单染 | 二级只:的Alexa Fluor 488nm的 | 1:2000 |
被包括在一个典型的流式细胞仪实验表1。L管IST。下表显示了一组所需的这个视频文章中描述的共染色实验样品管的最小的。一个理想的实验需要包括所有必要的控制(阴性,阳性以及补偿控制)对所获得的结果准确解释。
- 加入100微升细胞悬液(从2.7或1.3.2),以每次1.5 ml离心管。
注:确保最低0.1×10 6细胞是每100微升细胞悬液的存在。 - 添加荧光团共轭抗体与样品在适当的稀释度。
注:确定工作稀释为在实验前各抗体。 见表2列表Ø˚F神经表面抗原。
| 抗原 | 电池类型 | 参考 |
| CD15 | 神经干细胞 | [28,67] |
| CD24 | 神经细胞 | [28,68] |
| CD29 | 神经干细胞 | [28,69,70] |
| CD44 | 神经胶质细胞 | [25] |
| CD49f的 | 神经干细胞 | [38] |
| CD56(NCAM) | 神经细胞 | [71] |
| CD133 | 神经干细胞 | [27] |
| CD184 | 神经干细胞和神经胶质细胞 | [25] |
| CD200 | 神经细胞 | [38] |
| CD271 | 神经嵴干细胞 | [25] |
| A2B5 | 神经胶质细胞 | [31] |
| CORIN | 多巴胺的前体 | [35,36] |
| FORSE1 | 神经干细胞(NSC) | [72] |
| GLAST | 神经胶质细胞 | [33] |
| NG2 | 神经胶质细胞 | [32] |
表2.选择的神经表面抗原。此表提供发现由各种神经细胞类型被表示在举例用于表征神经谱系表面抗原的增加面板表面表位的列表。注意,这个选择是远未完成,大多数这些标记也通过一系列其他神经和非神经细胞中的表达。因此,将需要的几个标记物的组合,以更好地确定和分离指示神经子集。
- 孵育在轨道摇床(200rpm)下在黑暗中30分钟。
- 流缓冲区清洗
- 加入1毫升的流缓冲到管中。离心机在380×g离心在4℃下4分钟。
- 弃去上清液留下沉淀后面。
- 再次重复清洗步骤。
- 第二次洗涤后,倒出上清液,并重新悬浮细胞在流缓冲器中以达到100μl的最终体积。
- 使用样本流式细胞仪分析。另外,继续进行第4和第5。
注意:如果细胞是要排序并放回培养后的FACS( 即没有固定或透化的活细胞悬浮液),收获,染色和分析步骤期间应用无菌技术。
4.固定和透38
- 固定使用多聚甲醛(PFA):
- 制备含2%的PFA的PBS固定缓冲液中。
注:PFA是对人体有害的环境。使用合适的个人防护装备和丢弃垃圾按照当地法规。 - 加入500微升固定缓冲液100微升细胞悬浮液。
- 孵育管在室温15分钟在定轨摇床(100rpm下)在黑暗中。
- 制备含2%的PFA的PBS固定缓冲液中。
- PBS洗:
- 加入1毫升的PBS到管。离心机在380×g离心3分钟,在4℃。
- 丢弃/倒出上清液留在管大约100微升。
- 透用Tween-20:
- 制备含有0.7%吐温-20的PBS透化缓冲液中。
- 加入500微升的透化缓冲液至100μl细胞悬浮液。
- 孵育管在室温15分钟在定轨摇床(100rpm下)在黑暗中。
- 用PBS(如第4.2节 ),一旦洗细胞,并从协管去除上清mpletely,只留下沉淀的后面。
5.细胞内抗原染色的38(图4)
- 准备一抗的解决方案:
- 稀释含1%牛血清白蛋白,10%血清( 如正常驴或山羊血清)和0.5%吐温-20的PBS中稀释缓冲液中的一抗。
注:选择根据二次抗体中提出的物种中使用的血清。 - 或者,根据制造商的说明使用第一抗体泽农荧光标记。
- 制备1微克的PBS初级抗体在适当的稀释液(总体积≤20微升)。
- 添加5微升的Zenon IgG的荧光标记试剂(组分A)与抗体溶液。
- 为5分钟,在RT下孵育所述混合物。
- 添加5微升的Zenon封闭试剂(成分B)的反应混合物中。
- 孵化为5分钟,在RT下将混合物。在30分钟内应用该抗体对所述样品。
- 稀释含1%牛血清白蛋白,10%血清( 如正常驴或山羊血清)和0.5%吐温-20的PBS中稀释缓冲液中的一抗。
- 主要抗体染色:
- 添加100微升的初级抗体溶液到细胞沉淀中,并轻轻磨碎混合。
- 可替代地,泽农荧光素标记的抗体添加至细胞悬浮液在合适的稀释度。
- 孵育管在室温30分钟在定轨摇床(200rpm)下,避光。用PBS洗一次细胞(如描述在第4.2节),并从完全管去除上清,只留下沉淀的后面。
- 第二抗体染色(不需要的泽农荧光素标记的抗体):
- 稀释在PBS中的第二抗体在适当的浓度。
- 添加100微升的二次抗体溶液到细胞沉淀中,并轻轻磨碎混合。孵育管在RT在黑暗中30分钟在振荡器上(200rpm)下。
- 与PBS洗涤样品两次(如第4.2节 )。
- 与流缓冲洗一次(见第3.5节 )。
- 重新悬浮细胞在大约150微升流动缓冲液和流式细胞仪上的流动分析。
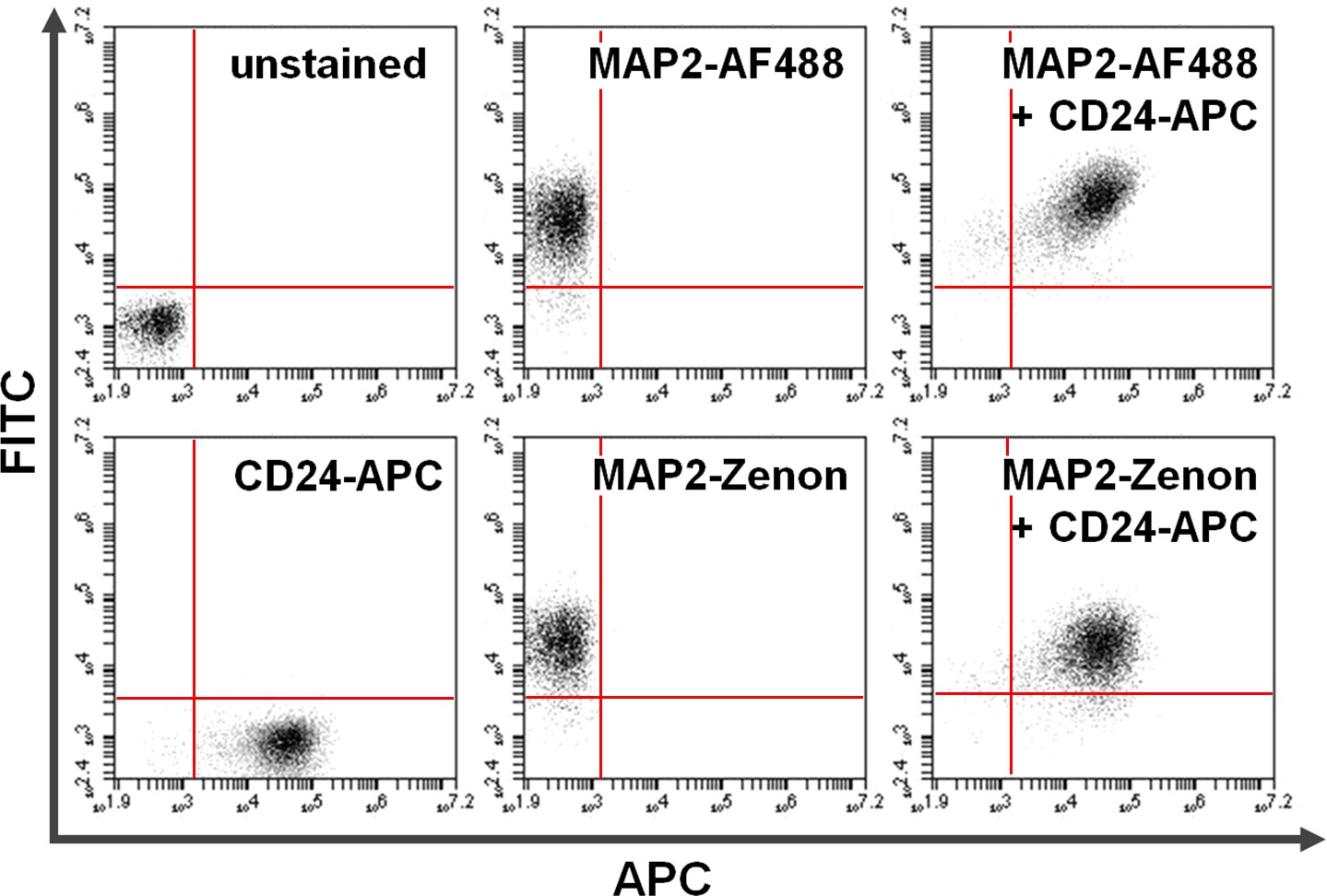
图4.共染色的表面和细胞内的蛋白质。流式细胞术数据举例说明了主+二级抗体为基础的对与表面染色组合泽农荧光素为基础的细胞内染色的比较。在y轴(左上象限)和x轴(右下象限)独家阳性细胞显示染色MAP2和CD24,分别。后共染色,共用MAP2和CD24的表达可以看出,在右上象限(右图)。使用比较的Alexa Fluor 488(最高; AF488)与泽农荧光素(底)部MAP2标签产生类似的结果,请点击这里查看该图的放大版本。
6.流式细胞仪分析
- 在完成使用流式细胞仪用适当的过滤器进行信号检测的染色方案后,立即进行流式细胞术分析。使用488nm的蓝色和640纳米的红色激光器FL-1(三十○分之五百三十三),FL-2(40分之585),和FL-4(25分之675)带通滤波器。
- 建立基于前向和侧向散射不含碎片和死细胞的主要栅极。
- 设置荧光门的表面和基于使用单一的彩色控制未染色样品,并赔偿频谱重叠细胞抗原≤0.5%。
Access restricted. Please log in or start a trial to view this content.
结果
这里介绍的协议允许多功能的实验方法( 图2)。在其最短的版本( 步骤1,3和6),它可以被认为是表面抗原的简单染色的指南。在它的更复杂的形式,一些共标记的范例与一系列胞内抗原可以追求(任选的步骤2和/或4至5)。此外,将CFSE标记步骤举例说明它的应用程序,用于细胞-细胞相互作用的研究细胞标记/亚群的跟...
Access restricted. Please log in or start a trial to view this content.
讨论
这里介绍的协议是公认的用于从人干细胞来源的神经细胞培养物,但也可以同样适用于其他的神经细胞来源,包括原代组织或神经细胞系。除了 胚胎来源,神经干细胞或祖细胞,可以提取自成人脑27的神经区域。此外,流式细胞仪和FACS可以被利用来量化,分 析和分离各种细胞群体,包括成熟的神经元54,星形胶质细胞33,小胶质细胞55,少突56,?...
Access restricted. Please log in or start a trial to view this content.
披露声明
The authors declare no potential conflicts of interest.
致谢
Our research program is funded through the Emmy Noether-Program of the German Research Foundation (DFG), grant PR1132/3-1. Further support by the Müller-Fahnenberg Foundation of the University of Freiburg is gratefully acknowledged. This study was supported in part by the Excellence Initiative of the German Research Foundation (GSC-4, Spemann Graduate School).
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 (1:1) (Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) |  Life Technologies Life Technologies | 11330057 | |
| DPBS without Ca2+ Mg2+ |  Life Technologies Life Technologies | 14190169 | |
| Fetal bovine serum, qualified, E.U.-approved, South America origin (FBS) |  Life Technologies Life Technologies | 10270-106 | |
| MEM Non-essential amino acids (100x) |  Life Technologies Life Technologies | 11140035 | |
| TrypLE Express |  Life Technologies Life Technologies | 12604013 | |
| Trypan blue solution, 0.4% |  Life Technologies Life Technologies | 15250061 | |
| Paraformaldehyde |  Carl Roth Carl Roth | 335.3 | |
| Bovine serum albumin (BSA) Fraction V |  PAA Laboratories, Coelbe PAA Laboratories, Coelbe | K41-001 | |
| Tween-20 Detergent |  Calbiochem Calbiochem | 655205 | |
| Carboxyfluorescein succinimidyl ester (CFSE) |  eBioscience eBioscience | 65-0850-84 | |
| DMSO |  AppliChem AppliChem | A1584 | |
| Bottle top filters express plus 0.22 µm, 250 ml |  Millipore Millipore | SCGPU02RE | |
| Cell culture treated flasks (T 25) |  NUNC NUNC | 156367 | |
| Cell culture treated flasks (T 75) |  NUNC NUNC | 156499 | |
| Conical tubes (15 ml) |  Greiner Bio-One Greiner Bio-One | 188271 | |
| Conical tubes (50 ml) |  Greiner Bio-One Greiner Bio-One | 227261 | |
| Pasteur pipet, glass (150 mm) |  STEIN Labortechnik, Remchingen STEIN Labortechnik, Remchingen | S03710150 | |
| Pipet tips (0.1-10 µl) |  Corning Corning | 4125 | |
| Pipet tips (1-200 µl) |  Corning Corning | 4126 | |
| Pipet tips (100-1000 µl) |  Corning Corning | 4129 | |
| Serological pipets, 5 ml |  Corning Corning | 4051 | |
| Serological pipets, 10 ml |  Corning Corning | 4101 | |
| Serological pipets, 25 ml |  Corning Corning | 4251 | |
| Microcentrifuge tubes (0.5 ml) |  Sarstedt Sarstedt | 72,699 | |
| Microcentrifuge tubes (1.5 ml) |  Greiner Bio-One Greiner Bio-One | 616201 | |
| Microcentrifuge tubes (2.0 ml) |  Sarstedt Sarstedt | 72,695,500 | |
| Anti-Human CD24 APC monoclonal antibody |  eBioscience eBioscience | 17-0247-42 | Working dilution 1:50 |
| Anti-Human CD54 PE monoclonal antibody |  eBioscience eBioscience | 12-0549-42 | Working dilution 1:50 |
| Neuronal Class III β-Tubulin (Tuj1) polyclonal antibody |  Covance Covance | PRB-435P | Working dilution 1:2,000 |
| Alexa Fluor 488 Donkey anti Rabbit |  Life Technologies Life Technologies | A21206 | Working dilution 1:2,000 |
| Zenon® Fluorescein Rabbit IgG Labeling Kit |  Life Technologies Life Technologies | Z-25342 | |
| Neubauer-Improved counting chamber |  Marienfeld Marienfeld | 0640010 | |
| Vortex |  Scientific Industries Scientific Industries | G560E | |
| Thermomixer comfort |  Eppendorf Eppendorf | 5355 000.001 | |
| Accuri C6 flow cytometer |  Becton Dickinson (BD) Becton Dickinson (BD) | 653118 | |
| Microcentrifuge refrigerated, PerfectSpin 24 R |  Peqlab Peqlab | 91-PSPIN-24R | |
| Orbital shaker, Unimax 1010 |  Heidolph Heidolph | 543-12310-00 | |
| Centrifuge refrigerated, Rotanta 96 RC |  Hettich Hettich | 4480-50 | |
| Class II Biological safety cabinet Safe 2020 |  Thermo Scientific Thermo Scientific | 51026640 | |
| CO2 Incubator, Heracell 240i |  Thermo Scientific Thermo Scientific | 51026331 | |
| Vacuum system, Vacusafe comfort |  Integra Biosciences Integra Biosciences | 158320 | |
| Microscope, Axiovert 40 CFL |  Zeiss Zeiss | 451212 | |
| Pipet controller, accu-jet pro |  Brand Brand | 26303 | |
| Micropipet, Pipetman neo P20N (2-20 µl) |  Gilson Gilson | F144563 | |
| Micropipet, Pipetman neo P200N (20-200 µl) |  Gilson Gilson | F144565 | |
| Micropipet, Pipetman neo P1000N (100-1000 µl) |  Gilson Gilson | F144566 |
参考文献
- Herzenberg, L. A., et al. The History and Future of the Fluorescence Activated Cell Sorter and Flow Cytometry: A View from. 48 (10), 1819-1827 (2002).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today’s technology and tomorrow's horizons. Methods (San Diego, Calif). 57 (3), 251-258 (2012).
- Jaye, D. L., Bray, R. A., Gebel, H. M., Harris, W. A. C., Waller, E. K. Translational applications of flow cytometry in clinical practice). J. Immunol. 188 (10), 4715-4719 (2012).
- Henel, G., Schmitz, J. Basic Theory and Clinical Applications of Flow Cytometry. Lab Med. 38 (7), 428-436 (2007).
- Seita, J., Weissman, I. L. Hematopoietic stem cell: self-renewal versus differentiation. Wiley Interdiscip. Rev. Syst. Biol. Med. 2 (6), 640-653 (2010).
- Ulrich, H., Bocsi, J. Phenotypes of stem cells from diverse origin. Cytometry. A. 77 (1), 6-10 (2010).
- Panchision, D. M., et al. Optimized flow cytometric analysis of central nervous system tissue reveals novel functional relationships among cells expressing CD133, CD15, and CD24. Stem cells. 25 (6), 1560-1570 (2007).
- Meyer, R. A., Zaruba, M. E., McKhann, G. M. Flow cytometry of isolated cells from the brain. Anal. Quant. Cytol. 2 (1), 66-74 (1980).
- Junger, H., Junger, W. G. CNTF and GDNF, but not NT-4, support corticospinal motor neuron growth via direct mechanisms. Neuroreport. 9 (16), 3749-3754 (1998).
- McLaren, F. H., Svendsen, C. N., Vander Meide, P., Joly, E. Analysis of neural stem cells by flow cytometry: cellular differentiation modifies patterns of MHC expression. J. Neuroimmunol. 112 (1-2), 35-46 (2001).
- Wang, S., Roy, N. S., Benraiss, A., Goldman, S. A. Promoter-based isolation and fluorescence-activated sorting of mitotic neuronal progenitor cells from the adult mammalian ependymal/subependymal. 22 (1-2), 167-176 (2000).
- Tanke, H. J., vander Keur, M. Selection of defined cell types by flow-cytometric cell sorting. Trends Biotechnol. 11 (2), 55-62 (1993).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243 (1-2), 77-97 (2000).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. J. Neurosci. Methods. 129 (1), 73-79 (2003).
- Ernst, A., et al. Neurogenesis in the striatum of the adult human brain. Cell. 156 (5), 1072-1083 (2014).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat. Rev. Immunol. 4 (8), 648-655 (2004).
- Bandura, D. R., et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time-of-flight mass spectrometry. Anal. Chem. 81 (16), 6813-6822 (2009).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Neveu, I., Rémy, S., Naveilhan, P. The neuropeptide Y receptors, Y1 and Y2, are transiently and differentially expressed in the developing cerebellum. Neuroscience. 113 (4), 767-777 (2002).
- Pruszak, J., Just, L., Isacson, O., Nikkhah, G. Isolation and culture of ventral mesencephalic precursor cells and dopaminergic neurons from rodent brains. Curr. Protoc. Stem Cell Biol. 2 (Unit 2D.5), (2009).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99 (22), 14506-14511 (2002).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993 (1-2), 18-29 (2003).
- Pruszak, J., Isacson, O. Molecular and cellular determinants for generating ES-cell derived dopamine neurons for cell therapy. Adv. Exp. Med. Biol. 651, 112-123 (2009).
- Carson, C. T., Aigner, S., Gage, F. H. Stem cells: the good, bad and barely in control. Nat. Med. 12 (11), 1237-1238 (2006).
- Yuan, S. H., et al. Cell-surface marker signatures for the isolation of neural stem cells, glia and neurons derived from human pluripotent stem cells. PloS One. 6 (3), e17540(2011).
- Roy, N. S., Cleren, C., Singh, S. K., Yang, L., Beal, M. F., Goldman, S. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat. Med. 12 (11), 1259-1268 (2006).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proc. Natl. Acad. Sci. U. S. A. 97 (26), 14720-14725 (2000).
- Pruszak, J., Ludwig, W., Blak, A., Alavian, K., Isacson, O. CD15, CD24, and CD29 define a surface biomarker code for neural lineage differentiation of stem cells. Stem Cells. 27 (12), 2928-2940 (2009).
- Peh, G. S. -L., Lang, R. J., Pera, M. F., Hawes, S. M. CD133 expression by neural progenitors derived from human embryonic stem cells and its use for their prospective isolation. Stem Cells Dev. 18 (2), 269-282 (2009).
- Golebiewska, A., Atkinson, S. P., Lako, M., Armstrong, L. Epigenetic landscaping during hESC differentiation to neural cells. Stem Cells. 27 (6), 1298-1308 (2009).
- Dietrich, J., Noble, M., Mayer-Proschel, M. Characterization of A2B5+ glial precursor cells from cryopreserved human fetal brain progenitor cells. Glia. 40 (1), 65-77 (2002).
- Nishiyama, A. NG2 cells in the brain: a novel glial cell population. Hum. Cell. 14 (1), 77-82 (2001).
- Jungblut, M., et al. Isolation and characterization of living primary astroglial cells using the new GLAST-specific monoclonal antibody ACSA-1. Glia. 60 (6), 894-907 (2012).
- Ono, Y., et al. Differences in neurogenic potential in floor plate cells along an anteroposterior location: midbrain dopaminergic neurons originate from mesencephalic floor plate cells. Development. 134 (17), 3213-3225 (2007).
- Chung, S., et al. ES cell-derived renewable and functional midbrain dopaminergic progenitors. Proc. Natl. Acad. Sci. U.S.A. 108 (23), 9703-9708 (2011).
- Doi, D., et al. Isolation of Human Induced Pluripotent Stem Cell-Derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation. Stem Cell Reports. 2 (3), 337-350 (2014).
- Solozobova, V., Wyvekens, N., Pruszak, J. Lessons from the embryonic neural stem cell niche for neural lineage differentiation of pluripotent stem cells. Stem Cell Rev. 8 (3), (2012).
- Turaç, G., et al. Combined flow cytometric analysis of surface and intracellular antigens reveals surface molecule markers of human neuropoiesis. PloS One. 8 (6), e68519(2013).
- Buchwalow, I. B., Böcker, W. Chapter 2. Immunohistochemistry: Basics and Methods. , 9-17 (2010).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. J. Vis. Exp. (70), e4287(2012).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Hawkins, E. D., et al. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Quah, B. J. C., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. J. Vis. Exp. 44, (2010).
- Sukhdeo, K., et al. Multiplex flow cytometry barcoding and antibody arrays identify surface antigen profiles of primary and metastatic colon cancer cell lines. PloS One. 8 (1), e53015(2013).
- Jiang, L., et al. Daucosterol promotes the proliferation of neural stem cells. The J. Steroid Biochem. Mol. Biol. 140, 90-99 (2014).
- Hulspas, R., et al. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry. B. 76 (6), 355-364 (2009).
- Moloney, M., Shreffler, W. G. Basic science for the practicing physician: flow cytometry and cell sorting. Annals of Allergy, Asthm., & Immunology: Official Publication of the American College of Allergy, Asthma., & Immunology. 101 (5), 544-549 (2008).
- Siebzehnrubl, F. A., et al. Isolation and characterization of adult neural stem cells. Methods Mol. Biol. 750, 61-77 (2011).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain). J. Neurosci. Methods. 203 (1), 10-18 (2012).
- Tham, C. -S., Lin, F. -F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. Int. J. Dev. Neurosci. 21 (8), 431-443 (2003).
- Nguyen, H. X., Beck, K. D., Anderson, A. J. Quantitative assessment of immune cells in the injured spinal cord tissue by flow cytometry: a novel use for a cell purification method. J. Vis. Exp. (50), e2698(2011).
- Marchenko, S., Flanagan, L. Counting human neural stem cells. J. Vis. Exp. (7), 262(2007).
- Brunlid, G., Pruszak, J., Holmes, B., Isacson, O., Sonntag, K. C. Immature and neurally differentiated mouse embryonic stem cells do not express a functional Fas/Fas ligand system. Stem Cells. 25 (10), 2551-2558 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J. Neurosci. Methods. 71 (2), 143-155 (1997).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat. Protoc. 1 (4), 1947-1951 (2006).
- Nielsen, J. A., Maric, D., Lau, P., Barker, J. L., Hudson, L. D. Identification of a novel oligodendrocyte cell adhesion protein using gene expression profiling. J. Neurosci. 26 (39), 9881-9891 (2006).
- Daneman, R., et al. The mouse blood-brain barrier transcriptome: a new resource for understanding the development and function of brain endothelial cells. PloS One. 5 (10), e13741(2010).
- Gräbner, R., Till, U., Heller, R. Flow cytometric determination of E-selectin, vascular cell adhesion molecule-1, and intercellular cell adhesion molecule-1 in formaldehyde-fixed endothelial cell monolayers. Cytometry. 40 (3), 238-244 (2000).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Lathia, J. D., et al. High-throughput flow cytometry screening reveals a role for junctional adhesion molecule a as a cancer stem cell maintenance factor. Cell Rep. 6 (1), 117-129 (2014).
- Ganat, Y. M., et al. Identification of embryonic stem cell-derived midbrain dopaminergic neurons for engraftment. J. Clin. Invest. 122 (8), 2928-2939 (2012).
- Hedlund, E., et al. Embryonic stem cell-derived Pitx3-enhanced green fluorescent protein midbrain dopamine neurons survive enrichment by fluorescence-activated cell sorting and function in an animal model of Parkinson’s disease. Stem Cells. 26 (6), 1526-1536 (2008).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Chivet, M., Hemming, F., Pernet-Gallay, K., Fraboulet, S., Sadoul, R. Emerging role of neuronal exosomes in the central nervous system. Front. Physiol. 3, 145(2012).
- Graner, M. W., et al. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 23 (5), 1541-1557 (2009).
- Eldh, M., Lötvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. (59), e3037(2012).
- Capela, A., Temple, S. LeX is expressed by principle progenitor cells in the embryonic nervous system, is secreted into their environment and binds Wnt-1. Dev. Biol. 291 (2), 300-313 (2006).
- Nieoullon, V., Belvindrah, R., Rougon, G., Chazal, G. mCD24 regulates proliferation of neuronal committed precursors in the subventricular zone. Mol. Cell. Neurosci. 28 (3), 462-474 (2005).
- Nagato, M., et al. Prospective characterization of neural stem cells by flow cytometry analysis using a combination of surface markers. J. Neurosci. Res. 80 (4), 456-466 (2005).
- Hall, P. E., Lathia, J. D., Miller, N. G. A., Caldwell, M. A., French-Constant, C. Integrins are markers of human neural stem cells. Stem Cells. 24 (9), 2078-2084 (2006).
- Hargus, G., et al. Differentiated Parkinson patient-derived induced pluripotent stem cells grow in the adult rodent brain and reduce motor asymmetry in Parkinsonian rats. Proc. Natl. Acad. Sci. U.S.A. 107 (36), 15921-15926 (2010).
- Elkabetz, Y., et al. Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes Dev. 22 (2), 152-165 (2008).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。