A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח cytometry זרימת פרוטוקולים למשטח והתאי Antigen של סוגי תאים עצביים
In This Article
Summary
We provide a detailed description of a protocol for flow cytometric analysis of surface antigens and/or intracellular antigens in neural cell types. Critical aspects of experimental planning, step-by-step methodological procedures, and fundamental principles of flow cytometry are explained in order to enable neurobiologists to exploit this powerful technology.
Abstract
Flow cytometry has been extensively used to define cell populations in immunology, hematology and oncology. Here, we provide a detailed description of protocols for flow cytometric analysis of the cluster of differentiation (CD) surface antigens and intracellular antigens in neural cell types. Our step-by-step description of the methodological procedures include: the harvesting of neural in vitro cultures, an optional carboxyfluorescein succinimidyl ester (CFSE)-labeling step, followed by surface antigen staining with conjugated CD antibodies (e.g., CD24, CD54), and subsequent intracellar antigen detection via primary/secondary antibodies or fluorescently labeled Fab fragments (Zenon labeling). The video demonstrates the most critical steps. Moreover, principles of experimental planning, the inclusion of critical controls, and fundamentals of flow cytometric analysis (identification of target population and exclusion of debris; gating strategy; compensation for spectral overlap) are briefly explained in order to enable neurobiologists with limited prior knowledge or specific training in flow cytometry to assess its utility and to better exploit this powerful methodology.
Introduction
Cytometry זרימה נוצל בהרחבה באימונולוגיה, המטולוגיה ואונקולוגיה להגדיר אוכלוסיות תאים באמצעות מאפיינים פנימיים פיזור, ביטוי אנטיגן שטח פני תא, ופרמטרים אחרים הקרינה 1-3. תובנות שלנו לפיתוח שושלת דם ומחלות הן תוצאה למידה משמעותית של העידון המתמשך של מתודולוגיה זו לאחר 4,5 היישום לראשונה שלה. הגברת מודעות לפוטנציאל האנליטי כמותיים והכולל של זרימת cytometry לאחרונה עודדו את השימוש הנרחב יותר שלה במחקר בתאי גזע ועשויות לאפשר התקדמות דומה עמוקה במסגרת זמן קצרה יותר 6. עם זאת, היישום של הזרימה cytometry לנתח באופן ספציפי ולבודד אוכלוסיות עצביות נתפס עוד מאתגר. בניגוד לתאי hematopoietic שקיימים באופן טבעי בהשעיה, סוגים עצביים תא נקצרים בדרך כלל ממקורות מוגזמים מורכבים שעשויות לכלול גליה וo השונותיס תאים המקיפים כמו גם רשת סבוכה של תאי עצב נושאות תהליך. כתוצאה מכך, נוירוביולוגיה טרם ליישם את הרבגוניות של הזרימה cytometry לפוטנציאל המלא שלה בשגרת מחקר יומית. עם זאת, כל עוד השעיה תא בודדת קיימא יכולה להיות שנוצרה (ופרוטוקולים כבר המציא ומותאם במיוחד למטרה זו 7), cytometry זרימה ותא הקרינה המופעל מיון (FACS) יכול להיחשב מרכיב חשוב ברפרטואר האנליטיות בנוירוביולוגיה 8-11.
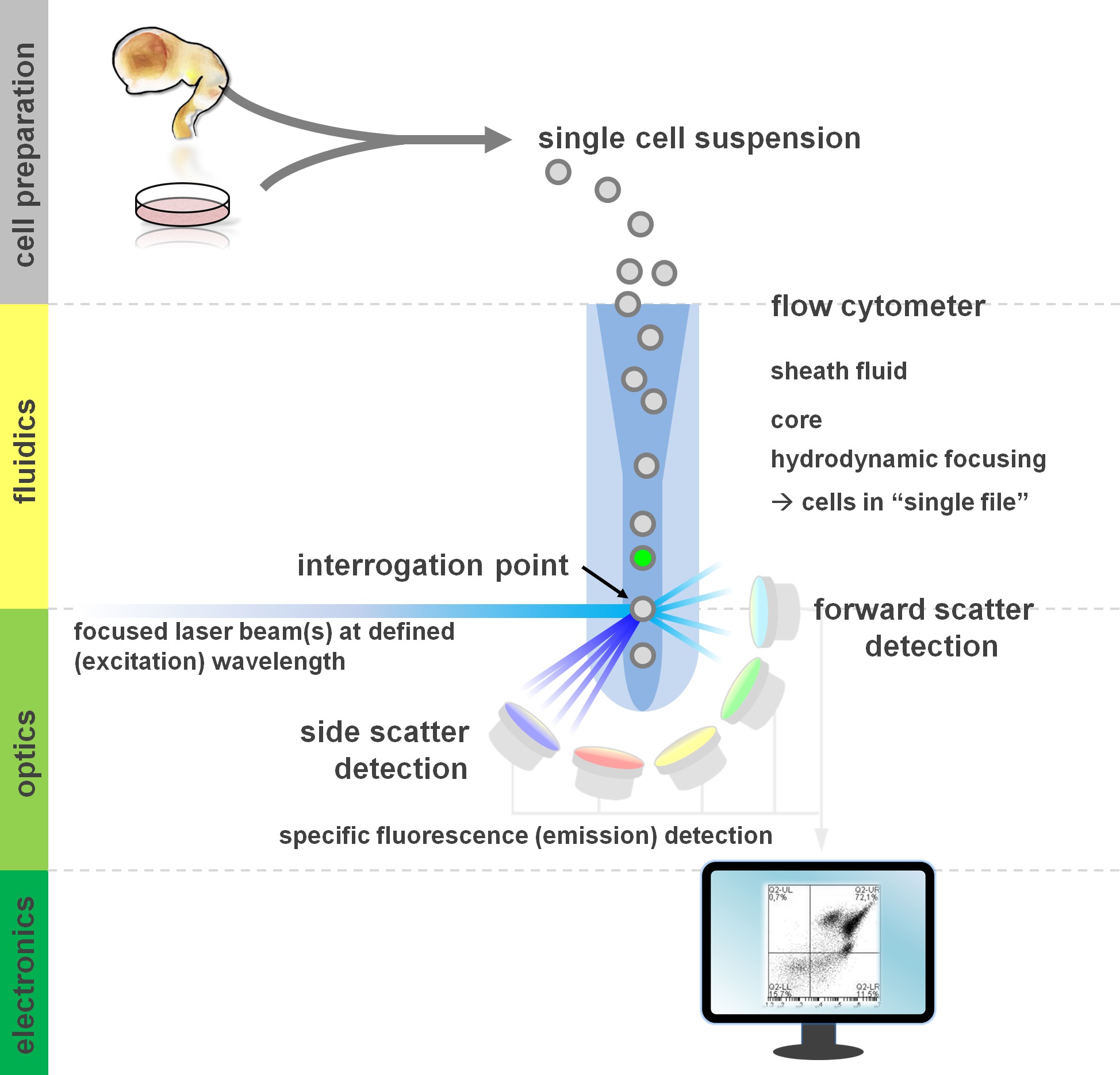
. Cytometers עיקרון איור 1. ניתוח cytometric זרימה ורכיבים של cytometer זרימת זרימה יורכב משלוש מערכות עיקריות: fluidics, אופטיקה ואלקטרוניקה. זרימה יעילה של תאים בתרחיף (שהוכנה מרקמות ראשוניות או בתרבות חוץ גופית) מושגת על ידי flui הנדןד באמצעות הידרודינמית התמקדות, המגביל את המדגם למרכז הליבה שלה. החלקים האופטיים מורכבים מלייזרים שמאירים את הזרם של תאים ומסננים אופטיים המכוונים את האות לגלאים המתאימים. אותות האור זוהו מומרים לאותות אלקטרוניים, מעובד לאחר מכן על ידי מחשב ודמיינו על צג לניתוח נתונים וgating. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
משתמשים של רווח שיטות cytometric זרימה מלפחות הבנה בסיסית של היסודות הבסיסיים כוללים אבני הבניין של cytometer (לסקירה ראה 12,13; גם ראו איור 1). קרן לייזר מצטלבת עם זרם fluidic hydrodynamically ממוקד המכיל את התאים בתרחיף, אשר בתורו לעבור בקרן הלייזר ב'קובץ יחיד "בזה אחר זה. Interceptiבתא (או כל חלקיק אחר, לצורך העניין) עם תוצאות הלייזר בפיזור של אור מחקירת נקודה זו. אור מפוזר ניתן לאתרם בהמשך לכיוון הלייזר (הפיזור קדימה, הקשורים לגודל של החלקיקים), כמו גם בניצב לכיוון שלו (פיזור הצד; המשקף את granulosity של החלקיקים / התא). מאפייני הפיזור האמורים אלה אינם דורשים תיוג ספציפי, ולכן מדגם ללא תווית (או גם פסולת תאית, בועות אוויר, וכו ') יפיק אות (אירוע) על הפיזור קדימה bivariate לעומת פיזור עלילה בצד משמשת בדרך כלל לgating הראשוני. על ידי שימוש בלייזרים ומסננים ספציפיים לספקטרום עירור והפליטה המתאים המתאימים, תאים ניתן לנתח לחיוביות שלה, רמת האינטנסיביות, או היעדרם של סמני ניאון. רוב יישומי cytometric זרימה התמקדו באפיון באמצעות אנטיגנים פני תא. בניגוד לlineag hematopoieticדואר, השושלת העצבית נשארה מוגדרת פחות בהרחבה על פי דפוסי ביטוי epitope משטח 5. אחד יתרונות של ניצול אנטיגנים פני השטח הוא שיכולים להיות נתונה תאי חיים ועד לתא פרדיגמות מיון כגון FACS. בניגוד לכך, מכתים אנטיגן תאיים דורש צעדי קיבעון וpermeabilization לתווך את האינטראקציה epitope-נוגדן, המונע יישומים במורד הזרם שדורשים תאי קיימא. ראוי לציין, גישות כאלה עדיין לאפשר למבחנים כמותיים רבים 14 וכן ניתוחים במורד הזרם לRNA וחלבון ביטוי 15. המטולוגיה, אימונולוגיה ואונקולוגיה השתמשו לעתים קרובות יותר מתריסר סמנים בשיתוף להגדיר תת-אוכלוסיות מסוימות 16. בנוסף, cytometry ההמוני או CyTOF כעת ניתן להשתמש כדי לנתח עד 30 פרמטרים בו זמנית 17,18.
עבור יישומי תאי גזע עצביים, כמו גם תרבויות עיקריות 14,19,20 ההטרוגניות של תאים במבחנה היא תופעה נפוצה 21-23. התאים לא מייצגים את אוכלוסיית היעד של עניין מגלמים גורם שעלול להיות מבלבל עבור קריאה ניסיונית 24,25. נוח, תת הסלולרי השונים קיימים בתוך השעיה תא הטרוגנית לשאת פרופילי ביטוי אנטיגן שונים (ידועים או שעדיין לא פוענחו), אשר יכול להיות מנוצל כדי להגדיר אלה אוכלוסיות שונות. Cytometry זרימה ומכאן יכול לשחק תפקיד מכריע בפתרון ההטרוגניות סלולרית, ובכך, להקל על יישומים ביו-רפואיים (במבחנה מבחני, טיפול בתאים) ולייעל את הקריאה כמותית על ידי התמקדות בתת-קבוצה הרלוונטית ביותר 24,26. שילובי אנטיגן פני השטח שונים זוהו בשנים האחרונות, כדי לאפשר quantitation ובידוד של סוגי תאים עצביים ספציפיים. זה כולל CD133 להעשרה של תאי גזע עצביים 27, שילוב של CD15 / CD24 / אנטיגנים משטח CD29 לבידודה של המועצה לביטחון לאומי, דיפרנציאלינוירון טד ותאי רכס עצביים 28 או CD15 / CD24 / CD44 / CD184 / CD271 לבודד עצבי ותת גליה 25, בין חתימות אחרות 29,30. מעבר לתאי עצב, סמני גליה כוללים A2B5 31, CD44 25, NG2 32 וGLAST 33. הפרסום האחרון ניצל את סמן המוח התיכון floorplate מבשר קורין 34,35 להעשיר למבשרי דופאמין בהשתלת תאי פרקינסון הפרדיגמות 36. מולקולות CD הן לא רק סמנים, אך מתווכים רלוונטיים מבחינה תפקודית של תאי תאי אינטראקציות ושל היכולת של תא להגיב לאותות ממולקולות חוץ-תאיות וצמיחת הגורמים 37. אסטרטגיה אחת של עוד שיפור הארסנל של אנטיגנים CD קומבינטורית לאפיין פיתוח שושלת עצבי היא להשתמש סמנים תאיים ידועים למסך וללהגדיר שילובי אנטיגן CD לסוג תא מסוים של עניין. יש לנו לאחרונה ניצלנו גישה כזו וזיהה CD49F - / CD200 דפוסי ביטוי קומבינטורית גבוהים כגישה חדשנית להעשרת תת נוירונים ממובחנים עצבי מערכות תרבות תאי גזע pluripotent המושרה 38. כאן, אנו כוללים ולדון בפרוטוקול האחרון (ווריאציות אופציונליות ממנו) שבמכתים פני השטח וצביעה תאית ניתן להשתמש בו זמנית להגדרה תת-אוכלוסיות של תאים עצביים על ידי cytometry זרימה.
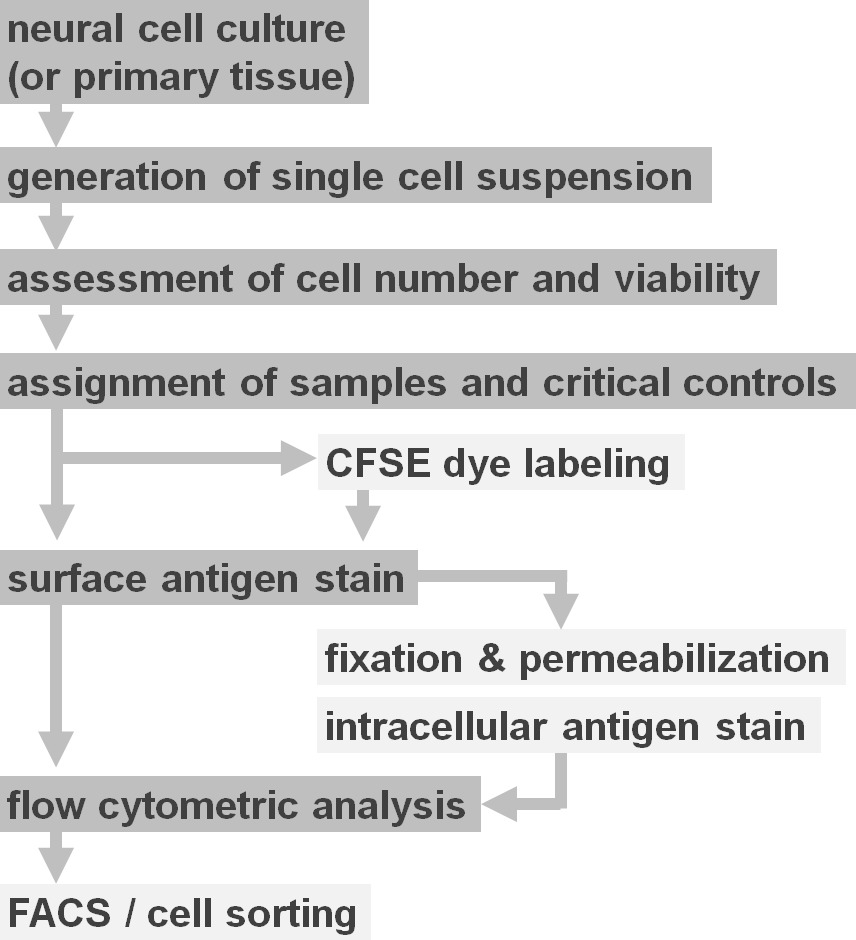
איור 2. תרשים זרימה של אפשרויות פרוטוקול ניסוי. הדמות מתארת ייצוג סכמטי של המעורבים בפרוטוקול את השלבים העיקריים. צעדים אופציונליים (צבע CFSE או תיוג אנטיגן תאיים) מסומנים על ידי קופסות צבע אפור בהירות. לאחר קציר, זה חיוני כדי להעריך את מספר הכדאיות ותא של השעיות תא עצביות לפני מכתים שטח פני תא. חיובי כגם בקרות שליליות צריכה להיות כלולות בתוספת לדגימות של עניין. ניתן לנתח דגימות על ידי ניתוח התזרים cytometric ו / או שימוש בפרדיגמות מיון תא. אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
אמנם יש לנו בעבר השתמשתי נוגדן ראשוני בשילוב עם נוגדנים משני עבור מכתים תאיים 38, אנחנו עכשיו להציג את התיוג שאינו קוולנטיים של הנוגדן הראשוני באמצעות שברי ניאון Fab (תיוג זנון) כוריאציה קלה, ובכך להפחית את הצעדים של תא מניפולציה 39. יתר על כן, כדוגמא נוספת לרבגוניות של הפרוטוקול, אנו מעסיקים תיוג אופציונאלי של תת-קבוצה אחת ניסיונית על ידי carboxyfluorescein succinimidyl אסתר (CFSE) לפני המשטח מכתים אנטיגן. לפני תיוג CFSE כזו מאפשר השוואה המיידית הישירה של שתי שורות תאים או תנאי ניסוי (CFSE שכותרתו vs. ללא תווית) בתוך צינור מדגם יחיד, הפחתת שונות או הבדלים דקים בזמן דגירה ושמירת נוגדן. CFSE הוא צבע פלואורסצנטי הוקם המשמש בדרך כלל לתא מעקב 40, בניסויי התפשטות 41,42 וbarcoding 43,44. לבסוף, בזמן שצעדים ממשיים מיון (FACS, הפרדת תאי immunomagnetic או immunopanning) אינם חלק מפרוטוקול זה, באופן עקרוני, נהלי הקצירה ותיוג המתוארים כאן לעשות דגימות תשואה שיכול להיות נתון למשטח יישומים מבוסס תיוג תאיים מיון antigen- או 15 25,28.
עם מאמר זה, אנו שואפים: לסכם פרוטוקול מכתים אנטיגן שטח קיימא 25,28, לסכם פרוטוקול לזיהוי של מטרות תאיות, כמו גם משטח משולב וניתוח אנטיגן תאיים 38, מציג צעד תיוג צבע תאיים CFSE 41,45 כ אפשרות ניסיונית לcomparative הניתוחים של אוכלוסיות תאים עצביות, ולסכם גישות לזרום ניתוח cytometric (שליטה ובקרה נאותה 13,46, gating אסטרטגיה ונתונים מצגת 47).
Access restricted. Please log in or start a trial to view this content.
Protocol
1. קציר Cell העצבי
- הערכה על ידי מיקרוסקופ:
- לפני שיתחיל בניסוי, לבדוק את מצב התרבות בשדה בהיר או מיקרוסקופ לעומת שלב.
הערה: בעוד רקמה עצבית העיקרית המתקבלת מניתוחים היא, בעיקרון, נוח באותה מידה לזרום ניתוח cytometric 14,28, שים לב שהפוקוס של הפרוטוקול הוא על תאים המתקבלים ממערכות תא עצביות במבחנה.
- לפני שיתחיל בניסוי, לבדוק את מצב התרבות בשדה בהיר או מיקרוסקופ לעומת שלב.
- תאי קציר 7:
- לשטוף בעדינות את הצלחת / הבקבוקון של תאים חסיד עם Mg 2 + / Ca 2 + פוספט שנאגרו מלוח חופשי (PBS) בשעה RT (למשל, 5 מיליליטר לבקבוק T75, 3 מ"ל לכל גם לצלחת 6-היטב, או 10 מ"ל ל צלחת 10 סנטימטרים).
הערה: PBS בשימוש בכל הפרוטוקול היא Mg 2 + / Ca 2 + חופשי.- לדוגמא הווידאו, השתמש בקבוק T75 של תאי נוירובלסטומה SH-SY5Y בconfluency 80%. החל צעדי כביסה נוספים במקרים בהםפסולת רבה נמצאת בצלחת.
- שקול שוטף עם, Percoll, או Ficoll 49 הדרגתיים בסרום PBS 48 המכיל אלבומין צנטריפוגה ו / או חרוזים זמינים מסחרי 50,51. הסרת המיאלין ושומנים אחרים או מזהמים אחרים היא קריטית, במיוחד כאשר מקורות עיקריים רקמה בוגרות נמצאים בשימוש.
- להוסיף החלפת טריפסין מראש התחמם (37 ° C) בנפח מתאים, המכסה את כל פני השטח של כלי תרבית רקמה.
הערה: לחלופין, לשקול Accutase או אפשרויות עיכול אנזימטי אחרות. שלב קריטי זה עלול להשפיע לרעה על ביטוי epitope משטח (ראה 7). - דגירה הצלחת / הבקבוק בC ° 37 ל2-5 דקות (תלוי בסוג התא) כדי לאפשר לתאי לנתק. לטפוח בעדינות את כלי תרבית רקמה או מיושר עם pipet סרולוגיות כדי לסלק את התאים. הימנע על עיכול (כמו זה יכול לגרום לאובדן תא וקרישה בשלבים מאוחר יותר).
- Quench החלפת טריפסין ידי הוספת הנפח כפול של זרימת חיץ (2% FBS PBS) ולאסוף את התאים בצינור חרוטי 15 מיליליטר.
- בעדינות triturate ההשעיה התא באמצעות pipet microliter (100 - 1,000 μl) או pipet 5 מיליליטר סרולוגיות להכין השעיה תא בודדת.
- צנטריפוגה התאים ב 220 XG במשך 5 דקות במהירות של 25 ° C. בזהירות לשאוב supernatant עוזב גלולה מאחורי.
- מחדש להשעות את גלולה בנפח מתאים של זרימת חיץ, תלוי בגודל של גלולה (למשל, לבקבוק T75 ומחוברות אחת של תאי SH-SY5Y התשואה הטיפוסית היא לפחות 10 x 10 6 תאים, ובמקרה זה התאים הם resuspended ב 5 מיליליטר של חיץ זרימה).
הערה: אם גושים או קרישה גדולים יותר הם נצפו, לסנן דרך 30 - רשת מיקרומטר 100.
- לשטוף בעדינות את הצלחת / הבקבוקון של תאים חסיד עם Mg 2 + / Ca 2 + פוספט שנאגרו מלוח חופשי (PBS) בשעה RT (למשל, 5 מיליליטר לבקבוק T75, 3 מ"ל לכל גם לצלחת 6-היטב, או 10 מ"ל ל צלחת 10 סנטימטרים).
- תא ספירה 52:
- העבר את aliquot קטן של ההשעיה תא צינור microcentrifuge ולדלל ביחס מוגדר בהיקף של TRכחול ypan או צבע כדאיות חלופי לפני שמערכת תא ספירה אוטומטית ההעברה לhemocytometer או.
- לדלל את ההשעיה התא בריכוז של 1 x 10 6 תאים / מיליליטר קיימא על ידי הוספת הנפח המתאים של זרימת חיץ או PBS עם BSA 0.1% (אם ימשיך עם תיוג CFSE).
הערה: יודיד Propidium, D-7 aminoactinomycin, V Annexin וערכות assay הכדאיות ניתן לתקן זמינות מסחרי מייצגים אפשרויות חלופיים כדי להעריך את הכדאיות של תאים. כמו כן, מבחני אפופטוזיס באמצעות caspase-3 הקרינה כפי שתוארו לעיל 53 ניתן להשתמש. ערוצי ניאון יהיו "כבושים" על ידי חומרים כימיים אלה שעלולים להגביל את האפשרויות לצעדים הבאים אם הוא כלול בכל הדגימות.
2. תאיים Dye תיוג שימוש CFSE (איור 3)
- לדלל את CFSE לריכוז המניה רצוי שיכול לשמש בקלות.
הערה: בניסויים אלה ריכוז מניות של0.01 מ"מ היה בשימוש. קבע את ריכוז העבודה האופטימלי של CFSE אמפירי. - הוסף 10 μl של 0.01 מ"מ פתרון CFSE לכל מיליליטר של תאים (סעיף 1.3.2, ריכוז של 1 x 10 6 תאים / מיליליטר בBSA + 0.1% PBS) לריכוז סופי של 0.1 מיקרומטר. בקצרה מערבולת לערבב היטב.
הערה: ריכוזי CFSE משמשים כאן הם על פי עשרה נמוכים יותר מאלה מיושמים בדרך כלל במבחני שגשוג, ומכאן תא רעילות של הצבע הוא מינימאלי. אנחנו לא שומרים השפעות שליליות על כדאיות תא. - דגירה במשך 5 דקות בRT עם רעד קבוע (200 סל"ד). להגן מפני אור.
- להרוות את הצבע על ידי הוספת 5 כרכים של זרימת חיץ לצינורות. צנטריפוגה XG ב 94 דקות 5 ב RT.
- בטל supernatant עוזב גלולה מאחורי. מחדש להשעות את התאים עם 5 כרכים של זרימת חיץ.
- צנטריפוגה XG ב 94 דקות 5 ב RT. בטל supernatant מחדש להשעות את התאים בזרימת חיץ בריכוז של 1 x 10 6 תאים / מיליליטר.
- להוסיף מספר שווה של תאים בלא כתם המעניינים את ההשעיה התא המוכתמת. המשך לעלות על פני השטח פרוטוקול אנטיגן צביעה (סעיף 3).

איור 3. איתור של אנטיגן ביטוי פני השטח CD ההפרש בין שתי שורות תאים באמצעות תאי נוירובלסטומה SH-SY5Y CFSE צבע תיוג. הוא מראש שכותרתו עם CFSE לזיהוי שלאחר מכן בהשוואה לfibroblasts BJ ללא תווית. Co-הכתמה של המדגם המעורב (לוחות מימין) עם סמני פני השטח CD24 או CD54 (שני מצומדות לAPC) מוכיחה כי שורות תאים הן בקלות להבחין בשל הכתמת CFSE (חיצים = SH-SY5Y; ראשי חץ = fibroblasts BJ). רוב תאי SH-SY5Y להביע CD54 CD24 אבל לא (ICAM-1). בניגוד לכך, fibroblasts BJ (CFSE-שלילי) הם חיובי לשלילי CD54 אבל במידה רבה לCD24.יעד "https://www.jove.com/files/ftp_upload/52241/52241fig3highres.jpg" = "_ blank"> לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
מכתים Surface 3. Cell
- צינורות תווית כולל דגימות ובקרה קריטית (ראה טבלה 1).
| צינור לא. | שם לדוגמא | Antigen-fluorophore | דילול |
| 1 | תאים בלא כתם | - | |
| 2 | צבעוני יחיד | CD24-APC | 01:50 |
| 3 | צבעוני יחיד | 488nm פלואוריד Tuj1-Alexa | 1: 2,000 |
| 4 | Double צבעוני | CD24-APC | 01:50 |
| 488nm פלואוריד Tuj1-Alexa | 1: 2,000 | ||
| 5 | צבעוני יחיד | משני בלבד: 488nm פלואוריד Alexa | 1: 2,000 |
טבלת 1. ist L של צינורות להיכלל בזרימה אופיינית cytometry ניסוי. הטבלה מציגה במספר מינימלי של צינורות מדגם דרושים לניסוי שיתוף מכתים המתואר במאמר זה וידאו. ניסוי אידיאלי צריך לכלול את כל הפקדים הדרושים (בקרות שליליות, חיוביות, כמו גם פיצוי) לפירוש מדויק של התוצאות שהתקבלו.
- הוספה של השעיה תא (מסעיף 2.7 או 1.3.2) 100 μl לכל צינור 1.5 מיליליטר microcentrifuge.
הערה: ודא מינימום של 0.1 x 10 6 תאים נמצא בהשעית תא 100 μl. - הוסף נוגדן fluorophore מצומדת למדגם בדילול מתאים.
הערה: קביעה עובדת דילול עבור כל נוגדן לפני הניסוי. ראה טבלה 2 לo רשימהאנטיגנים משטח עצביים ו.
| Antigen | סוג התא | התייחסות |
| CD15 | תאי גזע עצביים | [28, 67] |
| CD24 | תאים עצביים | [28, 68] |
| CD29 | תאי גזע עצביים | [28, 69, 70] |
| CD44 | תאי גלייה | [25] |
| CD49f | תאי גזע עצביים | [38] |
| CD56 (NCAM) | תאים עצביים | [71] |
| CD133 | תאי גזע עצביים | [27] |
| CD184 | תאי גזע עצביים ותאי גלייה | [25] |
| CD200 | תאים עצביים | [38] |
| CD271 | תאי גזע רכס עצבי | |
| A2B5 | תאי גלייה | [31] |
| קורין | מבשרי דופאמין | [35, 36] |
| FORSE1 | תאי גזע עצביים (NSC) | [72] |
| GLAST | תאי גלייה | [33] |
| NG2 | תאי גלייה | [32] |
בחירת טבלת 2. אנטיגנים משטח עצביים. טבלה זו מספקת רשימה של פני השטח epitopes מצאה להתבטא בסוגי תאים שונים עצביים כדי להדגים את הלוח הגובר של אנטיגנים משטח משמשים כדי לאפיין את השושלת העצבית. שים לב שבחירה זו היא רחוקה מלהיות מושלם ושרוב הסמנים אלה באים לידי ביטוי גם בטווח של תאים עצביים ולא עצביים אחרים. כתוצאה מכך, שילוב של מספר סמנים יידרש להגדיר טוב יותר ולבודד את תת עצביים מצויינים.
- אמנות = "4">
- דגירה למשך 30 דקות על שייקר מסלולית (200 סל"ד) בחושך.
- לשטוף חיץ זרימה
- הוסף 1 מיליליטר של חיץ זרימה לצינורות. צנטריפוגה ב380 XG במשך 4 דקות ב 4 מעלות צלזיוס.
- בטל supernatant עוזב גלולה מאחורי.
- חזור על השלב לשטוף שוב.
- לאחר לשטוף את השני, למזוג supernatant מחדש להשעות את התאים בזרימת חיץ לנפח סופי של 100 μl.
- השתמש במדגם לניתוח הזרימה cytometric. לחלופין, להמשיך בסעיף 4 ו -5.
הערה: אם תאים הם להיות מסודרים ולהחזיר לפוסט FACS-התרבות (כלומר, השעיה תא קיימא ללא קיבוע או permeabilization), ליישם טכניקות ספטית במהלך המסיק, הצביעה וצעדים אנליטיים.
4. קיבוע וpermeabilization 38
- paraformaldehyde קיבעון באמצעות (PFA):
- הכן חיץ קיבעון המכיל 2% PFA בPBS.
הערה: PFA מזיק לאדם ולסביבה. השתמש בציוד מגן אישי מתאים וזורקי פסולת בהתאם לתקנות מקומיות. - הוסף 500 μl של חיץ קיבעון להשעית תא 100 μl.
- דגירה הצינורות ב RT במשך 15 דקות על שייקר מסלולית (100 סל"ד) בחושך.
- הכן חיץ קיבעון המכיל 2% PFA בPBS.
- לשטוף PBS:
- הוסף 1 מיליליטר של PBS לצינור. צנטריפוגה ב380 XG במשך 3 דקות ב 4 מעלות צלזיוס.
- בטל / למזוג supernatant עוזב כ -100 μl בצינור.
- Permeabilization עם Tween-20:
- הכן חיץ permeabilization המכיל 0.7% Tween-20 בPBS.
- הוסף 500 μl של חיץ permeabilization להשעית תא 100 μl.
- דגירה הצינורות ב RT במשך 15 דקות על שייקר מסלולית (100 סל"ד) בחושך.
- שוטף את התאים פעם עם PBS (כמתואר בסעיף 4.2) ולהסיר את supernatant משיתוף הצינורותmpletely, ומשאיר רק את גלולה מאחורי.
5. תאיים Antigen מכתים 38 (איור 4)
- הכנה של פתרונות נוגדן ראשוניים:
- לדלל את הנוגדנים הראשוניים במאגר דילול המכילים 1% אלבומין בסרום שור, סרום 10% (לדוגמא, בסרום נורמלי חמור או עז) וTween-20 0.5% ב- PBS.
הערה: בחר את הסרום לשימוש בהתאם למין הנוגדנים משני הועלו ב. - לחלופין, להשתמש בתיוג והעמסת זנון של הנוגדן הראשוני על פי הוראות היצרן.
- הכן 1 מיקרוגרם של נוגדן ראשוני PBS ב דילול מתאים (נפח כולל ≤ 20 μl).
- הוסף 5 μl של מגיב זנון והעמסת IgG תיוג (רכיב) לפתרון הנוגדנים.
- דגירה את התערובת במשך 5 דקות בRT.
- הוסף 5 μl של מגיב חסימת זנון (המרכיב B) לתערובת התגובה.
- דגירההתערובת במשך 5 דקות בRT. החל הנוגדנים למדגם תוך 30 דקות.
- לדלל את הנוגדנים הראשוניים במאגר דילול המכילים 1% אלבומין בסרום שור, סרום 10% (לדוגמא, בסרום נורמלי חמור או עז) וTween-20 0.5% ב- PBS.
- צביעת נוגדן ראשונית:
- הוספה של פתרון הנוגדן הראשוני לתא גלולה 100 μl ועדינות triturate לערבב.
- לחלופין, להוסיף נוגדן שכותרתו והעמסת זנון להשעית התא בדילול המתאים.
- דגירה הצינורות ב RT למשך 30 דקות על שייקר מסלולית (200 סל"ד), מוגן מפני אור. שוטף את התאים פעם עם PBS (כמתאר בסעיף 4.2) ולהסיר את supernatant מהצינורות לחלוטין, ומשאיר רק את גלולה מאחורי.
- צביעה משנית נוגדן (לא נדרשה לנוגדנים והעמסת זנון שכותרתו):
- לדלל את הנוגדנים משני בPBS בריכוז מתאים.
- הוספה של פתרון נוגדנים משני לתא גלולה 100 μl ועדינות triturate לערבב. דגירה הצינורות ב RT למשך 30 דקות על שייקר (סל"ד 200) בחושך.
- שטוף את הדגימות פעמיים עם PBS (כמתואר בסעיף 4.2).
- שטפים פעם עם זרימת חיץ (ראה סעיף 3.5).
- להשעות מחדש את התאים בכ -150 μl של זרימת חיץ ולנתח על cytometer את הזרימה.
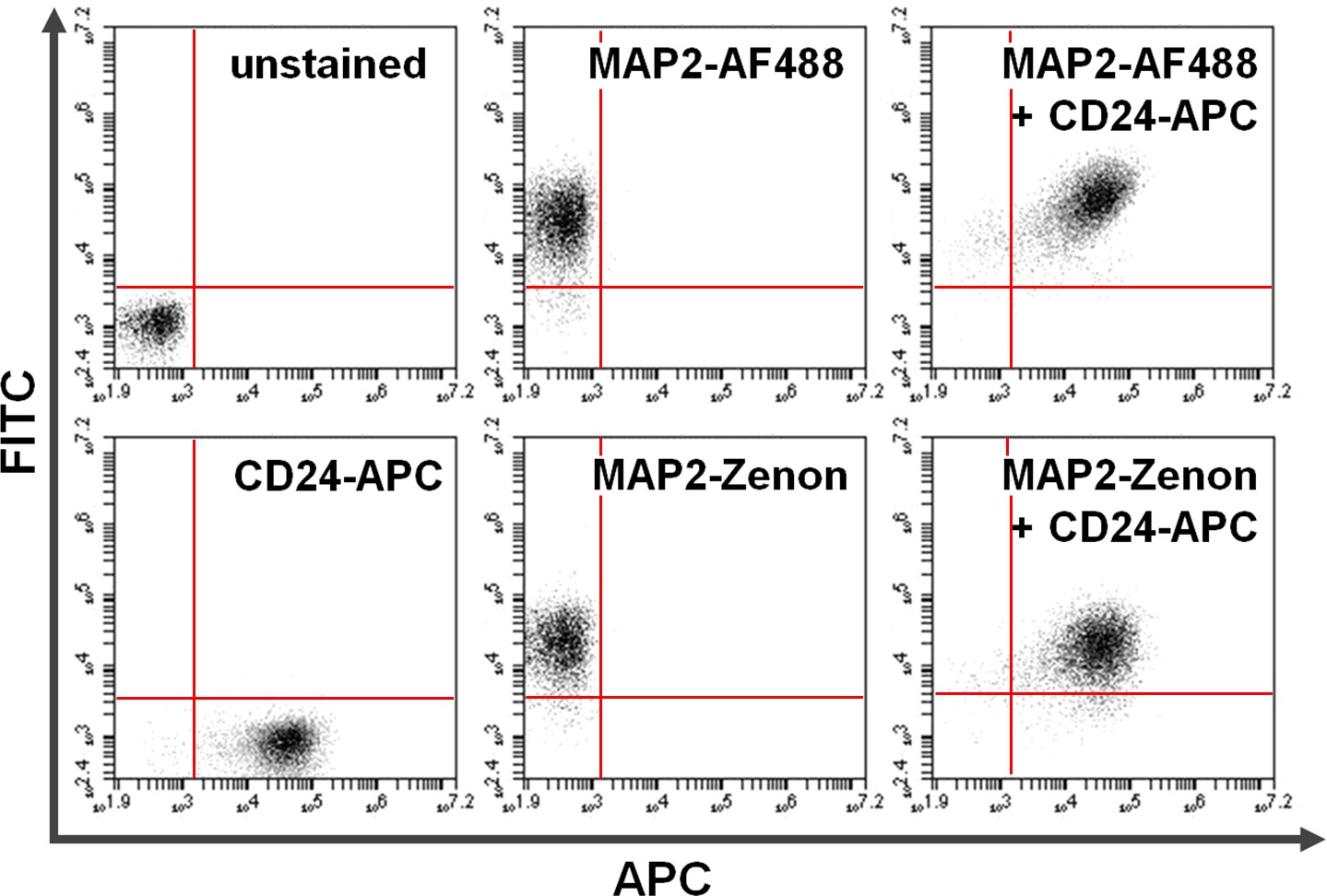
איור 4. Co-הכתמה של פני השטח וחלבונים תאיים. Cytometry זרימת נתונים מדגימה השוואה בין עיקריים + משניים נוגדנים מבוסס לעומת מכתים תאיים המבוססת על העמסת זנון בשילוב עם צביעת פני השטח. חיוביות בלעדיות על ציר y (רבע עליון משמאל) וציר ה- x (רבע ימני תחתון) מראה תאים מוכתמים עבור MAP2 וCD24, בהתאמה. לאחר שיתוף מכתים, MAP2 משותף וביטוי CD24 ניתן לראות ברבע הימני העליון (לוחות מימין). השוואה של שימושאלקסה פלואוריד 488. (למעלה; AF488) לעומת זנון והעמסת (למטה) לתוצאות דומות תשואות MAP2 תיוג אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.
6. זרימה Cytometric ניתוח
- לבצע ניתוח התזרים cytometric מייד לאחר השלמת הפרוטוקול מכתים באמצעות cytometer זרימה עם מסננים מתאימים לגילוי אות. השתמש 488 nm לייזר אדום כחול ו 640 ננומטר עם FL-1 (533/30), FL-2 (585/40), ומסנני FL-4 (675/25) bandpass.
- הגדר את השערים עיקריים המבוססים על הפיזור קדימה וצד לא כולל פסולת ותאים מתים.
- שערי הקרינה שנקבעו למשטח ואנטיגן תאיים ל≤0.5% המבוססים על הדגימות בלא כתם והפיצוי לחפיפה ספקטרלית באמצעות פקדים צבעוניים יחידים.
Access restricted. Please log in or start a trial to view this content.
תוצאות
הפרוטוקול שהוצג כאן מאפשר לגישות מגוונות ניסוי (איור 2). בגרסה הקצרה שלו (שלבים 1, 3 ו -6), זה יכולים להיחשב מדריך לצביעה פשוטה של אנטיגנים על פני שטח. בצורה המורכבת יותר שלו, מספר פרדיגמות שיתוף תיוג עם מגוון של אנטיגנים תאיים יכול להיות רדוף
Access restricted. Please log in or start a trial to view this content.
Discussion
הפרוטוקול המובא כאן הוא מבוסס היטב לתרביות תאים עצביות שמקורם בתאי גזע אנושיים, אבל יכול להיות מיושם באופן שווה למקורות תא עצביים אחרים, כולל רקמה ראשונית או שורות תאים עצביות. בנוסף למקורות עובריים, ניתן לחלץ תאי גזע עצביים או מהאזורים העצביים של המוח בוגר 27. י...
Access restricted. Please log in or start a trial to view this content.
Disclosures
The authors declare no potential conflicts of interest.
Acknowledgements
Our research program is funded through the Emmy Noether-Program of the German Research Foundation (DFG), grant PR1132/3-1. Further support by the Müller-Fahnenberg Foundation of the University of Freiburg is gratefully acknowledged. This study was supported in part by the Excellence Initiative of the German Research Foundation (GSC-4, Spemann Graduate School).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM/F12 (1:1) (Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) |  Life Technologies Life Technologies | 11330057 | |
| DPBS without Ca2+ Mg2+ |  Life Technologies Life Technologies | 14190169 | |
| Fetal bovine serum, qualified, E.U.-approved, South America origin (FBS) |  Life Technologies Life Technologies | 10270-106 | |
| MEM Non-essential amino acids (100x) |  Life Technologies Life Technologies | 11140035 | |
| TrypLE Express |  Life Technologies Life Technologies | 12604013 | |
| Trypan blue solution, 0.4% |  Life Technologies Life Technologies | 15250061 | |
| Paraformaldehyde |  Carl Roth Carl Roth | 335.3 | |
| Bovine serum albumin (BSA) Fraction V |  PAA Laboratories, Coelbe PAA Laboratories, Coelbe | K41-001 | |
| Tween-20 Detergent |  Calbiochem Calbiochem | 655205 | |
| Carboxyfluorescein succinimidyl ester (CFSE) |  eBioscience eBioscience | 65-0850-84 | |
| DMSO |  AppliChem AppliChem | A1584 | |
| Bottle top filters express plus 0.22 µm, 250 ml |  Millipore Millipore | SCGPU02RE | |
| Cell culture treated flasks (T 25) |  NUNC NUNC | 156367 | |
| Cell culture treated flasks (T 75) |  NUNC NUNC | 156499 | |
| Conical tubes (15 ml) |  Greiner Bio-One Greiner Bio-One | 188271 | |
| Conical tubes (50 ml) |  Greiner Bio-One Greiner Bio-One | 227261 | |
| Pasteur pipet, glass (150 mm) |  STEIN Labortechnik, Remchingen STEIN Labortechnik, Remchingen | S03710150 | |
| Pipet tips (0.1-10 µl) |  Corning Corning | 4125 | |
| Pipet tips (1-200 µl) |  Corning Corning | 4126 | |
| Pipet tips (100-1000 µl) |  Corning Corning | 4129 | |
| Serological pipets, 5 ml |  Corning Corning | 4051 | |
| Serological pipets, 10 ml |  Corning Corning | 4101 | |
| Serological pipets, 25 ml |  Corning Corning | 4251 | |
| Microcentrifuge tubes (0.5 ml) |  Sarstedt Sarstedt | 72,699 | |
| Microcentrifuge tubes (1.5 ml) |  Greiner Bio-One Greiner Bio-One | 616201 | |
| Microcentrifuge tubes (2.0 ml) |  Sarstedt Sarstedt | 72,695,500 | |
| Anti-Human CD24 APC monoclonal antibody |  eBioscience eBioscience | 17-0247-42 | Working dilution 1:50 |
| Anti-Human CD54 PE monoclonal antibody |  eBioscience eBioscience | 12-0549-42 | Working dilution 1:50 |
| Neuronal Class III β-Tubulin (Tuj1) polyclonal antibody |  Covance Covance | PRB-435P | Working dilution 1:2,000 |
| Alexa Fluor 488 Donkey anti Rabbit |  Life Technologies Life Technologies | A21206 | Working dilution 1:2,000 |
| Zenon® Fluorescein Rabbit IgG Labeling Kit |  Life Technologies Life Technologies | Z-25342 | |
| Neubauer-Improved counting chamber |  Marienfeld Marienfeld | 0640010 | |
| Vortex |  Scientific Industries Scientific Industries | G560E | |
| Thermomixer comfort |  Eppendorf Eppendorf | 5355 000.001 | |
| Accuri C6 flow cytometer |  Becton Dickinson (BD) Becton Dickinson (BD) | 653118 | |
| Microcentrifuge refrigerated, PerfectSpin 24 R |  Peqlab Peqlab | 91-PSPIN-24R | |
| Orbital shaker, Unimax 1010 |  Heidolph Heidolph | 543-12310-00 | |
| Centrifuge refrigerated, Rotanta 96 RC |  Hettich Hettich | 4480-50 | |
| Class II Biological safety cabinet Safe 2020 |  Thermo Scientific Thermo Scientific | 51026640 | |
| CO2 Incubator, Heracell 240i |  Thermo Scientific Thermo Scientific | 51026331 | |
| Vacuum system, Vacusafe comfort |  Integra Biosciences Integra Biosciences | 158320 | |
| Microscope, Axiovert 40 CFL |  Zeiss Zeiss | 451212 | |
| Pipet controller, accu-jet pro |  Brand Brand | 26303 | |
| Micropipet, Pipetman neo P20N (2-20 µl) |  Gilson Gilson | F144563 | |
| Micropipet, Pipetman neo P200N (20-200 µl) |  Gilson Gilson | F144565 | |
| Micropipet, Pipetman neo P1000N (100-1000 µl) |  Gilson Gilson | F144566 |
References
- Herzenberg, L. A., et al. The History and Future of the Fluorescence Activated Cell Sorter and Flow Cytometry: A View from. 48 (10), 1819-1827 (2002).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today’s technology and tomorrow's horizons. Methods (San Diego, Calif). 57 (3), 251-258 (2012).
- Jaye, D. L., Bray, R. A., Gebel, H. M., Harris, W. A. C., Waller, E. K. Translational applications of flow cytometry in clinical practice). J. Immunol. 188 (10), 4715-4719 (2012).
- Henel, G., Schmitz, J. Basic Theory and Clinical Applications of Flow Cytometry. Lab Med. 38 (7), 428-436 (2007).
- Seita, J., Weissman, I. L. Hematopoietic stem cell: self-renewal versus differentiation. Wiley Interdiscip. Rev. Syst. Biol. Med. 2 (6), 640-653 (2010).
- Ulrich, H., Bocsi, J. Phenotypes of stem cells from diverse origin. Cytometry. A. 77 (1), 6-10 (2010).
- Panchision, D. M., et al. Optimized flow cytometric analysis of central nervous system tissue reveals novel functional relationships among cells expressing CD133, CD15, and CD24. Stem cells. 25 (6), 1560-1570 (2007).
- Meyer, R. A., Zaruba, M. E., McKhann, G. M. Flow cytometry of isolated cells from the brain. Anal. Quant. Cytol. 2 (1), 66-74 (1980).
- Junger, H., Junger, W. G. CNTF and GDNF, but not NT-4, support corticospinal motor neuron growth via direct mechanisms. Neuroreport. 9 (16), 3749-3754 (1998).
- McLaren, F. H., Svendsen, C. N., Vander Meide, P., Joly, E. Analysis of neural stem cells by flow cytometry: cellular differentiation modifies patterns of MHC expression. J. Neuroimmunol. 112 (1-2), 35-46 (2001).
- Wang, S., Roy, N. S., Benraiss, A., Goldman, S. A. Promoter-based isolation and fluorescence-activated sorting of mitotic neuronal progenitor cells from the adult mammalian ependymal/subependymal. 22 (1-2), 167-176 (2000).
- Tanke, H. J., vander Keur, M. Selection of defined cell types by flow-cytometric cell sorting. Trends Biotechnol. 11 (2), 55-62 (1993).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243 (1-2), 77-97 (2000).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. J. Neurosci. Methods. 129 (1), 73-79 (2003).
- Ernst, A., et al. Neurogenesis in the striatum of the adult human brain. Cell. 156 (5), 1072-1083 (2014).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat. Rev. Immunol. 4 (8), 648-655 (2004).
- Bandura, D. R., et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time-of-flight mass spectrometry. Anal. Chem. 81 (16), 6813-6822 (2009).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Neveu, I., Rémy, S., Naveilhan, P. The neuropeptide Y receptors, Y1 and Y2, are transiently and differentially expressed in the developing cerebellum. Neuroscience. 113 (4), 767-777 (2002).
- Pruszak, J., Just, L., Isacson, O., Nikkhah, G. Isolation and culture of ventral mesencephalic precursor cells and dopaminergic neurons from rodent brains. Curr. Protoc. Stem Cell Biol. 2 (Unit 2D.5), (2009).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99 (22), 14506-14511 (2002).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993 (1-2), 18-29 (2003).
- Pruszak, J., Isacson, O. Molecular and cellular determinants for generating ES-cell derived dopamine neurons for cell therapy. Adv. Exp. Med. Biol. 651, 112-123 (2009).
- Carson, C. T., Aigner, S., Gage, F. H. Stem cells: the good, bad and barely in control. Nat. Med. 12 (11), 1237-1238 (2006).
- Yuan, S. H., et al. Cell-surface marker signatures for the isolation of neural stem cells, glia and neurons derived from human pluripotent stem cells. PloS One. 6 (3), e17540(2011).
- Roy, N. S., Cleren, C., Singh, S. K., Yang, L., Beal, M. F., Goldman, S. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat. Med. 12 (11), 1259-1268 (2006).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proc. Natl. Acad. Sci. U. S. A. 97 (26), 14720-14725 (2000).
- Pruszak, J., Ludwig, W., Blak, A., Alavian, K., Isacson, O. CD15, CD24, and CD29 define a surface biomarker code for neural lineage differentiation of stem cells. Stem Cells. 27 (12), 2928-2940 (2009).
- Peh, G. S. -L., Lang, R. J., Pera, M. F., Hawes, S. M. CD133 expression by neural progenitors derived from human embryonic stem cells and its use for their prospective isolation. Stem Cells Dev. 18 (2), 269-282 (2009).
- Golebiewska, A., Atkinson, S. P., Lako, M., Armstrong, L. Epigenetic landscaping during hESC differentiation to neural cells. Stem Cells. 27 (6), 1298-1308 (2009).
- Dietrich, J., Noble, M., Mayer-Proschel, M. Characterization of A2B5+ glial precursor cells from cryopreserved human fetal brain progenitor cells. Glia. 40 (1), 65-77 (2002).
- Nishiyama, A. NG2 cells in the brain: a novel glial cell population. Hum. Cell. 14 (1), 77-82 (2001).
- Jungblut, M., et al. Isolation and characterization of living primary astroglial cells using the new GLAST-specific monoclonal antibody ACSA-1. Glia. 60 (6), 894-907 (2012).
- Ono, Y., et al. Differences in neurogenic potential in floor plate cells along an anteroposterior location: midbrain dopaminergic neurons originate from mesencephalic floor plate cells. Development. 134 (17), 3213-3225 (2007).
- Chung, S., et al. ES cell-derived renewable and functional midbrain dopaminergic progenitors. Proc. Natl. Acad. Sci. U.S.A. 108 (23), 9703-9708 (2011).
- Doi, D., et al. Isolation of Human Induced Pluripotent Stem Cell-Derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation. Stem Cell Reports. 2 (3), 337-350 (2014).
- Solozobova, V., Wyvekens, N., Pruszak, J. Lessons from the embryonic neural stem cell niche for neural lineage differentiation of pluripotent stem cells. Stem Cell Rev. 8 (3), (2012).
- Turaç, G., et al. Combined flow cytometric analysis of surface and intracellular antigens reveals surface molecule markers of human neuropoiesis. PloS One. 8 (6), e68519(2013).
- Buchwalow, I. B., Böcker, W. Chapter 2. Immunohistochemistry: Basics and Methods. , 9-17 (2010).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. J. Vis. Exp. (70), e4287(2012).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Hawkins, E. D., et al. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Quah, B. J. C., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. J. Vis. Exp. 44, (2010).
- Sukhdeo, K., et al. Multiplex flow cytometry barcoding and antibody arrays identify surface antigen profiles of primary and metastatic colon cancer cell lines. PloS One. 8 (1), e53015(2013).
- Jiang, L., et al. Daucosterol promotes the proliferation of neural stem cells. The J. Steroid Biochem. Mol. Biol. 140, 90-99 (2014).
- Hulspas, R., et al. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry. B. 76 (6), 355-364 (2009).
- Moloney, M., Shreffler, W. G. Basic science for the practicing physician: flow cytometry and cell sorting. Annals of Allergy, Asthm., & Immunology: Official Publication of the American College of Allergy, Asthma., & Immunology. 101 (5), 544-549 (2008).
- Siebzehnrubl, F. A., et al. Isolation and characterization of adult neural stem cells. Methods Mol. Biol. 750, 61-77 (2011).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain). J. Neurosci. Methods. 203 (1), 10-18 (2012).
- Tham, C. -S., Lin, F. -F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. Int. J. Dev. Neurosci. 21 (8), 431-443 (2003).
- Nguyen, H. X., Beck, K. D., Anderson, A. J. Quantitative assessment of immune cells in the injured spinal cord tissue by flow cytometry: a novel use for a cell purification method. J. Vis. Exp. (50), e2698(2011).
- Marchenko, S., Flanagan, L. Counting human neural stem cells. J. Vis. Exp. (7), 262(2007).
- Brunlid, G., Pruszak, J., Holmes, B., Isacson, O., Sonntag, K. C. Immature and neurally differentiated mouse embryonic stem cells do not express a functional Fas/Fas ligand system. Stem Cells. 25 (10), 2551-2558 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J. Neurosci. Methods. 71 (2), 143-155 (1997).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat. Protoc. 1 (4), 1947-1951 (2006).
- Nielsen, J. A., Maric, D., Lau, P., Barker, J. L., Hudson, L. D. Identification of a novel oligodendrocyte cell adhesion protein using gene expression profiling. J. Neurosci. 26 (39), 9881-9891 (2006).
- Daneman, R., et al. The mouse blood-brain barrier transcriptome: a new resource for understanding the development and function of brain endothelial cells. PloS One. 5 (10), e13741(2010).
- Gräbner, R., Till, U., Heller, R. Flow cytometric determination of E-selectin, vascular cell adhesion molecule-1, and intercellular cell adhesion molecule-1 in formaldehyde-fixed endothelial cell monolayers. Cytometry. 40 (3), 238-244 (2000).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Lathia, J. D., et al. High-throughput flow cytometry screening reveals a role for junctional adhesion molecule a as a cancer stem cell maintenance factor. Cell Rep. 6 (1), 117-129 (2014).
- Ganat, Y. M., et al. Identification of embryonic stem cell-derived midbrain dopaminergic neurons for engraftment. J. Clin. Invest. 122 (8), 2928-2939 (2012).
- Hedlund, E., et al. Embryonic stem cell-derived Pitx3-enhanced green fluorescent protein midbrain dopamine neurons survive enrichment by fluorescence-activated cell sorting and function in an animal model of Parkinson’s disease. Stem Cells. 26 (6), 1526-1536 (2008).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Chivet, M., Hemming, F., Pernet-Gallay, K., Fraboulet, S., Sadoul, R. Emerging role of neuronal exosomes in the central nervous system. Front. Physiol. 3, 145(2012).
- Graner, M. W., et al. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 23 (5), 1541-1557 (2009).
- Eldh, M., Lötvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. (59), e3037(2012).
- Capela, A., Temple, S. LeX is expressed by principle progenitor cells in the embryonic nervous system, is secreted into their environment and binds Wnt-1. Dev. Biol. 291 (2), 300-313 (2006).
- Nieoullon, V., Belvindrah, R., Rougon, G., Chazal, G. mCD24 regulates proliferation of neuronal committed precursors in the subventricular zone. Mol. Cell. Neurosci. 28 (3), 462-474 (2005).
- Nagato, M., et al. Prospective characterization of neural stem cells by flow cytometry analysis using a combination of surface markers. J. Neurosci. Res. 80 (4), 456-466 (2005).
- Hall, P. E., Lathia, J. D., Miller, N. G. A., Caldwell, M. A., French-Constant, C. Integrins are markers of human neural stem cells. Stem Cells. 24 (9), 2078-2084 (2006).
- Hargus, G., et al. Differentiated Parkinson patient-derived induced pluripotent stem cells grow in the adult rodent brain and reduce motor asymmetry in Parkinsonian rats. Proc. Natl. Acad. Sci. U.S.A. 107 (36), 15921-15926 (2010).
- Elkabetz, Y., et al. Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes Dev. 22 (2), 152-165 (2008).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved