このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
神経細胞型の表面のためのフローサイトメトリーのプロトコルおよび細胞内抗原解析
要約
We provide a detailed description of a protocol for flow cytometric analysis of surface antigens and/or intracellular antigens in neural cell types. Critical aspects of experimental planning, step-by-step methodological procedures, and fundamental principles of flow cytometry are explained in order to enable neurobiologists to exploit this powerful technology.
要約
Flow cytometry has been extensively used to define cell populations in immunology, hematology and oncology. Here, we provide a detailed description of protocols for flow cytometric analysis of the cluster of differentiation (CD) surface antigens and intracellular antigens in neural cell types. Our step-by-step description of the methodological procedures include: the harvesting of neural in vitro cultures, an optional carboxyfluorescein succinimidyl ester (CFSE)-labeling step, followed by surface antigen staining with conjugated CD antibodies (e.g., CD24, CD54), and subsequent intracellar antigen detection via primary/secondary antibodies or fluorescently labeled Fab fragments (Zenon labeling). The video demonstrates the most critical steps. Moreover, principles of experimental planning, the inclusion of critical controls, and fundamentals of flow cytometric analysis (identification of target population and exclusion of debris; gating strategy; compensation for spectral overlap) are briefly explained in order to enable neurobiologists with limited prior knowledge or specific training in flow cytometry to assess its utility and to better exploit this powerful methodology.
概要
フローサイトメトリーを広範囲に固有の散乱特性、細胞表面抗原の発現、および他の蛍光パラメーター1-3を介して細胞集団を定義するために、免疫学、血液学および腫瘍学に おいて利用されてきた。血液系統の開発および疾患に私達の洞察は、その初期の実装4,5の後にこの方法論の連続洗練の有意な程度の結果である。フローサイトメトリーの定量的および全体的な分析的な潜在意識の高まりは、最近、幹細胞研究におけるそのより広範な使用を奨励している短い時間枠6と同様に深い進歩を可能にすることができる。しかし、特に神経集団を分析し、単離するためのフローサイトメトリーの適用は、長い挑戦として認識されている。当然、懸濁液中に存在する造血細胞とは対照的に、神経細胞型は、典型的には、グリアおよび様々Oを含んでいてもよい過度に複雑なソースから収穫するTHER周囲の細胞ならびにプロセス有利子ニューロンの複雑なネットワーク。したがって、神経生物学、毎日研究ルーチンでの完全な電位にフローサイトメトリーの多様性を実現するために至っていない。しかし、神経生物学における分析レパートリーの貴重な要素とみなすことができる限り、生存単一細胞懸濁液を生成することができる(およびプロトコルは、その目的の7のために考案し、最適化されている)として、フローサイトメトリーおよび蛍光活性化細胞選別(FACS) 8-11。
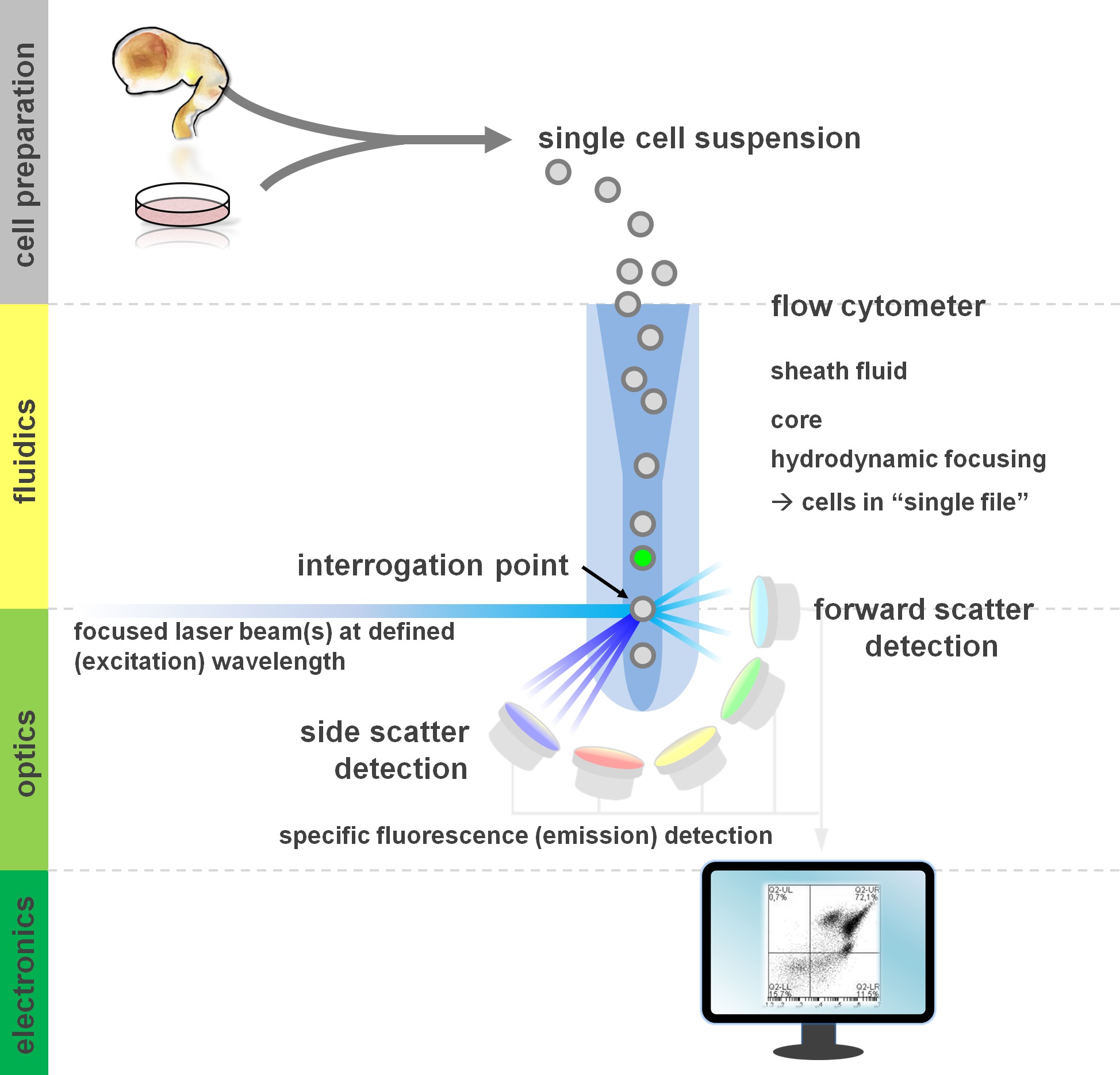
。流体工学、光学、エレクトロニクス: フローサイトメトリー分析フローサイトメーターの構成要素の、図1の原理フローサイトメーターは、3つの主要な系を含む。 (一次組織から、またはインビトロ培養中で調製)懸濁液中の細胞の層流をシースfluiによって達成される流体力学経由dは、その中心コアにサンプルを限定フォーカシング。光学部品は、適切な検出器に信号を導く細胞および光学フィルタのストリームを照らすレーザーで構成されている。検出された光信号は、電気信号に変換し、その後、コンピュータで処理し、データ分析とゲーティングのためのモニター上で可視化されている。この図の拡大版をご覧になるにはこちらをクリックしてください。
サイトメーターのビルディングブロックを含む根本的なファンダメンタルズの少なくとも基本的な理解から、フローサイトメトリー法利益のユーザーは、(レビューのために12,13を参照してください。また、 図1を参照)。レーザビームは、次に、「単一のファイル」次々レーザビームを通過懸濁液中の細胞を含み、流体力学的に集束流体の流れと交差する。 interceptiこの呼掛け点からの光の散乱レーザ結果と細胞(またはそのことについては、他の粒子)の上。散乱光は、レーザー方向(粒の大きさに関連付けられた前方散乱)、ならびにその方向に垂直な(;粒子/細胞のgranulosityを反映する側方散乱)を連続して検出することができる。これらの前述の散乱特性は、(またまたは細胞破片、空気の泡、 など )、非標識試料は、一般的に最初のゲーティングのために使用される側方散乱プロット変量前方散乱の信号(イベント)が生成されますなぜ特異的標識を必要としない。適切なレーザ及び対応する励起および発光スペクトルのために特定のフィルタを使用することにより、細胞は、その陽性、強度のレベル、または蛍光マーカーの非存在について分析することができる。フローサイトメトリー用途の大部分は、細胞表面抗原を介して特性評価に焦点を当てている。造血lineagとは異なり、eは、神経系統は、表面エピトープの発現パターン5によれば以下広く定義されて残っている。表面抗原を利用することの利点の一つは、生きている細胞は、FACSなどのパラダイムを選別細胞を施すことができることである。これとは対照的に、細胞内抗原の染色は、生細胞を必要とする下流の適用を排除する、エピトープ - 抗体相互作用を媒介するために固定および透過手順が必要です。注目すべきは、このようなアプローチは、まだ数多くの定量的アッセイ14だけでなく、RNAとタンパク質発現の15のための下流の分析を可能にします。血液学、免疫学および腫瘍学は、多くの場合、特定の部分集団16を定義するために連携してダース以上のマーカーを使用してきた。さらに、質量フローサイトメトリーまたはCyTOFは現在30のパラメータを同時に17,18まで分析することができる。
神経幹細胞の用途、ならびに初代培養物における細胞の不均一性のために14,19,20体外は一般的な現象で21-23です。興味のある標的集団を代表していない細胞は、実験的な読み出し24,25のための潜在的交絡因子を具現化。好都合には、不均一な細胞懸濁液中に存在する異なる細胞のサブセットは、これらの様々な集団を定義するために利用することができる抗原の発現プロファイル、(既知の、またはまだ解読する)別個に耐える。したがって、細胞の不均一性を解決する際に重要な役割を果たし、それによって、(in vitroアッセイ 、細胞療法における )生物医学的適用を容易にし、最も関連性のサブセット24,26に着目して定量的な読み出しを最適化することができるフローサイトメトリー。種々の表面抗原の組み合わせは、特定の神経細胞型の定量および単離を可能にするために、過去数年にわたって確認されている。これは、神経幹細胞27、NSCの単離のためのCD15 / CD24 / CD29表面抗原の組み合わせの濃縮にCD133を含み、差異他の署名29,30の中で、神経およびグリアサブセット25を分離するためのテッドニューロンと神経堤細胞28またはCD15 / CD24 / CD44 / CD184 / CD271。ニューロンを超えて、グリアマーカーは、A2B5 31、CD44 25、NG2 32とGLAST 33が含まれています。最近の出版物は、パーキンソン細胞移植におけるドーパミン作動性前駆体を濃縮するために、中脳底板前駆体マーカーコリン34,35を36パラダイムに利用している。 CD分子は、マーカーが、細胞-細胞相互作用および細胞外マトリックス分子および成長因子37からの合図に応答する細胞の能力の機能的に関連するメディエーターだけではない。さらに、神経系統の発達を特徴づけるために、コンビナトリアルCD抗原の武器を強化する一つの戦略は、目的の特定の細胞型のためのCD抗原の組み合わせをスクリーニングし、定義することが知られている細胞内マーカーを使用することである。我々は最近、このようなアプローチを悪用し、CD4を特定した9F - / CD200神経に分化誘導された多能性幹細胞培養系38からのニューロンのサブセットを豊かにするための新しいアプローチとして高い組合せ発現パターン。ここでは、表面染色および細胞内染色は、フローサイトメトリーにより神経細胞の亜集団を定義するために同時に使用することができる後者のプロトコル(およびその任意の変形)を議論する。
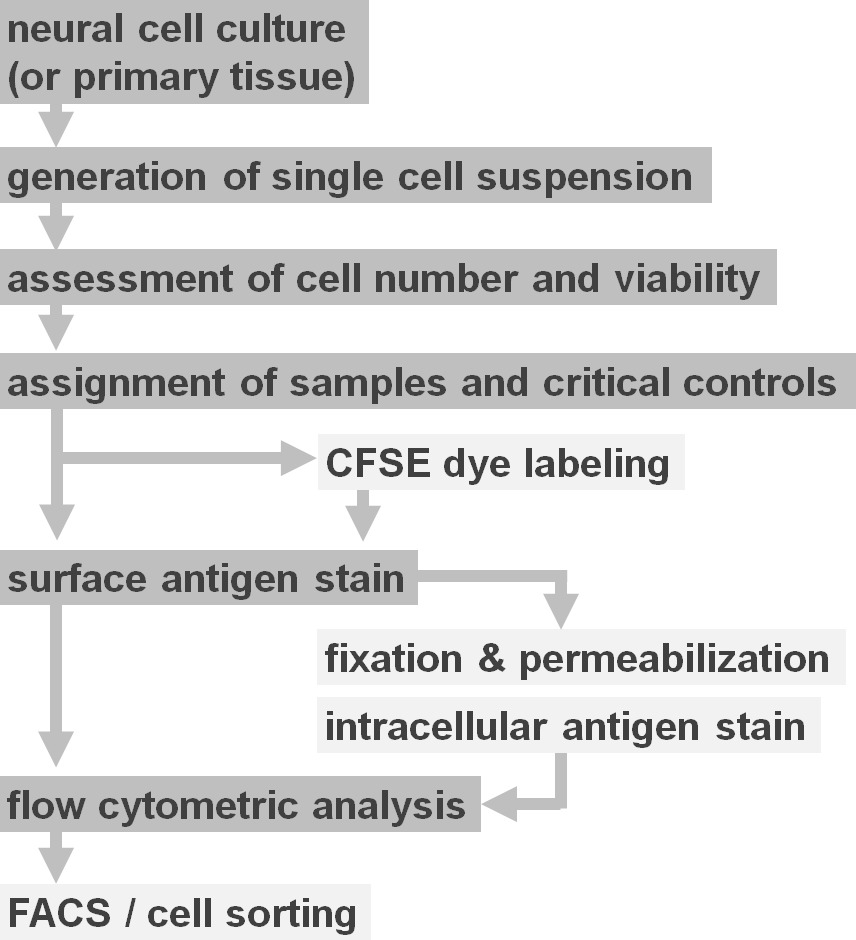
実験プロトコルオプションの図2のフロー図は図は、プロトコルに関与する主要な工程の概略図を示している。任意の工程(CFSE色素または細胞内抗原の標識は)ライトグレーのボックスで示されます。収穫後、細胞表面染色の前に、神経細胞懸濁液の生存度および細胞数を評価することが不可欠である。陽性と同様にネガティブコントロールは、対象のサンプルに加えて、含まれる必要がある。サンプルは、フローサイトメトリー分析によって分析および/ または細胞ソーティングパラダイムで使用することができる。 この図の拡大版をご覧になるにはこちらをクリックしてください。
我々は以前に細胞内染色38二次抗体と組み合わせて一次抗体を使用しているが、我々は今、それによって細胞操作39のステップを減らす、わずかな変化などの蛍光Fab断片(Zenon標識)を介して一次抗体の非共有結合標識を導入する。また、プロトコルの汎用性のさらなる例としては、抗原染色表面の前スクシンイミジルエステル(CFSE)のカルボキシフルオレセインずつの実験のサブセットの任意の標識を使用する。このようなCFSEプレ標識は(2つの細胞株または実験条件の即時の直接比較を可能にする対 CFSE標識。分散またはインキュベーション時間の微妙な違いを削減し、抗体を保存する、単一のサンプルチューブ内で)標識されていない。 CFSEは、一般的に増殖41,42及びバーコード実験43,44において、細胞追跡40のために使用される確立された蛍光色素である。最後に、ここで説明収穫とラベル付けの手順は実行し、実際のソート·ステップ(FACS、免疫磁気細胞分離またはイムノ)は原則的に、このプロトコルの一部ではありませんが、降伏抗原表面受けることができるサンプルまたは細胞内のラベルベースの並べ替えのアプリケーション15 25,28。
この記事では、我々はを目指し:として細胞内のCFSE色素標識工程41,45を提示し 、細胞内の標的の検出のためのプロトコルとしてだけでなく、組み合わせた表面と細胞内の抗原解析38をまとめ、実行可能な表面抗原染色プロトコル25,28をまとめるcomのための実験的なオプションparativeは、神経細胞集団の解析、およびサイトメトリー分析を(適切なコントロール13,46、戦略およびデータプレゼンテーション47をゲート制御)流れるようにアプローチをまとめる。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1.神経細胞の回収
- 顕微鏡による評価:
- 実験を開始する前に、明視野または位相差顕微鏡による培養物の状態を確認。
注:解剖から得られた一次神経組織ではあるが、原則的に、均等に影響を受けやすいサイトメトリー分析14,28を流れるように、プロトコルの焦点はインビトロ神経細胞システムから得られた細胞であることに注意してください。
- 実験を開始する前に、明視野または位相差顕微鏡による培養物の状態を確認。
- 収穫細胞7:
- RT( 例えば 、T75フラスコに5 mlの6ウェルプレートにウェル当たり3ミリリットル、または10 mlの優しく/ Ca 2+のMgを有する接着細胞の皿/フラスコを洗浄2+を含まないリン酸緩衝生理食塩水(PBS) 10cmディッシュ)。
注:PBSをプロトコル全体で使用さは、Mg 2+ / Ca 2+の自由である。- ビデオ例えば、80%のコンフルエンシーでSH-SY5Y神経芽細胞腫細胞のT75フラスコを使用する。例ここで追加の洗浄工程を適用しますかなりの破片が皿の中の存在である。
- 血清アルブミンを含むPBS 48を 、パーコール、またはフィコール49遠心分離勾配および/ または市販のビーズ50,51との洗浄を考慮してください。ミエリンおよび他の脂質または他の汚染物質の除去は、成人原発組織源が使用されている場合は特に重要である。
- 組織培養容器の表面全体を覆って適切な音量で予め温めておいた(37℃)トリプシン置換を加える。
注:あるいは、のAccutaseまたは他の酵素消化のオプションを検討してください。この重要な工程は、負(7参照)表面エピトープの発現に影響を及ぼし得る。 - 細胞は切り離すことができるように(細胞型に応じて)を5分間2 - 37℃で皿/フラスコをインキュベートする。静かに細胞を取り除くために、血清学的ピペットで組織培養容器またはフラッシュをタップします。 (このように、後の工程での細胞の損失および凝固を引き起こす可能性があります)消化の上は避けてください。
- Q二回フローバッファー(PBS中の2%FBS)の体積を添加することによりトリプシン交換uenchし、15mlコニカルチューブ中で細胞を集める。
- 単一細胞懸濁液を調製するために - (1,000μlの100)または5ミリリットルの血清学的ピペットを穏やかにマイクロピペットを用いて細胞懸濁液を粉砕する。
- 25℃で5分間、220×gで細胞を集める。慎重に後ろにペレットを残して上清を吸引除去する。
- フローバッファの適切な体積でペレットを再懸濁ペレット( 例えば、サイズに応じて、SH-SY5Y細胞の一つコンフルエントT75フラスコのための典型的な収率は、少なくとも10×10 6個の細胞を、ケース内のセルであるフロー緩衝液5ml)中に再懸濁する。
注: - 100μmのメッシュ大きなチャンクまたは凝固が認められた場合、30を介してフィルタリングする。
- RT( 例えば 、T75フラスコに5 mlの6ウェルプレートにウェル当たり3ミリリットル、または10 mlの優しく/ Ca 2+のMgを有する接着細胞の皿/フラスコを洗浄2+を含まないリン酸緩衝生理食塩水(PBS) 10cmディッシュ)。
- 52を数えるセル:
- trは、体積で定義された比率で微量遠心管に細胞懸濁液の少量のアリコートを移し、希釈血球計または自動細胞計数システムへの転送前にypan青または代替可能性染料。
- (CFSE標識に進む場合)0.1%BSAでフローバッファーまたはPBSの適切な体積を添加することによって、1×10 6生細胞/ mlの濃度の細胞懸濁液を希釈する。
NOTE:ヨウ化プロピジウム、7-アミノD、アネキシンV及び市販の固定可能な生存率アッセイキットは、細胞の生存率を評価するための代替オプションを表す。また、先に記載53のようにカスパーゼ3蛍光を用いてアポトーシスアッセイを使用することができる。蛍光チャネルは、すべてのサンプルに含まれている場合、後続のステップのためのオプションが制限される場合があり、これらの試薬により「占有」されます。
CFSEを使用して2細胞内の色素の標識(図3)
- 容易に使用することができ、所望のストック濃度にCFSE希釈する。
注:これらの実験のためのストック濃度0.01ミリモルを用いた。経験的にCFSEの最適な使用濃度を決定します。 - 0.1μMの最終濃度のために細胞( セクション1.3.2、PBS + 0.1%BSA中1×10 6細胞/ mlの濃度)の1mlあたり0.01 mMのCFSE溶液10μlを追加します。簡単に言えば渦はよく混合する。
注:ここで使用CFSE濃度は、一般的に増殖アッセイに適用されるものよりも約10倍低い、染料のため、細胞毒性は最小限に抑えられます。我々は、細胞の生存率にマイナスの効果を観察しないでください。 - 絶えず振盪(200rpm)しながら室温で5分間インキュベートする。光から保護します。
- チューブに流れバッファの5ボリュームを追加することで染料を消光。 RTで5分間94×gで遠心分離する。
- 背後にペレットを残して上澄みを捨てる。フロー·バッファの5ボリュームで細胞を再懸濁する。
- RTで5分間94×gで遠心分離する。 / 1×10 6細胞の濃度で上清を、フロー緩衝液中の再懸濁細胞を捨てるミリリットル。
- 染色された細胞懸濁液に興味のある非染色細胞の数と同じ数を追加します。抗原染色プロトコル( 第3節 ) を表面に進みます。

CFSE色素標識を介して2つの細胞株の間の差動CD表面抗原発現の図3の検出。SH-SY5Y神経芽腫細胞を非標識BJ線維芽細胞と比較して、後続の識別のためCFSEで予め標識されている。表面マーカーCD24またはCD54(APCへの結合の両方)との混合試料(右パネル)の共染色は、細胞株によりCFSE染色(;矢頭= BJ線維芽細胞の矢印= SH-SY5Y)に容易に識別可能であることを示している。 SH-SY5Y細胞の大多数は、CD24ではないCD54(ICAM-1)を発現する。これとは対照的に、BJ線維芽細胞(CFSE陰性)は、CD54陽性であるが、CD24のための大部分はネガティブ。「https://www.jove.com/files/ftp_upload/52241/52241fig3highres.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。
3.細胞表面染色
- サンプルおよびクリティカルコントロールを含むラベルチューブ( 表1参照)。
| チューブなし。 | サンプル名 | 抗原フォア | 希釈 |
| 1 | 非染色細胞 | - | |
| 2 | シングルステンド | CD24-APC | 午前1時50分 |
| 3 | シングルステンド | TUJ1-アレクサフルオロ488 | 1:2000 |
| 4 | ステンドダブル | CD24-APC | 午前1時50分 |
| TUJ1-アレクサフルオロ488 | 1:2000 | ||
| 5 | シングルステンド | セカンダリのみ:アレクサフルオロ488 | 1:2000 |
典型的なフローサイトメトリー実験に含まれるチューブの表1. Lイスト。表には、このビデオの記事で説明した共染色実験に必要なサンプル管の最小セットを示しています。理想的な実験は、得られた結果の正確な解釈のために必要なすべての(正、負、ならびに補償制御)の制御を含む必要がある。
- ( セクション2.7または1.3.2からの)各1.5ミリリットルマイクロ遠心チューブに100μlの細胞懸濁液を追加します。
注:必ず、0.1×10 6細胞の最小値は、細胞懸濁液100μlあたり存在していることを確認します。 - 適切な希釈でサンプルにフォアコンジュゲートした抗体を追加します。
注:実験前に各抗体の作業希釈を決定します。リストOについては、表2を参照してくださいF神経表面抗原。
| 抗原 | 細胞型 | リファレンス |
| CD15 | 神経幹細胞 | [28、67] |
| CD24 | 神経細胞 | [28、68] |
| CD29 | 神経幹細胞 | [28、69、70] |
| CD44 | グリア細胞 | [25] |
| たCD49f | 神経幹細胞 | [38] |
| CD56(NCAM) | 神経細胞 | [71] |
| CD133 | 神経幹細胞 | [27] |
| CD184 | 神経幹細胞およびグリア細胞 | [25] |
| CD200 | 神経細胞 | [38] |
| CD271 | 神経堤幹細胞 | [25] |
| A2B5 | グリア細胞 | [31] |
| コリン | ドーパミン作動性前駆体 | [35、36] |
| FORSE1 | 神経幹細胞(NSC) | [72] |
| GLAST | グリア細胞 | [33] |
| NG2 | グリア細胞 | [32] |
神経表面抗原の表2の選択。この表は、神経系統を特徴づけるために使用される表面抗原の増加パネルを例示するために、様々な神経細胞タイプによって発現されることが見出され、表面エピトープのリストを提供する。この選択が完了し、これらのマーカーのほとんどは、他の神経および非神経細胞の範囲で表現されていることをほど遠いであることに注意してください。したがって、いくつかのマーカーの組み合わせは、より良い示さ神経サブセットを定義し、単離するために必要とされる。
- 暗闇の中でオービタルシェーカー(200 rpm)で30分間インキュベートする。
- フロー緩衝液洗浄
- チューブに流れ緩衝液1mlを追加します。 4℃で4分間380×gで遠心し。
- 背後にペレットを残して上澄みを捨てる。
- 再び洗浄ステップを繰り返します。
- 2回目の洗浄の後、上清をデカントし、100μlの最終容量に流れバッファー中で細胞を再懸濁する。
- フローサイトメトリー分析のためのサンプルを使用してください。また、 第4節と5に進みます。
注:細胞が選別し、培養後のFACSに戻されるべきである場合( つまり、固定または透過処理せずに実行可能な細胞懸濁液)は、収穫、染色および分析ステップの間に無菌技術を適用します。
4.固定および透過38
- パラホルムアルデヒド(PFA)を使用して固定。
- PBS中の2%PFAを含む固定バッファを準備します。
注:PFAは人間や環境に有害である。適切な個人保護具を使用して、地域の規制に従って廃棄物を捨てる。 - 細胞懸濁液100μlに固定緩衝液500μlを追加。
- 暗闇の中でオービタルシェーカー(100 rpm)の上で室温で15分間チューブをインキュベートします。
- PBS中の2%PFAを含む固定バッファを準備します。
- PBS洗浄。
- チューブに1mlのPBSを追加します。 4℃で3分間380×gで遠心し。
- チューブに約100μlのを残して上清をデカント/捨てる。
- Tween-20を持つ透過化:
- PBS中の0.7%のTween-20を含む透過化バッファを準備します。
- 細胞懸濁液100μlに透過化緩衝液500μlを追加。
- 暗闇の中でオービタルシェーカー(100 rpm)の上で室温で15分間チューブをインキュベートします。
- (4.2節で説明したように)をPBSで細胞を1回洗浄し、チューブのcoから上清を除去mpletely、背後にある唯一のペレットを残す。
5.細胞内抗原染色38(図4)
- 一次抗体溶液の調製:
- 1%ウシ血清アルブミン、10%血清( 例えば、正常ロバ又はヤギ血清)および0.5%Tween-20をPBS中に含有する希釈緩衝液中の一次抗体を希釈する。
注:二次抗体がで提起された種に応じて、使用する血清を選択してください。 - また、メーカーの指示に従って、一次抗体のゼノンフルオレセイン標識を使用しています。
- 適切な希釈(20μlの≤総量)でPBS中に一次抗体1μgのを準備します。
- 抗体溶液にゼノンフルオレセインのIgG標識試薬(成分A)の5μlを添加する。
- RTで5分間混合物をインキュベートする。
- 反応混合物にゼノンブロッキング試薬(成分B)の5μlを添加する。
- インキュベートRTで5分間混合。 30分以内にサンプルに抗体を適用します。
- 1%ウシ血清アルブミン、10%血清( 例えば、正常ロバ又はヤギ血清)および0.5%Tween-20をPBS中に含有する希釈緩衝液中の一次抗体を希釈する。
- 一次抗体染色:
- 細胞ペレットに一次抗体溶液100μlを加え、穏やかに混合するために粉砕する。
- また、適切な希釈で細胞懸濁液にゼノンのフルオレセイン標識抗体を追加。
- 光から保護し、オービタルシェーカー(200rpm)し、上で室温で30分間チューブをインキュベートします。 (セクション4.2で説明したように)、PBSで細胞を1回洗浄し背後にある唯一のペレットを残して、完全にチューブから上清を除去。
- (ゼノンフルオレセイン標識抗体には必要ありません)二次抗体染色:
- 適切な濃度でPBS中に二次抗体を希釈する。
- 細胞ペレットに二次抗体溶液100μlを加え、穏やかに混合するために粉砕する。暗闇の中でシェーカー(200 rpm)の上で、室温で30分間チューブをインキュベートします。
- (4.2節で説明したように)PBSでサンプルを2回洗浄します。
- フロー緩衝液で1回洗浄する(3.5節を参照)。
- フロー·バッファの約150μlの細胞を再懸濁し、フローサイトメーターで分析する。
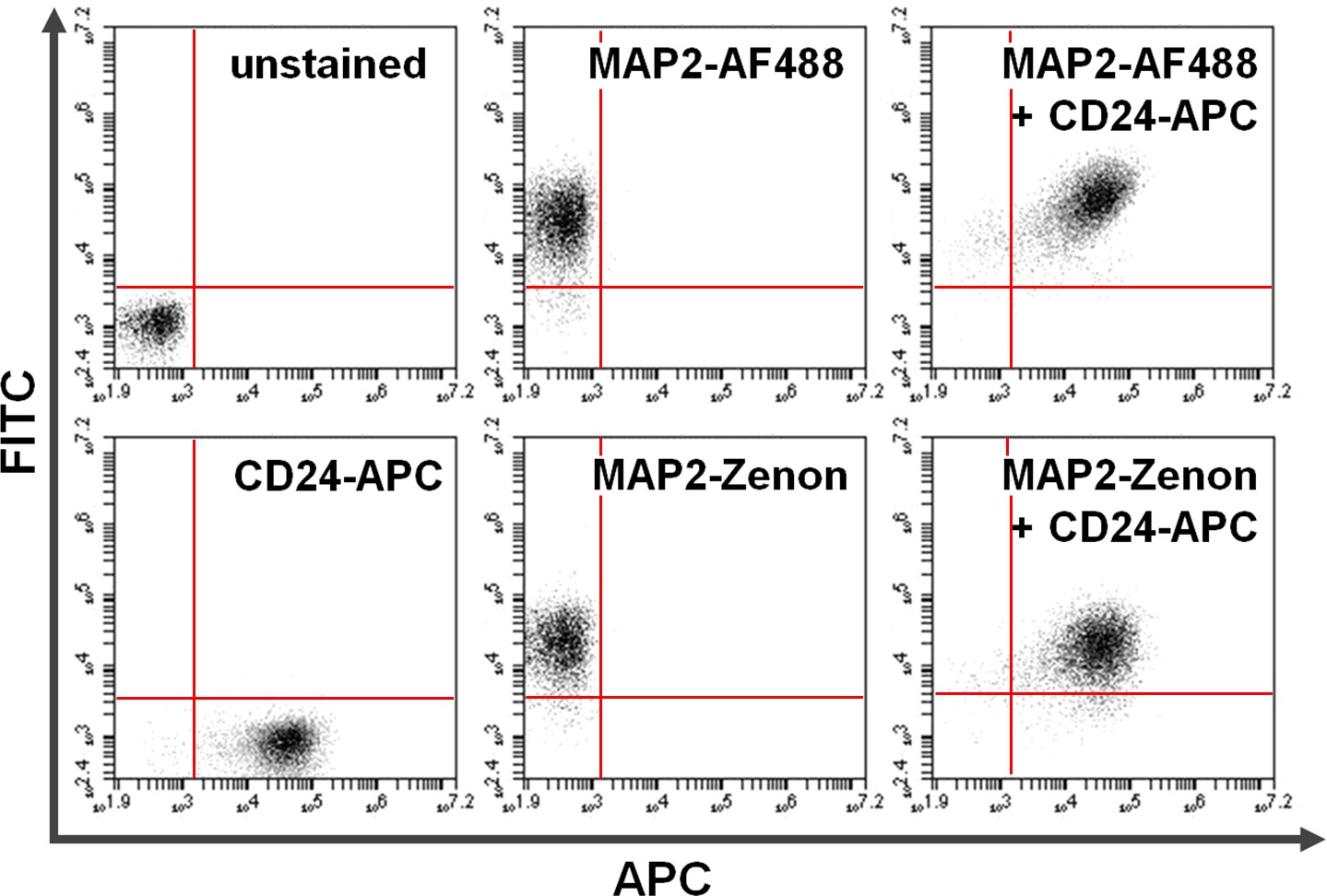
表面および細胞内タンパク質の、図4の共染色。フローサイトメトリーのデータの一次+二次抗体ベースの表面染色と組み合わせたゼノンフルオレセインベースの細胞内染色の対の間の比較を例示する。 y軸(左上象限)及びx軸(右下象限)の排他的陽性はそれぞれ、MAP2およびCD24について染色した細胞を示す。共染色した後、共有MAP2及びCD24の発現は、右上象限(右パネル)に見ることができる。使用しての比較アレクサフルオロ488。MAP2標識利回り同様の結果のためのゼノンフルオレセイン(下)対(上AF488) この図の拡大版をご覧になるにはこちらをクリックしてください。
6.フローサイトメトリー分析
- 信号検出のための適切なフィルターを、フローサイトメーターを用いて染色プロトコルの完了直後にフローサイトメトリー分析を行う。 FL-1(30分の533)、FL-2(40分の585)、およびFL-4(25分の675)バンドパスフィルタと488nmの青と640nmの赤色レーザーを使用してください。
- 破片および死細胞を除く前方および側方散乱に基づいて主ゲートを設定します。
- 未染色標本とシングルステンドコントロールを使用して、スペクトルの重複のための補償に基づく≤0.5%に表面と細胞内抗原のための蛍光ゲートを設定します。
Access restricted. Please log in or start a trial to view this content.
結果
ここで紹介するプロトコルは、汎用性の実験的アプローチ( 図2)を可能にします。その短いバージョン(1、3、6ステップ )においては、表面抗原の単純な染色のためのガイドと考えることができる。そのより複雑な形態において、細胞内抗原の範囲で共標識パラダイムの数は(2および/ または4〜5の任意の工程 )を追求す...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここに提示されたプロトコルがよくヒト幹細胞由来の神経細胞培養のために確立されているが、同様の一次組織または神経細胞株を含む他の神経細胞供給源に適用することができる。胚のソースに加えて、神経幹細胞または前駆細胞は、成人の脳27の神経原性領域から抽出することができる。また、フローサイトメトリーおよびFACSが成熟ニューロン54、アストロ33、ミ...
Access restricted. Please log in or start a trial to view this content.
開示事項
The authors declare no potential conflicts of interest.
謝辞
Our research program is funded through the Emmy Noether-Program of the German Research Foundation (DFG), grant PR1132/3-1. Further support by the Müller-Fahnenberg Foundation of the University of Freiburg is gratefully acknowledged. This study was supported in part by the Excellence Initiative of the German Research Foundation (GSC-4, Spemann Graduate School).
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| DMEM/F12 (1:1) (Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) |  Life Technologies Life Technologies | 11330057 | |
| DPBS without Ca2+ Mg2+ |  Life Technologies Life Technologies | 14190169 | |
| Fetal bovine serum, qualified, E.U.-approved, South America origin (FBS) |  Life Technologies Life Technologies | 10270-106 | |
| MEM Non-essential amino acids (100x) |  Life Technologies Life Technologies | 11140035 | |
| TrypLE Express |  Life Technologies Life Technologies | 12604013 | |
| Trypan blue solution, 0.4% |  Life Technologies Life Technologies | 15250061 | |
| Paraformaldehyde |  Carl Roth Carl Roth | 335.3 | |
| Bovine serum albumin (BSA) Fraction V |  PAA Laboratories, Coelbe PAA Laboratories, Coelbe | K41-001 | |
| Tween-20 Detergent |  Calbiochem Calbiochem | 655205 | |
| Carboxyfluorescein succinimidyl ester (CFSE) |  eBioscience eBioscience | 65-0850-84 | |
| DMSO |  AppliChem AppliChem | A1584 | |
| Bottle top filters express plus 0.22 µm, 250 ml |  Millipore Millipore | SCGPU02RE | |
| Cell culture treated flasks (T 25) |  NUNC NUNC | 156367 | |
| Cell culture treated flasks (T 75) |  NUNC NUNC | 156499 | |
| Conical tubes (15 ml) |  Greiner Bio-One Greiner Bio-One | 188271 | |
| Conical tubes (50 ml) |  Greiner Bio-One Greiner Bio-One | 227261 | |
| Pasteur pipet, glass (150 mm) |  STEIN Labortechnik, Remchingen STEIN Labortechnik, Remchingen | S03710150 | |
| Pipet tips (0.1-10 µl) |  Corning Corning | 4125 | |
| Pipet tips (1-200 µl) |  Corning Corning | 4126 | |
| Pipet tips (100-1000 µl) |  Corning Corning | 4129 | |
| Serological pipets, 5 ml |  Corning Corning | 4051 | |
| Serological pipets, 10 ml |  Corning Corning | 4101 | |
| Serological pipets, 25 ml |  Corning Corning | 4251 | |
| Microcentrifuge tubes (0.5 ml) |  Sarstedt Sarstedt | 72,699 | |
| Microcentrifuge tubes (1.5 ml) |  Greiner Bio-One Greiner Bio-One | 616201 | |
| Microcentrifuge tubes (2.0 ml) |  Sarstedt Sarstedt | 72,695,500 | |
| Anti-Human CD24 APC monoclonal antibody |  eBioscience eBioscience | 17-0247-42 | Working dilution 1:50 |
| Anti-Human CD54 PE monoclonal antibody |  eBioscience eBioscience | 12-0549-42 | Working dilution 1:50 |
| Neuronal Class III β-Tubulin (Tuj1) polyclonal antibody |  Covance Covance | PRB-435P | Working dilution 1:2,000 |
| Alexa Fluor 488 Donkey anti Rabbit |  Life Technologies Life Technologies | A21206 | Working dilution 1:2,000 |
| Zenon® Fluorescein Rabbit IgG Labeling Kit |  Life Technologies Life Technologies | Z-25342 | |
| Neubauer-Improved counting chamber |  Marienfeld Marienfeld | 0640010 | |
| Vortex |  Scientific Industries Scientific Industries | G560E | |
| Thermomixer comfort |  Eppendorf Eppendorf | 5355 000.001 | |
| Accuri C6 flow cytometer |  Becton Dickinson (BD) Becton Dickinson (BD) | 653118 | |
| Microcentrifuge refrigerated, PerfectSpin 24 R |  Peqlab Peqlab | 91-PSPIN-24R | |
| Orbital shaker, Unimax 1010 |  Heidolph Heidolph | 543-12310-00 | |
| Centrifuge refrigerated, Rotanta 96 RC |  Hettich Hettich | 4480-50 | |
| Class II Biological safety cabinet Safe 2020 |  Thermo Scientific Thermo Scientific | 51026640 | |
| CO2 Incubator, Heracell 240i |  Thermo Scientific Thermo Scientific | 51026331 | |
| Vacuum system, Vacusafe comfort |  Integra Biosciences Integra Biosciences | 158320 | |
| Microscope, Axiovert 40 CFL |  Zeiss Zeiss | 451212 | |
| Pipet controller, accu-jet pro |  Brand Brand | 26303 | |
| Micropipet, Pipetman neo P20N (2-20 µl) |  Gilson Gilson | F144563 | |
| Micropipet, Pipetman neo P200N (20-200 µl) |  Gilson Gilson | F144565 | |
| Micropipet, Pipetman neo P1000N (100-1000 µl) |  Gilson Gilson | F144566 |
参考文献
- Herzenberg, L. A., et al. The History and Future of the Fluorescence Activated Cell Sorter and Flow Cytometry: A View from. 48 (10), 1819-1827 (2002).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today’s technology and tomorrow's horizons. Methods (San Diego, Calif). 57 (3), 251-258 (2012).
- Jaye, D. L., Bray, R. A., Gebel, H. M., Harris, W. A. C., Waller, E. K. Translational applications of flow cytometry in clinical practice). J. Immunol. 188 (10), 4715-4719 (2012).
- Henel, G., Schmitz, J. Basic Theory and Clinical Applications of Flow Cytometry. Lab Med. 38 (7), 428-436 (2007).
- Seita, J., Weissman, I. L. Hematopoietic stem cell: self-renewal versus differentiation. Wiley Interdiscip. Rev. Syst. Biol. Med. 2 (6), 640-653 (2010).
- Ulrich, H., Bocsi, J. Phenotypes of stem cells from diverse origin. Cytometry. A. 77 (1), 6-10 (2010).
- Panchision, D. M., et al. Optimized flow cytometric analysis of central nervous system tissue reveals novel functional relationships among cells expressing CD133, CD15, and CD24. Stem cells. 25 (6), 1560-1570 (2007).
- Meyer, R. A., Zaruba, M. E., McKhann, G. M. Flow cytometry of isolated cells from the brain. Anal. Quant. Cytol. 2 (1), 66-74 (1980).
- Junger, H., Junger, W. G. CNTF and GDNF, but not NT-4, support corticospinal motor neuron growth via direct mechanisms. Neuroreport. 9 (16), 3749-3754 (1998).
- McLaren, F. H., Svendsen, C. N., Vander Meide, P., Joly, E. Analysis of neural stem cells by flow cytometry: cellular differentiation modifies patterns of MHC expression. J. Neuroimmunol. 112 (1-2), 35-46 (2001).
- Wang, S., Roy, N. S., Benraiss, A., Goldman, S. A. Promoter-based isolation and fluorescence-activated sorting of mitotic neuronal progenitor cells from the adult mammalian ependymal/subependymal. 22 (1-2), 167-176 (2000).
- Tanke, H. J., vander Keur, M. Selection of defined cell types by flow-cytometric cell sorting. Trends Biotechnol. 11 (2), 55-62 (1993).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243 (1-2), 77-97 (2000).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. J. Neurosci. Methods. 129 (1), 73-79 (2003).
- Ernst, A., et al. Neurogenesis in the striatum of the adult human brain. Cell. 156 (5), 1072-1083 (2014).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat. Rev. Immunol. 4 (8), 648-655 (2004).
- Bandura, D. R., et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time-of-flight mass spectrometry. Anal. Chem. 81 (16), 6813-6822 (2009).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Neveu, I., Rémy, S., Naveilhan, P. The neuropeptide Y receptors, Y1 and Y2, are transiently and differentially expressed in the developing cerebellum. Neuroscience. 113 (4), 767-777 (2002).
- Pruszak, J., Just, L., Isacson, O., Nikkhah, G. Isolation and culture of ventral mesencephalic precursor cells and dopaminergic neurons from rodent brains. Curr. Protoc. Stem Cell Biol. 2 (Unit 2D.5), (2009).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99 (22), 14506-14511 (2002).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993 (1-2), 18-29 (2003).
- Pruszak, J., Isacson, O. Molecular and cellular determinants for generating ES-cell derived dopamine neurons for cell therapy. Adv. Exp. Med. Biol. 651, 112-123 (2009).
- Carson, C. T., Aigner, S., Gage, F. H. Stem cells: the good, bad and barely in control. Nat. Med. 12 (11), 1237-1238 (2006).
- Yuan, S. H., et al. Cell-surface marker signatures for the isolation of neural stem cells, glia and neurons derived from human pluripotent stem cells. PloS One. 6 (3), e17540(2011).
- Roy, N. S., Cleren, C., Singh, S. K., Yang, L., Beal, M. F., Goldman, S. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat. Med. 12 (11), 1259-1268 (2006).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proc. Natl. Acad. Sci. U. S. A. 97 (26), 14720-14725 (2000).
- Pruszak, J., Ludwig, W., Blak, A., Alavian, K., Isacson, O. CD15, CD24, and CD29 define a surface biomarker code for neural lineage differentiation of stem cells. Stem Cells. 27 (12), 2928-2940 (2009).
- Peh, G. S. -L., Lang, R. J., Pera, M. F., Hawes, S. M. CD133 expression by neural progenitors derived from human embryonic stem cells and its use for their prospective isolation. Stem Cells Dev. 18 (2), 269-282 (2009).
- Golebiewska, A., Atkinson, S. P., Lako, M., Armstrong, L. Epigenetic landscaping during hESC differentiation to neural cells. Stem Cells. 27 (6), 1298-1308 (2009).
- Dietrich, J., Noble, M., Mayer-Proschel, M. Characterization of A2B5+ glial precursor cells from cryopreserved human fetal brain progenitor cells. Glia. 40 (1), 65-77 (2002).
- Nishiyama, A. NG2 cells in the brain: a novel glial cell population. Hum. Cell. 14 (1), 77-82 (2001).
- Jungblut, M., et al. Isolation and characterization of living primary astroglial cells using the new GLAST-specific monoclonal antibody ACSA-1. Glia. 60 (6), 894-907 (2012).
- Ono, Y., et al. Differences in neurogenic potential in floor plate cells along an anteroposterior location: midbrain dopaminergic neurons originate from mesencephalic floor plate cells. Development. 134 (17), 3213-3225 (2007).
- Chung, S., et al. ES cell-derived renewable and functional midbrain dopaminergic progenitors. Proc. Natl. Acad. Sci. U.S.A. 108 (23), 9703-9708 (2011).
- Doi, D., et al. Isolation of Human Induced Pluripotent Stem Cell-Derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation. Stem Cell Reports. 2 (3), 337-350 (2014).
- Solozobova, V., Wyvekens, N., Pruszak, J. Lessons from the embryonic neural stem cell niche for neural lineage differentiation of pluripotent stem cells. Stem Cell Rev. 8 (3), (2012).
- Turaç, G., et al. Combined flow cytometric analysis of surface and intracellular antigens reveals surface molecule markers of human neuropoiesis. PloS One. 8 (6), e68519(2013).
- Buchwalow, I. B., Böcker, W. Chapter 2. Immunohistochemistry: Basics and Methods. , 9-17 (2010).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. J. Vis. Exp. (70), e4287(2012).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Hawkins, E. D., et al. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Quah, B. J. C., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. J. Vis. Exp. 44, (2010).
- Sukhdeo, K., et al. Multiplex flow cytometry barcoding and antibody arrays identify surface antigen profiles of primary and metastatic colon cancer cell lines. PloS One. 8 (1), e53015(2013).
- Jiang, L., et al. Daucosterol promotes the proliferation of neural stem cells. The J. Steroid Biochem. Mol. Biol. 140, 90-99 (2014).
- Hulspas, R., et al. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry. B. 76 (6), 355-364 (2009).
- Moloney, M., Shreffler, W. G. Basic science for the practicing physician: flow cytometry and cell sorting. Annals of Allergy, Asthm., & Immunology: Official Publication of the American College of Allergy, Asthma., & Immunology. 101 (5), 544-549 (2008).
- Siebzehnrubl, F. A., et al. Isolation and characterization of adult neural stem cells. Methods Mol. Biol. 750, 61-77 (2011).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain). J. Neurosci. Methods. 203 (1), 10-18 (2012).
- Tham, C. -S., Lin, F. -F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. Int. J. Dev. Neurosci. 21 (8), 431-443 (2003).
- Nguyen, H. X., Beck, K. D., Anderson, A. J. Quantitative assessment of immune cells in the injured spinal cord tissue by flow cytometry: a novel use for a cell purification method. J. Vis. Exp. (50), e2698(2011).
- Marchenko, S., Flanagan, L. Counting human neural stem cells. J. Vis. Exp. (7), 262(2007).
- Brunlid, G., Pruszak, J., Holmes, B., Isacson, O., Sonntag, K. C. Immature and neurally differentiated mouse embryonic stem cells do not express a functional Fas/Fas ligand system. Stem Cells. 25 (10), 2551-2558 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J. Neurosci. Methods. 71 (2), 143-155 (1997).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat. Protoc. 1 (4), 1947-1951 (2006).
- Nielsen, J. A., Maric, D., Lau, P., Barker, J. L., Hudson, L. D. Identification of a novel oligodendrocyte cell adhesion protein using gene expression profiling. J. Neurosci. 26 (39), 9881-9891 (2006).
- Daneman, R., et al. The mouse blood-brain barrier transcriptome: a new resource for understanding the development and function of brain endothelial cells. PloS One. 5 (10), e13741(2010).
- Gräbner, R., Till, U., Heller, R. Flow cytometric determination of E-selectin, vascular cell adhesion molecule-1, and intercellular cell adhesion molecule-1 in formaldehyde-fixed endothelial cell monolayers. Cytometry. 40 (3), 238-244 (2000).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Lathia, J. D., et al. High-throughput flow cytometry screening reveals a role for junctional adhesion molecule a as a cancer stem cell maintenance factor. Cell Rep. 6 (1), 117-129 (2014).
- Ganat, Y. M., et al. Identification of embryonic stem cell-derived midbrain dopaminergic neurons for engraftment. J. Clin. Invest. 122 (8), 2928-2939 (2012).
- Hedlund, E., et al. Embryonic stem cell-derived Pitx3-enhanced green fluorescent protein midbrain dopamine neurons survive enrichment by fluorescence-activated cell sorting and function in an animal model of Parkinson’s disease. Stem Cells. 26 (6), 1526-1536 (2008).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Chivet, M., Hemming, F., Pernet-Gallay, K., Fraboulet, S., Sadoul, R. Emerging role of neuronal exosomes in the central nervous system. Front. Physiol. 3, 145(2012).
- Graner, M. W., et al. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 23 (5), 1541-1557 (2009).
- Eldh, M., Lötvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. (59), e3037(2012).
- Capela, A., Temple, S. LeX is expressed by principle progenitor cells in the embryonic nervous system, is secreted into their environment and binds Wnt-1. Dev. Biol. 291 (2), 300-313 (2006).
- Nieoullon, V., Belvindrah, R., Rougon, G., Chazal, G. mCD24 regulates proliferation of neuronal committed precursors in the subventricular zone. Mol. Cell. Neurosci. 28 (3), 462-474 (2005).
- Nagato, M., et al. Prospective characterization of neural stem cells by flow cytometry analysis using a combination of surface markers. J. Neurosci. Res. 80 (4), 456-466 (2005).
- Hall, P. E., Lathia, J. D., Miller, N. G. A., Caldwell, M. A., French-Constant, C. Integrins are markers of human neural stem cells. Stem Cells. 24 (9), 2078-2084 (2006).
- Hargus, G., et al. Differentiated Parkinson patient-derived induced pluripotent stem cells grow in the adult rodent brain and reduce motor asymmetry in Parkinsonian rats. Proc. Natl. Acad. Sci. U.S.A. 107 (36), 15921-15926 (2010).
- Elkabetz, Y., et al. Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes Dev. 22 (2), 152-165 (2008).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved