JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
신경 세포 유형의 표면에 대한 유동 세포 계측법 프로토콜 및 세포 내 항원 분석
요약
We provide a detailed description of a protocol for flow cytometric analysis of surface antigens and/or intracellular antigens in neural cell types. Critical aspects of experimental planning, step-by-step methodological procedures, and fundamental principles of flow cytometry are explained in order to enable neurobiologists to exploit this powerful technology.
초록
Flow cytometry has been extensively used to define cell populations in immunology, hematology and oncology. Here, we provide a detailed description of protocols for flow cytometric analysis of the cluster of differentiation (CD) surface antigens and intracellular antigens in neural cell types. Our step-by-step description of the methodological procedures include: the harvesting of neural in vitro cultures, an optional carboxyfluorescein succinimidyl ester (CFSE)-labeling step, followed by surface antigen staining with conjugated CD antibodies (e.g., CD24, CD54), and subsequent intracellar antigen detection via primary/secondary antibodies or fluorescently labeled Fab fragments (Zenon labeling). The video demonstrates the most critical steps. Moreover, principles of experimental planning, the inclusion of critical controls, and fundamentals of flow cytometric analysis (identification of target population and exclusion of debris; gating strategy; compensation for spectral overlap) are briefly explained in order to enable neurobiologists with limited prior knowledge or specific training in flow cytometry to assess its utility and to better exploit this powerful methodology.
서문
유동 세포 계측법 광범위 고유의 분산 특성, 세포 표면 항원의 발현 및 기타 형광 매개 변수 1-3을 통해 세포 집단을 정의 할 수 면역학, 혈액학 및 종양학에 악용되고있다. 혈통 개발 및 질병에 우리의 통찰력은 초기 구현 4,5 후이 방법의 지속적인 정제 상당한 정도의 결과입니다. 흐름의 양적 및 전반적인 분석 가능성의 증가에 대한 인식은 세포 계측법 최근 줄기 세포 연구에서의 더 광범위한 사용을 권장하고 짧은 시간 프레임 (6)의 유사 깊은 진행을 가능하게 할 수있다. 그러나, 구체적으로는 신경 개체군을 분석 및 분리하는 유동 세포 계측법의 적용은 긴 도전로 인식되어왔다. 자연적 현탁액에 존재 조혈 세포와 대조적으로, 신경 세포 유형은 전형적 신경교 다양한 O를 포함 할 수있다 지나치게 복잡한 출처 수확거기는 주변 세포뿐만 아니라 공정 함유 신경 세포의 복잡한 네트워크. 따라서, 신경 생물학 매일 연구 루틴의 완전한 잠재력을 유동 세포 계측법의 다양성을 구현하기 위해 아직있다. 그러나 신경 생물학에서 분석 레퍼토리 중요한 요소로 간주 될 수있는 한 가능한 단일 세포 현탁액을 생성 할 수있다 (그리고 프로토콜 그 목적 7 고안 및 최적화 된)로 유동 세포 계측법, 형광 - 활성화 된 세포 (FACS)를 정렬 8-11.
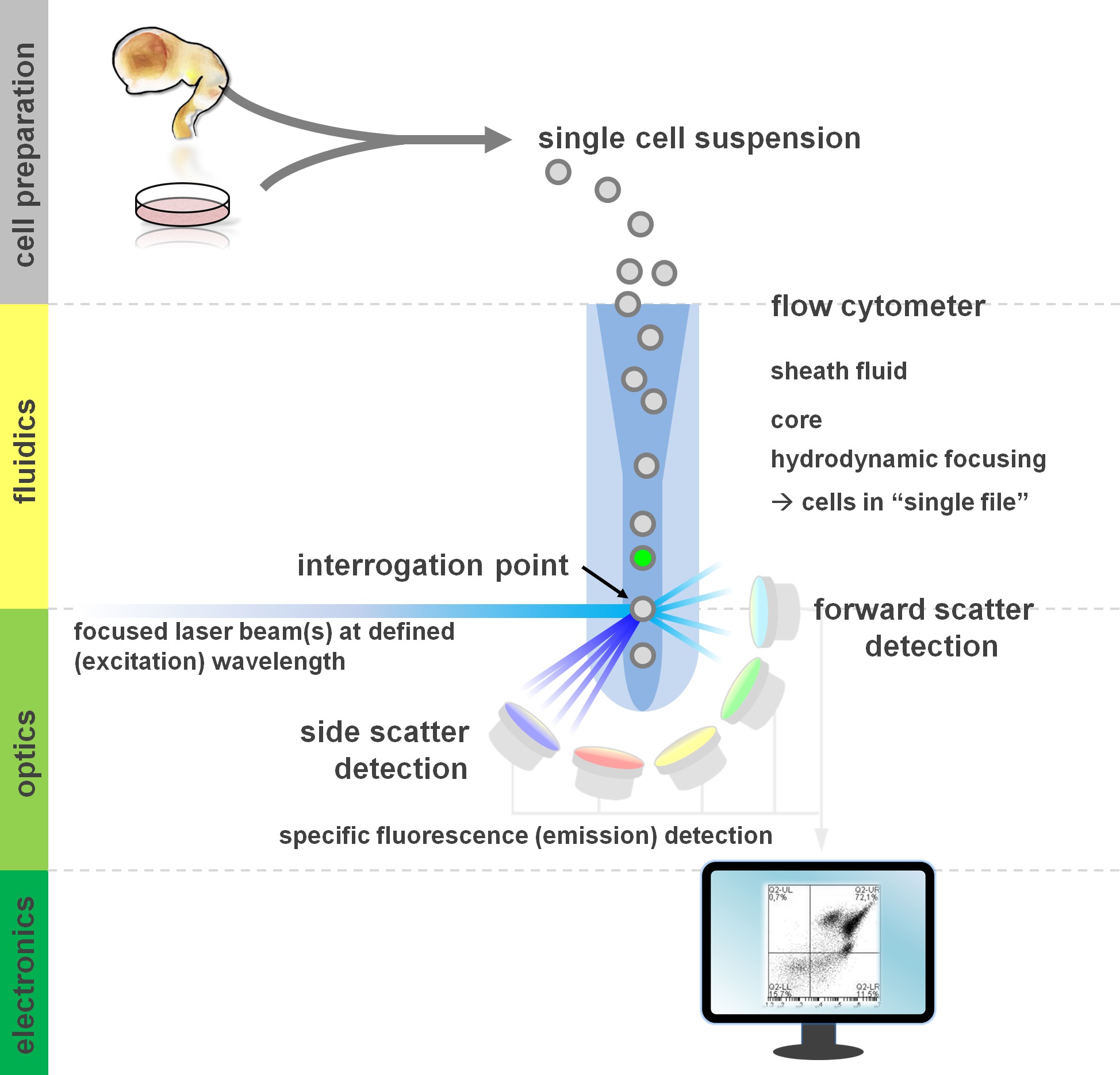
. 유체 공학, 광학 및 전자 제품 : 유세포 분석 및 유세포의 구성 요소도 1 원리 유동 세포 계측기는 세 가지 시스템을 포함한다. 현탁액 세포의 효율적인 흐름은 시스 flui하여 수행됩니다 (기본 조직 또는 체외 배양에서 준비)유체 역학을 통해 D는 중앙 코어 샘플을 제한, 집중. 광학 부품은 적절한 검출기에 신호를 지향 세포 및 광학 필터 스트림을 조명 레이저로 구성된다. 전자 신호, 이후 컴퓨터에 의해 처리 및 데이터 분석 및 게이팅 모니터에 가시화로 변환 검출 된 광 신호를 출력합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
사이토의 빌딩 블록을 포함하는 기본 원리의 적어도 기본적인 이해에서 유세포 방법 이익의 사용자 (검토를 위해 12, 13 참조; 또한 그림 1 참조). 레이저 빔은 다시 '단일 파일'잇달아되는 레이저 빔을 통과 현탁액 중의 세포를 포함하는 유체 역학적 유체 스트림 중점과 교차. intercepti이 심문 포인트에서 빛의 산란에 레이저 결과 셀 (또는 그 문제에 대해 다른 입자)의에. (상기 입자 / 세포의 granulosity 반사 측면 스 캐터) 산란광뿐만 아니라 그 수직 방향 (입자의 크기와 연관된 순방향 산란) 레이저의 연속 방향으로 검출 할 수있다. 이러한 상기 분산 특성은 (또한 또는 세포 파편, 기포 등) 레이블이없는 샘플이 일반적으로 초기 게이팅에 사용되는 측면 산포도 대 이변 앞으로 분산에 신호 (이벤트)를 생성합니다 왜 특정 표시를 필요로하지 않는다. 적절한 레이저와 대응 여기 및 방출 스펙트럼에 대한 특정 필터를 사용함으로써, 전지의 양성, 강도의 정도, 또는 형광 마커의 유무에 대해 분석 할 수있다. 유세포 애플리케이션의 대부분은 세포 표면 항원을 통해 특성화에 초점을 맞추고있다. 조혈 lineag 달리E는 신경 혈통은 표면 항원의 발현 패턴에 따른 5 이하 광범위하게 정의 남아있다. 표면 항원을 이용하는 장점 중 하나는 생균 그러한 FACS 소팅 같은 패러다임을 전지에 실시 될 수 있다는 것이다. 대조적으로, 세포 내 항원 염색 가능한 세포를 필요로 다운 스트림 응용 프로그램을 배제, 항원 - 항체 상호 작용을 중재하는 고정 및 투과성으로 단계가 필요합니다. 참고로, 이러한 접근 방식은 여전히 다수의 정량 분석 (14)뿐만 아니라 RNA와 단백질 식 (15)에 대한 다운 스트림 분석을 위해 수 있습니다. 혈액학, 면역학 및 종양학는 종종 특정 하위 집단 (16)을 정의하기 위해 함께 십여 마커를 사용했습니다. 또한, 질량 계측법 또는 CyTOF 해주기 30 파라미터 (17, 18)까지 동시에 분석하기 위해 사용될 수있다.
신경 줄기 세포 응용 프로그램뿐만 아니라 차 문화 14,19,20 세포의 이질성에 들어시험관은 일반적인 현상 21-23이다. 관심의 표적 집단을 대표하지 셀 (24, 25)에 대한 판독 실험 잠재적 교란 요인을 구현. 편리하게는, 이종 세포 현탁액 내에 존재하는 다른 셀룰러 서브 세트들은 이러한 다양한 집단을 정의하는데 이용 될 수있는 고유 한 (또는 아직 공지 해독 함) 항원 발현 프로파일을 부담. 생물 의학 응용을 촉진, 따라서 이에, 세포 이질성 해결에 중요한 역할을 할 수 있습니다 유동 세포 계측법 (체외 분석, 세포 치료)와 가장 관련성이 높은 일부 (24, 26)에 초점을 맞춤으로써 양적 판독을 최적화 할 수 있습니다. 다양한 표면 항원 조합은 특정 신경 세포 유형의 정량 및 아이솔레이션을 허용하도록 지난 몇년 동안에 확인되었다. 이 신경줄 기세포 27 NSC의 절연을위한 CD15 / CD24 / CD29 표면 항원의 결합, differentia의 농축을 위해 CD133를 포함테드 신경 세포와 신경 능선 세포 (28) 또는 CD15 / CD24 / CD44 / CD184 / CD271 다른 서명 (29, 30) 중 신경과 신경 교세포 부분 집합 (25)을 분리합니다. 신경을 넘어, 아교 마커는 A2B5 (31), CD44 (25), NG2 32 GLAST (33)를 포함한다. 최근 출판물은 파킨슨 세포 이식에 도파민 전구 물질에 대한 풍부하게 중뇌 floorplate 전구체 마커 코린 34, 35을 36 패러다임 악용하고있다. CD 분자 마커 만 아니지만, 세포 - 세포 상호 작용 및 세포의 능력을 기능적으로 중요한 매개체 외 매트릭스 분자로부터 큐에 대응하는 37과 성장 인자. 상기 신경 계통 개발 조합을 특성화하기 위해 CD 항원 아스날 향상 전략 중 하나는 관심있는 특정 세포 유형에 대해 CD 항원의 조합을 스크리닝하고 정의하는 것으로 알려진 세포 마커를 사용하는 것이다. 우리는 최근에 이러한 접근 방식을 이용하고 CD4를 확인했다9 층 - / CD200 신경을 분화 유도 만능 줄기 세포 배양 시스템 (38)에서 신경 세포의 부분 집합을 풍부하게하기위한 새로운 접근 방식으로 높은 조합 발현 패턴. 여기서 우리는 포함하고 후자 프로토콜 (및 그 선택의 변화)하는 표면의 얼룩 및 세포 내 염색 유동 세포 계측법에 의해 신경 세포의 부분 집단을 정의하는 동시에 사용할 수 있습니다에 대해 설명합니다.
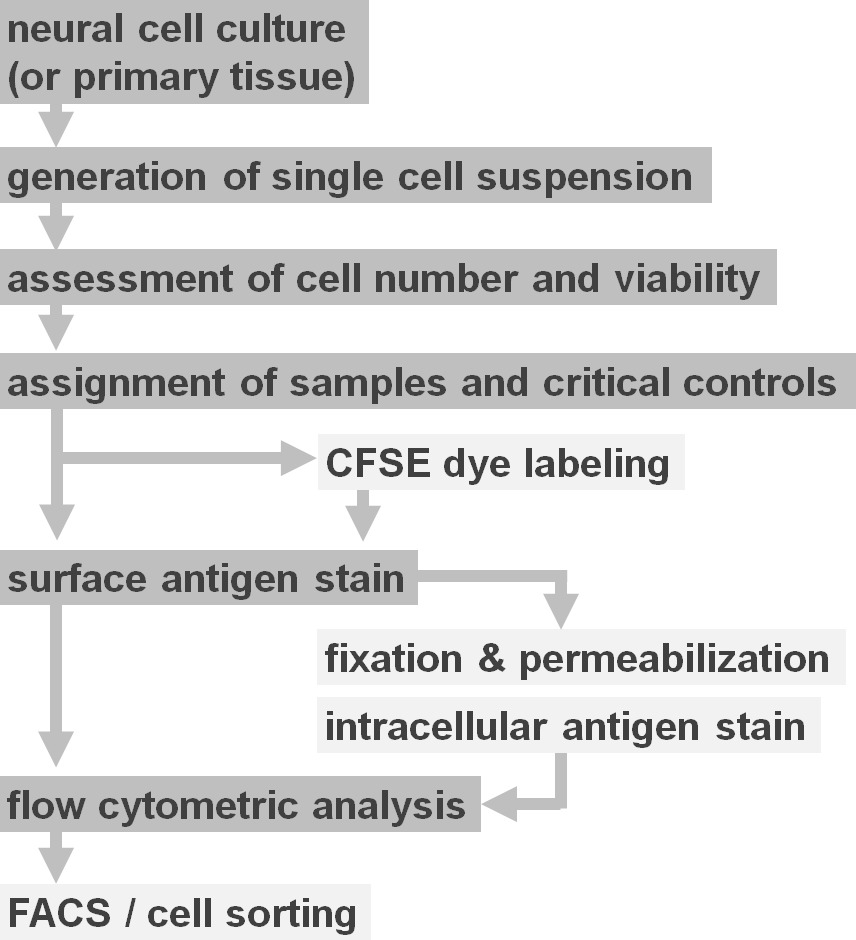
실험 프로토콜 옵션도 2의 흐름도. 도면은 프로토콜에 관련된 주요 단계의 개략도를 도시한다. 선택 단계 (CFSE 염료 또는 세포 내 항원 라벨)은 밝은 회색 상자로 표시됩니다. 수확 후에, 세포 표면 염색 전에 신경 세포 현탁액의 생존율 및 세포 수를 평가하기 위해 필수적이다. 긍정적으로뿐만 아니라 음성 대조군의 관심 샘플 이외에 포함 할 필요가있다. 샘플은 유세포 분석에 의해 분석 및 / 또는 셀 정렬 패러다임에서 사용할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
우리는 이전에 세포 내 염색 (38)에 대한 이차 항체와 함께 일차 항체를 사용 하였지만, 이제시켜 세포 조작 (39)의 단계를 줄이고, 약간 변형 형광의 Fab 단편 (제논 라벨링)을 통해 차 항체의 비공유 라벨링을 소개한다. 또한, 프로토콜의 다양성의 또 다른 예로서, 우리는 항원 염색 전에 표면 숙신 이미 딜 에스터 (CFSE)를 카르복시로 실험 한 서브 세트의 선택적 표지를 사용한다. 이러한 사전 CFSE 표지는 두 세포주 또는 실험 조건의 직접 비교를 즉시 (수대 CFSE 표지. 하나의 샘플 튜브, 분산 또는 배양 시간의 미묘한 차이를 줄이고 항체를 절약 이내) 레이블. CFSE (41, 42)는 일반적으로 증식 및 바코드 실험 43, 44에서, 트래킹 셀 (40)에 사용되는 확립 된 형광 염료이다. 실제 정렬 단계 (FACS, 면역 자기 세포 분리 또는 immunopanning)이이 프로토콜의 일부가 아닌 상태에서 마지막으로, 원칙적으로, 여기에 설명 된 수확 및 라벨 절차는 항원 또는 세포 내 라벨 기반의 정렬 응용 프로그램을 표면에 노출 될 수 수율 샘플을 15 25, 28.
이 기사로, 우리는 목표 : 같은 세포 내 CFSE 염료 라벨 단계 조립 방법을 제시, 세포 내 표적의 탐지를위한 프로토콜뿐만 아니라 결합 된 표면과 세포 내 항원 분석 (38)를 요약, 실행 가능한 표면 항원 염색 프로토콜 25, 28을 요약 COM에 대한 실험 옵션parative 신경 세포 집단의 분석, 유세포 분석 (데이터 전략 및 프리젠 테이션 (47)을 적절한 게이팅 컨트롤을 13,46) 흐름 방식을 요약한다.
프로토콜
1. 신경 세포 수확
- 현미경에 의해 평가 :
- 실험을 개시하기 전에, 시야 또는 위상차 현미경으로 배양 상태를 확인한다.
참고 : 해부에서 얻은 주 신경 조직이지만, 원칙적으로 동등하게 의무 유세포 분석 14,28 흐름에, 프로토콜의 초점은 체외 신경 세포 시스템에서 얻은 세포에주의하시기 바랍니다.
- 실험을 개시하기 전에, 시야 또는 위상차 현미경으로 배양 상태를 확인한다.
- 수확 세포 7 :
- 부드럽게 2+에 Mg 부착 세포의 접시 / 플라스크를 씻어 / 칼슘 무료로 인산 완충 식염수 (PBS) RT에서 (예를 들어, T75 플라스크 5 ml의 6 웰 플레이트에 잘 당 3 ㎖, 10 ㎖를위한 10cm 접시).
참고 : PBS는 프로토콜 전반에 걸쳐 사용되는 마그네슘 2+ / 칼슘 무료입니다.- 비디오 예를 들어, 80 % 컨 플루 언시 SH-SY5Y 세포의 신경 모세포종의 T75 플라스크를 사용한다. 경우 어디에서 추가 세척 단계를 적용상당한 파편은 요리에 존재한다.
- 혈청 알부민 함유 PBS (48), 퍼콜, 또는 피콜 49 원심 분리 구배 및 / 또는 시판 구슬 50, 51과 세척을 고려하십시오. 미엘린 및 다른 지질 또는 다른 오염 물질의 제거는 성인 일차 조직 소스가 사용되는 경우 특히 중요하다.
- 조직 배양 용기의 전체 표면을 덮는 적절한 음량으로 예열 된 (37 ° C) 트립신 대체 추가.
참고 : 또는 Accutase 또는 다른 효소 소화 옵션을 고려하십시오. 이것은 중요한 단계는 부정적 (7)의 표면 항원의 발현에 영향을 미칠 수있다. - 세포를 분리 할 수 있도록 (세포 유형)에 따라 5 분 - 2 37 ℃에서 요리 / 플라스크를 인큐베이션. 조심스럽게 셀을 제거하기 위해 혈청 학적 피펫으로 조직 배양 용기 또는 플러시를 누릅니다. (이 같은 이후 단계에서 세포 손실과 응고가 발생할 수 있습니다) 소화를 통해 마십시오.
- 큐두 유동 완충액 (PBS에서 2 % FBS)의 볼륨을 가산함으로써 트립신 교체 uench 및 15ml의 원뿔형 튜브에 세포를 수집한다.
- 단일 세포 현탁액을 제조 - (1000 μL 100) 또는 5 ㎖ 혈청 부드럽게 피펫 마이크로 리터 피펫을 사용하여 세포 현탁액을 연화.
- 25 ° C에서 5 분 동안 220 XG에 세포를 원심 분리기. 조심스럽게 뒤에 펠렛을 떠나 뜨는을 대기음.
- 다시 일시 펠릿 (의 크기에 따라 유동 완충액 적절한 부피 펠릿을 예를 들면, SH-SY5Y 세포의 하나 합류 T75 플라스크의 일반적인 수율은 적어도 10 × 106 세포 인 경우 세포에 유동 완충액 5 ㎖)에 재현 탁된다.
참고 : 큰 덩어리 또는 응고가 관찰되는 경우, (30)를 통해 필터링 - 100 μm의 메쉬.
- 부드럽게 2+에 Mg 부착 세포의 접시 / 플라스크를 씻어 / 칼슘 무료로 인산 완충 식염수 (PBS) RT에서 (예를 들어, T75 플라스크 5 ml의 6 웰 플레이트에 잘 당 3 ㎖, 10 ㎖를위한 10cm 접시).
- 셀 카운팅 52 :
- TR의 부피로 정의 된 비율로 마이크로 원심 분리 튜브에 세포 현탁액의 분취 량을 작은 전송 묽은ypan 청색 또는 혈구로 전송 또는 자동 셀 카운팅 시스템 전에 다른 생존 염료.
- (CFSE 라벨링을 진행하는 경우) 0.1 % BSA와 함께 플로우 버퍼 또는 PBS의 적절한 양을 첨가하여 1 × 106 생존 세포 / ml의 농도로 세포 현탁액을 희석.
주 : 프로피 듐 요오다 이드, 7- aminoactinomycin D, 아 넥신 V 및 시판 고칠 생존력 분석 키트는 세포의 생존 능력을 평가하기 위해 다른 옵션들을 나타낸다. 이전 53 사용될 수있다 바와 같이 또한, 세포 사멸 분석은 카스파 제 -3 형광성을 사용. 형광 채널은 모든 샘플에 포함 된 경우 다음 단계에 대한 옵션을 제한 할 수있다 이러한 시약에 의해 "점령"됩니다.
CFSE를 사용하여 2. 세포 내 염료 라벨 (그림 3)
- 쉽게 사용할 수있는 콘텐츠 원하는 농도로 희석 CFSE.
참고 :이 실험의 주식 농도0.01 mM의 사용 하였다. 경험적으로 CFSE의 최적의 작업 농도를 결정합니다. - 0.1 μM의 최종 농도에 대한 세포를 1 ㎖ 당 0.01 mM의 CFSE 용액 (1.3.2 절, PBS + 0.1 % BSA에 1 × 10 6 세포 / ml의 농도)의 10 μl를 추가합니다. 간단히 소용돌이가 잘 혼합한다.
참고 : 여기에 사용 CFSE 농도가 약 염료의 독성 세포 따라서, 일반적으로 증식 분석에 적용되는 것보다 낮은 열 배 아르는 최소이다. 우리는 세포 생존 능력에 부정적인 영향을 관찰하지 않습니다. - 일정 흔들림 (200 RPM)와 실온에서 5 분 동안 품어. 빛으로부터 보호합니다.
- 유동 튜브 완충액 5 볼륨을 추가하여 염료를 켄 칭하고. RT에서 5 분 94 XG에 원심 분리기.
- 뒤에 펠렛을 떠나 상층 액을 제거한다. 흐름 버퍼의 5 볼륨이있는 세포를 다시 일시 중지합니다.
- RT에서 5 분 94 XG에 원심 분리기. 상층 액을 제거하고 1 × 106 세포의 농도로 유동 버퍼 셀을 다시 일시 중지 / ml의.
- 염색 된 세포 현탁액의 관심 흠없는 세포의 동일한 수를 추가합니다. 항원 염색 프로토콜 (섹션 3) 표면 진행합니다.

CFSE 표지 염료. SH-SY5Y 세포의 신경 아세포종 세포를 통한 두 개의 라인들 사이의 차동 CD 표면 항원의 발현의 검출도 3은 미리 라벨링되어 비 표지 BJ 섬유 아세포에 비해 후속 식별을 CFSE로. (; 화살촉 = BJ 섬유 아 세포 화살표 = SH-SY5Y) 표면 마커 CD24 또는 CD54 (두 APC에 복합)와 혼합 된 샘플 (오른쪽 패널)의 공동 염색 세포주 인해 CFSE 염색을 쉽게 구별 할 수 있음을 보여줍니다. SH-SY5Y 세포의 대부분은 아니지만 CD24 CD54 (ICAM-1)을 표현한다. 반면, BJ 섬유 아세포 (음성 CFSE)는 CD54 양성하지만 CD24에 대한 대부분 부정적이다."https://www.jove.com/files/ftp_upload/52241/52241fig3highres.jpg"대상 = "_ 빈">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 세포 표면 얼룩
- 샘플 및 중요한 컨트롤 (표 1 참조)를 포함하는 레이블 튜브.
| 튜브 없음. | 샘플 이름 | 항원 형광 | 희석 |
| (1) | 흠 세포 | - | |
| 이 | 단일 스테인드 | CD24-APC | 1시 50분 |
| 3 | 단일 스테인드 | TUJ1 - 알렉사 불소 488nm | 1 : 2,000 |
| 4 | 스테인드 더블 | CD24-APC | 1시 50분 |
| TUJ1 - 알렉사 불소 488nm | 1 : 2,000 | ||
| (5) | 단일 스테인드 | 보조 만 : 알렉사 불소 488nm | 1 : 2,000 |
튜브 표 1. L 경악 실험 세포 계측법 일반적인 흐름에 포함된다. 표는이 비디오 문서에서 설명하는 공동 염색 실험에 필요한 샘플 튜브의 최소 세트를 표시합니다. 이상적인 얻어진 실험 결과의 정확한 해석에 필요한 모든 제어 (네거티브, 포지티브뿐만 아니라, 보상 제어)를 포함 할 필요가있다.
- 각 1.5 ml의 microcentrifuge 관에 (2.7 절 또는 1.3.2)에서 세포 현탁액 100 μl를 추가합니다.
주 : 확인 0.1 × 10 6 세포의 최소 세포 현탁액 100 ㎕ 당 존재합니다. - 적절한 희석 시료에 형광 물질 항체를 추가합니다.
주 : 실험에 앞서 각각의 항체에 대한 희석 작업을 결정합니다. 목록 O 표 2 참조F 신경 표면 항원.
| 항원 | 셀 유형 | 참고 |
| CD15 | 신경줄 기세포 | [28, 67] |
| CD24 | 신경 세포 | [28, 68] |
| CD29 | 신경줄 기세포 | [28, 69, 70] |
| CD44 | 신경 교세포 | [25] |
| CD49f | 신경줄 기세포 | [38] |
| CD56 (NCAM) | 신경 세포 | [71] |
| CD133 | 신경줄 기세포 | [27] |
| CD184 | 신경 줄기 세포와 신경 교세포 | [25] |
| CD200 | 신경 세포 | [38] |
| CD271 | 신경 크레스트 줄기 세포 | [25] |
| A2B5 | 신경 교세포 | [31] |
| 코린 | 도파민 전구 물질 | [35, 36] |
| FORSE1 | 신경줄 기세포 (NSC) | [72] |
| GLAST | 신경 교세포 | [33] |
| NG2 | 신경 교세포 | [32] |
신경 표면 항원의 선택은 표 2.이 테이블은 신경 혈통을 특성화하는 데 사용되는 표면 항원의 증가 패널을 예시하는 다양한 신경 세포 유형에 의해 발현되는 것으로 밝혀 표면 에피토프의리스트를 제공한다. 이 선택이 완전하고 마커의 대부분이 다른 신경 및 비 신경 세포의 범위에 의해 표현되어있는 거리가 멀다 있습니다. 따라서, 여러 마커의 조합은 잘 정의 나타낸 뉴럴 서브 세트를 분리해야한다.
- 어둠 속에서 진탕 기 (200 RPM)에서 30 분 동안 품어.
- 흐름 버퍼 세척
- 튜브에 흐름 버퍼의 1 ML을 추가합니다. 4 ° C에서 4 분 380 XG에 원심 분리기.
- 뒤에 펠렛을 떠나 상층 액을 제거한다.
- 다시 세척 단계를 반복합니다.
- 두 번째 세척 후에, 상등액 캔트 100 μL의 최종 부피 유량 버퍼 셀을 다시 일시.
- 유세포 분석을위한 샘플을 사용하십시오. 또한, 제 4, 5를 진행합니다.
참고 : 세포가 정렬 문화 후 FACS에 다시 넣어 될 경우 (즉, 고정 또는 투과성으로하지 않고 생존 세포 현탁액), 수확, 염색 및 분석 단계에서 무균 기술을 적용.
4. 고정 및 투과성으로 (38)
- 고정하여 파라 포름 알데히드 (PFA) :
- PBS에 2 % PFA를 포함하는 고정 버퍼를 준비합니다.
참고 : PFA는 인간과 환경에 해 롭습니다. 적절한 개인 보호 장비를 반드시 착용하고, 지역 규정에 따라 폐기물을 폐기합니다. - 세포 현탁액 100 ㎕에 고정 버퍼의 500 μl를 추가합니다.
- 어둠 속에서 진탕 (100 RPM)에 실온에서 15 분 동안 인큐베이션 튜브.
- PBS에 2 % PFA를 포함하는 고정 버퍼를 준비합니다.
- PBS 세척 :
- 튜브에 1 ㎖의 PBS를 추가합니다. 4 ℃에서 3 분 380 XG에 원심 분리기.
- 튜브에 약 100 μl를 떠나 뜨는을 가만히 따르다 / 폐기하십시오.
- 트윈 -20으로 투과성으로 :
- PBS에 0.7 % 트윈 20을 포함 투과성으로 버퍼를 준비합니다.
- 세포 현탁액 100 ㎕에 투과성으로 버퍼의 500 μl를 추가합니다.
- 어둠 속에서 진탕 (100 RPM)에 실온에서 15 분 동안 인큐베이션 튜브.
- (4.2 절에 설명 된대로) PBS로 한 번 세포를 씻고 튜브 공동에서 뜨는을 제거mpletely, 뒤에 만 펠렛을 떠나.
5. 세포 내 항원 염색 (38) (그림 4)
- 차 항체 용액의 제조 :
- 1 % 소 혈청 알부민, 10 %의 혈청 (예, 당나귀 또는 정상 염소 혈청)와 0.5 % 트윈 -20을 함유하는 PBS에서 희석 완충액 일차 항체를 희석.
참고 : 보조 항체가 제기 된 종류에 따라 사용되는 혈청을 선택합니다. - 대안 적으로, 제조자의 지시에 따라 차 항체의 제논 형광 표지를 사용한다.
- 적절한 희석 (20 μL ≤ 총 부피)에서 PBS에서 일차 항체의 1 μg의를 준비합니다.
- 항체 용액에 제논 형광 IgG의 표지 시약 (구성 요소)의 5 μl를 추가합니다.
- RT에서 5 분 동안 혼합물을 배양한다.
- 반응 혼합물에 제논 차단 시약 (구성 요소 B)의 5 μl를 추가합니다.
- 품다RT에서 5 분 동안 혼합물. 30 분 이내에 시료에 항체를 적용합니다.
- 1 % 소 혈청 알부민, 10 %의 혈청 (예, 당나귀 또는 정상 염소 혈청)와 0.5 % 트윈 -20을 함유하는 PBS에서 희석 완충액 일차 항체를 희석.
- 차 항체 염색 :
- 세포 펠렛에 차 항체 용액 100 μl를 추가하고 부드럽게 섞어 씹다.
- 대안 적으로, 적절한 희석 세포 현탁액에 제논의 형광 표지 된 항체를 추가한다.
- 빛으로부터 보호 진탕 기 (200 RPM)에 실온에서 30 분 동안 인큐베이션 튜브. (4.2 절에 설명 등) PBS로 한 번 세포를 씻으 뒤에 만 펠렛을 떠나, 완전히 튜브에서 뜨는을 제거합니다.
- (제논의 형광 표지 항체 필요하지 않음) 이차 항체 염색 :
- 적절한 농도로 PBS에서 차 항체를 희석.
- 세포 펠렛에 차 항체 용액 100 μl를 추가하고 부드럽게 섞어 씹다. 어둠 속에서 진탕 (200 RPM)에 실온에서 30 분 동안 인큐베이션 튜브.
- (4.2 절에 설명 된대로) PBS로 샘플을 두 번 씻으십시오.
- 흐름 버퍼로 한번 세척 (3.5 절 참조).
- 유동 완충액 약 150 μL의 셀을 다시 중지하고 사이토 흐름 분석.
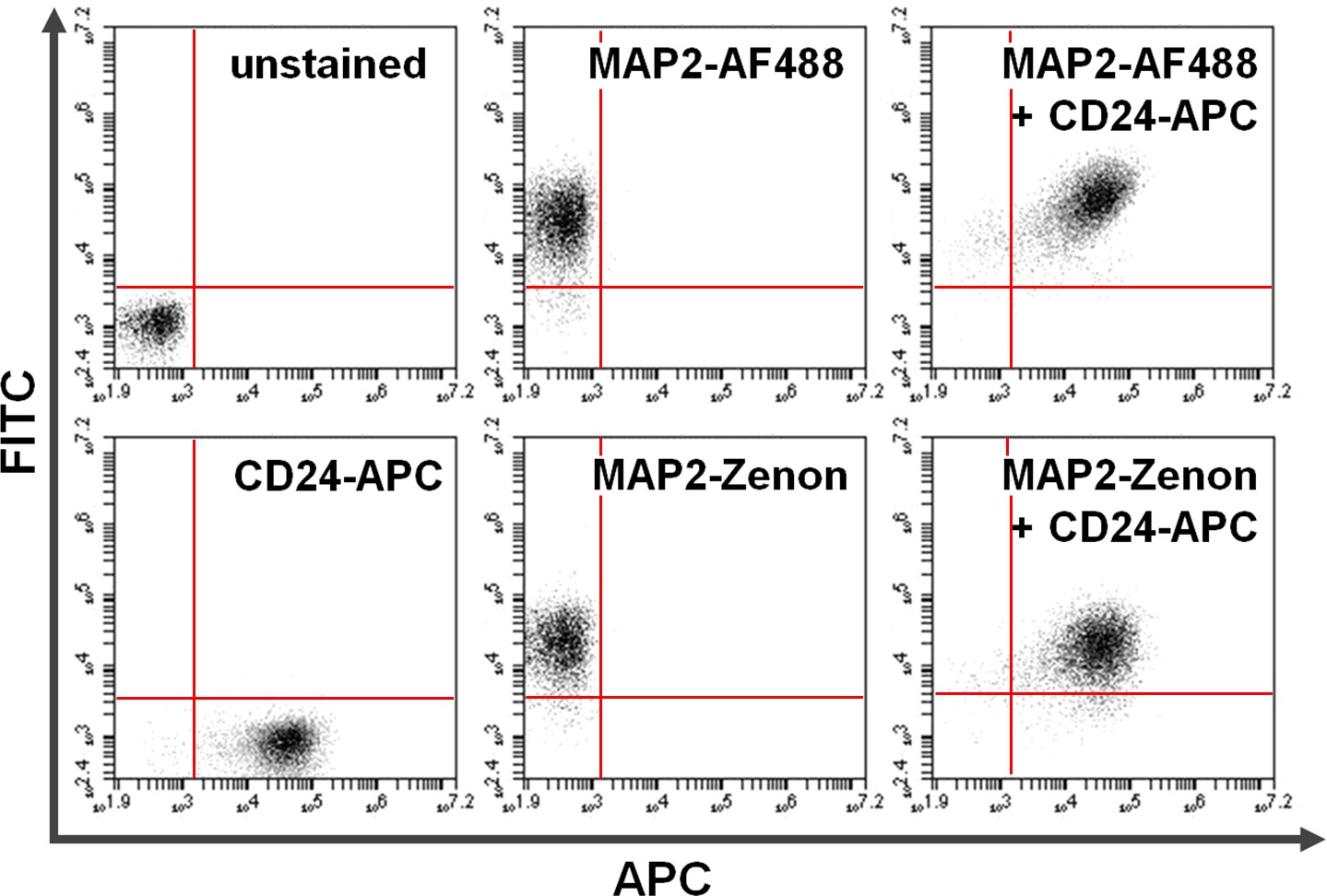
표면 및 세포 내 단백질의 그림 4. 공동 염색. 데이터 유동 세포 계측법 보조 + 차 표면의 얼룩과 함께 제논의 형광 기반의 세포 내 염색 대 항체 기반의 비교를 예시한다. y 축 (사분면)과 x 축 (오른쪽 아래 사분면)에 독점 양성은 각각 MAP2 및 CD24에 대한 염색 된 세포를 보여줍니다. 공동 염색 후, MAP2 공유 및 CD24 발현은 사분면 (오른쪽 패널)에서 볼 수있다. 사용의 비교알렉사 형석 488., MAP2 라벨링 수익률과 유사한 결과 제논 형광 (아래) 대 (상단 AF488) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
6. 유세포 분석
- 신호 검출에 적합한 필터 플로우 사이토 미터를 사용하여 염색 프로토콜의 완료 직후 유세포 분석을 수행. FL-1 (30분의 533), FL-2 (40분의 585) 및 FL-4 (25분의 675) 대역 통과 필터와 488 nm의 파란색과 640 nm의 적색 레이저를 사용합니다.
- 파편과 죽은 세포를 제외한 전방 및 측면 산란을 기반으로 차 문을 설정합니다.
- 표면과 하나의 스테인드 컨트롤을 사용하여 스펙트럼 오버랩 흠 샘플 및 보상에 따라 ≤0.5 %로 세포 내 항원에 대한 설정 형광 게이트.
결과
여기에 제시된 프로토콜은 다양한 실험 방법 (그림 2) 수 있습니다. 최단 버전에서는, 그것이 표면 항원의 간단한 염색 가이드 간주 될 수있다 (1, 3, 6 단계). 그것의 더 복잡한 형태에있어서, 세포 내 항원의 범위 공동 라벨 패러다임의 수는 (2 및 / 또는 4~5 선택적 단계) 추구 될 수있다. 또한, CFSE 표지 단계는 세포 - 세포 상호 작용 연?...
토론
여기에 제시된 프로토콜은 물론 인간 줄기 세포로부터 유도 된 신경 세포 배양 확립되어 있지만, 동일하게 주 조직 또는 신경 세포주를 포함하는 다른 신경 세포 소스에 적용될 수있다. 배아 공급원 이외에, 신경 줄기 세포 또는 전구 성인 뇌 신경 인성 (27)의 영역으로부터 추출 될 수있다. 또한, 유동 세포 계측법 및 FACS는 성숙한 뉴런 (54), 아스트로 글 리아 (33), 미세 아교...
공개
The authors declare no potential conflicts of interest.
감사의 말
Our research program is funded through the Emmy Noether-Program of the German Research Foundation (DFG), grant PR1132/3-1. Further support by the Müller-Fahnenberg Foundation of the University of Freiburg is gratefully acknowledged. This study was supported in part by the Excellence Initiative of the German Research Foundation (GSC-4, Spemann Graduate School).
자료
| Name | Company | Catalog Number | Comments |
| DMEM/F12 (1:1) (Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) |  Life Technologies Life Technologies | 11330057 | |
| DPBS without Ca2+ Mg2+ |  Life Technologies Life Technologies | 14190169 | |
| Fetal bovine serum, qualified, E.U.-approved, South America origin (FBS) |  Life Technologies Life Technologies | 10270-106 | |
| MEM Non-essential amino acids (100x) |  Life Technologies Life Technologies | 11140035 | |
| TrypLE Express |  Life Technologies Life Technologies | 12604013 | |
| Trypan blue solution, 0.4% |  Life Technologies Life Technologies | 15250061 | |
| Paraformaldehyde |  Carl Roth Carl Roth | 335.3 | |
| Bovine serum albumin (BSA) Fraction V |  PAA Laboratories, Coelbe PAA Laboratories, Coelbe | K41-001 | |
| Tween-20 Detergent |  Calbiochem Calbiochem | 655205 | |
| Carboxyfluorescein succinimidyl ester (CFSE) |  eBioscience eBioscience | 65-0850-84 | |
| DMSO |  AppliChem AppliChem | A1584 | |
| Bottle top filters express plus 0.22 µm, 250 ml |  Millipore Millipore | SCGPU02RE | |
| Cell culture treated flasks (T 25) |  NUNC NUNC | 156367 | |
| Cell culture treated flasks (T 75) |  NUNC NUNC | 156499 | |
| Conical tubes (15 ml) |  Greiner Bio-One Greiner Bio-One | 188271 | |
| Conical tubes (50 ml) |  Greiner Bio-One Greiner Bio-One | 227261 | |
| Pasteur pipet, glass (150 mm) |  STEIN Labortechnik, Remchingen STEIN Labortechnik, Remchingen | S03710150 | |
| Pipet tips (0.1-10 µl) |  Corning Corning | 4125 | |
| Pipet tips (1-200 µl) |  Corning Corning | 4126 | |
| Pipet tips (100-1000 µl) |  Corning Corning | 4129 | |
| Serological pipets, 5 ml |  Corning Corning | 4051 | |
| Serological pipets, 10 ml |  Corning Corning | 4101 | |
| Serological pipets, 25 ml |  Corning Corning | 4251 | |
| Microcentrifuge tubes (0.5 ml) |  Sarstedt Sarstedt | 72,699 | |
| Microcentrifuge tubes (1.5 ml) |  Greiner Bio-One Greiner Bio-One | 616201 | |
| Microcentrifuge tubes (2.0 ml) |  Sarstedt Sarstedt | 72,695,500 | |
| Anti-Human CD24 APC monoclonal antibody |  eBioscience eBioscience | 17-0247-42 | Working dilution 1:50 |
| Anti-Human CD54 PE monoclonal antibody |  eBioscience eBioscience | 12-0549-42 | Working dilution 1:50 |
| Neuronal Class III β-Tubulin (Tuj1) polyclonal antibody |  Covance Covance | PRB-435P | Working dilution 1:2,000 |
| Alexa Fluor 488 Donkey anti Rabbit |  Life Technologies Life Technologies | A21206 | Working dilution 1:2,000 |
| Zenon® Fluorescein Rabbit IgG Labeling Kit |  Life Technologies Life Technologies | Z-25342 | |
| Neubauer-Improved counting chamber |  Marienfeld Marienfeld | 0640010 | |
| Vortex |  Scientific Industries Scientific Industries | G560E | |
| Thermomixer comfort |  Eppendorf Eppendorf | 5355 000.001 | |
| Accuri C6 flow cytometer |  Becton Dickinson (BD) Becton Dickinson (BD) | 653118 | |
| Microcentrifuge refrigerated, PerfectSpin 24 R |  Peqlab Peqlab | 91-PSPIN-24R | |
| Orbital shaker, Unimax 1010 |  Heidolph Heidolph | 543-12310-00 | |
| Centrifuge refrigerated, Rotanta 96 RC |  Hettich Hettich | 4480-50 | |
| Class II Biological safety cabinet Safe 2020 |  Thermo Scientific Thermo Scientific | 51026640 | |
| CO2 Incubator, Heracell 240i |  Thermo Scientific Thermo Scientific | 51026331 | |
| Vacuum system, Vacusafe comfort |  Integra Biosciences Integra Biosciences | 158320 | |
| Microscope, Axiovert 40 CFL |  Zeiss Zeiss | 451212 | |
| Pipet controller, accu-jet pro |  Brand Brand | 26303 | |
| Micropipet, Pipetman neo P20N (2-20 µl) |  Gilson Gilson | F144563 | |
| Micropipet, Pipetman neo P200N (20-200 µl) |  Gilson Gilson | F144565 | |
| Micropipet, Pipetman neo P1000N (100-1000 µl) |  Gilson Gilson | F144566 |
참고문헌
- Herzenberg, L. A., et al. The History and Future of the Fluorescence Activated Cell Sorter and Flow Cytometry: A View from. 48 (10), 1819-1827 (2002).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today’s technology and tomorrow's horizons. Methods (San Diego, Calif). 57 (3), 251-258 (2012).
- Jaye, D. L., Bray, R. A., Gebel, H. M., Harris, W. A. C., Waller, E. K. Translational applications of flow cytometry in clinical practice). J. Immunol. 188 (10), 4715-4719 (2012).
- Henel, G., Schmitz, J. Basic Theory and Clinical Applications of Flow Cytometry. Lab Med. 38 (7), 428-436 (2007).
- Seita, J., Weissman, I. L. Hematopoietic stem cell: self-renewal versus differentiation. Wiley Interdiscip. Rev. Syst. Biol. Med. 2 (6), 640-653 (2010).
- Ulrich, H., Bocsi, J. Phenotypes of stem cells from diverse origin. Cytometry. A. 77 (1), 6-10 (2010).
- Panchision, D. M., et al. Optimized flow cytometric analysis of central nervous system tissue reveals novel functional relationships among cells expressing CD133, CD15, and CD24. Stem cells. 25 (6), 1560-1570 (2007).
- Meyer, R. A., Zaruba, M. E., McKhann, G. M. Flow cytometry of isolated cells from the brain. Anal. Quant. Cytol. 2 (1), 66-74 (1980).
- Junger, H., Junger, W. G. CNTF and GDNF, but not NT-4, support corticospinal motor neuron growth via direct mechanisms. Neuroreport. 9 (16), 3749-3754 (1998).
- McLaren, F. H., Svendsen, C. N., Vander Meide, P., Joly, E. Analysis of neural stem cells by flow cytometry: cellular differentiation modifies patterns of MHC expression. J. Neuroimmunol. 112 (1-2), 35-46 (2001).
- Wang, S., Roy, N. S., Benraiss, A., Goldman, S. A. Promoter-based isolation and fluorescence-activated sorting of mitotic neuronal progenitor cells from the adult mammalian ependymal/subependymal. 22 (1-2), 167-176 (2000).
- Tanke, H. J., vander Keur, M. Selection of defined cell types by flow-cytometric cell sorting. Trends Biotechnol. 11 (2), 55-62 (1993).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243 (1-2), 77-97 (2000).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. J. Neurosci. Methods. 129 (1), 73-79 (2003).
- Ernst, A., et al. Neurogenesis in the striatum of the adult human brain. Cell. 156 (5), 1072-1083 (2014).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat. Rev. Immunol. 4 (8), 648-655 (2004).
- Bandura, D. R., et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time-of-flight mass spectrometry. Anal. Chem. 81 (16), 6813-6822 (2009).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Neveu, I., Rémy, S., Naveilhan, P. The neuropeptide Y receptors, Y1 and Y2, are transiently and differentially expressed in the developing cerebellum. Neuroscience. 113 (4), 767-777 (2002).
- Pruszak, J., Just, L., Isacson, O., Nikkhah, G. Isolation and culture of ventral mesencephalic precursor cells and dopaminergic neurons from rodent brains. Curr. Protoc. Stem Cell Biol. 2 (Unit 2D.5), (2009).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99 (22), 14506-14511 (2002).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993 (1-2), 18-29 (2003).
- Pruszak, J., Isacson, O. Molecular and cellular determinants for generating ES-cell derived dopamine neurons for cell therapy. Adv. Exp. Med. Biol. 651, 112-123 (2009).
- Carson, C. T., Aigner, S., Gage, F. H. Stem cells: the good, bad and barely in control. Nat. Med. 12 (11), 1237-1238 (2006).
- Yuan, S. H., et al. Cell-surface marker signatures for the isolation of neural stem cells, glia and neurons derived from human pluripotent stem cells. PloS One. 6 (3), e17540 (2011).
- Roy, N. S., Cleren, C., Singh, S. K., Yang, L., Beal, M. F., Goldman, S. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat. Med. 12 (11), 1259-1268 (2006).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proc. Natl. Acad. Sci. U. S. A. 97 (26), 14720-14725 (2000).
- Pruszak, J., Ludwig, W., Blak, A., Alavian, K., Isacson, O. CD15, CD24, and CD29 define a surface biomarker code for neural lineage differentiation of stem cells. Stem Cells. 27 (12), 2928-2940 (2009).
- Peh, G. S. -. L., Lang, R. J., Pera, M. F., Hawes, S. M. CD133 expression by neural progenitors derived from human embryonic stem cells and its use for their prospective isolation. Stem Cells Dev. 18 (2), 269-282 (2009).
- Golebiewska, A., Atkinson, S. P., Lako, M., Armstrong, L. Epigenetic landscaping during hESC differentiation to neural cells. Stem Cells. 27 (6), 1298-1308 (2009).
- Dietrich, J., Noble, M., Mayer-Proschel, M. Characterization of A2B5+ glial precursor cells from cryopreserved human fetal brain progenitor cells. Glia. 40 (1), 65-77 (2002).
- Nishiyama, A. NG2 cells in the brain: a novel glial cell population. Hum. Cell. 14 (1), 77-82 (2001).
- Jungblut, M., et al. Isolation and characterization of living primary astroglial cells using the new GLAST-specific monoclonal antibody ACSA-1. Glia. 60 (6), 894-907 (2012).
- Ono, Y., et al. Differences in neurogenic potential in floor plate cells along an anteroposterior location: midbrain dopaminergic neurons originate from mesencephalic floor plate cells. Development. 134 (17), 3213-3225 (2007).
- Chung, S., et al. ES cell-derived renewable and functional midbrain dopaminergic progenitors. Proc. Natl. Acad. Sci. U.S.A. 108 (23), 9703-9708 (2011).
- Doi, D., et al. Isolation of Human Induced Pluripotent Stem Cell-Derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation. Stem Cell Reports. 2 (3), 337-350 (2014).
- Solozobova, V., Wyvekens, N., Pruszak, J. Lessons from the embryonic neural stem cell niche for neural lineage differentiation of pluripotent stem cells. Stem Cell Rev. 8 (3), (2012).
- Turaç, G., et al. Combined flow cytometric analysis of surface and intracellular antigens reveals surface molecule markers of human neuropoiesis. PloS One. 8 (6), e68519 (2013).
- Buchwalow, I. B., Böcker, W. Chapter 2. Immunohistochemistry: Basics and Methods. , 9-17 (2010).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. J. Vis. Exp. (70), e4287 (2012).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Hawkins, E. D., et al. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Quah, B. J. C., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. J. Vis. Exp. 44, (2010).
- Sukhdeo, K., et al. Multiplex flow cytometry barcoding and antibody arrays identify surface antigen profiles of primary and metastatic colon cancer cell lines. PloS One. 8 (1), e53015 (2013).
- Jiang, L., et al. Daucosterol promotes the proliferation of neural stem cells. The J. Steroid Biochem. Mol. Biol. 140, 90-99 (2014).
- Hulspas, R., et al. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry. B. 76 (6), 355-364 (2009).
- Moloney, M., Shreffler, W. G. Basic science for the practicing physician: flow cytometry and cell sorting. Annals of Allergy, Asthm., & Immunology: Official Publication of the American College of Allergy, Asthma., & Immunology. 101 (5), 544-549 (2008).
- Siebzehnrubl, F. A., et al. Isolation and characterization of adult neural stem cells. Methods Mol. Biol. 750, 61-77 (2011).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain). J. Neurosci. Methods. 203 (1), 10-18 (2012).
- Tham, C. -. S., Lin, F. -. F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. Int. J. Dev. Neurosci. 21 (8), 431-443 (2003).
- Nguyen, H. X., Beck, K. D., Anderson, A. J. Quantitative assessment of immune cells in the injured spinal cord tissue by flow cytometry: a novel use for a cell purification method. J. Vis. Exp. (50), e2698 (2011).
- Marchenko, S., Flanagan, L. Counting human neural stem cells. J. Vis. Exp. (7), 262 (2007).
- Brunlid, G., Pruszak, J., Holmes, B., Isacson, O., Sonntag, K. C. Immature and neurally differentiated mouse embryonic stem cells do not express a functional Fas/Fas ligand system. Stem Cells. 25 (10), 2551-2558 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J. Neurosci. Methods. 71 (2), 143-155 (1997).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat. Protoc. 1 (4), 1947-1951 (2006).
- Nielsen, J. A., Maric, D., Lau, P., Barker, J. L., Hudson, L. D. Identification of a novel oligodendrocyte cell adhesion protein using gene expression profiling. J. Neurosci. 26 (39), 9881-9891 (2006).
- Daneman, R., et al. The mouse blood-brain barrier transcriptome: a new resource for understanding the development and function of brain endothelial cells. PloS One. 5 (10), e13741 (2010).
- Gräbner, R., Till, U., Heller, R. Flow cytometric determination of E-selectin, vascular cell adhesion molecule-1, and intercellular cell adhesion molecule-1 in formaldehyde-fixed endothelial cell monolayers. Cytometry. 40 (3), 238-244 (2000).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Lathia, J. D., et al. High-throughput flow cytometry screening reveals a role for junctional adhesion molecule a as a cancer stem cell maintenance factor. Cell Rep. 6 (1), 117-129 (2014).
- Ganat, Y. M., et al. Identification of embryonic stem cell-derived midbrain dopaminergic neurons for engraftment. J. Clin. Invest. 122 (8), 2928-2939 (2012).
- Hedlund, E., et al. Embryonic stem cell-derived Pitx3-enhanced green fluorescent protein midbrain dopamine neurons survive enrichment by fluorescence-activated cell sorting and function in an animal model of Parkinson’s disease. Stem Cells. 26 (6), 1526-1536 (2008).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Chivet, M., Hemming, F., Pernet-Gallay, K., Fraboulet, S., Sadoul, R. Emerging role of neuronal exosomes in the central nervous system. Front. Physiol. 3, 145 (2012).
- Graner, M. W., et al. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 23 (5), 1541-1557 (2009).
- Eldh, M., Lötvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. (59), e3037 (2012).
- Capela, A., Temple, S. LeX is expressed by principle progenitor cells in the embryonic nervous system, is secreted into their environment and binds Wnt-1. Dev. Biol. 291 (2), 300-313 (2006).
- Nieoullon, V., Belvindrah, R., Rougon, G., Chazal, G. mCD24 regulates proliferation of neuronal committed precursors in the subventricular zone. Mol. Cell. Neurosci. 28 (3), 462-474 (2005).
- Nagato, M., et al. Prospective characterization of neural stem cells by flow cytometry analysis using a combination of surface markers. J. Neurosci. Res. 80 (4), 456-466 (2005).
- Hall, P. E., Lathia, J. D., Miller, N. G. A., Caldwell, M. A., French-Constant, C. Integrins are markers of human neural stem cells. Stem Cells. 24 (9), 2078-2084 (2006).
- Hargus, G., et al. Differentiated Parkinson patient-derived induced pluripotent stem cells grow in the adult rodent brain and reduce motor asymmetry in Parkinsonian rats. Proc. Natl. Acad. Sci. U.S.A. 107 (36), 15921-15926 (2010).
- Elkabetz, Y., et al. Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes Dev. 22 (2), 152-165 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유