Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Проточной цитометрии протоколы для поверхностных и внутриклеточных антиген анализ нейронных типов клеток
В этой статье
Резюме
We provide a detailed description of a protocol for flow cytometric analysis of surface antigens and/or intracellular antigens in neural cell types. Critical aspects of experimental planning, step-by-step methodological procedures, and fundamental principles of flow cytometry are explained in order to enable neurobiologists to exploit this powerful technology.
Аннотация
Flow cytometry has been extensively used to define cell populations in immunology, hematology and oncology. Here, we provide a detailed description of protocols for flow cytometric analysis of the cluster of differentiation (CD) surface antigens and intracellular antigens in neural cell types. Our step-by-step description of the methodological procedures include: the harvesting of neural in vitro cultures, an optional carboxyfluorescein succinimidyl ester (CFSE)-labeling step, followed by surface antigen staining with conjugated CD antibodies (e.g., CD24, CD54), and subsequent intracellar antigen detection via primary/secondary antibodies or fluorescently labeled Fab fragments (Zenon labeling). The video demonstrates the most critical steps. Moreover, principles of experimental planning, the inclusion of critical controls, and fundamentals of flow cytometric analysis (identification of target population and exclusion of debris; gating strategy; compensation for spectral overlap) are briefly explained in order to enable neurobiologists with limited prior knowledge or specific training in flow cytometry to assess its utility and to better exploit this powerful methodology.
Введение
Проточной цитометрии была широко использована в иммунологии, гематологии и онкологии для определения клеточных популяций с помощью внутренних свойств рассеяния, экспрессии антигенов на клеточной поверхности, и других параметров флуоресценции 1-3. Наши идеи в развитие родословия и болезни являются результатом в значительной степени непрерывного уточнения этой методологии после ее первоначального 4,5 реализации. Повышение осведомленности о количественном и в целом аналитический потенциал проточной цитометрии недавно призвал к его более широкое применение в исследованиях стволовых клеток и может позволить так же глубокое прогресса в более короткие сроки 6. Тем не менее, применение проточной цитометрии конкретно анализировать и изолировать нейронных популяций уже давно воспринимается как сложной. В отличие от гемопоэтических клеток, что, естественно, существует в виде суспензии, нейронные клеточные типы, как правило, собирают из чрезмерно сложных источников, которые могут включать в себя глии и различные OРОЧИЕ окружающие клетки, а также сложная сеть технологических несущих нейронов. Следовательно, нейробиологии еще реализовать универсальность проточной цитометрии до его полного потенциала в повседневной исследовательских процедур. Тем не менее, до тех пор, жизнеспособным суспензии отдельных клеток могут быть созданы (и протоколы были разработаны и оптимизированы для этой цели 7), проточной цитометрии и флуоресценции активированных сортировки клеток (FACS) можно считать ценным элементом аналитического репертуара в нейробиологии 8-11.
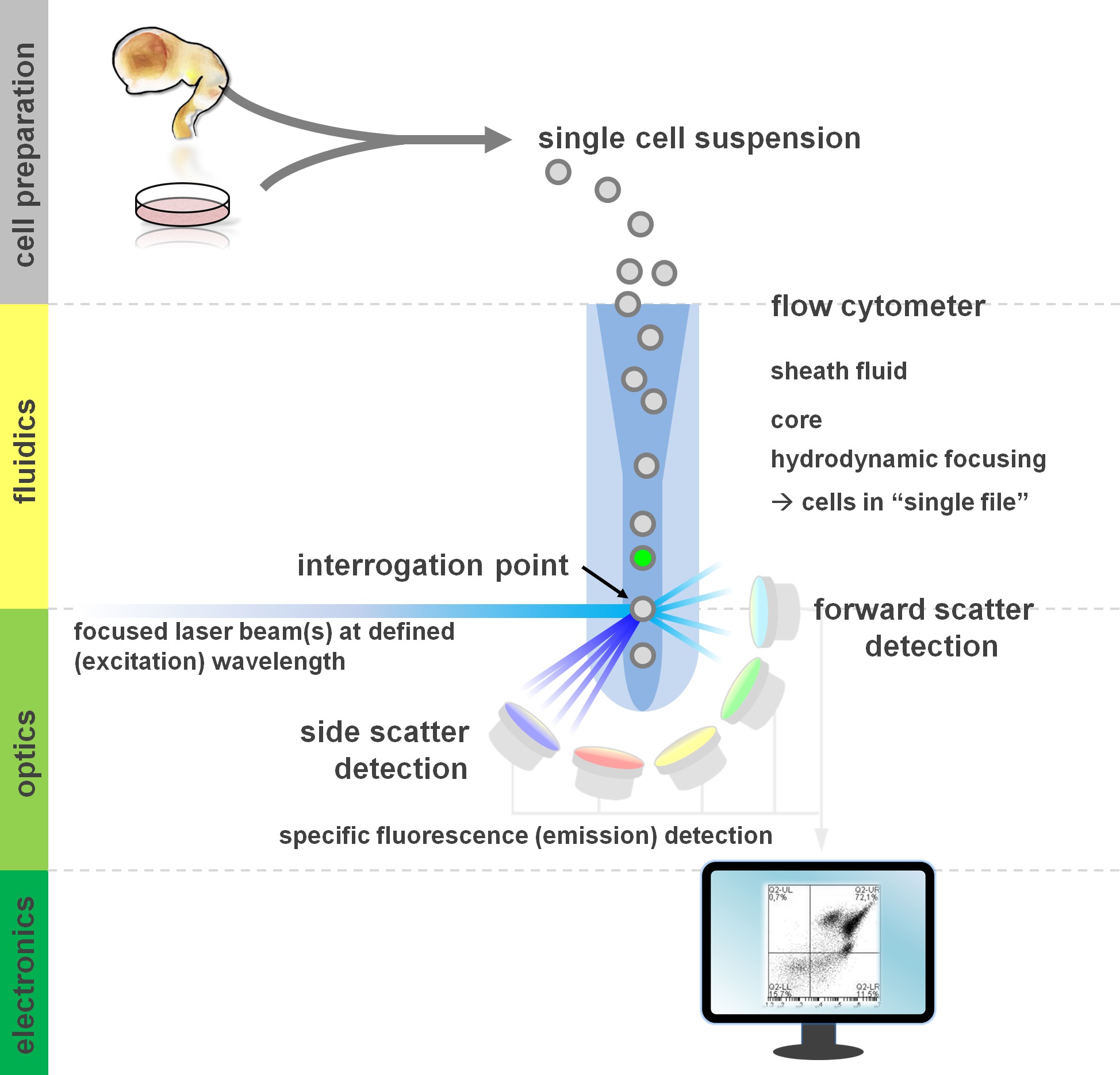
. Рисунок 1. Принцип анализа проточной цитометрии и компонентов проточной цитометрии потока цитометры включает в себя три основные системы: струйная, оптики и электроники. Упорядочить поток клеток в суспензии (полученного из первичной ткани или в пробирке культуры) осуществляется оболочки Флуиd помощью гидродинамической фокусировки, ограничивая образца к его центру ядра. Оптические части состоят из лазеров, которые освещают поток клеток и оптических фильтров, которые направляют сигнал на соответствующие детекторы. Световые сигналы, обнаруженные преобразуются в электрические сигналы, затем обрабатываются на компьютере и визуализированных на мониторе для анализа данных и стробирования. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
Пользователи расхода методы цитометрические прибыли из, по меньшей мере, базовое понимание основных фундаментальных том числе строительных блоков цитометром (для обзора см 12,13; также рисунок 1). Лазерный луч пересекается с гидродинамически сосредоточены жидкостного потока, который содержит клетки в суспензии, которая, в свою очередь проходят через лазерный луч в «одном файле" один за другим. Interceptiна клетки (или любой другой частицы, если на то пошло) с лазерными результатов в рассеянии света с этой точки допроса. Рассеянный свет может быть обнаружен в продолжение лазерного направлении (вперед разброс, связанный с размером частиц), а также перпендикулярно к ее стороной (разброса; отражающий зернистости частицы / клетки). Эти вышеупомянутые свойства рассеяния не требует специального маркировки, поэтому немеченый образец (или также продукты распада клеток, пузырьки воздуха, и т.д.) будет генерировать сигнал (событие) на двумерной рассеяния вперед по сравнению с боковой разброс участка обычно используется для начальной селекции. С помощью соответствующих лазеров и фильтры, специфичных для соответствующего спектров возбуждения и испускания, клетки могут быть проанализированы для его положительности, уровень интенсивности, или отсутствие флуоресцентных маркеров. Большинство приложений цитометрии потока были сосредоточены на характеристики с помощью антигенов клеточной поверхности. В отличие от гемопоэтических lineagе, нейронная линия осталась менее широко определяется в соответствии с поверхности профилей экспрессии эпитоп 5. Одним из преимуществ использования поверхностных антигенов в том, что живые клетки могут быть подвергнуты сортировки клеток парадигмы, такие как FACS. В отличие от этого, внутриклеточное окрашивание антиген требуется фиксация и пермеабилизирующего шаги, чтобы посредничать эпитоп-антитело взаимодействия, исключающие вниз по течению приложений, которые требуют жизнеспособных клеток. Следует отметить, что такие подходы по-прежнему обеспечивают многочисленные количественных анализов 14, а также вниз по течению анализов РНК и белка выражение 15. Гематология, иммунология и онкология часто используется более чем десятка маркеры в сочетании, чтобы определить конкретные субпопуляции 16. Кроме того, масса цитометрии или CyTOF теперь могут быть использованы для анализа до 30 параметров одновременно 17,18.
Для применений нейронных стволовых клеток, а также в первичных культурах 14,19,20 гетерогенности клеток впробирке является распространенным явлением 21-23. Клетки не представляющие целевую популяцию интерес воплотить потенциально сбивающий фактор экспериментального считывания 24,25. Удобно, различные клеточные подмножества, присутствующие в гетерогенной суспензии клеток несут различные (известные или еще не расшифрованы) профили экспрессии антигена, которые могут быть использованы, чтобы определить эти различные группы населения. Проточной цитометрии, следовательно, могут сыграть решающую роль в урегулировании сотовой неоднородность и, следовательно, способствовать биомедицинских приложений (анализы в пробирке, клеточной терапии) и оптимизировать количественный отсчет, сосредоточив внимание на наиболее значимой подмножества 24,26. Различные комбинации поверхностного антигена были определены в течение последних нескольких лет, чтобы позволить количественное и выделение специфических нейронных типов клеток. Это включает в себя CD133 для обогащения нервных стволовых клеток 27, сочетание CD15 / CD24 / CD29 поверхностных антигенов для выделения НСК, отличительноеТед нейрон и клетки нервного гребня 28 или CD15 / CD24 / CD44 / CD184 / CD271, чтобы изолировать нервных и глиальных подмножества 25, среди других подписей 29,30. Помимо нейронов, глиальных маркеры включают A2B5 31, CD44 25, NG2 32 и Glast 33. Недавняя публикация эксплуатировал среднего мозга донной маркер предшественника Корин 34,35 обогащать дофаминергических прекурсоров в трансплантации Паркинсона клеток парадигм 36. Молекулы CD не только маркеры, но функционально соответствующие медиаторы межклеточных взаимодействий и способности клеток к реагируют на сигналы от молекул внеклеточного матрикса и факторов роста 37. Одна из стратегий дальнейшего повышения арсенал комбинаторных CD антигенов охарактеризовать развитие нейронального происхождения является использование известных внутриклеточных маркеров для скрининга и определить комбинации CD-антиген для конкретного типа клеток, представляющих интерес. Мы недавно эксплуатируются такой подход и определил CD49F - / CD200 высокие комбинаторные паттерны экспрессии в качестве нового подхода к обогащению нейронов подмножества из ЦНС дифференцированных индуцированных плюрипотентных стволовых клеток культуры систем 38. Здесь мы включаем и обсуждать последний протокол (и дополнительные варианты таковых), в котором поверхность окрашивание и внутриклеточное окрашивание может быть использован одновременно для определения нейронных субпопуляций клеток с помощью проточной цитометрии.
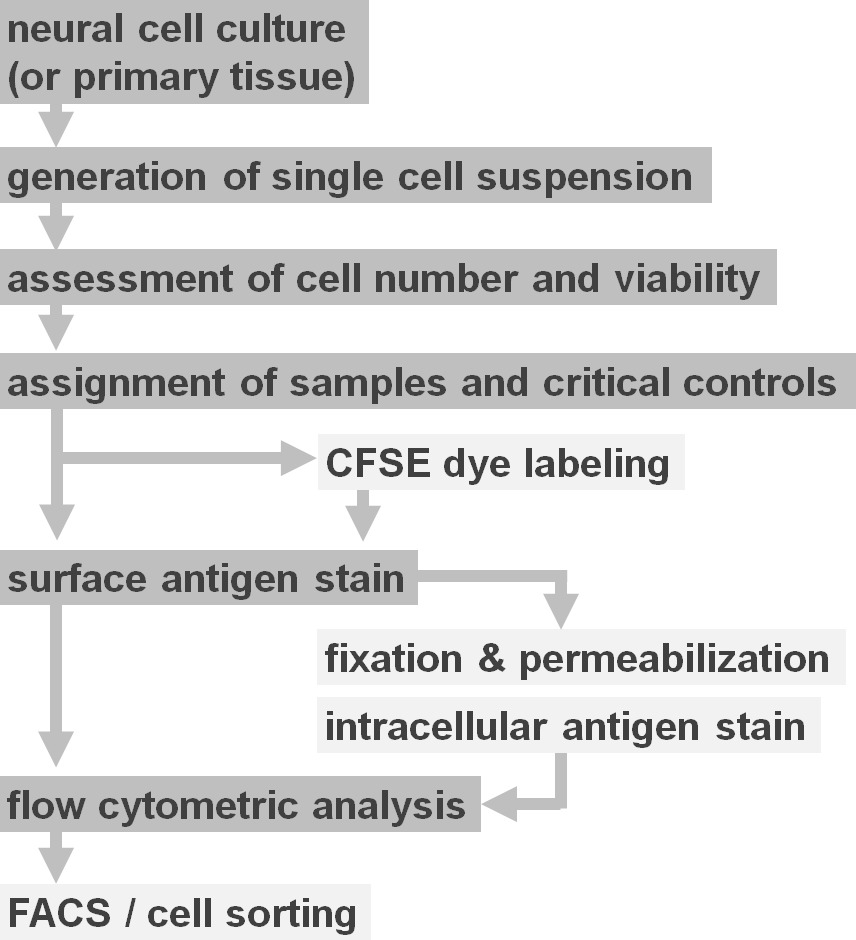
Рисунок 2. Блок-схема экспериментальной вариантов протокола. Рисунок изображает схематическое представление основных этапов в протоколе. Дополнительные шаги (CFSE краситель или внутриклеточная антиген маркировка) обозначены светло-серых коробок. После сбора важно, чтобы оценить жизнеспособность клеток и количество нейронных клеточных суспензий предшествующих окрашивания клеточной поверхности. Как положительные,также должны быть включены в дополнение к образцам, представляющим интерес отрицательные контроли. Образцы могут быть проанализированы с помощью анализа проточной цитометрии и / или используются в сотовых сортировки парадигм. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
В то время как мы уже использовали первичное антитело в сочетании с вторичным антителом для внутриклеточного окрашивания 38, теперь ввести нековалентную маркировки первичного антитела с помощью флуоресцентных Fab фрагментов (Зенон маркировка), как небольшое изменение, тем самым уменьшая этапы клеток манипуляции 39. Кроме того, в качестве дополнительного примера универсальности этого протокола, мы используем дополнительный маркировки одной экспериментальной подгруппе по карбоксифлуоресцеина сукцинимидилпальмитата эфир (CFSE) до поверхности окрашивание антиген. Такое CFSE предварительно маркировка позволяет немедленно прямое сравнение двух клеточных линий или экспериментальных условиях (CFSE меченных против. немеченый) в пределах одного образца трубы, снижая дисперсию или тонкие различия во времени инкубации и экономии антитела. CFSE является признанным флуоресцентный краситель, который обычно используется для отслеживания 40 клеток, пролиферации в 41,42 и 43,44 штрих кода экспериментов. Наконец, в то время как реальные шаги для сортировки (FACS, разделение иммуномагнитный клетка или immunopanning) не являются частью данного протокола, в принципе, процедуры сбора урожая и маркировки описанные здесь образцы урожая, которые могут быть подвергнуты поверхностной антиген или внутриклеточные маркировки на основе сортировки приложений 15 25,28.
В этой статье мы стремимся: обобщить жизнеспособным поверхности окрашивания антигена протокол 25,28, обобщить протокол для обнаружения внутриклеточных мишеней, а также в сочетании поверхностных и внутриклеточных анализ антигена 38, представить внутриклеточный CFSE маркировки краситель шаг 41,45 в экспериментальная опция для COMсравнительный анализ нейронных популяций клеток, и обобщить подходы к анализ течения цитометрический (соответствующие элементы управления 13,46, воротные стратегии и представление данных 47).
протокол
1. нервных клеток урожая
- Оценка микроскопом:
- До начала эксперимента, проверки состояния культуры с ярко-поле или фазово-контрастной микроскопии.
ПРИМЕЧАНИЕ: При первичной нервной ткани, полученной от вскрытия, в принципе, одинаково поддаются проточной цитометрии анализ 14,28, пожалуйста, обратите внимание, что фокус протокола является в клетках, полученных от в пробирке нейронных клеточных системах.
- До начала эксперимента, проверки состояния культуры с ярко-поле или фазово-контрастной микроскопии.
- Сбора клеток 7:
- Осторожно мыть посуды / флакон адгезивных клеток с Mg 2+ / Ca 2+ свободный забуференный фосфатом физиологический раствор (PBS) при комнатной температуре (например, 5 мл на колбу Т75, 3 мл на лунку для 6-луночный планшет, или 10 мл в течение 10 см блюдо).
ПРИМЕЧАНИЕ: PBS используется во всем протокола является Mg 2+ / Ca 2+ бесплатно.- Для примера видео используйте T75 колбу SH-SY5Y клеток нейробластомы в 80% слияния. Применить дополнительные меры стиральные в тех случаях, когдаЗначительное мусора присутствует в чашке.
- Рассмотрим промывок альбумин-содержащего PBS 48, Перколла или Ficoll 49 центрифугирования градиентов и / или коммерчески доступных бисера 50,51 в сыворотке крови. Удаление миелина и других липидов или других загрязняющих веществ имеет решающее значение, в частности, когда используются для взрослых первичные источники ткани.
- Добавить подогретого (37 ° С) замену трипсина на соответствующем объеме, который покрывает всю поверхность тканевой культуры судна.
ПРИМЕЧАНИЕ: Кроме того, считают Accutase или другие ферментативные варианты пищеварения. Это важный шаг может негативно влиять на экспрессию эпитоп поверхности (см 7). - Инкубируйте блюдо / колбе при 37 ° С в течение 2 - 5 мин (в зависимости от типа клеток), чтобы отделить клетки. Аккуратно нажмите на тканевой культуры судно или на одном уровне с серологического пипетки, чтобы выбить клеток. Избегайте чрезмерного пищеварения (так как это может привести к потере клеток и свертывание на более поздних стадий).
- Quench замену трипсина путем добавления в два раза объем буфера потока (2% FBS в PBS) и собирают клетки в 15 мл коническую трубку.
- Осторожно растирают клеточной суспензии с помощью пипетки в микролитр (100 - 1000 мкл) или 5 мл серологической пипеткой с получением однородной клеточной суспензии.
- Центрифуга клетки при 220 х г в течение 5 мин при 25 ° С. Тщательно аспирата супернатант оставляя осадок позади.
- Повторное приостановить осадок в соответствующем объеме буфера потока, в зависимости от размера гранул (например, в течение одного сливной T75 колбу SH-SY5Y клеток Типичный выход, по крайней мере 10 х 10 6 клеток, и в этом случае клетки ресуспендируют в 5 мл буфера потока).
ПРИМЕЧАНИЕ: Если наблюдаются большие куски или свертывания, процеживают через 30 - мкм сетки 100.
- Осторожно мыть посуды / флакон адгезивных клеток с Mg 2+ / Ca 2+ свободный забуференный фосфатом физиологический раствор (PBS) при комнатной температуре (например, 5 мл на колбу Т75, 3 мл на лунку для 6-луночный планшет, или 10 мл в течение 10 см блюдо).
- Сотовый счета 52:
- Передача Небольшую аликвоту клеточной суспензии в микроцентрифужных трубки и разбавленной в определенном соотношении в объеме ТРypan синий или альтернатива жизнеспособность красителя до перевода в гемоцитометре или автоматизированной системы подсчета клеток.
- Развести клеточной суспензии в концентрации 1 · 10 6 жизнеспособных клеток / мл путем добавления соответствующего объема буфера потока или PBS с 0,1% BSA (если приступить CFSE маркировки).
Примечание: пропидийиодидом, 7-D aminoactinomycin, аннексина V и коммерчески доступные наборы Исправимые жизнеспособности анализов представляют альтернативные варианты для оценки жизнеспособности клеток. Кроме того, анализы с использованием апоптоза каспазы-3 флуоресценции, как описано выше, может быть использован 53. Флуоресцентные каналы будут "заняты" в этих реагентов, которые могут ограничивать возможности для последующих шагов, если включен во всех образцах.
2. Внутриклеточные Краска Маркировка Использование CFSE (Рисунок 3)
- Развести CFSE до требуемой концентрации акций, которые могут быть легко использован.
ПРИМЕЧАНИЕ: Для этих экспериментов концентрации запасБыл использован 0,01 мм. Определить оптимальную рабочую концентрацию CFSE эмпирически. - Добавить 10 мкл 0,01 мМ раствора в CFSE мл клеток (раздел 1.3.2, концентрации 1 × 10 6 клеток / мл в PBS + 0,1% BSA) для конечной концентрации 0,1 мкМ. Кратко вихрь хорошо перемешать.
ПРИМЕЧАНИЕ: концентрации CFSE, используемые здесь, около десяти раз ниже, чем те, обычно применяемых в пролиферации, следовательно, клетки токсичности красителя является минимальным. Мы не наблюдаем отрицательное воздействие на жизнеспособность клеток. - Инкубировать в течение 5 минут при комнатной температуре при постоянном встряхивании (200 оборотов в минуту). Защищать от света.
- Гасят краситель путем добавления 5 объемов буфера потока в трубах. Центрифуга на 94 мкг в течение 5 мин при комнатной температуре.
- Удалите супернатант, оставляя осадок позади. Повторное приостановить клетки с 5 объемами буфера потока.
- Центрифуга на 94 мкг в течение 5 мин при комнатной температуре. Жидкость над осадком сливают и вновь приостановить клеток в буфере потока при концентрации 1 × 10 6 клеток / мл.
- Добавить равное количество неокрашенных клеток, представляющих интерес для окрашенных клеточной суспензии. Перейдите к поверхностного антигена протокол окрашивания (раздел 3).

Рисунок 3. Обнаружение дифференциального поверхности CD экспрессии антигена между двух клеточных линий через CFSE краситель маркировка. SH-SY5Y клеток нейробластомы предварительно помечены CFSE для последующей идентификации по сравнению с немеченых BJ фибробластов. Co-окрашивание смешанного образца (правая панели) с поверхностных маркеров CD24 или CD54 (как сопряженного с APC) показывает, что клеточные линии легко различимы из-за CFSE окрашивания (стрелки = SH-SY5Y; наконечники стрел = BJ фибробластов). Большинство SH-SY5Y клеток экспрессируют CD24, но не CD54 (ICAM-1). В отличие от этого, BJ фибробласты (CFSE-отрицательный) являются позитивными для CD54, но в основном негативные для CD24."Https://www.jove.com/files/ftp_upload/52241/52241fig3highres.jpg" TARGET = "_ пустое"> Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
3. клеточной поверхности Окрашивание
- Этикетка трубки включая образцы и критических контрольных (табл 1).
| Tube нет. | Образец название | Антиген-флюорофор | Разведение |
| 1 | Неокрашенные клетки | - | |
| 2 | Одноместный пятнами | CD24-APC | 1:50 |
| 3 | Одноместный пятнами | TUJ1-Alexa Fluor 488nm | 1: 2000 |
| 4 | Двухместный витражи | CD24-APC | 1:50 |
| TUJ1-Alexa Fluor 488nm | 1: 2000 | ||
| 5 | Одноместный пятнами | Среднее только: Alexa Fluor 488nm | 1: 2000 |
Таблица 1. Спи труб должны быть включены в типичном эксперименте проточной цитометрии. Из таблицы видно, минимальный набор пробирок, необходимых для совместного окрашивания эксперимента, описанного в этом видео статьи. Идеально подходит эксперимент должен включать все необходимые элементы управления (отрицательные, положительные, а также органы управления компенсация) за точной интерпретации полученных результатов.
- Добавить 100 мкл клеточной суспензии (из раздела 2.7 или 1.3.2) для каждого 1,5 мл микроцентрифужных трубки.
ПРИМЕЧАНИЕ: Убедитесь, что минимум 0,1 х 10 6 клеток присутствуют в 100 мкл клеточной суспензии. - Добавить флуорофора конъюгированных антител в образце в соответствующем разведении.
ПРИМЕЧАНИЕ: Определить готовый раствор для каждого антитела до эксперимента. Таблицу 2 для списка OF нейронные поверхностные антигены.
| Антиген | Тип клетки | Ссылка |
| CD15 | Нервные стволовые клетки | [28, 67] |
| CD24 | Нервные клетки | [28, 68] |
| CD29 | Нервные стволовые клетки | [28, 69, 70] |
| CD44 | Глиальные клетки | [25] |
| CD49f | Нервные стволовые клетки | [38] |
| CD56 (NCAM) | Нервные клетки | [71] |
| CD133 | Нервные стволовые клетки | [27] |
| CD184 | Нервные стволовые клетки и глиальные клетки | [25] |
| CD200 | Нервные клетки | [38] |
| CD271 | Нервного гребня стволовых клеток | [25] |
| A2B5 | Глиальные клетки | [31] |
| CORIN | Дофаминергические предшественники | [35, 36] |
| FORSE1 | Нервные стволовые клетки (НСК) | [72] |
| GLAST | Глиальные клетки | [33] |
| NG2 | Глиальные клетки | [32] |
Таблица 2. Выбор нейронных поверхностных антигенов. Эта таблица содержит список поверхностных эпитопов нашли быть выражены с помощью различных типов нейронных клеток для иллюстрации растущего панель поверхностных антигенов, используемых для описания нейронального происхождения. Обратите внимание, что этот выбор далеко от завершения и что большинство из этих маркеров также выразил ряд других нервных и не-нервных клеток. Следовательно, комбинации нескольких маркеров должны будут лучше определить и выделить указанные нервные подмножеств.
- Выдержите в течение 30 мин на орбитальном шейкере (200 оборотов в минуту) в темноте.
- Поток промывочный буфер
- Добавить 1 мл буфера потока в трубах. Центрифуга при 380 мкг в течение 4 мин при 4 ° С.
- Удалите супернатант, оставляя осадок позади.
- Повторите стадии промывки снова.
- После второй промывки, декантируют надосадочную жидкость и повторно приостанавливать клеток в буфере потока до конечного объема 100 мкл.
- Используйте образец для анализа проточной цитометрии. Кроме того, перейдите к разделу 4 и 5.
ПРИМЕЧАНИЕ: Если клетки должны быть отсортированы и положить обратно в культуре после FACS (т.е. жизнеспособным суспензии клеток без фиксации или проницаемости), применяются правила асептики во время сбора урожая, окрашивание и аналитических шагов.
4. Фиксация и пермеабилизирующего 38
- Фиксация с помощью параформальдегида (PFA):
- Подготовка фиксации буфера, содержащего 2% PFA в PBS.
Примечание: PFA является вредным для человека и окружающей среды. Используйте соответствующие средства индивидуальной защиты и выбросить отходы в соответствии с местными правилами. - Добавить 500 мкл буфера фиксации к 100 мкл клеточной суспензии.
- Инкубировать пробирки при комнатной температуре в течение 15 мин на орбитальном шейкере (100 оборотов в минуту) в темноте.
- Подготовка фиксации буфера, содержащего 2% PFA в PBS.
- PBS стирка:
- Добавить 1 мл PBS в пробирку. Центрифуга при 380 мкг в течение 3 мин при 4 ° С.
- Отменить / декантируют надосадочную жидкость, оставив приблизительно 100 мкл в трубке.
- Проницаемости с Tween-20:
- Подготовка проницаемости буфера, содержащего 0,7% Tween-20 в PBS.
- Добавить 500 мкл буфера пермеабилизации к 100 мкл клеточной суспензии.
- Инкубировать пробирки при комнатной температуре в течение 15 мин на орбитальном шейкере (100 оборотов в минуту) в темноте.
- Вымойте клетки один раз PBS (как описано в разделе 4.2) и удалить супернатант из сопредседателей трубmpletely, оставив только осадок позади.
5. Внутриклеточные антиген Окрашивание 38 (Рисунок 4)
- Приготовление растворов первичных антител:
- Развести первичных антител в буфере для разведения, содержащего 1% бычьего сывороточного альбумина, 10% сыворотки (например, обычный осел или козьей сывороткой) и 0,5% Tween-20 в PBS.
ПРИМЕЧАНИЕ: Выберите сыворотку, которая будет использоваться в зависимости от вида вторичные антитела были подняты в. - Кроме того, использование Зенон флуоресцеина маркировки первичных антител в соответствии с инструкциями изготовителя.
- Подготовка 1 мкг первичного антитела в PBS в соответствующем разведении (общий объем ≤ 20 мкл).
- Добавить 5 мкл Зенон флуоресцеина IgG маркировки реагента (компонент А) в раствор антител.
- Выдержите смесь в течение 5 мин при комнатной температуре.
- Добавить 5 мкл блокирующего реагента Зенон (компонент Б) к реакционной смеси.
- ВысиживатьСмесь в течение 5 мин при комнатной температуре. Применение антитела к образцу в течение 30 мин.
- Развести первичных антител в буфере для разведения, содержащего 1% бычьего сывороточного альбумина, 10% сыворотки (например, обычный осел или козьей сывороткой) и 0,5% Tween-20 в PBS.
- Первичного окрашивания антител:
- Добавить 100 мкл первичного раствора антител к клеточному осадку и осторожно растирают перемешать.
- С другой стороны, добавление Зенон флуоресцеина меченого антитела к клеточной суспензии в соответствующем разведении.
- Инкубировать пробирки при комнатной температуре в течение 30 мин на орбитальном шейкере (200 оборотов в минуту), защищенном от света месте. Промыть клетки один раз PBS (как описано в разделе 4.2) и удалить супернатант из труб полностью, оставляя лишь осадок позади.
- Среднее окрашивание антитела (не требуется для Зенон флуоресцеина меченых антител):
- Развести вторичными антителами в PBS при соответствующей концентрации.
- Добавить 100 мкл вторичного раствора антител к клеточному осадку и осторожно растирают перемешать. Инкубировать пробирки при комнатной температуре в течение 30 мин на шейкере (200 оборотов в минуту) в темноте.
- Вымойте образцы два раза PBS (как описано в разделе 4.2).
- Вымойте раз с буфером потока (см раздел 3.5).
- Повторное приостановить клеток в приблизительно 150 мкл буфера потока и анализировать на проточном цитометре.
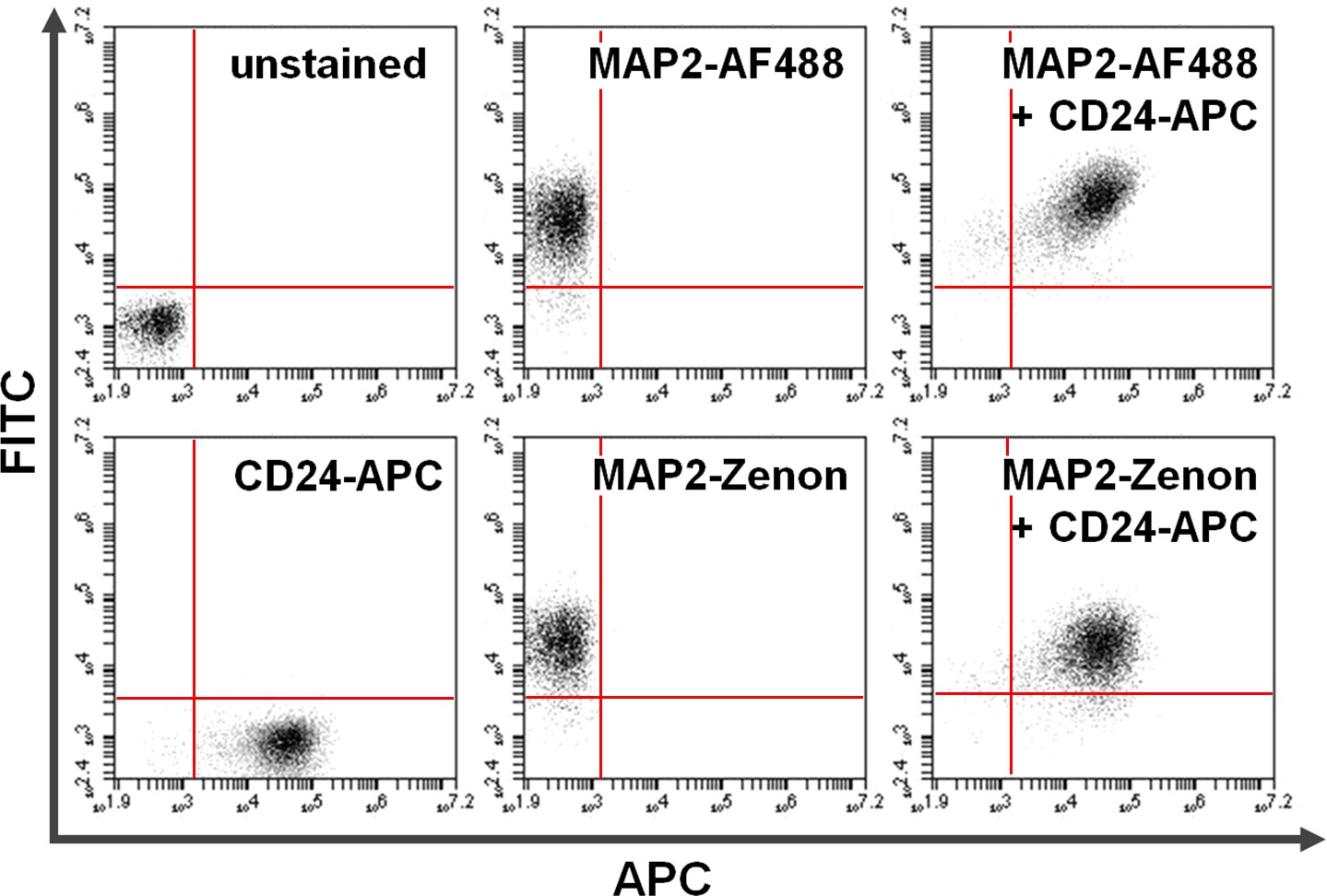
Рисунок 4. Совместное окрашивание поверхности и внутриклеточных белков. Проточной цитометрии данных пример сравнение между первичным + вторичное антитело на основе флуоресцеин сравнению Зенон основе внутриклеточного окрашивания в сочетании с окрашиванием поверхности. Исключительное положительность на оси ординат (верхний левый квадрант) и оси абсцисс (нижний правый квадрант) показывает клетки окрашивали в течение MAP2 и CD24 соответственно. После совместным окрашиванием, общий МАР2 и экспрессия CD24 можно увидеть в верхнем правом квадранте (правая панели). Сравнение с помощьюAlexa Fluor 488. (Верх; AF488) по сравнению с Зенон флуоресцеина (внизу) для урожайности MAP2-маркировки аналогичными результатами Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.
6. Анализ проточной цитометрии
- Немедленно провести анализ проточной цитометрии после завершения протокола окрашивания с использованием проточного цитометра с соответствующими фильтрами для детектирования сигнала. Используйте 488 нм синий и 640 нм красный лазер с FL-1 (533/30), FL-2 (585/40), и FL-4 (675/25) полосовых фильтров.
- Установка начальных ворота, основанные на прямом и боковое рассеивание за исключением мусора и мертвых клеток.
- Установите флуоресценции ворота для поверхностных и внутриклеточных антигенов к ≤0.5% в пересчете на неокрашенных образцов и компенсации для спектрального наложения с использованием одиночных окрашенных управления.
Результаты
Протокол, представленные здесь позволяет универсальный экспериментальных подходов (Рисунок 2). В своем сжатые версии (шаги 1, 3 и 6), можно считать, руководство для простого окрашивания поверхностных антигенов. В более сложной форме, количество со-маркировки па...
Обсуждение
Протокол, представленные здесь, хорошо известна в культурах нервных клеток, полученных из человеческих стволовых клеток, но может быть в равной степени применено к другим нейронных клеточных источников в том числе первичной ткани или нейронных клеточных линий. В дополнение к эмбриона...
Раскрытие информации
The authors declare no potential conflicts of interest.
Благодарности
Our research program is funded through the Emmy Noether-Program of the German Research Foundation (DFG), grant PR1132/3-1. Further support by the Müller-Fahnenberg Foundation of the University of Freiburg is gratefully acknowledged. This study was supported in part by the Excellence Initiative of the German Research Foundation (GSC-4, Spemann Graduate School).
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM/F12 (1:1) (Dulbecco's Modified Eagle Medium/Nutrient Mixture F-12) |  Life Technologies Life Technologies | 11330057 | |
| DPBS without Ca2+ Mg2+ |  Life Technologies Life Technologies | 14190169 | |
| Fetal bovine serum, qualified, E.U.-approved, South America origin (FBS) |  Life Technologies Life Technologies | 10270-106 | |
| MEM Non-essential amino acids (100x) |  Life Technologies Life Technologies | 11140035 | |
| TrypLE Express |  Life Technologies Life Technologies | 12604013 | |
| Trypan blue solution, 0.4% |  Life Technologies Life Technologies | 15250061 | |
| Paraformaldehyde |  Carl Roth Carl Roth | 335.3 | |
| Bovine serum albumin (BSA) Fraction V |  PAA Laboratories, Coelbe PAA Laboratories, Coelbe | K41-001 | |
| Tween-20 Detergent |  Calbiochem Calbiochem | 655205 | |
| Carboxyfluorescein succinimidyl ester (CFSE) |  eBioscience eBioscience | 65-0850-84 | |
| DMSO |  AppliChem AppliChem | A1584 | |
| Bottle top filters express plus 0.22 µm, 250 ml |  Millipore Millipore | SCGPU02RE | |
| Cell culture treated flasks (T 25) |  NUNC NUNC | 156367 | |
| Cell culture treated flasks (T 75) |  NUNC NUNC | 156499 | |
| Conical tubes (15 ml) |  Greiner Bio-One Greiner Bio-One | 188271 | |
| Conical tubes (50 ml) |  Greiner Bio-One Greiner Bio-One | 227261 | |
| Pasteur pipet, glass (150 mm) |  STEIN Labortechnik, Remchingen STEIN Labortechnik, Remchingen | S03710150 | |
| Pipet tips (0.1-10 µl) |  Corning Corning | 4125 | |
| Pipet tips (1-200 µl) |  Corning Corning | 4126 | |
| Pipet tips (100-1000 µl) |  Corning Corning | 4129 | |
| Serological pipets, 5 ml |  Corning Corning | 4051 | |
| Serological pipets, 10 ml |  Corning Corning | 4101 | |
| Serological pipets, 25 ml |  Corning Corning | 4251 | |
| Microcentrifuge tubes (0.5 ml) |  Sarstedt Sarstedt | 72,699 | |
| Microcentrifuge tubes (1.5 ml) |  Greiner Bio-One Greiner Bio-One | 616201 | |
| Microcentrifuge tubes (2.0 ml) |  Sarstedt Sarstedt | 72,695,500 | |
| Anti-Human CD24 APC monoclonal antibody |  eBioscience eBioscience | 17-0247-42 | Working dilution 1:50 |
| Anti-Human CD54 PE monoclonal antibody |  eBioscience eBioscience | 12-0549-42 | Working dilution 1:50 |
| Neuronal Class III β-Tubulin (Tuj1) polyclonal antibody |  Covance Covance | PRB-435P | Working dilution 1:2,000 |
| Alexa Fluor 488 Donkey anti Rabbit |  Life Technologies Life Technologies | A21206 | Working dilution 1:2,000 |
| Zenon® Fluorescein Rabbit IgG Labeling Kit |  Life Technologies Life Technologies | Z-25342 | |
| Neubauer-Improved counting chamber |  Marienfeld Marienfeld | 0640010 | |
| Vortex |  Scientific Industries Scientific Industries | G560E | |
| Thermomixer comfort |  Eppendorf Eppendorf | 5355 000.001 | |
| Accuri C6 flow cytometer |  Becton Dickinson (BD) Becton Dickinson (BD) | 653118 | |
| Microcentrifuge refrigerated, PerfectSpin 24 R |  Peqlab Peqlab | 91-PSPIN-24R | |
| Orbital shaker, Unimax 1010 |  Heidolph Heidolph | 543-12310-00 | |
| Centrifuge refrigerated, Rotanta 96 RC |  Hettich Hettich | 4480-50 | |
| Class II Biological safety cabinet Safe 2020 |  Thermo Scientific Thermo Scientific | 51026640 | |
| CO2 Incubator, Heracell 240i |  Thermo Scientific Thermo Scientific | 51026331 | |
| Vacuum system, Vacusafe comfort |  Integra Biosciences Integra Biosciences | 158320 | |
| Microscope, Axiovert 40 CFL |  Zeiss Zeiss | 451212 | |
| Pipet controller, accu-jet pro |  Brand Brand | 26303 | |
| Micropipet, Pipetman neo P20N (2-20 µl) |  Gilson Gilson | F144563 | |
| Micropipet, Pipetman neo P200N (20-200 µl) |  Gilson Gilson | F144565 | |
| Micropipet, Pipetman neo P1000N (100-1000 µl) |  Gilson Gilson | F144566 |
Ссылки
- Herzenberg, L. A., et al. The History and Future of the Fluorescence Activated Cell Sorter and Flow Cytometry: A View from. 48 (10), 1819-1827 (2002).
- Chattopadhyay, P. K., Roederer, M. Cytometry: today’s technology and tomorrow's horizons. Methods (San Diego, Calif). 57 (3), 251-258 (2012).
- Jaye, D. L., Bray, R. A., Gebel, H. M., Harris, W. A. C., Waller, E. K. Translational applications of flow cytometry in clinical practice). J. Immunol. 188 (10), 4715-4719 (2012).
- Henel, G., Schmitz, J. Basic Theory and Clinical Applications of Flow Cytometry. Lab Med. 38 (7), 428-436 (2007).
- Seita, J., Weissman, I. L. Hematopoietic stem cell: self-renewal versus differentiation. Wiley Interdiscip. Rev. Syst. Biol. Med. 2 (6), 640-653 (2010).
- Ulrich, H., Bocsi, J. Phenotypes of stem cells from diverse origin. Cytometry. A. 77 (1), 6-10 (2010).
- Panchision, D. M., et al. Optimized flow cytometric analysis of central nervous system tissue reveals novel functional relationships among cells expressing CD133, CD15, and CD24. Stem cells. 25 (6), 1560-1570 (2007).
- Meyer, R. A., Zaruba, M. E., McKhann, G. M. Flow cytometry of isolated cells from the brain. Anal. Quant. Cytol. 2 (1), 66-74 (1980).
- Junger, H., Junger, W. G. CNTF and GDNF, but not NT-4, support corticospinal motor neuron growth via direct mechanisms. Neuroreport. 9 (16), 3749-3754 (1998).
- McLaren, F. H., Svendsen, C. N., Vander Meide, P., Joly, E. Analysis of neural stem cells by flow cytometry: cellular differentiation modifies patterns of MHC expression. J. Neuroimmunol. 112 (1-2), 35-46 (2001).
- Wang, S., Roy, N. S., Benraiss, A., Goldman, S. A. Promoter-based isolation and fluorescence-activated sorting of mitotic neuronal progenitor cells from the adult mammalian ependymal/subependymal. 22 (1-2), 167-176 (2000).
- Tanke, H. J., vander Keur, M. Selection of defined cell types by flow-cytometric cell sorting. Trends Biotechnol. 11 (2), 55-62 (1993).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243 (1-2), 77-97 (2000).
- Sergent-Tanguy, S., Chagneau, C., Neveu, I., Naveilhan, P. Fluorescent activated cell sorting (FACS): a rapid and reliable method to estimate the number of neurons in a mixed population. J. Neurosci. Methods. 129 (1), 73-79 (2003).
- Ernst, A., et al. Neurogenesis in the striatum of the adult human brain. Cell. 156 (5), 1072-1083 (2014).
- Perfetto, S. P., Chattopadhyay, P. K., Roederer, M. Seventeen-colour flow cytometry: unravelling the immune system. Nat. Rev. Immunol. 4 (8), 648-655 (2004).
- Bandura, D. R., et al. Mass cytometry: technique for real time single cell multitarget immunoassay based on inductively coupled plasma time-of-flight mass spectrometry. Anal. Chem. 81 (16), 6813-6822 (2009).
- Bendall, S. C., et al. Single-cell mass cytometry of differential immune and drug responses across a human hematopoietic continuum. Science. 332 (6030), 687-696 (2011).
- Neveu, I., Rémy, S., Naveilhan, P. The neuropeptide Y receptors, Y1 and Y2, are transiently and differentially expressed in the developing cerebellum. Neuroscience. 113 (4), 767-777 (2002).
- Pruszak, J., Just, L., Isacson, O., Nikkhah, G. Isolation and culture of ventral mesencephalic precursor cells and dopaminergic neurons from rodent brains. Curr. Protoc. Stem Cell Biol. 2 (Unit 2D.5), (2009).
- Suslov, O. N., Kukekov, V. G., Ignatova, T. N., Steindler, D. A. Neural stem cell heterogeneity demonstrated by molecular phenotyping of clonal neurospheres. Proc. Natl. Acad. Sci. U.S.A. 99 (22), 14506-14511 (2002).
- Bez, A., et al. Neurosphere and neurosphere-forming cells: morphological and ultrastructural characterization. Brain Res. 993 (1-2), 18-29 (2003).
- Pruszak, J., Isacson, O. Molecular and cellular determinants for generating ES-cell derived dopamine neurons for cell therapy. Adv. Exp. Med. Biol. 651, 112-123 (2009).
- Carson, C. T., Aigner, S., Gage, F. H. Stem cells: the good, bad and barely in control. Nat. Med. 12 (11), 1237-1238 (2006).
- Yuan, S. H., et al. Cell-surface marker signatures for the isolation of neural stem cells, glia and neurons derived from human pluripotent stem cells. PloS One. 6 (3), e17540 (2011).
- Roy, N. S., Cleren, C., Singh, S. K., Yang, L., Beal, M. F., Goldman, S. Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes. Nat. Med. 12 (11), 1259-1268 (2006).
- Uchida, N., et al. Direct isolation of human central nervous system stem cells. Proc. Natl. Acad. Sci. U. S. A. 97 (26), 14720-14725 (2000).
- Pruszak, J., Ludwig, W., Blak, A., Alavian, K., Isacson, O. CD15, CD24, and CD29 define a surface biomarker code for neural lineage differentiation of stem cells. Stem Cells. 27 (12), 2928-2940 (2009).
- Peh, G. S. -. L., Lang, R. J., Pera, M. F., Hawes, S. M. CD133 expression by neural progenitors derived from human embryonic stem cells and its use for their prospective isolation. Stem Cells Dev. 18 (2), 269-282 (2009).
- Golebiewska, A., Atkinson, S. P., Lako, M., Armstrong, L. Epigenetic landscaping during hESC differentiation to neural cells. Stem Cells. 27 (6), 1298-1308 (2009).
- Dietrich, J., Noble, M., Mayer-Proschel, M. Characterization of A2B5+ glial precursor cells from cryopreserved human fetal brain progenitor cells. Glia. 40 (1), 65-77 (2002).
- Nishiyama, A. NG2 cells in the brain: a novel glial cell population. Hum. Cell. 14 (1), 77-82 (2001).
- Jungblut, M., et al. Isolation and characterization of living primary astroglial cells using the new GLAST-specific monoclonal antibody ACSA-1. Glia. 60 (6), 894-907 (2012).
- Ono, Y., et al. Differences in neurogenic potential in floor plate cells along an anteroposterior location: midbrain dopaminergic neurons originate from mesencephalic floor plate cells. Development. 134 (17), 3213-3225 (2007).
- Chung, S., et al. ES cell-derived renewable and functional midbrain dopaminergic progenitors. Proc. Natl. Acad. Sci. U.S.A. 108 (23), 9703-9708 (2011).
- Doi, D., et al. Isolation of Human Induced Pluripotent Stem Cell-Derived Dopaminergic Progenitors by Cell Sorting for Successful Transplantation. Stem Cell Reports. 2 (3), 337-350 (2014).
- Solozobova, V., Wyvekens, N., Pruszak, J. Lessons from the embryonic neural stem cell niche for neural lineage differentiation of pluripotent stem cells. Stem Cell Rev. 8 (3), (2012).
- Turaç, G., et al. Combined flow cytometric analysis of surface and intracellular antigens reveals surface molecule markers of human neuropoiesis. PloS One. 8 (6), e68519 (2013).
- Buchwalow, I. B., Böcker, W. Chapter 2. Immunohistochemistry: Basics and Methods. , 9-17 (2010).
- Tario, J. D., et al. Optimized staining and proliferation modeling methods for cell division monitoring using cell tracking dyes. J. Vis. Exp. (70), e4287 (2012).
- Lyons, A. B., Parish, C. R. Determination of lymphocyte division by flow cytometry. J. Immunol. Methods. 171 (1), 131-137 (1994).
- Hawkins, E. D., et al. Measuring lymphocyte proliferation, survival and differentiation using CFSE time-series data. Nat. Protoc. 2 (9), 2057-2067 (2007).
- Quah, B. J. C., Parish, C. R. The use of carboxyfluorescein diacetate succinimidyl ester (CFSE) to monitor lymphocyte proliferation. J. Vis. Exp. 44, (2010).
- Sukhdeo, K., et al. Multiplex flow cytometry barcoding and antibody arrays identify surface antigen profiles of primary and metastatic colon cancer cell lines. PloS One. 8 (1), e53015 (2013).
- Jiang, L., et al. Daucosterol promotes the proliferation of neural stem cells. The J. Steroid Biochem. Mol. Biol. 140, 90-99 (2014).
- Hulspas, R., et al. Considerations for the control of background fluorescence in clinical flow cytometry. Cytometry. B. 76 (6), 355-364 (2009).
- Moloney, M., Shreffler, W. G. Basic science for the practicing physician: flow cytometry and cell sorting. Annals of Allergy, Asthm., & Immunology: Official Publication of the American College of Allergy, Asthma., & Immunology. 101 (5), 544-549 (2008).
- Siebzehnrubl, F. A., et al. Isolation and characterization of adult neural stem cells. Methods Mol. Biol. 750, 61-77 (2011).
- Guez-Barber, D., et al. FACS purification of immunolabeled cell types from adult rat brain). J. Neurosci. Methods. 203 (1), 10-18 (2012).
- Tham, C. -. S., Lin, F. -. F., Rao, T. S., Yu, N., Webb, M. Microglial activation state and lysophospholipid acid receptor expression. Int. J. Dev. Neurosci. 21 (8), 431-443 (2003).
- Nguyen, H. X., Beck, K. D., Anderson, A. J. Quantitative assessment of immune cells in the injured spinal cord tissue by flow cytometry: a novel use for a cell purification method. J. Vis. Exp. (50), e2698 (2011).
- Marchenko, S., Flanagan, L. Counting human neural stem cells. J. Vis. Exp. (7), 262 (2007).
- Brunlid, G., Pruszak, J., Holmes, B., Isacson, O., Sonntag, K. C. Immature and neurally differentiated mouse embryonic stem cells do not express a functional Fas/Fas ligand system. Stem Cells. 25 (10), 2551-2558 (2007).
- Brewer, G. J. Isolation and culture of adult rat hippocampal neurons. J. Neurosci. Methods. 71 (2), 143-155 (1997).
- Cardona, A. E., Huang, D., Sasse, M. E., Ransohoff, R. M. Isolation of murine microglial cells for RNA analysis or flow cytometry. Nat. Protoc. 1 (4), 1947-1951 (2006).
- Nielsen, J. A., Maric, D., Lau, P., Barker, J. L., Hudson, L. D. Identification of a novel oligodendrocyte cell adhesion protein using gene expression profiling. J. Neurosci. 26 (39), 9881-9891 (2006).
- Daneman, R., et al. The mouse blood-brain barrier transcriptome: a new resource for understanding the development and function of brain endothelial cells. PloS One. 5 (10), e13741 (2010).
- Gräbner, R., Till, U., Heller, R. Flow cytometric determination of E-selectin, vascular cell adhesion molecule-1, and intercellular cell adhesion molecule-1 in formaldehyde-fixed endothelial cell monolayers. Cytometry. 40 (3), 238-244 (2000).
- Quah, B. J. C., Parish, C. R. New and improved methods for measuring lymphocyte proliferation in vitro and in vivo using CFSE-like fluorescent dyes. J. Immunol. Methods. 379 (1-2), 1-14 (2012).
- Lathia, J. D., et al. High-throughput flow cytometry screening reveals a role for junctional adhesion molecule a as a cancer stem cell maintenance factor. Cell Rep. 6 (1), 117-129 (2014).
- Ganat, Y. M., et al. Identification of embryonic stem cell-derived midbrain dopaminergic neurons for engraftment. J. Clin. Invest. 122 (8), 2928-2939 (2012).
- Hedlund, E., et al. Embryonic stem cell-derived Pitx3-enhanced green fluorescent protein midbrain dopamine neurons survive enrichment by fluorescence-activated cell sorting and function in an animal model of Parkinson’s disease. Stem Cells. 26 (6), 1526-1536 (2008).
- Maroof, A. M., et al. Directed differentiation and functional maturation of cortical interneurons from human embryonic stem cells. Cell Stem Cell. 12 (5), 559-572 (2013).
- Chivet, M., Hemming, F., Pernet-Gallay, K., Fraboulet, S., Sadoul, R. Emerging role of neuronal exosomes in the central nervous system. Front. Physiol. 3, 145 (2012).
- Graner, M. W., et al. Proteomic and immunologic analyses of brain tumor exosomes. FASEB J. 23 (5), 1541-1557 (2009).
- Eldh, M., Lötvall, J. Isolation and characterization of RNA-containing exosomes. J. Vis. Exp. (59), e3037 (2012).
- Capela, A., Temple, S. LeX is expressed by principle progenitor cells in the embryonic nervous system, is secreted into their environment and binds Wnt-1. Dev. Biol. 291 (2), 300-313 (2006).
- Nieoullon, V., Belvindrah, R., Rougon, G., Chazal, G. mCD24 regulates proliferation of neuronal committed precursors in the subventricular zone. Mol. Cell. Neurosci. 28 (3), 462-474 (2005).
- Nagato, M., et al. Prospective characterization of neural stem cells by flow cytometry analysis using a combination of surface markers. J. Neurosci. Res. 80 (4), 456-466 (2005).
- Hall, P. E., Lathia, J. D., Miller, N. G. A., Caldwell, M. A., French-Constant, C. Integrins are markers of human neural stem cells. Stem Cells. 24 (9), 2078-2084 (2006).
- Hargus, G., et al. Differentiated Parkinson patient-derived induced pluripotent stem cells grow in the adult rodent brain and reduce motor asymmetry in Parkinsonian rats. Proc. Natl. Acad. Sci. U.S.A. 107 (36), 15921-15926 (2010).
- Elkabetz, Y., et al. Human ES cell-derived neural rosettes reveal a functionally distinct early neural stem cell stage. Genes Dev. 22 (2), 152-165 (2008).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены