需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
重组离子通道的相对细胞表面表达的总用流式细胞仪测定
摘要
继承心律失常通常是由改变一种或多种离子通道的表面上输送的突变引起的。在这里,我们适应流式细胞测定法,以提供在TSA-201细胞中表达的重组的离子通道的相对总和细胞表面蛋白表达的定量。
摘要
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
引言
本文提供了可靠的测定报告的膜蛋白如在使用现有的流式细胞仪技术的重组细胞中表达离子通道的相对细胞表面表达。离子通道是孔隙形成膜蛋白是负责通过门控离子穿过细胞膜的流控制的电信号。它们被激活的机制,性质和离子物质通过在那里它们被局部孔隙过渡的选择性分类。在细胞和组织水平,通过离子通道的宏观离子通量的生物物理(选通和渗透),生物化学(磷酸化),和生物合成(合成,糖基化,贩卖,和降解)特性1的产物。每个这些过程是唯一的每一种类型的离子通道,并且被优化以满足离子通道的生理作用。因此,在改变这些微调过程中通过继承或遗传修饰,通常被称为"离子通道",可能是有害的细胞稳态。需要强调的是在细胞表面传递的离子通道的"正确"的金额为细胞稳态关键的是非常重要的。即使是很小的增加(增益的功能)和小下降(失函数)的离子通道活性有可能引起过一辈子了严重的病变的可能性。在成熟的离子通道的细胞表面输送的缺陷是在许多离子通道,如囊性纤维化(CFTR离子通道)2和长QT综合征形式(心脏钾通道)3的心律失常的重要决定因素。
离子通道与心脏猝死4有关。所有心脏离子通道的当前世界范围内流行被认为是至少为1:2,000-1:3000每个人5和负责一半左右突然心律失常心脏病死亡的CaSES 6。功能障碍在心脏的电压门控钠 - ,钾和钙 - 选择性离子通道已知在此过程中的关键作用。的L-型Ca V 1.2电压门控钙通道,需要发起同步心脏肌肉收缩。心脏L-型Ca V 1.2通道是α2δ1辅助亚基7-12的主孔形成的Ca Vα1亚单位和Ca V SS和Ca 的V组成的多亚基蛋白复合物。需要注意的是辅亚基的满装需要产生在质膜官能的Ca V 1.2通道和动态相互作用之间的这些亚基是必不可少的,以支持心脏13的正常电动功能。钙V SS促进钙Ⅴ的细胞表面表达通过非共价纳摩尔疏水相互作用14 1.2通道。钙Vα2δ1亚基无线的共表达次的Ca V SS结合的Ca Vα1刺激峰值电流表达式(5至10倍),并促进信道激活的更多负电压。增益的函数的孔隙形成亚基的Ca V 1.2已经用称为而形成L-型Ca V 1.2通道的三个主要亚单位的宿主点突变的长QT综合征15的室性心律失常的形式相关联的基因突变从短QT综合征形式16,17心律失常的受试者已经确定。离子通道是可以从生物化学观点(蛋白质化学)进行调查,或使用电的工具(电流产生的机器),并常常使用这些互补的方法膜蛋白。电生理学,特别是全细胞膜片钳,是阐明离子通道15的功能的合适的方法,但不能从它们的生物物理变化解决蛋白质运输的修改属性。蛋白质化学已然而,经常使用有限的,由于相对于较小的可溶性蛋白大的膜蛋白的相对低的表达。用荧光读数鲁棒高通量方法需要为了专门解决在蛋白质生物合成引起离子通道的细胞表面表达的变化的缺陷被开发。
流式细胞术是在细胞计数,分拣,生物标志物的检测,以及蛋白质工程18中采用的生物物理技术。当活细胞或颗粒的样品溶液被注入到流式细胞仪,细胞被排序成可由机器的检测系统( 图1)被探测的单个流。第一流式细胞仪1956 19产生仪器检测到只有一个参数,但现代的流式细胞仪具有多个激光器和荧光检测器,使超过30荧光参数20,21的检测。镜和反射镜(光学发射)指示细胞的光散射或荧光到按比例转换成光的强度的电子网络(光电二极管和探测器)。数字数据使用专门的软件分析和主输出显示为一个点图21。
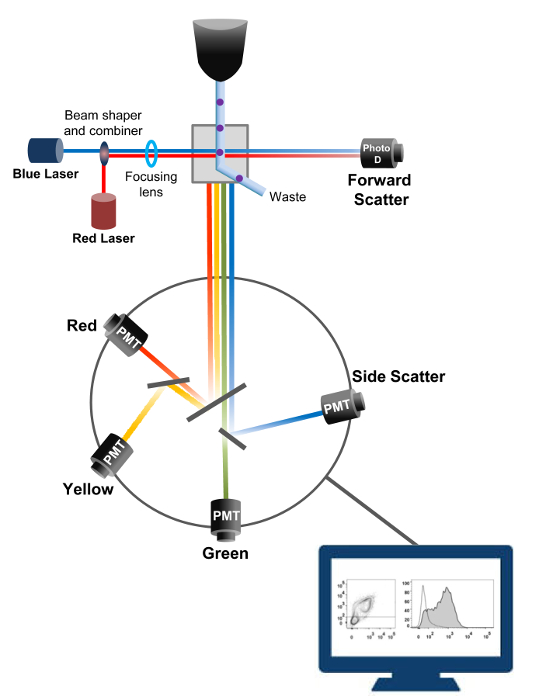
图1:流量生物物理学原理术分选的单细胞被通过喷嘴在高压下鞘流体的流,其通过一个或多个激光询问点移动他们内推。的光束被传递细胞偏转并在向前的方向(前向散射,FCS)的收集的光被发送到的光转换成成比例的小区的大小的信号的光电二极管。的光也收集在一个90°角的激光路径并传送到检测器(也称为光电倍增管(PMT))。如果激发荧光染料是存在于细胞中这个光透过分色镜允许侧向散射信号(SSC),这反映了细胞内的粒度的检测,和荧光发射路由。三个检测器(绿色,黄色和红色)被表示具有不同波长的带通滤波器,允许不同的荧光染料的同时检测。不同的信号被外部的计算机数字化并转换成将要分析量化细胞的特性数据。 请点击此处查看该图的放大版本。
流式细胞仪的高通量容量利用来量化重组野生型和贩卖缺陷电压门控L-型Ca V 1.2通道和在活细胞相关亚基的相对膜表达。 cDNA构建合作丁对蛋白双重标记同时进行,可以由一个不渗透的荧光缀合的抗体和细胞内的荧光团是组成型荧光来检测细胞外的非荧光的表位。两者胞外表位,插在该蛋白质的细胞外环,与细胞内荧光团,C末端后插入,被翻译的蛋白质。在这一系列的实验中,钙Vα2δ1蛋白质工程改造以表达一种细胞外血凝素(HA)表位(YPYDVPDYA)由一个不渗透的FITC(异硫氰酸荧光素)检测到的缀合的抗HA和mCherry作为固有细胞内荧光团。为了确定mCherry钙Vα2δ1HA标记的蛋白的相对细胞表面的表达水平,表达的融合蛋白的重组细胞转染后,收获,并用FITC-缀合的小鼠单克隆抗HA表位标签antibod染色Y( 图2)。 FITC是有机荧光化合物为比酶记者相当小,因此不作为可能与生物功能干涉。 mCherry-钙Vα2δ1-HA在TSA-201cells过表达时,产生在FITC荧光和mCherry荧光二维图22显著3-日志增加。鉴于该HA抗原决定基位于所述蛋白的细胞外部分,在完整细胞的存在下获得的FITC的荧光强度反映的HA标记的蛋白的细胞表面表达的相对指数。在结构的HA抗原决定基的可访问性系统通过测量细胞透后FITC信号验证。这项措施也有助于证实了标准化总蛋白的表达,因为对FITC荧光的相对强度在透细胞估计是定性相媲美的相对荧光值FOřmCherry透和非透化条件22,23下进行测定。要注意的是本征荧光光谱透后向更高值移位但相比于对照构建所报告的唯一值是在荧光强度的变化是很重要的。在荧光强度为测试构建体的相对变化所使用的ΔMean荧光强度(ΔMFI)值对于每个荧光团(mCherry或FITC)估算。实验设计用于测量相对于在相同条件下表达的对照构建的荧光强度测试构建体的荧光强度,以限制在所述荧光团共轭抗体的固有荧光实验的变化。使用该测定两膜蛋白被成功地研究了:在一个不同系列的L型电压门控钙通道的Ca V 1.2 14,22和孔形成亚基实验中,细胞外辅助的Ca Vα2δ1亚基22,23。以下方案用于测定1.2信道控制的条件下,影响离子通道的翻译后修饰的突变后的心脏L-型CaⅤ的钙Vα2δ1亚基的细胞表面表达。根据标准化的实验条件下,FITC的细胞表面的荧光增加的准线性的cDNA编码的mCherry钙Vα2δ1-HA蛋白质( 图5从参考22)的表达。
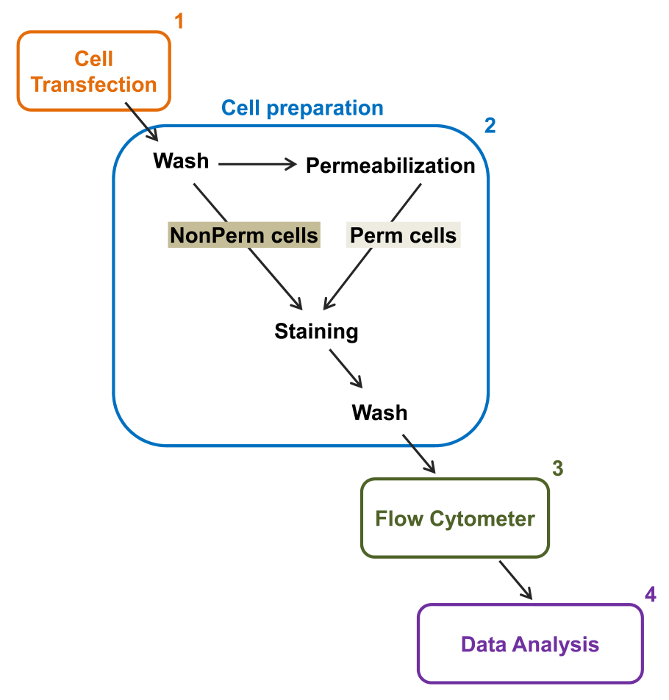
图2:在流式细胞术实验方案的总流量和膜标签的示意图的方案概述了一些必要的主要步骤来量化由佛罗里达州的重组离子通道的相对总和细胞表面表达流式细胞仪。细胞在TSA-201细胞(1)用双标记的结构mCherry钙Vα2δ1-HA转染的和之前或透化后染色的(2)。多参数数据在流动收购仪(3)多因素分析(4)。 请点击此处查看该图的放大版本。
研究方案
1.双标记的DNA构建
- 通过定点诱变( 图3B)20插入在D676和R677之间的Ca Vα2δ1的胞外接头的HA抗原决定基(YPYDVPDYA)。使用正向引物gccggattatgcgGGAAAACTCCAAACAACC和反向引acatcatacggataTCAATAAATTCATTGAAATTTAAAAGAAATTC。
- 亚克隆被标记的HA的Ca Vα2δ1的cDNA序列为设计为表达融合到SacI和SalI位点( 图3B)20之间mCherry的N-末端的蛋白质的哺乳动物pmCherry-N1表达载体。
注意:适当的通道功能需要使用标准的电生理学方法24的控制结构进行测试。
2.脂质体介导瞬时转染(30分钟,所有的步骤中进行在层流罩)
- 第1天:板五十万TSA-201细胞(或HEKT)在35毫米培养皿用Dulbecco的2毫升的高葡萄糖的最低必需培养基(DMEM-HG)补充有10%胎牛血清(FBS)和1%青霉素 - 链霉素(PS)的培养基中。算使用标准血细胞计数器细胞。使用台盼蓝的细胞样品的一小部分评估细胞生存力。板足够的细胞在转染时达到90%汇合。
- 第2天:用2ml新鲜预热(37℃)培养液的无PS变化的培养基。
- 对于每一个转染样本,准备2个1.5 mL管。在管1,稀4微克DNA在250微升血清培养基降低。在管2,混合10微升用250微升血清减少培养基中脂质体介导的转染试剂。使用前轻轻混合转染试剂。
- 孵育在室温下5分钟。
- 结合管1和管2的内容,轻轻混匀孵育在室温下至少20分钟。
- 添加脂质体/ DN一个复合物培养的细胞,轻轻摇晃培养皿中混合。
- 在37℃孵育下,5%CO 2气氛中 24小时。
3.细胞的流式细胞染色(3小时)
- 准备电池样品
- 第3天:小心地取出从培养皿中并用400μl的预热(37℃)0.05%胰蛋白酶-1X EDTA(乙二胺四乙酸)洗涤细胞。
- 添加400μl的胰蛋白酶-EDTA,并在5%的CO 2气氛中孵育在37℃下的菜5分钟以使细胞从培养皿中分离。
- 通过加入1毫升冷的培养基中无PS停止酶消化并吹打轻轻4-5倍洗出从表面所有的细胞。避免过度消化和过度吸液,减少细胞死亡。
- 收集细胞1.5毫升管,并立即置于冰上。使用冰冷的溶液,并保持细胞在4℃下,以防止内在化表面抗原。减少照明,以限制所述荧光信号的光漂白。
- 离心管,在400×g离心在4℃下5分钟。小心吸弃上清。
- 重悬在1ml磷酸盐缓冲盐水1X的粒料(PBS)中以制备单细胞悬浮液。
- 简而言之轻轻涡管并重复步骤3.1.5和3.1.6彻底清除培养基。
- 重悬在600微升1×PBS中的沉淀和调节细胞浓度至最小的3×10 6个细胞/ ml。
- 分裂细胞有两种新的1.5毫升管的细胞外和细胞内染色。包括适当的控制,以区分与非特异性染色特异性染色。
注:同种型对照抗体有助于评估背景染色的水平和应该理想匹配每个初级抗体的宿主物种,同种型和荧光团。使用同种型对照和缀合的抗体在相同的蛋白质浓度。

表1: 流式细胞仪对于实验对照样品不透和透化的细胞的每个实验需要包括以下阴性对照:(1)未转染的细胞(无抗体,同种型或同偶联的抗体)。 (2)转染的细胞与感兴趣的质粒亚克隆而不构荧光细胞内荧光蛋白(pCMV-钙Vα2δ1-HA)或者与双重标记的结构(pmCherry钙Vα2δ1和无抗体温育,用同种型或同共轭抗体)。单一的色彩控制用于荧光发射重叠的赔偿。相同的控制将运行于非透化,并在各系列实验透条件。
- 的完整细胞表面染色活细胞
- 等分试样1×10 6细胞/100μl的在1.5ml管中。
- 添加FITC偶联的单克隆抗HA抗体以5微克/毫升和,涡流在4℃下孵育细胞上在黑暗中摇杆平台(200rpm)下进行45分钟前。
注:在初步滴定实验测定抗体的最佳浓度( 图4)。 - 从黑暗中取出细胞,并添加900微升1×PBS /管。离心机在400×g离心在4℃下5分钟。
- 吸出上清液,并在400 xg离心重悬沉淀在1ml 1×PBS中,涡旋并离心在4℃下5分钟。
- 重复洗(步骤3.2.4)两次以去除任何未结合的抗体。如果使用未缀合的初级抗体,孵育用适当的二级抗体。
- 最后一次洗涤后,重悬细胞于500μl1×PBS中的和传送单细胞悬浮液在5毫升流式细胞术管。保持细胞S IN在4℃黑暗中直到运行样品。
- 在流式细胞仪上运行样本。为了达到最佳效果,分析仪上尽快但不迟于24小时后流的单元格。
- 细胞内染色:固定,通透和染色
- 等分试样1×10 6细胞/100μl的1.5毫升管和离心机在400×g离心在4℃下5分钟。
- 弃上清,悬浮细胞在100微升直接从股票注视通透的解决方案。
- 孵育在黑暗中在4℃下20分钟。
- 添加新鲜配制的1X通透,洗涤液100微升(稀释蒸馏水2 O 10倍通透,洗涤液)。使用在400×g离心5分钟一台离心机在4℃涡流和沉积物的细胞。
- 吸弃上清。
- 重复步骤3.3.4和3.3.5。
- 添加FITC偶联的单克隆抗HA抗体以5微克/毫升在100μl1×透洗涤缓冲液中,于4℃下30分钟在黑暗中温育细胞前涡流。
注意:下面的相同的步骤,用于细胞表面染色的一种是进行细胞内染色。皂素介导的细胞透然而,一个快速可逆的过程,因此,用1×彼尔姆/洗涤缓冲液,以取代1×PBS中,以保持细胞的皂素的细胞内染色过程中恒定存在是重要的。 - 从黑暗中取出细胞,并加入100微升通透,洗涤液。离心机在400×g离心在4℃下5分钟。
- 吸小心上清,重悬在100μl透洗涤缓冲液,涡旋和离心沉淀,在400×g离心在4℃下5分钟。
- 重复洗(步骤3.3.9)1次,以去除任何未结合的抗体。
- 最后一次洗涤后,重悬细胞于500μl1×PBS中的和传送罪GLE细胞悬液5毫升流式细胞仪管。保持在黑暗中的细胞在4℃下直到样品注入流式细胞仪。
- 在流式细胞仪上运行样本。尽快但不迟超过1周染色后运行的流式细胞仪的固定样本。运行在同一天,非透化和透化的细胞。
4.流式细胞仪
- 流式细胞仪细胞分选日报安装
- 打开流式细胞仪软件。试验,标定和设置流式细胞仪细胞分选流程,以确保最佳的仪器性能之前使用的仪器设置珠( 即激光和光学系统,满足规格,激光和流动池正确对齐)。
- 使用100微米的喷嘴以20 PSI鞘压力。
注:该喷嘴不具有的长椅上改变流式细胞仪。 - 根据厂家专业设置流式细胞仪的流率呃规范。非常高的流速将在检测的荧光变化的降低的敏感度。
- 选择蓝色(488纳米激发荧光Isothiocayanate或FITC)和黄绿色(561纳米激发mCherry)激光器。收集FITC和mCherry荧光水平与530/30 nm和分别与二十零分之六百十纳米的带通滤波器。
- 获得前向散射(FCS)对侧向角散射(SSC)的点积用线性刻度未染色细胞。调整各检测器的放大的可视化的细胞中的点图的左下象限。
- 完整的非渗透细胞的样品读数
- 由划定游离形式围绕待分析的细胞不包括细胞碎片和细胞聚集体,从而限制了荧光信号以完整细胞设置P1gate活非透化的细胞。
注:活/死排斥染料可以用来促进活细胞上闸门布置。设置10,000个事件记录在止动门P1。设置此向更高一些事件如果需要的话。 - 收购mCherry与FITC双参数等高线图来检测未染色细胞的自发荧光基线。使用双对数刻度显示负值,提高人口25之间的分辨率。调整各检测器的电压来设置所述第一10个单位的日志荧光强度曲线的下部分内的未染色的阴性细胞。
- 通过收购成立于4.1.5和4.1.6设置都完好无透样本和收集FSC,SSC和信号的荧光检测器。
- 出口和保存* .fcs文件被用于使用流式细胞分析软件分析。
- 由划定游离形式围绕待分析的细胞不包括细胞碎片和细胞聚集体,从而限制了荧光信号以完整细胞设置P1gate活非透化的细胞。
- 透细胞样本解读
- 移动至P1栅极透样品中选择活细胞和所示4.1.5和4.1.6调整FSC和SSC电压。
- 收购全部透样本和收集FSC,SSC一在荧光检测第二信号。
- 出口和保存* .fcs文件被用于使用流式细胞分析软件分析。
- 数据分析
- 启动仪保存在4.2.4和4.3.3分析软件和进口* .fcs文件流。
- 单击工作区窗口中列出的第一个样本。一个管ID号命名的新窗口自动打开。在SSC的与FSC的情节开始浇注过程。绘制周围使用活细胞的椭圆图标栅极(P1)和消除任何碎片,死细胞,或聚集体具有比活细胞不同的前向散射和侧向散射
- 绘制mCherry(y轴)对FITC(x轴)的活细胞的荧光强度的双参数等高线图,点击首先在x轴和选择的FITC的信道,然后单击在y轴并选择PE-mCherry-A通道。点击"四"图标象限标记处的边缘位置utofluorescent细胞各荧光通道。
注:门周围的FITC和mCherry阳性细胞集是P2大门。荧光阴性细胞群称为P3栅极。参见图5本文中所使用的典型门的方法。 - 选择P2和P3盖茨和点击原工作区窗口中的"添加统计信息"图标。点击"计数"(阳性细胞数的),然后点击"中庸"(平均荧光每个荧光强度)或"中间"(每个荧光染料的荧光强度中值)的选项列表中的统计信息。再次单击"添加统计信息"图标。所有这些值都自动转移到原来的工作区窗口。
注:"平均"只有当荧光强度服从正态分布使用。在所有其他情况下,单击"中间"选项卡。因此,小额信贷机构可以参考平均荧光Intensity或中位数的荧光强度。
注:下一步骤是栅极'参数和统计信息应用于通过流式细胞仪探测的所有样本。 - 在工作区窗口中,用鼠标拖放盖茨和统计参数上标出所有样本。
- 生成二维等值线图(mCherry VS FITC)和直方图(细胞计数与荧光强度)对非透化和透化的细胞( 图6A - B)的批处理报告。
- 从在步骤4.4.4生成的统计信息,计算每个荧光的染色的细胞的平均荧光强度(MFI)。从这个值,减去未染色的细胞获得的表面和感兴趣的蛋白质的总表达量化MFI值。
- 报告各荧光(mCherry和FITC)( 图6C - D)的ΔMFI值。规范化的钙测量的ΔMFI Vα2δ1构建突变体,为FITC和mCherry与WT构建体获得的ΔMFI值。
注:荧光强度的绝对值可能大幅变化,这取决于批量的抗体和各实验室工作人员的技术能力,因此需要正常化使用WT构建体中的突变体构建体的荧光强度。
结果
本文介绍了一种可靠的协议通过双色流式细胞术测定法来量化TSA-201cells表达的重组的离子通道的总和细胞表面。作为一个例子,相对的细胞表面和总蛋白表达的钙Vα2δ1subunit定量。为了进行流式细胞术测定中两色流动,钙Vα2δ1被双重标记,以表示可被一个抗HA FITC缀合的抗体和组成型荧光灯内mCherry荧光团来检测一个细胞外的非荧光的表位的HA。对FITC和mCherry...
讨论
此术为基础的流量测定成功地应用于电压门控钙通道14,22,26的荧光标记的成孔和相关的亚基的相对总和细胞表面水平的测量。调查基因突变的影响时,最好使用,因此要求该荧光标记标记的野生型构建体的固有荧光强度为至少10至100倍的荧光标记未标记的构建体的荧光强度大。在这个特殊的情况下,在此描述的mCherry钙Vα2δ1-HA构建体产生了较大的信噪比和更大的动态范围比对于先前...
披露声明
The authors declare that they have no competing financial interests.
致谢
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the "Fondation de l'Institut de Cardiologie de Montréal" to L.P.
材料
| Name | Company | Catalog Number | Comments |
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1.5 ml | Sarstedt | 72-690-001 | |
| Tubes 15 ml | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100 mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35 mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25 ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37 °C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/ml) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37 °C water bath before use. |
| Trypsin-EDTA (1x) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 ml microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1x | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
参考文献
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。