JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
유동 세포 계측법을 사용하여 재조합 이온 채널의 상대 셀 표면 및 전체 식의 결정
요약
속됨 부정맥은 종종 하나 이상의 이온 채널의 표면에 전달 변경 돌연변이에 의해 야기된다. 여기서는 TSA-201 세포에서 발현 된 재조합 이온 채널의 상대적 총 세포 표면 단백질 발현의 정량 분석을 제공하기 위해 유세포 적응.
초록
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
서문
이 문서는 기존의 유동 세포 계측법 기술을 사용하여 재조합 세포에서 발현 이온 통로와 같은 막 단백질의 상대적인 세포 표면 발현을보고 신뢰성 분석을 제공한다. 이온 채널은 세포막을 가로 지르는 이온의 흐름을 게이팅함으로써 전기 신호를 제어 할 책임이 조공 막 단백질이다. 그들은 활성화 메커니즘, 자연, 그들이 지역화 된 구멍을 통해 환승 이온 종의 선택에 의해 분류된다. 세포 및 조직 수준에서 이온 채널을 통해 거시적 인 이온 플럭스는 생물 물리학 (게이팅 및 침투), 생화학 (인산화) 및 생합성 (합성, 글리코 실화, 인신 매매 및 저하) 특성 (1)의 제품이다. 이러한 프로세스 각각은 이온 채널의 모든 유형에 고유 한 이온 채널의 생리적 역할을 수행하도록 최적화된다. 결과적으로,을 통해 이러한 미세 조정 과정 중 어느 하나의 변경상속 또는 종종 "channelopathy"이라 유전 적 변형은 세포 항상성에 해로울 수있다. 이는 세포 표면에서 이온 채널의 "오른쪽"양을 전달하는 것은 세포의 항상성에 중요한 것을 강조하는 것이 중요하다. 심지어 작은 증가 (기능 획득) 및 이온 채널 활성의 저하가 적은 (기능 상실) 일생 심각한 병리를 유발할 수있다. 성숙한 이온 채널의 세포 표면 전달의 결함은 낭포 성 섬유증 (CFTR 이온 채널) 2 긴 QT 증후군 양식 (심장 칼륨 채널) (3) 심장 부정맥 등 수많은 channelopathies에서 결정하는 중요한 요소이다.
Channelopathies은 심장 돌연사 (4)와 연결되어 있습니다. 2,000-1 : 개인 5 당 3,000 갑작스런 부정맥 심장 죽음 캘리포니아의 약 절반에 대한 책임이 있습니다 모든 심장 channelopathies의 현재 전 세계적으로 유병률은 적어도 한 것으로 생각된다SES 6. 심장 전압 게이트 된 나트륨, 칼륨 -에 장애, 및 칼슘 - 선택적인 이온 채널은이 과정에서 중요한 역할을하는 것으로 알려져있다. L 자 형 칼슘 1.2 V 전압 게이트 된 칼슘 채널 동기화 심장 근육의 수축을 개시해야한다. 심장 L 형 칼슘 채널 1.2 V 보조 소단위 7-12 α2δ1 주 조공 칼슘 V의 α1 서브 유닛 및 CA V의 ß 및 CA V 이루어지는 다중 서브 유니트 단백질 복합체이다. 이들 서브 유닛은 심장 (13)의 통상의 전기 기능을 지원하는 데 필수적인 보조 서브 유닛 사이의 완전한 보완은 세포막에 작용 칼슘 V 1.2 채널의 동적 상호 작용을 생성 할 필요가 있습니다. 칼슘 V의 ß는 칼슘 V의 세포 표면 발현을 비공유 나노 몰 소수성 상호 작용 (14)를 통해 1.2 채널을 촉진한다. 칼슘의 V α2δ1 서브 유닛 위스콘신의 공동 발현일 칼슘 V의 ß-결합 된 칼슘 V의 α1은 피크 전류 식 (5 ~ 10 배까지)를 자극하고 더 음의 전압에서 채널 활성화를 촉진한다. 기능 획득 칼슘 V 1.2은 L 형 칼슘 V 1.2 채널을 형성하는 세 개의 주요 소단위에서 점 돌연변이의 호스트 반면 긴 QT 증후군 15라는 심실 부정맥의 형태와 연관되어있는 조공 단위체의 돌연변이 짧은 QT 증후군 양식 (16, 17)의 부정맥을 앓고있는 환자에서 확인되었다. 이온 채널은 생화학 적 관점 (단백질 화학)에서 조사 또는 이러한 보완적인 접근 방식을 사용하여 자주 전기 생리 도구 (전류 생성 기계) 등을 사용 할 수 막 단백질이다. 전기 생리학, 특히 전체 셀 패치 클램프에, 이온 채널 (15)의 기능을 규명하는 적합한 방법이지만, 자신의 생물 물리학 적 변화에서 단백질 인신 매매에 수정 사항을 해결할 수속성. 단백질 화학 그러나 인해 종종 작은 가용성 단백질에 비해 큰 막 단백질의 상대적으로 낮은 발현에 사용을 제한하고있다. 형광 판독을 사용하여 강력한 높은 처리량 방법은 특별히 이온 채널의 세포 표면 발현의 변화를 유발 단백질 생합성에서의 결함을 해결하기 위해 개발 될 필요가있다.
유동 세포 계측법은 셀 카운팅 정렬 바이오 마커 검출, 단백질 공학 (18)에 이용되는 생물 물리학 적 기술이다. 생균 또는 입자의 샘플 용액을 플로우 사이토 미터에 주입하는 경우, 셀은 시스템의 감지 장치 (도 1)로 탐색 할 수있는 단일 스트림으로 순서화된다. 1956 (19)에서 생산 기기 사이토 제 1 유로는 단지 하나의 파라미터를 감지하지만 현대 유동 세포 계측기 여러 레이저와 30 개 이상의 형광 파라미터 (20, 21)의 검출을 허용 형광 검출기를 갖는다.필터 및 거울 (발광 광학)의 강도에 비례하여 빛을 변환하는 전자 네트워크 (포토 다이오드 및 감지기)에 세포의 빛 산란이나 형광등을 직접. 디지털 데이터는 특수한 소프트웨어를 사용하여 분석하고, 기본 출력 도트 플롯 (21)로 표시된다.
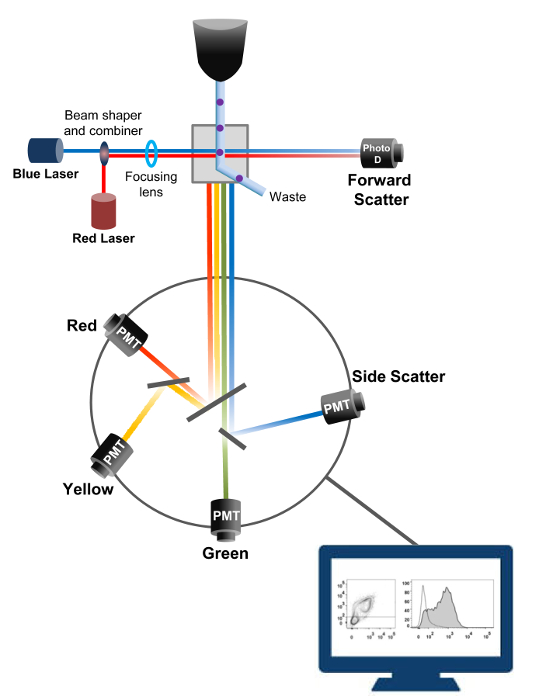
그림 1. 유동 세포 계측법 생물 물리학 원리 정렬이 단일 세포가 하나 이상의 레이저 질의 포인트를 가로 질러 이동 시스 유체 스트림 내의 고압 노즐을 통해 가압된다. 광 빔이 통과하는 세포에 의해 편향되고, 순방향 (순방향 산란 FCS)에 수집 된 광은 셀의 크기에 비례 한 신호로 변환하는 광 다이오드로 전송된다. 빛은 레이저 경로에 90 ° 각도로 수집 감지기 (또한 광전자 증 배관 (PMT))로 전송됩니다.여기 된 형광 색소는 상기 셀에 존재하는 경우,이 광은 셀 내의 입도를 반영 측면 산란 신호 (SSC)의 검출을 허용 이색 거울, 형광 방출을 통해 라우팅된다. 세 검출기 (녹색, 황색, 및 빨강)은 상이한 형광 색소를 동시에 검출 할 수 있도록, 서로 다른 파장 대역 통과 필터들로 표현된다. 서로 다른 신호는 외부 컴퓨터에 의해 디지털화하고 세포의 특성을 정량화 분석 할 데이터로 변환된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
유동 세포 계측기의 높은 처리량은 재조합 야생형과 피킹 결핍 전압 게이트 된 L 형 칼슘 채널 및 1.2 V 생균에 연결된 소단위의 상대 세포막 발현을 정량화 시키는데 이용되었다. cDNA를 공동 구축단백질에 대한 딩은 이중으로 동시에 불 투과성 형광 접합 된 항체와 구조적으로 형광 세포 내 형광 검출 할 수있는 세포 외 비 형광 에피토프를 수행하기 위해 태그되었습니다. 모두 C 말단에 삽입 한 후, 단백질의 세포 외 루프에 삽입 된 세포 에피토프 및 형광 세포가 단백질로 번역된다. 이러한 일련의 실험에서, 칼슘 V의 α2δ1 단백질 고유 세포 형광 항 - HA 및 mCherry를 π 공역 계 세포 외 헤 마글 루티 닌 (HA) 에피토프 불 침투성 FITC (플루오 레세 인 이소 티오 시아 네이트)에 의해 검출 (YPYDVPDYA)을 발현하도록 설계 하였다. mCherry - 칼슘 V의 α2δ1 HA 표지 된 단백질의 상대적인 세포 표면 발현 레벨을 결정하기 위해, 융합 단백질을 발현하는 재조합 세포를 형질 전환 한 후 수확하고, FITC 접합 마우스 단일 클론 항 HA 에피토프 태그 antibod 염색 하였다Y (그림 2). FITC 따라서 생물학적 기능을 방해하는 등의 가능성이없는 효소 리포터보다 상당히 작고, 형광 유기 화합물이다. TSA-201cells에서 과발현 mCherry- 칼슘 α2δ1 V-HA는 이차원 플롯 (22)에 대한 FITC 형광 및 mCherry 형광 크게 3 로그의 증가를 생성한다. 는 HA 에피토프는 단백질의 세포 외 부분에 위치되는 것을 감안할 때, FITC에 대한 형광 강도는 손상 세포의 존재 하에서 얻어진 HA 표지 된 단백질의 세포 표면 발현의 상대적인 인덱스를 반영한다. 작 제물의 HA 에피토프의 접근성 체계적 셀 permeabilization 후 FITC 신호를 측정함으로써 확인된다. FITC 형광에 대한 상대 강도가 상대적 형광 값 FO한다 질적 비교 투과성이 세포에서 예상 때문에 계수는 정규화 된 총 단백질 발현을 확증하는 역할R mCherry은 투과성이 비 투과성이 조건 22, 23에서 측정. 이는 고유의 형광 스펙트럼 permeabilization 후 높은 값 측으로 시프트되어 있지만, 상기 제어 구조에 비해보고되는 유일한 값 형광 강도의 변화가 있음을 주목하는 것이 중요하다. 테스트 구조에 대한 형광 세기의 상대적 변화는 각 형광 물질 (FITC 또는 mCherry)에 ΔMean 형광 강도 (ΔMFI) 값을 사용하여 추정된다. 실험 형광 접합 된 항체의 고유 형광 실험 변동을 제한하기 위해 동일한 조건 하에서 발현 제어 구조의 형광 강도의 테스트 구조의 상대적 형광 강도를 측정하도록 설계된다. 두 개의 막 단백질이 성공적이 분석을 이용하여 검토했다 : L 형 전압 게이트 된 칼슘 채널 칼슘 1.2 V 14, 22 및 다른 일련의 조공 소단위실험, 세포 외 보조 칼슘 V의 α2δ1 서브 유닛 22, 23. 다음 프로토콜은 1.2 채널의 제어 조건에서 이온 채널의 번역 후 변형에 영향을 미치는 돌연변이 후에 심장 L 형 칼슘 V의 칼슘 V의 α2δ1 서브 유닛의 세포 표면 발현을 측정 하였다. 표준 실험 조건하에 FITC의 세포 표면 형광은 mCherry - 칼슘 α2δ1 V-HA 단백질 (참조 (22)로부터도 5)을 코딩하는 cDNA의 발현과 유사 선형 증가한다.
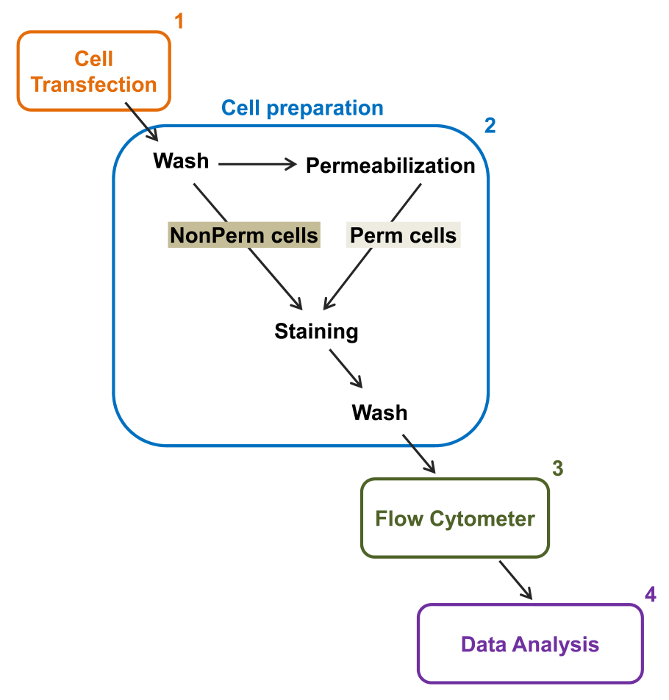
그림 2 :. 실험 프로토콜 유동 세포 계측법 총 멤브레인 라벨의 도식 표현 계획은 필요한 주요 단계 중 일부는 플로리다에 의해 재조합 이온 채널의 상대적인 총과 세포 표면 발현을 정량화 설명유동 세포 계측법. 셀 (1)은 TSA-201 세포에서 이중 태그 구조 mCherry - 칼슘 α2δ1 V-HA 형질 permeabilization과 전 또는 후에 염색 (2). (3) 다변량 분석 (4). 사이토 다중 매개 데이터 흐름에 취득 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
프로토콜
1. 이중 태그 DNA 구조
- 사이트 특이 적 변이 (그림 3B) 20 D676 및 R677 사이에 칼슘 V의 α2δ1의 세포 외 링커에서 HA 에피토프 (YPYDVPDYA)를 삽입합니다. 앞으로 프라이머 gccggattatgcgGGAAAACTCCAAACAACC를 사용하여 프라이머 acatcatacggataTCAATAAATTCATTGAAATTTAAAAGAAATTC 역.
- 를 SacI 및 SalI로 위치 (도 3b) (20) 사이 mCherry의 N 말단에 융합 단백질을 발현하도록 설계 포유류 pmCherry-N1 발현 벡터로 태그 HA 칼슘 V의 α2δ1의 cDNA 서열을 서브 클로닝.
주 : 적절한 채널 기능은 표준 전기 생리 학적 방법 (24)을 사용하여 제어 구조에서 테스트되어야한다.
2. 리포솜 매개 과도 형질 (30 분, 모든 단계 층류 후드에서 수행됩니다)
- 1 일 : 플레이트 TSA-201 세포 (또는 HEKT)에서의 50 만이 용액의 베코 높은 글루코스 최소 필수 배지 10 % 소 태아 혈청 (FBS) 및 1 % 페니실린 - 스트렙토 마이신 (PS) 배지로 보충 (DMEM-HG)를 35mm 배양 접시. 표준 hemacytometer를 사용하여 셀을 계산합니다. 트리 판 블루를 이용하여 세포 샘플의 일부분에서 세포 생존 능력을 평가한다. 접시에 충분한 세포를 형질 전환시에 90 % 합류에 도달한다.
- 주 2 : PS없이 신선한 예열 (37 ° C) 배지 2 ㎖로 변경 배지.
- 각 형질 샘플의 경우, 두 개의 1.5 ml의 튜브를 준비합니다. 관 (1)에있어서, 감소 된 혈청 배지 250 μL의 DNA 4 μg의 희석. 튜브 (2)에서, 250 ㎕의 혈청 감소 배지와 리포좀 - 매개 형질 감염 시약 10 μL를 혼합한다. 사용하기 전에 부드럽게 형질 전환 시약을 섞는다.
- 실온에서 5 분 동안 인큐베이션.
- 관 (1) 및 튜브 (2)의 내용을 결합하여, 부드럽게 혼합하고, 실온에서 적어도 20 분 동안 배양한다.
- 리포좀 추가 / DN상기 배양 된 세포에 단지 부드럽게 믹스 할 수있는 배양 접시 바위.
- 24 시간 동안 CO 2 분위기 5 %에서 37 ° C에서 품어.
유동 세포 계측법에 대한 세포의 3. 염색 (3 시간)
- 세포 샘플을 준비
- 주 3 :주의 깊게 배양 접시에서 매체를 제거하고 0.05 % 트립신 1 배 EDTA (에틸렌 디아민 테트라 아세트산) (37 ° C를) 미리 예열 400 μL와 세포를 씻는다.
- 트립신 EDTA 400 μl를 추가하고 5 분 세포가 접시에서 분리 할 수 있도록하는 CO 2 분위기 5 %에서 37 ° C에서 접시를 품어.
- PS 않고 차가운 배양 배지 1 ㎖를 첨가하여 효소 분해를 중지하고 부드럽게 4-5 회 피펫 팅하여 표면의 모든 세포를 세척한다. 세포 사멸을 감소 소화이고 피펫 피한다.
- 1.5 ml의 튜브에 세포를 수집하고 얼음에 즉시 배치합니다. 차가운 얼음 솔루션을 사용하고 내재화를 방지하기 위해 4 ° C에서 세포를 유지의 항원을 표면. 형광 신호의 광표백을 제한하기 위해 조명을 낮 춥니 다.
- 4 ℃에서 5 분 동안 400 XG에 원심 분리기 튜브. 조심스럽게 기음과 상층 액을 버린다.
- 다시 일시 인산 완충 식염수 (1X) 1 ㎖의 펠릿 (PBS) 단일 세포 현탁액을 제조 하였다.
- 간단히 매우 부드럽게 튜브 와동를 반복 완전히 배지를 제거 3.1.5와 3.1.6 단계를 반복합니다.
- 1X PBS 600 μL의 펠릿을 다시 중지하고 3 × 106 세포 / ml의 최소한으로 세포 농도를 조절한다.
- 세포와 세포 내 염색을위한 두 개의 새로운 1.5 ml의 튜브에 세포를 나눈다. 비특이적 염색에서 특정 얼룩을 구별하기 위해 적절한 컨트롤을 포함합니다.
주 : 이소 제어 항체 배경 염색의 수준을 평가하는 데 도움이 이상적으로 각 차 항체의 호스트 종, 이소과 형광 일치해야합니다. 같은에서 이소 제어 및 복합 항체를 사용하여단백질 농도.

표 1에 대한 플로우 계측법 실험 대조 시료 세포 비는 - 투과 가능하고 투과 가능 각 실험은 다음 음성 대조군이 포함되어야 :. (이소 타입 또는 공액 항체, 항체 없음) (1) Nontransfected 세포. (2) 제정 형광 세포 내 형광 색소없이 플라스미드에 서브 클로닝 관심의 단백질로 형질 세포 (pCMV- 칼슘 V α2δ1-HA) 또는 이중 태그 공사 (pmCherry - 칼슘 V의 α2δ1와 이소 타입 또는으로, 항체없이 배양 공액 항체). 단색 제어, 형광 발광 오버랩 보상에 사용된다. 같은 컨트롤은 비 투과성이 출마 실험의 각 시리즈에 조건을 투과성이있다.
- 본래의 세포 표면 염색라이브 셀
- 나누어지는 1.5 ml의 튜브에 1 × 106 세포 / 100 μL.
- 5 μg의에서 FITC 접합 된 단일 클론 항-HA 항체 추가 / ㎖하고, 45 분 동안 4 ° C에서 어둠 속에서 로커 플랫폼 (200 RPM)에서 세포를 배양하기 전에 소용돌이.
참고 : 항체의 최적 농도는 예비 적정 실험에서 측정 하였다 (그림 4). - 어둠에서 세포를 제거하고 1X PBS / 튜브 900 μl를 추가합니다. 4 ℃에서 5 분 동안 400 XG에 원심 분리기.
- 뜨는을 대기음 4 ℃에서 5 분 동안 400 XG에 1X PBS, 소용돌이와 원심 분리기 1 ml의 펠렛을 재현 탁.
- 어떤 언 바운드 항체를 제거하기 위해 두 번 세척한다 (단계 3.2.4)를 반복합니다. 접합되지 차 항체가 사용되는 경우, 해당 이차 항체와 함께 배양한다.
- 최종 세척 후, 1X PBS 500 ㎕를 상기 세포를 재현 탁하고 유동 세포 계측법 튜브 5 ㎖ 단일 세포 현탁액을 전송. 세포 유지샘플을 실행 할 때까지 4 ℃에서 어둠 속에서의.
- 유동 세포 계수기에 샘플을 실행합니다. 최상의 결과를 얻으려면 가능한 한 빨리하고 늦어도 후 24 시간 이상 흐름 cytometer에 세포를 분석 할 수 있습니다.
- 세포 내 염색 : 고정, Permeabilization 및 염색
- 나누어지는 4 ℃에서 5 분 동안 400 XG에 1 × 106 세포 / 100 1.5 ml의 튜브 μl를 원심 분리기.
- 재고에서 직접 고정-permeabilization 용액 100 ㎕의 상층 액과에 resuspend 세포를 폐기하십시오.
- 20 분 동안 4 ° C에서 어둠 속에 품어.
- 갓 준비 1 배 permeabilization 세척 버퍼의 100 μl를 (증류수 H 2 O의 10 배 permeabilization 세척 버퍼를 희석)를 추가합니다. 4 ° C에서 5 분 동안 400 XG에 테이블 원심 분리기를 사용하여 소용돌이과 침전물 세포.
- 기음과 상층 액을 버린다.
- 반복 3.3.4와 3.3.5 단계를 반복합니다.
- 5에서 FITC 접합 된 모노클로 날 항 HA 항체를 추가μg의 / ㎖ 100 배일 permeabilization 세정 완충액 μL하고, 30 분 동안 4 ℃에서 어둠 속에서 세포를 배양 하였다 선회한다.
주 : 세포 염색은 세포 표면 염색에 사용되는 것과 동일한 절차에 따라 수행된다. 사포닌 매개 세포 permeabilization 따라서는 세포 내 염색 중 사포닌의 지속적인 존재 세포를 유지하기 위해 1 배 파마 / 워시 버퍼와 1X PBS를 교체하는 것이 중요하다, 그러나 신속하게 가역 과정이다. - 어둠에서 세포를 제거하고 100 μL permeabilization 세척 버퍼를 추가합니다. 4 ℃에서 5 분 동안 400 XG에 원심 분리기.
- 기음 조심스럽게 상층 액을 4 ℃에서 5 분 동안 400 XG에 100 ㎕의 permeabilization 세척 버퍼, 소용돌이와 원심 분리기에서 펠렛을 재현 탁.
- 어떤 언 바운드 항체를 제거하는 세척 (단계 3.3.9)를 한 번 더 반복합니다.
- 최종 세척 후, 1X PBS 500 μL의 세포를 재현 탁하고 죄를 전송튜브 세포 계측법 5 mL의 흐름에 GLE 세포 현탁액. 흐름 cytometer에 샘플을 주입 할 때까지 4 ° C에서 어둠 속에서 세포를 유지합니다.
- 유동 세포 계수기에 샘플을 실행합니다. 가능한 한 빨리 있지만 나중에 일주보다 염색 한 후 세포 계수기에 고정 된 샘플을 실행합니다. 같은 날에 비 투과성이와 투과성이 세포를 실행합니다.
4. 유동 세포 계측법
- 셀 분류기 데일리 설치 사이토 흐름
- 유동 세포 계측법 소프트웨어를 켭니다. 최적의 기기 성능을 보장하기 위해, 실험 셀 소터 흐름 cytometer를 보정 및 설정하기 전에 장비 설정 비즈를 사용하여 (셀 즉, 레이저 및 광학 사양을 수행, 레이저와 흐름이 제대로 정렬)을.
- 20 psi의 시스 압력으로 100 μm의 노즐을 사용합니다.
참고 : 노즐이없는이 사이토 흐름 벤치에 변경 될 수 있습니다. - manufactur의에 따른 사이토의 유량 설정어 사양. 과도하게 높은 유량에서 형광 변화의 검출 감도가 저하된다.
- 노란색 - 녹색 레이저 (mCherry을 자극하는 561 ㎚) (플루 오레 Isothiocayanate 또는 FITC를 자극하는 488 ㎚) 파란색을 선택합니다. 30분의 530의 나노와 각각 20분의 610 nm의 대역 통과 필터와 FITC와 mCherry 형광 수준을 수집합니다.
- 리니어 스케일을 사용하여 흠없는 셀 사이드 분산 형 (SSC) 도트 플롯 대 전방 산란 (FCS)를 취득. 도트 플롯의 왼쪽 사분면에 세포를 시각화하기 위해 각 검출기의 증폭을 조절합니다.
- 본래 비 투과성이 세포의 샘플 읽기
- 세포가 이렇게 손상 세포에 형광 신호를 제한, 세포 파편 및 세포 집합체 제외하고 분석 할 주위에 무료로 양식을 서술하여 라이브 비 투과성이 세포의 P1gate를 설정합니다.
주의 : 라이브 / 죽은 제외 염료 생균에 게이트 위치를 용이하게하기 위해 사용될 수있다. 기록하기 만 이벤트를 설정정지 게이트 P1있다. 필요가있을 경우 이벤트의 높은 숫자로 설정합니다. - 염색 세포의 기본 형광도를 검출하는 FITC 개의 파라미터 등고선 플롯 대 mCherry 획득. 음수 값을 표시하고 인구 25 사이의 해상도를 개선하기 위해 이중 로그 스케일을 사용합니다. 로그 형광 강도 플롯의 처음 10 개 단위의 하부 내에 흠 음성 세포를 설정하기 위해 각각의 검출 전압을 조정한다.
- 4.1.5과 4.1.6에 설립 된 설정을 사용하여 모든 그대로 비 투과성이 샘플을 획득하고, 형광 검출기에 FSC, SSC 및 신호를 수집합니다.
- 수출 및 * 저장 .fcs 파일 분석 소프트웨어를 이용하여 유세포 분석을 위해 사용된다.
- 세포가 이렇게 손상 세포에 형광 신호를 제한, 세포 파편 및 세포 집합체 제외하고 분석 할 주위에 무료로 양식을 서술하여 라이브 비 투과성이 세포의 P1gate를 설정합니다.
- 투과성이 세포의 샘플 읽기
- 투과성이 샘플에서 살아있는 세포를 선택하고 4.1.5과 4.1.6에서와 같이 FSC와 SSC 전압을 조정 P1 게이트를 이동합니다.
- 모든 투과성이 샘플을 획득하고 FSC, SSC a를 수집형광 검출기의 차 신호.
- 수출 및 * 저장 .fcs 파일 분석 소프트웨어를 이용하여 유세포 분석을 위해 사용된다.
- 데이터 분석
- 4.2.4과 4.3.3에 저장된 분석 소프트웨어 및 가져 오기 * .fcs 파일 유동 세포 계측법을 시작합니다.
- 작업 공간 창에 나열된 첫 번째 샘플을 클릭합니다. 튜브 ID 번호의 이름을 딴 새 창이 자동으로 열립니다. FSC 대 SSC의 음모에 게이팅 프로세스를 시작합니다. 살아있는 세포와 다른 앞으로 산란 및 측면 산란이 이물질, 죽은 세포, 또는 집계 게이트 (P1) 살아있는 세포 주위의 타원 아이콘을 사용하여 그리기 및 제거
- FITC (X 축) 생균의 형광 강도 대 mCherry (Y 축)의 2 파라미터 윤곽 플롯을 그리려면, X 축에 제 클릭하여 FITC-A 채널을 선택하고, Y 클릭 시킴으로써 행한다 및 PE-mCherry-A 채널을 선택합니다. a의 가장자리에 사분면 마커를 배치합니다 "쿼드"아이콘을 클릭합니다각각의 형광 채널에서 utofluorescent 세포.
참고 : FITC와 mCherry 양성 세포 주변에 게이트는 P2 게이트입니다. 음극 형광 세포 집단은 P3의 게이트로 불린다. 이 문서에서 사용되는 대표적인 게이팅 방법에 대한 그림 5를 참조하십시오. - P2와 P3 게이트를 선택하고 원래의 작업 공간 창에서 "추가 통계"아이콘을 클릭합니다. "백작"(양성 세포의 수)을 클릭하고 "평균"(각 형광 색소의 평균 형광 강도) 또는 "중간"(각 형광 색소의 중간 형광 강도) 옵션 목록 중 통계를 클릭합니다. 다시 "추가 통계"아이콘을 클릭합니다. 이러한 모든 값이 자동으로 원래의 작업 창으로 전송된다.
주 : 형광 강도가 정규 분포에 따른 경우에만 사용되는 "평균". 다른 모든 경우에, "중간"탭을 클릭합니다. MFI 따라서 형광 Intensit 평균을 참조 할 수Y 또는 중간 형광 강도.
주 :이 단계는 세포 계측기에 의해 프로브 모든 샘플에 게이츠 파라미터 및 통계를 적용하는 것이다. - 작업 영역 창에서 드래그 앤 라인의 모든 샘플을 표시 위에 게이트 및 통계 매개 변수를 드롭 마우스를 사용합니다.
- 비 투과성이와 투과성이 세포 (- B도 6A) 두 가지 차원 형상 (FITC 대 mCherry) 플롯과 히스토그램 (세포가 형광 강도에 비해 계산)의 배치 보고서를 생성합니다.
- 단계 4.4.4에서 생성 된 통계에서, 염색 된 세포에 대한 각각의 형광 색소에 대한 평균 형광 강도 (MFI)를 계산한다. 이 값으로부터, 표면 및 관심있는 단백질의 총 발현을 정량화하는 염색 세포로부터 얻은 MFI 값을 뺀다.
- 각 형광 (mCherry 및 FITC) (- D 그림 6C)의 ΔMFI 값을보고합니다. 칼슘 측정 한 ΔMFI을 정상화 V는 WT 구조와 FITC 및 mCherry 얻은 ΔMFI 값에 돌연변이 체를 구성 α2δ1.
주 : 형광 강도의 절대 값은 따라서, 항체 및 각 실험실 작업자의 기술적 능력의 배치에 따라 급격히 WT 작 제물을 사용하여 돌연변이 구조의 형광 강도를 정규화 할 필요가 달라질 수있다.
결과
이 문서에서는 분석 세포 계측법 2 색의 흐름에 의해 TSA-201cells로 표현 재조합 이온 채널의 총 세포 표면을 정량화 할 수있는 신뢰할 수있는 프로토콜을 설명합니다. 예를 들어, 상대적인 세포 표면 및 총 단백질 발현은 칼슘 V의 α2δ1subunit 대해 정량 하였다. 분석 계측법 2 색 흐름을 수행하기 위해, 칼슘 V의 α2δ1은 이중 항 HA FITC 공액 된 항체 및 항시 형광 ...
토론
이 유동 세포 계측법 기반 분석은 성공적 전압 게이트 된 칼슘 채널 14,22,26의 조공 - 형광 표지와 연관된 서브 유닛의 상대적 총 세포 표면 수준의 측정에 적용했다. 이것은 유전 적 돌연변이의 영향을 조사 할 때 가장 사용함으로써 표지화 - 형광 태그 야생형 구조체의 내재적 형광 강도는 형광 표지 된 태그가없는 구조의 형광 강도보다 큰 100 배, 적어도 10 인 것이 요구되고 . 이 특정 예에...
공개
The authors declare that they have no competing financial interests.
감사의 말
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the "Fondation de l'Institut de Cardiologie de Montréal" to L.P.
자료
| Name | Company | Catalog Number | Comments |
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1.5 ml | Sarstedt | 72-690-001 | |
| Tubes 15 ml | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100 mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35 mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25 ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37 °C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/ml) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37 °C water bath before use. |
| Trypsin-EDTA (1x) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 ml microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1x | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
참고문헌
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유