Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Определение относительной клеточной поверхности и Total экспрессии рекомбинантных ионных каналов с помощью проточной цитометрии
В этой статье
Резюме
Наследственные нарушения ритма сердца часто бывают вызваны мутациями, которые изменяют доставку поверхности одного или нескольких ионных каналов. Здесь мы приспосабливаемся проточной цитометрии анализов, чтобы обеспечить количественную оценку относительной общей и поверхностной клеточной экспрессии белка рекомбинантных ионных каналов, выраженные в клетках TSA-201.
Аннотация
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Введение
Эта статья обеспечивает надежный анализ, чтобы сообщить об относительной экспрессии на клеточной поверхности мембранных белков, таких как ионные каналы, выраженные в рекомбинантных клетках с использованием существующей технологии проточной цитометрии. Ионные каналы являются пороформирующие мембранные белки, которые отвечают за регулирование электрических сигналов с помощью стробирования поток ионов через клеточную мембрану. Они классифицируются по механизму активации, природы и селективности видов ионов, проходящих через поры, где они локализованы. На клеточном и тканевом уровнях, макроскопические потоки ионов через ионные каналы являются продуктом биофизической (стробирования и проникания), биохимические (фосфорилирования), и биогенеза (синтез, гликозилирование, торговля людьми и деградации) свойств 1. Каждый из этих процессов является уникальным для каждого типа ионных каналов и оптимизирована для выполнения физиологической роли ионного канала. Следовательно, изменения в любой из этих доработаны процессов черезунаследованные или генные модификации, часто упоминается как "channelopathy", может быть вредным для клеточного гомеостаза. Важно подчеркнуть, что обеспечение «правильного» количества ионных каналов на поверхности клетки имеет решающее значение для клеточного гомеостаза. Даже небольшое увеличение (коэффициента усиления из-функции) и небольшое снижение (с потерей функции) в канале активности ионов имеют потенциал, чтобы вызвать серьезные патологии в течение жизни. Дефекты в доставке на клеточной поверхности зрелых ионных каналов является важным фактором , определяющим в многочисленных каналопатии, таких как муковисцидоз (CFTR ионного канала) 2 и сердечных аритмий длинного интервала QT формы синдрома (сердечных калиевых каналов) 3.
Каналопатии связаны с сердечной внезапной смерти 4. В настоящее время во всем мире распространенность всех сердечных каналопатии считается по меньшей мере , 1: 2,000-1: 3000 в индивидуальной 5 и несут ответственность за примерно половину внезапной сердечной смерти от аритмии окSES 6. Дисфункция сердечного напряжения закрытого калиевые, натрий-и кальциевые селективные ионные каналы, как известно, играют ключевую роль в этом процессе. 1.2 потенциалзависимыми кальциевых каналов L-типа Ca V необходим для инициации синхронизированного сокращения мышц сердца. Сердечный L-типа Ca V 1,2 канал белковый комплекс мульти-субъединица состоит из основного порообразующего Са V & alpha ; 1 субъединицы и Ca V ß и Ca V α2δ1 вспомогательных подразделений 7-12. Обратите внимание , что полный комплект вспомогательных подразделений требуется для производства функциональных Ca V 1,2 каналов в плазматической мембране и динамические взаимодействия между этими субъединицами имеют важное значение для поддержания нормальной электрической функции сердца 13. Ca V ß способствует поверхности экспрессии клеток Са V 1,2 каналов через нековалентному наномолярной гидрофобного взаимодействия 14. Co-выражение V α2δ1 субъединиц Wi Caго Са V SS переплете Са V α1 стимулирует экспрессию пикового тока ( от 5 до 10 раз) и способствует активации канала при более отрицательных напряжений. Усиление-оф-функции мутации порообразующего субъединицей Ca V 1.2 были связаны с формой желудочковой аритмией называется длинный QT синдром 15 в то время как множество точечных мутаций в трех основных субъединиц , образующих L-типа Ca V 1.2 канала были выявлены у пациентов , страдающих от аритмий короткого интервала QT формы синдрома 16,17. Ионные каналы являются мембранные белки, которые могут быть исследованы с биохимической перспективной (белковой химии) с использованием или электрофизиологических инструментов (вольт-генераторные машины) и часто используя эти дополнительные подходы. Электрофизиологии, в частности , цельноклеточной патч-зажим, является подходящим подход к выяснению функции ионных каналов 15 , но не может разрешить изменения в области незаконного оборота белка с изменениями в их биофизическихсвойства. химии белков, однако, часто ограниченное применение из-за относительно низкой экспрессии больших мембранных белков относительно небольших растворимых белков. Надежные методы с высокой пропускной способностью с помощью флуоресцентной считывания необходимо разработать для того, чтобы конкретно рассмотреть дефекты белка биогенезе вызывая изменения в клеточной поверхности экспрессии ионных каналов.
Проточная цитометрия является биофизической технологии , используемой в подсчета клеток, сортировки, обнаружения биомаркеров и белковой инженерии 18. Когда раствор образца живых клеток или частиц вводят в проточном цитометре, клетки упорядочены в единый поток , который может быть зондируется системой обнаружения машины (рис 1). Первый поток цитометра прибора , произведенного в 1956 году 19 обнаружен только один параметр , но современные проточные цитометры несколько лазеров и детекторов флуоресценции , которые позволяют обнаруживать более 30 флуоресцентных параметров 20,21.Фильтры и зеркала (эмиссионные оптика) направляют рассеяния света или лампы дневного света клеток к электронной сети (фотодиод и детекторы), которые преобразуют свет пропорционально его интенсивности. Цифровые данные анализируются с помощью специализированного программного обеспечения и первичный выход отображается как точка участка 21.
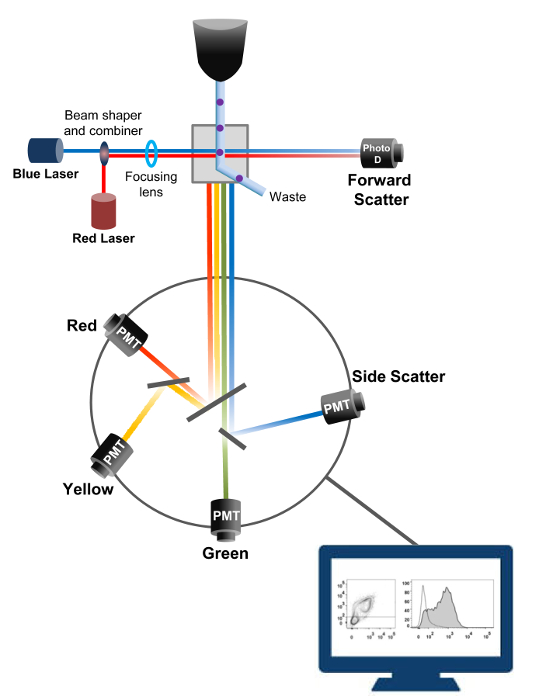
Рисунок 1:. Биофизические принципы проточной цитометрии сортировки Отдельные клетки выталкиваются через сопло под высоким давлением в потоке оболочки текучей среды , которая перемещает их через один или несколько лазерных точек допроса. Световой пучок отклоняется проходящими клеток и света, собираемого в прямом направлении (вперед Scatter, FCS), отправляется на фотодиод, который преобразует свет в сигнал, пропорциональный размеру клетки. Свет также собирается под углом к лазерному пути 90 ° и направлен детекторы (называемые также умножители (ФЭУ)).Этот свет проходит через дихроичных зеркал, которые позволяют обнаружение бокового рассеяния сигнала (SSC), который отражает детализацию в клетках, а также флуоресцентных излучений, если возбужденные флуорохромы присутствуют в клетке. Три детекторы (зеленый, желтый и красный) представлены с разными фильтрами длины волны полосовых, что позволяет одновременное обнаружение различных флюорохромами. Различные сигналы преобразуются в цифровую форму с помощью внешнего компьютера и преобразуются в данные , которые будут проанализированы для количественного определения характеристик ячеек. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
Высокой пропускная способность цитометров была использована для количественного определения относительной экспрессии мембранного рекомбинантного дикого типа и торговли людьми с дефицитом напряжения закрытого L-типа Ca V 1.2 каналов и связанных с ними субъединиц в живых клетках. кДНК создает совместноеDing для белков были двукратно помеченный одновременно нести внеклеточный нефлуоресцентного эпитоп, который может быть обнаружен с помощью непроницаемого флуоресцентного конъюгированных антител и внутриклеточный флуорофором, который конститутивно флуоресцентный. Оба внеклеточный эпитоп, вставленный во внеклеточной петле белка, и внутриклеточный флуорофор, вставленный после С-конца, пересчитаны с белком. В этой серии экспериментов V α2δ1 белок Са сконструированные для экспрессии внеклеточного гемагглютинина (HA) эпитоп (YPYDVPDYA) обнаружен непроницаемым FITC (флуоресцеин изотиоцианатом) -conjugated анти-HA и mCherry как внутренняя внутриклеточного флуорофора. Для определения относительного уровня экспрессии на клеточной поверхности клиновидного α2δ1 mCherry-Ca HA-меченый белок, рекомбинантные клетки , экспрессирующие слитый белок , собирали после трансфекции, и окрашивали ФИТЦ-конъюгированного мышиных моноклональных анти-HA эпитоп тег antibodY (рисунок 2). FITC представляет собой органическое соединение, которое флуоресцентный значительно меньше, чем ферментных репортеров и, следовательно, как вероятно, не препятствовать биологической функции. mCherry- Ca V α2δ1-HA избыточно экспрессируется в TSA-201cells, производит значительное увеличение 3-журнала в флуоресценции FITC и mCherry флуоресценции на двумерных участков 22. Учитывая, что эпитоп HA находится во внеклеточной части белка, интенсивность флуоресценции для FITC, полученный в присутствии неповрежденных клеток отражают относительный показатель клеточной поверхностной экспрессии HA-меченого белка. Доступность эпитопа HA в конструкциях систематически проверяется путем измерения сигнала FITC после клеточной проницаемости. Эта мера также служит для подтверждения нормализованное общее экспрессию белка, так как относительные интенсивности флуоресценции для FITC оценивается в проницаемыми клеток качественно сопоставимы с относительными значениями флуоресценции Foг mCherry измеряется при проницаемыми и непермеабилизированных условиях 22,23. Важно отметить, что собственный спектр флуоресценции смещается в сторону более высоких значений после того, как пермеабилизации но сообщается единственное значение является изменение интенсивности флуоресценции по сравнению с конструкцией управления. Относительные изменения интенсивности флуоресценции для испытаний конструкций оцениваются с использованием интенсивности флуоресценции (ΔMean ΔMFI) значения для каждого флуорофора (mCherry или FITC). Эксперименты предназначены для измерения интенсивности флуоресценции тест конструкта по отношению к интенсивности флуоресценции конструкции управления выраженной в тех же условиях, чтобы ограничить экспериментальные вариации в собственной флуоресценции флуорофора-конъюгированных антител. Два мембранных белков были успешно изучены с помощью этого анализа: в качестве порообразующего субъединицей напряжения закрытого кальциевых каналов L-типа Ca V 1,2 14,22 и в другой серииЭксперименты, внеклеточный Ca вспомогательный V α2δ1 субъединица 22,23. Следующий протокол использовали для определения экспрессии клеточной поверхности Са V α2δ1 субъединицей сердца L-типа Ca V 1,2 каналов в контрольных условиях и после мутаций , влияющих на посттрансляционной модификации ионного канала. В рамках стандартных экспериментальных условиях клеточной поверхности флуоресценции FITC увеличивает квази- линейно с выражением кДНК , кодирующей mCherry-Ca V α2δ1-HA белков (рисунок 5 из ссылки 22).
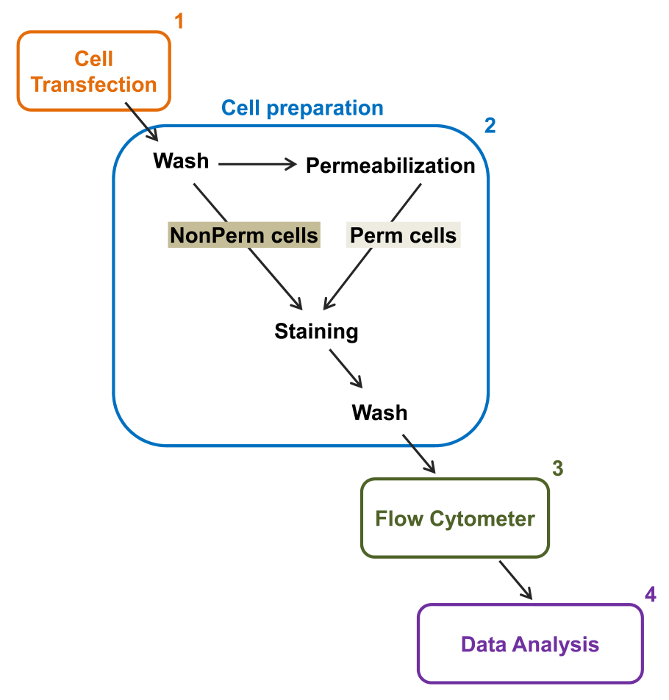
Рис . 2: Схематическое представление полной и мембранной маркировки в проточной цитометрии экспериментальный протокол Схема описывает некоторые из основных шагов , необходимых для количественной оценки относительной общей и поверхностной клеточной экспрессии рекомбинантных ионных каналов Ф.Л.вл цитометрии. Клетки трансфицируют с двойным меченого строительство mCherry-Ca V α2δ1-HA в TSA-201 клеток (1) и окрашивают до или после того, как пермеабилизации (2). Многопараметрические данные получают в проточном цитометре (3) для многомерного анализа (4). Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
протокол
1. Конструкции Вдвойне Меченый ДНК
- Вставьте эпитоп HA (YPYDVPDYA) во внеклеточной линкера Ca V α2δ1 между D676 и R677 с помощью сайт - направленного мутагенеза (рис 3B) 20. Использование прямого праймера gccggattatgcgGGAAAACTCCAAACAACC и обратного праймера acatcatacggataTCAATAAATTCATTGAAATTTAAAAGAAATTC.
- Подклон последовательность кДНК меченой HA Ca V α2δ1 в вектор экспрессии млекопитающих pmCherry-N1 предназначенный для экспрессии белка , слитый с N-концом mCherry между сайтами SacI и SalI (фигура 3В) 20.
Примечание: Соответствующая функция канала должна быть проверена с помощью конструкции управления с использованием стандартных электрофизиологических методов 24.
2. опосредованную липосомами Переходный Трансфекция (30 мин, все шаги выполняются под ламинарным потоком Hood)
- День 1: Пластинчатые полмиллиона клеток TSA-201 (или HEKT) в35 мм чашки культуры с 2 мл Дульбекко высокой глюкозы минимально необходимой среды Игла (DMEM-HG), дополненной 10% фетальной бычьей сыворотки (FBS) и 1% пенициллин-среде стрептомицина (PS) культуры. Граф клеток с использованием стандартного гемоцитометра. Оценка жизнеспособности клеток из фракции образца клеток с использованием трипанового синего. Пластинчатые достаточное количество клеток, чтобы достигнуть 90% сплошности во время трансфекции.
- День 2: Изменение культуральной среды с 2 мл свежей предварительно нагретом (37 ° С) культуральной среде без PS.
- Для каждого образца трансфекции, подготовить две 1,5 мл пробирки. В трубе 1, развести 4 мкг ДНК в 250 мкл восстановленного сыворотки среды. В трубке 2, смешивают 10 мкл липосом-опосредованной трансфекции реагента 250 мкл культуральной среды, не содержащей сыворотки снижается. Осторожно перемешать реагент трансфекции перед использованием.
- Выдержите в течение 5 мин при комнатной температуре.
- Смешайте содержимое трубки 1 и трубки 2, аккуратно перемешать и инкубировать по меньшей мере 20 мин при комнатной температуре.
- Добавить липосом / DNА комплексы в культуре клеток и осторожно встряхните культуры блюдо перемешать.
- Инкубировать при 37 ° С в атмосфере 5% СО 2 атмосферы в течение 24 часов.
3. Окрашивание клеток для проточной цитометрии (3 ч)
- Подготовка образцов мобильных
- День 3: Удалить среду из культуральной чашки тщательно и промыть клетки с 400 мкл предварительно нагретом (37 ° С) 0,05% трипсин-ЭДТА 1x (этилендиаминтетрауксусной кислоты).
- Добавить 400 мкл трипсина-ЭДТА и инкубировать блюдо при температуре 37 ° С в атмосфере 5% CO 2 атмосфере в течение 5 мин , чтобы позволить клеткам отсоединиться от тарелки.
- Остановить фермент пищеварение путем добавления 1 мл культуральной среды без холодной PS и промойте все клетки с поверхности пипеткой осторожно 4-5 раз. Избегайте чрезмерного пищеварения и чрезмерной пипеткой, чтобы уменьшить гибель клеток.
- Сбор клеток в 1,5 мл пробирки и помещают непосредственно на льду. Использование льда холодные растворы и сохранить клетки при 4 ° С для предотвращения интернализацииповерхностных антигенов. Снижение освещения для ограничения фотообесцвечивания флуоресцентного сигнала.
- Центрифуга трубки при 400 мкг в течение 5 мин при 4 ° С. Тщательно аспирата и отбросить супернатант.
- Повторно приостанавливать осадок в 1 мл фосфатно-солевого буфера 1х (PBS) с целью получения суспензии отдельных клеток.
- Кратко вихре трубки очень аккуратно и повторите шаги 3.1.5 и 3.1.6, чтобы полностью удалить культуральной среды.
- Повторное приостановить осадок в 600 мкл 1x PBS и регулировать концентрацию клеток до минимум 3 × 10 6 клеток / мл.
- Разделите клетки в двух новых 1,5 мл пробирки для внеклеточного и внутриклеточного окрашивания. Включить соответствующие элементы управления для различения специфическое окрашивание от неспецифического окрашивания.
ПРИМЕЧАНИЕ: контрольное антитело изотипа помогает оценить уровень фонового окрашивания и в идеале должны соответствовать каждого первичного антитела вида хозяина изотип и флуорофор. Используйте контроль изотипа и конъюгированных антител в то жеКонцентрацию белка.

Таблица 1: Flow-цитометрии контрольные образцы для эксперимента непермеабилизированных и проницаемыми клетки Каждый эксперимент должен включать в себя следующие негативные элементы управления:. (1) Nontransfected клетки (без антител, с изотипа или с сопряженными антителом). (2) Трансфицированных клетки с интересующим белком субклонировали в плазмиде без конститутивного флуоресцентного внутриклеточного флуорохромом (pCMV- Са V α2δ1-HA) , или с двукратно меченого конструкции (pmCherry-Ca V α2δ1 и инкубируют без антител, с изотипа или с сопряженный антитела). Одиночные контроля цвета используются для компенсации флюорохром перекрытия излучения. Одни и те же элементы управления для запуска непермеабилизированных и проницаемыми условий в каждой серии экспериментов.
- Поверхности клеток Окрашивание неповрежденнымиЖивые клетки
- Алиготе 1 х 10 6 клеток / 100 мкл в 1,5 мл пробирки.
- Добавляют ФИТЦ-конъюгированного моноклональные антитела анти-HA при концентрации 5 мкг / мл и, вихревое перед инкубацией клеток на качалке платформы (200 оборотов в минуту) в темноте при температуре 4 ° С в течение 45 мин.
Примечание: Оптимальная концентрация антител определяли в предварительных экспериментах по титрованию (рисунок 4). - Удалить клетки из темноты и добавить 900 мкл 1X PBS / пробирку. Центрифуга при 400 х г в течение 5 мин при температуре 4 ° С.
- Аспирируйте супернатант и ресуспендируют осадок в 1 мл 1x PBS, вихря и центрифуге при 400 х г в течение 5 мин при температуре 4 ° С.
- Повторите промывку (этап 3.2.4) дважды для удаления несвязанного антитела. Если несопр первичное антитело используют, инкубировать с соответствующим вторичным антителом.
- После последней промывки клетки вновь суспендируют в 500 мкл PBS и 1х передача одноклеточной суспензии в 5 мл проточной цитометрии трубки. Держите ячейкуs в темноте при 4 ° С до запуска образца.
- Запуск образцов на цитометра потока. Для достижения наилучших результатов анализа клетки на проточном цитометре как можно скорее и не позднее, чем через 24 часа после.
- Внутриклеточные Окрашивание: Закрепление, пермеабилизирующего и Окрашивание
- Аликвоты 1 × 10 6 клеток / 100 мкл в 1,5 мл пробирки и центрифугируют при 400 х г в течение 5 мин при температуре 4 ° С.
- Удалите супернатант и ресуспендирования клеток в 100 мкл фиксации-пермеабилизации раствора непосредственно со склада.
- Инкубируют в темноте при температуре 4 ° С в течение 20 мин.
- Добавляют 100 мкл свежеприготовленного 1x пермеабилизации-буфера для промывки (разбавленные 10х пермеабилизации-промывочный буфер в дистиллированной H 2 O). Вихревые и осадка клеток с использованием настольной центрифуге при 400 мкг в течение 5 мин при 4 ° С.
- Отберите и отбросить супернатант.
- Повторите шаги 3.3.4 и 3.3.5.
- Добавить FITC-конъюгированного моноклональных анти-HA антитела на 5мкг / мл в 100 мкл 1x пермеабилизации-буфера для промывки и, вихрем перед инкубацией клеток в темноте при температуре 4 ° С в течение 30 мин.
Примечание: внутриклеточное окрашивание производится по той же методике, что и использованный для окрашивания поверхности клетки. Сапонины-опосредованной проницаемости клеточной мембраны является однако, быстро обратимый процесс, поэтому важно, чтобы заменить 1X PBS буфером 1x Пермь / промывочного, чтобы сохранить клетки в постоянном присутствии сапонинов во время внутриклеточного окрашивания. - Удалить клетки из темноты и добавляют 100 мкл пермеабилизации-промывочный буфер. Центрифуга при 400 х г в течение 5 мин при температуре 4 ° С.
- Отберите тщательно супернатант и ресуспендируют осадок в 100 мкл пермеабилизации-буфера для промывки, вихря и центрифуге при 400 х г в течение 5 мин при температуре 4 ° С.
- Повторите промывку (этап 3.3.9) еще раз для удаления несвязанного антитела.
- После последней промывки клетки вновь суспендируют в 500 мкл PBS и 1х передать грехгле клеточной суспензии до 5 мл проточной цитометрии трубок. Хранить клетки в темноте при 4 ° С до инъекции пробы в проточном цитометре.
- Запуск образцов на цитометра потока. Запуск фиксированных образцов на цитометра как можно скорее, но не позднее чем за 1 неделю после окрашивания. Выполните непермеабилизированных и проницаемыми клетки в тот же день.
4. Проточная цитометрия
- Проточный цитометр Cell сортировщик Daily Setup
- Включите программное обеспечение проточной цитометрии. До эксперимента, откалибровать и настроить поток цитометра ячейки сортировщик для обеспечения оптимальной производительности инструмента (т.е. лазер и оптика выполняют спецификации, лазерный и поток ячейки правильно выровнены) с помощью установки прибора бусинки.
- Используйте насадку 100 мкм с 20 фунтов на квадратный дюйм давления оболочки.
Примечание: Насадка не должна быть изменена на скамейке проточном цитометре. - Установить скорость потока цитометр в соответствии с производстэр спецификация. Чрезвычайно высокие скорости потока уменьшается чувствительность при обнаружении изменений в флуоресценции.
- Выберите синий (488 нм для возбуждения флуоресцеин Isothiocayanate или FITC) и желто-зеленый (561 нм для возбуждения mCherry) лазеров. Собирают уровни флуоресценции FITC и mCherry с 530/30 нм и с 610/20 нм полосовой фильтр соответственно.
- Приобретать рассеяния вперед (FCS) в зависимости от бокового рассеяния (SSC) точка участка для неокрашенных клеток с использованием линейной шкалы. Отрегулируйте усиление каждого детектора, чтобы визуализировать клетки в нижнем левом квадранте точечного участка.
- Пример Чтение Малонарушенные непермеабилизированных клеток
- Установите P1gate для живых непермеабилизированных клеток путем очерчивания свободную форму вокруг клеток, которые будут проанализированы за исключением остатков клеток и клеточных агрегатов, тем самым ограничивая сигнал флуоресценции интактных клеток.
Примечание: Live / мертвые красители исключения могут быть использованы для облегчения размещения затвора на живые клетки. Набор 10000 событий для записитормозящей ворот P1. Установите на более высокий число событий, если это будет необходимо. - Приобретать mCherry по сравнению с FITC двупараметрической контура участка для определения базовой линии аутофлюоресценции неокрашенных клеток. Используйте би-логарифмической шкалы , чтобы показать отрицательные значения и улучшить разрешение между населением 25. Отрегулировать напряжение каждого из детекторов для установки неокрашенных отрицательных клеток в нижней части первых десяти единиц графиков интенсивности флуоресценции журнала.
- Приобретают все неповрежденные непермеабилизированных образцы с использованием параметров, установленных в 4.1.5 и 4.1.6, и собирать FSC, SSC и сигналы детекторов флуоресценции.
- Экспорт и сохранение * .fcs файлы, которые будут использоваться для анализа с помощью проточной цитометрии программного обеспечения для анализа.
- Установите P1gate для живых непермеабилизированных клеток путем очерчивания свободную форму вокруг клеток, которые будут проанализированы за исключением остатков клеток и клеточных агрегатов, тем самым ограничивая сигнал флуоресценции интактных клеток.
- Пример Чтение проницаемыми клеток
- Перемещение P1 ворота для выбора живых клеток в образцах проницаемыми и регулировать FSC и SSC напряжения, как показано в разделе 4.1.5 и 4.1.6.
- Приобретают все проницаемыми образцы и собирать FSC, SSC Aй сигналы детекторов флуоресценции.
- Экспорт и сохранение * .fcs файлы, которые будут использоваться для анализа с помощью проточной цитометрии программного обеспечения для анализа.
- Анализ данных
- Запуск проточной цитометрии программного обеспечения для анализа и импорта * .fcs файлов, сохраненных в 4.2.4 и 4.3.3.
- Нажмите на первом образце, перечисленных в окне рабочего пространства. Новое окно имени трубки идентификационного номера открывается автоматически. Запустить процесс стробирования в участке SSC по сравнению с FSC. Нарисуйте ворота (P1) с помощью значка Эллипс вокруг живых клеток и устранить любой мусор, мертвые клетки, или агрегаты, которые имеют различные рассеяния вперед и боковые разброс, чем живые клетки
- Чтобы нарисовать двухпараметрическое контур график mCherry (ось у) по сравнению с FITC (ось х) интенсивности флуоресценции живых клеток, нажмите сначала на оси х и выбрать-A FITC канал, а затем нажмите на у Оу и выбрать PE-mCherry-A канал. Нажмите на иконку "Quad", чтобы поместить квадранта маркер на краюutofluorescent клеток в каждом канале флуоресценции.
ПРИМЕЧАНИЕ: Ворота расположены вокруг FITC и mCherry положительных клеток является Р2 ворот. Флуоресценция отрицательной клеточной популяции называется Р3 ворот. На рисунке 5 репрезентативного метода стробирования , используемой в данной статье. - Выберите P2 и P3 ворота и нажмите на иконку "Добавить Статистика" в исходном окне рабочего пространства. Нажмите на кнопку "Count" (количество положительных клеток) и нажмите на кнопку "Среднее" (средней интенсивности флуоресценции каждого флуорохромом) или "Медиана" (медиана интенсивности флуоресценции каждого флуорохромом) Статистика среди списка опций. Нажмите на иконку "Добавить Статистика" еще раз. Все эти значения автоматически передаются в исходное окно рабочего пространства.
Примечание: «среднее» используется только тогда, когда интенсивность флуоресценции следует нормальное распределение. В любом другом случае, нажмите на вкладку "Медиана". MFI, таким образом, может относиться к средняя флуоресценция Intensitу или медиана интенсивности флуоресценции.
Примечание: Следующий шаг должен применять параметры и статистику Врат "ко всем образцам зондировали с помощью цитометра. - В окне рабочей области, использовать мышь, чтобы перетащить параметры ворота и статистика на линии, помеченной всех образцов.
- Сформировать пакетный отчет двумерных контурных графиков (mCherry против FITC) и гистограмм (подсчет клеток в зависимости от интенсивности флуоресценции) для непермеабилизированных и проницаемыми клеток (Фигуры 6A - В).
- Из статистики, полученной на этапе 4.4.4, вычислить среднюю интенсивность флуоресценции (MFI) для каждого флуорохрома для окрашенных клеток. Из этого значения, вычесть значение MFI, полученную из клеток неокрашенных для количественной оценки поверхности и общую экспрессию интересующего белка.
- Отчет значения ΔMFI для каждого флуорофора (mCherry и FITC) (рис 6C - D). Нормализация ΔMFI измеренную для Ca V α2δ1 построить мутанты к значению ΔMFI , полученного для FITC и mCherry с WT конструкцией.
Примечание: Абсолютное значение интенсивности флуоресценции может резко изменяться в зависимости от партии антител и технических способностей каждого лаборантом, следовательно, необходимость нормализации интенсивности флуоресценции мутантного конструкции, используя конструкцию WT.
Результаты
В данной статье описывается надежный протокол для количественной оценки общей и клеточной поверхности рекомбинантных ионных каналов, выраженные в TSA-201cells потоком двухцветного цитометрии. В качестве примера, относительная клеточной поверхности и общее экспрессии бе...
Обсуждение
Этот поток анализа цитометрии на основе был успешно применен к измерению относительного общего и клеточной поверхности уровней флуоресцентно-меченного пороформирующий и связанного субъединиц напряжения закрытого кальциевых каналов 14,22,26. Это лучше всего использовать при иссл...
Раскрытие информации
The authors declare that they have no competing financial interests.
Благодарности
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the "Fondation de l'Institut de Cardiologie de Montréal" to L.P.
Материалы
| Name | Company | Catalog Number | Comments |
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1.5 ml | Sarstedt | 72-690-001 | |
| Tubes 15 ml | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100 mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35 mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25 ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37 °C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/ml) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37 °C water bath before use. |
| Trypsin-EDTA (1x) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 ml microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1x | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
Ссылки
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены