Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Akım Sitometri Kullanımı rekombinant İyon Kanallarının göreli Hücre Yüzey ve toplam İfade tayini
Bu Makalede
Özet
Kalıtsal kardiyak aritmiler genellikle bir veya daha fazla iyon kanallarının yüzey teslim değiştiren mutasyonlar neden olur. Burada, TSA-201 hücrelerinde eksprese edilen rekombinant iyon kanallarının göreli ve toplam hücre yüzeyi protein ekspresyonunun bir ölçümünü sağlamak için tahliller flow sitometri uyum sağlar.
Özet
Inherited or de novo mutations in cation-selective channels may lead to sudden cardiac death. Alteration in the plasma membrane trafficking of these multi-spanning transmembrane proteins, with or without change in channel gating, is often postulated to contribute significantly in this process. It has thus become critical to develop a method to quantify the change of the relative cell surface expression of cardiac ion channels on a large scale. Herein, a detailed protocol is provided to determine the relative total and cell surface expression of cardiac L-type calcium channels CaV1.2 and membrane-associated subunits in tsA-201 cells using two-color fluorescent cytometry assays. Compared with other microscopy-based or immunoblotting-based qualitative methods, flow cytometry experiments are fast, reproducible, and large-volume assays that deliver quantifiable end-points on large samples of live cells (ranging from 104 to 106 cells) with similar cellular characteristics in a single flow. Constructs were designed to constitutively express mCherry at the intracellular C-terminus (thus allowing a rapid assessment of the total protein expression) and express an extracellular-facing hemagglutinin (HA) epitope to estimate the cell surface expression of membrane proteins using an anti-HA fluorescence conjugated antibody. To avoid false negative, experiments were also conducted in permeabilized cells to confirm the accessibility and proper expression of the HA epitope. The detailed procedure provides: (1) design of tagged DNA (deoxyribonucleic acid) constructs, (2) lipid-mediated transfection of constructs in tsA-201 cells, (3) culture, harvest, and staining of non-permeabilized and permeabilized cells, and (4) acquisition and analysis of fluorescent signals. Additionally, the basic principles of flow cytometry are explained and the experimental design, including the choice of fluorophores, titration of the HA antibody and control experiments, is thoroughly discussed. This specific approach offers objective relative quantification of the total and cell surface expression of ion channels that can be extended to study ion pumps and plasma membrane transporters.
Giriş
Bu çalışma, mevcut akış sitometrisi teknolojisi kullanılarak rekombinant hücrelerde eksprese iyon kanalları gibi zar proteinlerinin nispi hücre yüzey ekspresyonunu bildirmek için güvenilir bir tahlil içerir. İyon kanalları, hücre zarından iyonların akışını yolluk elektrik sinyallerini kontrol etmek için sorumlu olan gözenek oluşturan zar proteinlerdir. Bu, aktivasyon mekanizması, doğa ve lokalize gözenek transit iyon türü seçicilik göre sınıflandırılır. Hücre ve doku düzeylerinde, iyon kanalları aracılığıyla makroskopik iyon akıları biyofiziksel (yolluk ve nüfuz), biyokimyasal (fosforilasyon), ve biyogenezine (sentez, glikosilasyon, insan ticareti ve bozulma) özelliklerinin 1 ürünüdür. Bu işlemlerin her biri, iyon kanallarının her tür için benzersiz olan ve iyon kanalının fizyolojik rolü yerine getirmek için optimize edilmiştir. Sonuç olarak, bir ile bu ince ayarlanmış işlemlerin herhangi değişikliklerkalıtsal ya da çoğu zaman "kanal bozukluğu" olarak ifade edilen bir genetik modifikasyon, hücre homeostazının için zararlı olabilir. Hücre yüzeyinde iyon kanallarının "doğru" miktarda teslim hücre homeostazında kritik olduğunu vurgulamak önemlidir. Hatta küçük artışlar (kazanç fonksiyon-) ve iyon kanal aktivitesinin küçük düşüşler (zarar fonksiyon-) bir ömür boyunca ciddi bir patoloji neden olma potansiyeli var. Olgun iyon kanallarının hücre yüzey teslim Kusur kistik fibrozis (CFTR iyon kanalı) 2 ve uzun QT sendromu şeklinde (kardiyak potasyum kanalları) 3 kardiyak aritmiler gibi birçok kanalopatiler, önemli bir belirleyicisidir.
Kanalopatiler kardiyak ani ölüm 4 ile ilişkilidir. 2,000-1: Bireysel 5 başına 3,000 ve ani aritmik kardiyak ölüm ca yaklaşık yarısından sorumlu olan tüm kardiyak kanalopatiler mevcut dünya çapında yaygınlık en az 1 olduğu düşünülmektedirses 6. Kalp voltaj bağımlı sodyum-, potasyum-disfonksiyon ve kalsiyum seçici iyon kanalları bu süreçte önemli bir rol oynadığı bilinmektedir. L-tipi Ca V 1.2 voltaj bağımlı kalsiyum kanal senkronize kalp kas kasılmasını başlatmak için gereklidir. Kalp L-tipi Ca V 1.2 kanallı yardımcı alt birimden 7-12 α2δ1 ana gözenek oluşturucu Ca V α1 alt birimi ve Ca Vss ve Ca V oluşan çoklu bir alt birim protein kompleksidir. Bu alt birimleri kalp 13 normal elektrik fonksiyonunu desteklemek için gerekli olan arasındaki yardımcı alt birimlerin tam tamamlayıcı plazma membranında fonksiyonel Ca V 1.2 kanal ve dinamik etkileşimleri üretmek için gerekli olduğunu unutmayın. Ca Vss Ca V hücre yüzey ifadesi bir kovalent olmayan nanomolar hidrofobik etkileşim 14 ile 1.2 kanal teşvik etmektedir. Ca V α2δ1 altbirim wi Eş-ifadesiinci Ca V ß-bağlı Ca V α1 pik akımı ifade (5 ila 10 kat) uyarır ve daha olumsuz gerilimlerde kanal aktivasyonunu teşvik etmektedir. Kazanç fonksiyon-Ca V 1.2 L-tipi Ca V 1.2 kanal oluşturan üç ana alt birimden nokta mutasyonları bir dizi ise uzun QT sendromu 15 olarak adlandırılan ventriküler aritmi bir form ile ilişkili olan gözenek oluşturucu alt biriminin mutasyonlar kısa QT sendromu formunda 16,17 aritmi muzdarip hastalarda tespit edilmiştir. İyon kanalları biyokimyasal bakış açısı (protein kimyası) incelenmiştir veya bu tamamlayıcı yaklaşımlar kullanılarak sık sık elektrofizyolojik araçları (akım üreten makineler) kullanılarak olabilir membran proteinlerdir. Elektrofizyoloji, özellikle bütün hücre patch-klemp olarak, iyon kanalları 15 işlevini aydınlatmak için uygun bir yaklaşımdır ama onların biyofizik değişiklikler protein kaçakçılığı değişiklik çözemezseözellikleri. Protein kimyası, ancak çoğu zaman daha küçük çözünür proteinler göre büyük zar proteinlerinin, nispeten düşük ekspresyonuna kullanımı sınırlıdır. floresan okuma kullanarak Sağlam yüksek verimli yöntemleri özellikle iyon kanallarının hücre yüzeyinde ifade değişikliklerini neden protein biyogenezine kusurları gidermek için geliştirilmesi gerekmektedir.
Flow sitometri, hücre sayımı, sıralama, biyomarkır tespiti ve protein mühendisliği 18 kullanılan bir biyofiziksel teknolojidir. Canlı hücreler ya da parçacıkların bir numunesi çözeltisi bir akış sitometresinde enjekte edildiğinde, hücreler makinenin tespit sistemi (Şekil 1) problanabilir tek bir akış halinde sıralanır. 1956 19 üretilen alet sitometresi ilk akış tek bir parametre tespit ama modern akış sitometrelerinde birden lazerler ve 30'dan fazla floresan parametrelerinin 20,21 algılanmasına izin floresan dedektörleri var.Filtreler ve aynalar (emisyon optik) şiddetine orantılı olarak ışık dönüştürmek bir elektronik ağ (fotodiyot ve dedektörler) hücrelerin ışık yayılımı veya floresan ışık yönlendirir. Dijital veri özel yazılım kullanılarak analiz edilmektedir ve birincil çıkış nokta arsa 21 olarak görüntülenir.
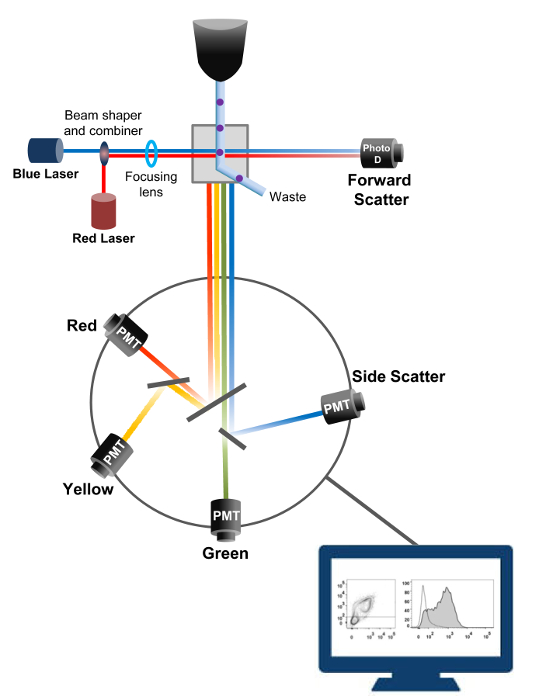
Şekil 1:. Akış biyofiziksel prensipleri sitometrisi sıralama tek hücre, bir veya daha fazla lazer sorgulama noktaları arasında taşır kılıf sıvısı akımı içinde yüksek basınç altında bir ağızlıktan itilir. ışık ışını geçirerek hücreleri tarafından saptırılır ve ileri doğrultuda (ileri dağılım, hem FCS) içinde toplanır ışık hücre büyüklüğü ile orantılı bir sinyal içine ışık dönüştüren bir fotodiyot gönderilir. Işık ayrıca lazer yolu 90 ° açıyla toplanmış ve dedektörler (de denir fotoçoğaltıcılar (PMT)) gönderilir.heyecan fluorochromes hücresinde mevcut ise, bu ışık hücreleri içinde ayrıntı gösterir yana saçılım sinyali (SSC) saptanmasına izin dikroik aynalar ve floresan emisyonu yoluyla yönlendirilir. Üç dedektörleri (Yeşil, Sarı ve Kırmızı) farklı fluorochromes eş zamanlı algılama sağlayan, farklı dalga boyu bant geçiren filtreler ile temsil edilmektedir. Farklı sinyaller harici bilgisayar tarafından sayısallaştırılmış ve hücrelerin özelliklerini ölçmek için analiz edilecektir veri dönüştürülür. Bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Akış sitometrelerinde yüksek verimlilik kapasitesi rekombinant yabani tip ve ticareti-eksik voltaj bağımlı L-tipi Ca V 1.2 kanalları ve canlı hücrelerde ilişkili alt birimleri göreli membran ifadesini ölçmek için istismar edilmiştir. cDNA co oluştururproteinler için Ding çift eş zamanlı olarak geçirgen olmayan bir floresan konjuge antikoru ve yapısal olarak floresan boylu bir intra-ile tespit edilebilir bir hücre dışı floresan olmayan epitopu taşıdığı etiketlendi. Her iki C-terminal sonra eklenen proteinin hücre dışı bir döngüde yerleştirilmiş hücre-dışı epitop, ve hücre içi flüorofor, protein ile çevrilir. Bu deney serisinde, Ca V α2δ1 proteini içsel hücre içi florofor gibi anti-HA ve mCherry konjüge edilmiş bir hücre dışı hemagglutinin (HA) epitop geçirimsiz FITC (floresein izotiyosiyanat) tarafından tespit edilen (YPYDVPDYA) ifade etmek için tasarlanmış edildi. MCherry-Ca-V α2δ1 HA-etiketli proteinin nispi hücre yüzey ifadesi seviyesini belirlemek için, füzyon proteinini eksprese eden rekombinant hücreler transfeksiyondan sonra hasat ve FITC ile konjüge edilmiş bir fare monoklonal anti-HA epitopu etiketi Antibod ile boyanmıştıry (Şekil 2). FITC Dolayısıyla biyolojik fonksiyonuna müdahale etmek için olası değildir enzim muhabir önemli ölçüde daha küçük olan ve bir organik flüoresan bileşiktir. TSA-201cells aşırı eksprese mCherry- Ca V α2δ1-HA, iki boyutlu araziler 22 FITC floresan ve MCherry floresanın belirgin bir 3-günlük bir artış sağlar. HA epitopunun proteinin hücre-dışı kısmına yerleştirilir olduğu göz önüne alındığında, FITC floresan yoğunluğu sağlam hücrelerin varlığında elde edilen HA-etiketli protein, hücre yüzeyi ekspresyonu göreli indeksi göstermektedir. yapıları HA epitopunun erişilebilirlik sistematik hücre permeabilization sonra FITC sinyali ölçerek doğrulanır. FITC için göreli floresan yoğunlukları göreceli floresan değerleri fo için niteliksel karşılaştırılabilir permeabilize hücrelerde tahmin beri bu önlem de normalize toplam protein ifadesini doğrulayacak hizmetr MCherry permeabilize ve non-permeabilize koşullar 22,23 altında ölçülür. Içsel floresans spektrumu permeabilization sonra daha yüksek değerlere doğru kaydırılır olduğunu ancak kontrol yapı ile karşılaştırıldığında olarak rapor ediliyor tek değer floresan değişiklik olduğuna dikkat etmek önemlidir. Test yapıları için floresan göreli değişiklikler her fluorofor (mCherry veya FITC) için ΔMean Floresan Yoğunluğu (ΔMFI) değerleri kullanılarak hesaplanmıştır. Deneyler florofor bağlı antikor iç floresan deneysel varyasyon sınırlamak için aynı şartlar altında ifade kontrol yapısı floresan yoğunluğunun test yapısı göreceli olarak floresans yoğunluğunu ölçmek için tasarlanmıştır. İki zarı proteinleri başarıyla bu testi kullanılarak incelenmiştir: L-tipi voltaj bağımlı kalsiyum kanal Ca V 1.2 14,22 ve farklı bir seride gözenek oluşturucu alt birimDeneyler, hücre dışı yardımcı Ca V α2δ1 alt birim 22,23. Aşağıdaki protokol 1.2 kanallı kontrol koşulları altında ve iyon kanalının sonrası modifikasyon etkileyen mutasyonların sonrasında kalp L-tipi Ca V Ca V α2δ1 alt biriminin hücre yüzey ekspresyonunu belirlemek için kullanılmıştır. Standart deney koşullarında, FITC floresan hücre yüzeyi MCherry-Ca-V α2δ1-HA proteinleri (referans 22, Şekil 5) için kodlama yapan cDNA ifadesi ile yarı-doğrusal artar.
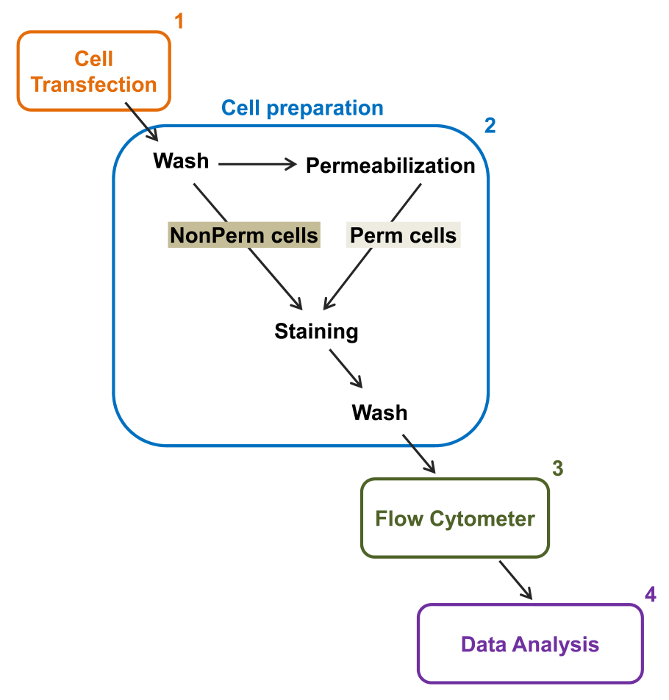
Şekil 2:. Deney protokolünde akım sitometri toplam ve membran etiketleme şematik gösterimi şeması gerekli ana adımlardan bazıları fl rekombinant iyon kanallarının göreli total ve hücre yüzey ifadesi ölçmek için özetliyorow sitometri. Hücreler (1) TSA-201 hücrelerinde çift etiketli yapım MCherry-Ca-V α2δ1-HA transfekte edilmiş ve önce veya geçirgenliği sonra boyanır (2). (3) çok değişkenli analiz için (4). Sitometresi multiparameter veri akımı elde edilir , bu rakamın büyük halini görmek için lütfen buraya tıklayınız.
Protokol
1. Çifte Etiketli DNA yapıları
- Mevkiye yönelik mutagenez (Şekil 3B) 20 ile D676 ve R677 ile Ca V α2δ1 hücre dışı bağlayıcısı HA epitopu (YPYDVPDYA) yerleştirin. İleri primer gccggattatgcgGGAAAACTCCAAACAACC kullanın ve astar acatcatacggataTCAATAAATTCATTGAAATTTAAAAGAAATTC Ters.
- SacI ve SalI siteleri (Şekil 3B) 20 arasında mCherry N-terminine kaynaştırılmış proteini ifade etmek için tasarlanan bir memeli pmCherry-N1 sentezleme vektörüne etiketli HA Ca V α2δ1 cDNA dizisi alt-klonlanmıştır.
NOT: Uygun kanal fonksiyonu standart elektrofizyolojik yöntemler 24 kullanılarak kontrol yapısı ile test edilmesi gerekmektedir.
2. lipozom aracılığıyla geçici Transfeksiyon (30 dk, Tüm Adımlar Laminar Flow Hood altında yapılmaktadır)
- 1. Gün: Plate TSA-201 hücreleri (veya HEKT) içinde yarım milyon2 ml Dulbecco, yüksek glukoz, minimum temel ortam,% 10 fetal sığır serumu (FBS) ve% 1 penisilin-streptomisin (PS), kültür ortamı ile desteklenmiş (DMEM-HG) 35 mm kültür tabakları. Standart bir hemasitometre kullanarak hücreleri saymak. Tripan mavisi kullanarak hücre örneği bir fraksiyondan hücre canlılığını değerlendirmek. Plaka yeterli hücre transfeksiyon anda% 90 izdiham ulaşmak için.
- Gün 2: PS olmayan, taze, önceden ısıtılmış (37 ° C), kültür ortamı 2 ml değiştirme kültür ortamı.
- Her transfeksiyon numune için, iki adet 1,5 ml'lik tüpler hazırlamak. tüp 1 'de, düşük serum ortamında 250 ul DNA 4 ug seyreltin. boru 2'de, 250 ul serum, indirgenmiş kültür ortamı ile lipozom aracılı transfeksiyon reaktifi 10 ul karıştırın. Kullanmadan önce hafifçe transfeksiyon reaktifi karıştırın.
- Oda sıcaklığında 5 dakika süreyle inkübe edilir.
- borunun 1 ve boru 2 birleştirin, hafifçe karıştırılır ve oda sıcaklığında en az 20 dakika inkübe edilir.
- lipozomlar ekle / DNBir kültür hücreleri kompleksleri ve hafifçe karıştırın kültür çanak sallayın.
- 24 saat boyunca CO2 atmosferinde% 5 altında 37 ° C'de inkübe edin.
Akış sitometrisi için 3. Hücrelerin boyanması (3 saat)
- Hücre Örnekleri hazırlanması
- 3. Gün: dikkatle kültür kabı orta çıkarın ve% 0.05 tripsin-EDTA ile 1x (etilendiamintetraasetik asit) (37 ° C) önceden ısıtılmış 400 ul hücreleri yıkayın.
- Tripsin-EDTA 400 ul ilave edin ve 5 dakika hücreleri çanak ayırmak için izin vermek için CO2 atmosferinde% 5 altında 37 ° C de çanak inkübe edin.
- PS olmadan soğuk kültür ortamı 1 ml ekleyerek enzim sindirimi durdurun ve yavaşça 4-5 kez pipetleme yüzeyinden tüm hücreleri yıkayın. hücre ölümünü azaltmak için sindirim ve aşırı-pipetle kaçının.
- 1.5 ml tüpler içinde hücreleri toplamak ve buz üzerinde hemen yerleştirin. buz soğuk çözümleri kullanmalarını ve içselleştirilmesi önlemek için 4 ° C'de hücreleri tutmakantijenlerini yüzey. floresan sinyal photobleaching sınırlamak için aydınlatma azaltın.
- 4 ° C'de 5 dakika boyunca 400 x g'de santrifüj tüpleri. Dikkatle aspire ve supernatant atın.
- Yeniden askıya fosfat tamponlu tuz 1x 1 ml pelet (PBS) tek bir hücre süspansiyonu hazırlanır.
- Kısaca çok yavaşça vorteks tüpleri ve tekrar tamamen kültür ortamı kaldırmak için 3.1.5 ve 3.1.6 adımları.
- 1x PBS 600 ul pelet yeniden askıya 3 x 10 6 hücre / mL, en az hücre konsantrasyonunu ayarlamak.
- hücre dışı ve hücre içi boyama için iki yeni 1.5 ml tüpler hücreleri bölün. non-spesifik boyanması belirli boyama ayırt etmek uygun kontrolleri içerir.
NOT: izotip kontrol antikoru arka plan boyama düzeyini değerlendirmek yardımcı olur ve ideal olarak her birincil antikorun konak türleri, izotipini ve fluorofor eşleşmesi gerekir. Aynı de izotip kontrol ve konjüge olmamış antikor kullanarakProtein konsantrasyonu.

Tablo 1: akış sitometri deney kontrol numuneleri hücreleri olmayan geçirgenleştirildi ve geçirgen Her deney şu negatif kontroller içermesi gerekir. (Izo veya konjüge edilmiş antikor ile, antikor olmayan) (1) transfekte edilmemiş hücrelerin. (2) yapısal flüoresan hücre içine florokrom olmayan bir plazmide alt-klonlanmıştır ilgi protein ile transfekte edilmiş hücrelerin (pCMV- Ca V α2δ1-HA) ya da çift isim levhası yapı (pmCherry-Ca-V α2δ1 ve izotip ile ya da, antikor olmayan inkübe eşlenik haline gelen antikor). Tek renk kontrolleri florokrom emisyon örtüşme tazminat kullanılmaktadır. Aynı kontroller olmayan permeabilize aday ve deneyler her dizi koşulları permeabilize.
- Bozulmamış Hücre Yüzey BoyamaCanlı Hücreler
- Kısım 1.5 ml tüpler içinde 1 x 10 6 hücre / 100 ul.
- 5 ug FITC-konjuge monoklonal anti-HA antikor ekleyin / ml, 45 dakika boyunca 4 ° C'de karanlıkta ve bir rocker platformunda (200 rpm) üzerinde hücrelerin inkübe edildi vorteks.
Not: antikorun optimum konsantrasyon ön titrasyon deneylerinde saptanmıştır (Şekil 4). - Karanlık hücreleri çıkarmak ve 1x PBS / tüp 900 ul ekleyin. 4 ° C'de 5 dakika boyunca 400 x g'de santrifüjleyin.
- Süpernatant aspire edildi ve 4 ° C'de 5 dakika boyunca 400 x g'de 1 x PBS, girdap ve santrifüj 1 ml pelletini.
- Herhangi bir bağlanmamış antikorların çıkarılması için iki kez yıkama (aşama 3.2.4) tekrarlayın. Bir konjüge edilmemiş birincil antikor kullanılır, uygun ikincil antikor ile inkübe edin.
- Son yıkamadan sonra, 1 x 500 ul PBS içinde tekrar süspansiyon hücreleri ve sitometrisi tüpleri Akış 5 ml tek bir hücre süspansiyonu aktarın. hücreyi tutmakörnek çalışan kadar 4 ° C'de karanlıkta s.
- Bir Akış sitometresindeki örnekleri çalıştırın. En iyi sonuç için, en kısa sürede ve en geç 24 saat sonra daha akış sitometresinde hücreleri analiz.
- Hücre içi Boyama: Fiksasyon, Permeabilization ve Boyama
- Kısım 4 ° C'de 5 dakika boyunca 400 x g'de 1 x 10 6 hücre / 100 1.5 ml tüpler içinde ul ve santrifüjlenir.
- stoktan doğrudan sabitleme permeabilization solüsyonu 100 ul supernatant ve tekrar süspansiyon hücreleri atın.
- 20 dakika boyunca 4 ° C'de karanlıkta inkübe edin.
- Taze hazırlanmış 1x permeabilization yıkama tamponu 100 ul (damıtılmış H 2 O 10x Permeabilization yıkama tamponu sulandırmak) ekleyin. 4 ° C'de 5 dakika boyunca 400 x g'de tablo santrifüj kullanılarak vorteks, tortu hücreleri.
- Aspire ve supernatant atın.
- Tekrarlayın 3.3.4 ve 3.3.5 adımları.
- 5 ° C'de, FITC-konjuge monoklonal anti-HA antikor ekleyinug / ml, 100 1x permeabilizasyon yıkama tamponu ul ve 30 dakika boyunca 4 ° C'de karanlıkta inkübe önce girdap içinde.
Not: hücre içi boyama hücre yüzeyi boyama için kullanılan aynı prosedür izlenerek gerçekleştirilir. Saponin-aracılı hücre permeabilization nedenle hücre içi boyama sırasında saponin sürekli huzurunda hücreleri korumak için 1x Perm / Yıkama tamponu ile 1x PBS yerine önemlidir, ancak bir hızla geri dönüşümlü bir süreçtir. - Karanlık hücreleri çıkarın ve 100 ul permeabilization yıkama tampon ekleyin. 4 ° C'de 5 dakika boyunca 400 x g'de santrifüjleyin.
- Aspire dikkatle süpernatan ve 4 ° C'de 5 dakika boyunca 400 x g'de 100 ul permeabilizasyon yıkama tamponu girdap ve santrifüj pelletini.
- Herhangi bir bağlanmamış antikorların çıkarılması için yıkama (aşama 3.3.9) bir kez daha tekrarlayın.
- Son yıkamadan sonra, 1 x 500 ul PBS içinde tekrar süspansiyon hücreleri ve sin aktarmaktüpler sitometri 5 mL akış metini hücre süspansiyonu. akış sitometresi içine örnek enjekte kadar 4 ° C'de karanlıkta tutun hücreleri.
- Bir Akış sitometresindeki örnekleri çalıştırın. en kısa sürede, ancak en geç 1 haftadan daha fazla boyama sonrası sitometresinde sabit örneklerini yürüt. aynı gün olmayan permeabilize ve permeabilize hücreleri çalıştırın.
4. Akım Sitometri
- Hücre Sıralayıcısı Günlük Kur Cytometer Akış
- Akış sitometri yazılımı açın. Optimum enstrüman performansı sağlamak için, deneme hücre sıralayıcı sitometresi akış kalibre ve kurulum öncesi enstrüman kurulum boncuklar kullanılarak (hücre yani lazer ve optik şartnameye performans, lazer ve akış düzgün hizalanmış).
- 20 psi kılıf basıncı ile 100 mikron memesi kullanın.
NOT: meme yok akış sitometresi bir bankta değiştirilecek. - üretici uygun sitometresinin akış hızını ayarlamaer özellikleri. Son derece yüksek akış hızları floresanstaki değişimler saptanmasında hassasiyeti azalacaktır.
- ve sarı-yeşil lazerler (mCherry heyecanlandırmak için 561 nm) (Flöresein Isothiocayanate veya FITC heyecanlandırmak için 488 nm) mavi seçin. Bir 530/30 nm ve sırasıyla bir 610/20 nm bant-geçiş filtresi ile FITC ve MCherry floresan seviyeleri toplayın.
- doğrusal ölçeği kullanılarak lekesiz hücreler için yan dağılım (SSC) nokta arsa karşı ileri dağılım (FCS) kazanır. nokta arsa sol alt kadranda hücreleri görselleştirmek için her bir dedektörün amplifikasyon ayarlayın.
- Bozulmamış Olmayan geçirgen Hücreleri Örnek Okuma
- Hücreler bu şekilde sağlam hücreler floresan sinyali sınırlandırarak, hücre artıkları ve hücre agregatları hariç analiz etrafında serbest formu belirleyen canlı olmayan permeabilize hücrelerin P1gate ayarlayın.
Not: ölü / canlı dışlama boyalar, canlı hücreler üzerinde geçit yerleştirilmesini kolaylaştırmak için kullanılabilir. kaydetmek için 10.000 olayları ayarlayındurma kapı P1. eğer gerekirse olayların daha yüksek bir sayıya bu ayarlayın. - Lekesiz hücrelerinin bazal otofloresans tespit etmek için FITC iki parametre kontur arsa karşı mCherry kazanır. Negatif değerleri göstermek ve nüfus 25 arasındaki çözünürlüğü artırmak için iki logaritmik ölçek kullanın. Günlük floresan yoğunluğu araziler ilk on birimlerinin alt kısmı içinde lekesiz negatif hücreler ayarlamak için her bir dedektörün gerilimini ayarlamak.
- 4.1.5 ve 4.1.6 kurulan ayarları kullanarak tüm bozulmamış olmayan geçirgen örnekleri Edinme ve floresan dedektörleri FSC, SSC ve sinyalleri toplamak.
- İhracat ve * kaydetmek .fcs dosyaları analiz yazılımı flow sitometri kullanılarak analiz için kullanılacak.
- Hücreler bu şekilde sağlam hücreler floresan sinyali sınırlandırarak, hücre artıkları ve hücre agregatları hariç analiz etrafında serbest formu belirleyen canlı olmayan permeabilize hücrelerin P1gate ayarlayın.
- Geçirgen hücrelerin örnek Okuma
- permeabilize örneklerde canlı hücreleri seçmek ve 4.1.5 ve 4.1.6 de gösterildiği gibi FSC ve SSC voltajını ayarlamak için P1 kapısı taşıyın.
- tüm permeabilize örnekleri Edinme ve FSC, SSC a toplamakfloresan dedektörleri nd sinyaller.
- İhracat ve * kaydetmek .fcs dosyaları analiz yazılımı flow sitometri kullanılarak analiz için kullanılacak.
- Veri analizi
- 4.2.4 ve 4.3.3 kaydedilen analiz yazılımı ve ithalat * .fcs dosyaları flow sitometri başlatın.
- Çalışma alanı penceresinde listelenen ilk örnek üzerinde tıklayın. Tüp kimlik numarasına göre adlandırılmış yeni bir pencere otomatik olarak açılır. FSC karşı SSC arsa içinde yolluk işlemini başlatın. canlı hücreler farklı forward scatter ve yan dağılım var herhangi bir enkaz, ölü hücreleri veya agrega bir kapı (P1) canlı hücreler etrafında Elips simgesini kullanarak çizin ve ortadan
- FITC (x-ekseni) canlı hücrelerin floresans şiddeti ile mCherry (y-ekseni), iki-parametre dış hat planını çizmek için, x-ekseni ilk tıklayarak FITC bir kanal belirledikten sonra y tıklayarak -Axis ve PE-mCherry-A kanalı seçin. Bir kenarında kadranda işaretleyici konumlandırmak için "Quad" ikonuna tıklayınHer florasan kanalına utofluorescent hücreleri.
NOT: FITC ve mCherry pozitif hücrelerin etrafında ayarlamak kapı P2 kapısıdır. Floresan negatif hücre popülasyonu P3 kapı olarak adlandırılır. Bu makalede kullanılan temsili yolluk yöntemi için Şekil 5'e bakınız. - P2 ve P3 kapıları seçin ve orijinal çalışma alanı penceresinde "Add İstatistik" ikonuna tıklayın. "Kont" (pozitif hücre sayısı) tıklayın ve "Mean" (her florokrom Ortalama Floresan Yoğunluğu) ya da "Medyan" (her florokrom Medyan Floresan Yoğunluğu) seçenekler listesi arasında istatistik tıklayın. Yine "Add İstatistik" ikonuna tıklayın. Bütün bu değerler otomatik olarak orijinal çalışma penceresine aktarılır.
NOT: floresan yoğunluğu normal dağılıma takip yalnızca kullanılan "Mean". her durumda, "Medyan" sekmesine tıklayın. MFI böylece Floresan Intensit ortalama atıfta olabiliry ya da Medyan Floresan Yoğunluğu.
NOT: Bir sonraki adım Sitometre tarafından tanınacak tüm örneklerde Gates'in parametrelerini ve istatistik uygulamaktır. - çalışma penceresinde, sürükle ve çizgi TÜM ÖRNEKLERİ işaretli üzerine kapıları ve istatistik parametreleri bırakmak için fareyi kullanın.
- Olmayan permeabilize ve geçirgen hücreleri (- B Şekil 6A) için iki boyutlu kontur (FITC vs mCherry) araziler ve histogramlar (hücre floresan yoğunluğu karşı saymak) bir toplu rapor oluşturun.
- Adım 4.4.4 oluşturulan istatistiklerinden, lekeli hücrelerin her florokrom için ortalama floresan yoğunluğu (MFI) hesaplayın. Bu değerden, yüzey ve ilgilenilen proteinin toplam ekspresyonunu ölçmek için boyanmamış hücrelerinden elde edilen MFI değeri çıkarılır.
- Her fluorofor (mCherry ve FITC) (- D Şekil 6C) için ΔMFI değerlerini bildirin. Ca ölçülen ΔMFI normalize V WT yapısı ile FITC ve mCherry elde ΔMFI değerine mutantları oluşturmak α2δ1.
NOT: floresan yoğunluğu mutlak değeri dolayısıyla, antikorlar ve her laboratuar işçinin teknik yetenekleri toplu bağlı keskin WT yapısı kullanılarak mutant yapının floresan yoğunluğu normalleştirmek için gereğini değişebilir.
Sonuçlar
Bu makalede, tahlilinde sitometri iki renkli akımı ile TSA-201cells olarak eksprese edilen rekombinant iyon kanallarının toplam hücre yüzeyi ölçmek için güvenilir bir protokol açıklamaktadır. Bir örnek olarak, görece hücre yüzeyi ve total protein sentezleme Ca V α2δ1subunit için ölçülmüştür. Tahlilinde sitometri iki renkli akış gerçekleştirmek için, Ca V α2δ1 iki kat, bir anti-HA FITC ile konjüge edilmiş antikor ve bir kurucu flüo...
Tartışmalar
Bu akış sitometri tabanlı deney başarılı Voltaj geçitli kalsiyum kanalları 14,22,26 gözenek oluşturucu etiketli-flüoresan ve ilgili alt birimlerin göre toplam ve hücre yüzeyi seviyelerinin ölçümü uygulanmıştır. Genetik değişimin etkisini araştıran en iyi şekilde kullanılır ve böylece etiketli-floresan etiketli doğal tipte yapının iç floresan yoğunluğu floresan etiketli etiketlenmemiş yapının floresan yoğunluğu daha büyük 100 kat, en az 10 olması gerekir olduğu . Bu ...
Açıklamalar
The authors declare that they have no competing financial interests.
Teşekkürler
We thank Mr. Serge Sénéchal and Dr. Jacques Thibodeau for sharing their expertise and granting us access to their flow cytometry and cell sorting platform. This work was completed with the operating grant 130256 from the Canadian Institutes of Health Research, a grant-in-aid from the Canadian Heart and Stroke Foundation, and support from the "Fondation de l'Institut de Cardiologie de Montréal" to L.P.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Q5 Site-Directed Mutagenesis Kit | New England Biolabs | E0554S | Can be substitute with QuickChange site-directed mutagenesis Kit (Agilent, #200523). |
| Tubes 1.5 ml | Sarstedt | 72-690-001 | |
| Tubes 15 ml | Sarstedt | 62-554-002 | |
| Disposable graduated Tranfer Pipets | VWR | 160001-192 | |
| 100 mm culture dish | Corning | 430167 | For standard culture of HEKT cells. |
| 35 mm culture dish | Falcon | 353001 | For standard culture of HEKT cells. |
| Serological pipette 1 ml | Sarstedt | 86.1251.001 | |
| Serological pipette 5 ml | Sarstedt | 86.1253.001 | |
| Serological pipette 10 ml | Sarstedt | 86.1254.001 | |
| Serological pipette 25 ml | Sarstedt | 86.1285.001 | |
| Dulbecco's high-glucose medium | Life Technologies | 12100-046 | Warm in 37 °C water bath before use. |
| Fetal Bovine Serum, qualified, heat inactivated, US origin | Life Technologies | 16140-071 | |
| Penicillin-Streptomycin (10,000 U/ml) | Life Technologies | 15140-122 | |
| Lipofectamine 2000 | Life Technologies | 11668-019 | For liposomal transfection. Can be substituted with calcium phosphate transfection. |
| Opti-MEM I Reduced Serum Medium | Life Technologies | 31985-070 | Warm in 37 °C water bath before use. |
| Trypsin-EDTA (1x) 0.05%, phenol red | Life Technologies | 25300-062 | |
| 1.5 ml microtubes | Sarstedt | 72.690.001 | |
| Phosphate Buffered Saline 1x | Fisher | BP661-10 | Can be "home-made". |
| Anti-HA FITC conjugated antibody | Sigma | H7411 | |
| IgG1−FITC Isotype Control antibody | Sigma | F6397 | |
| BD Cytofix/Cytoperm Fixation/Permeabilization Solution Kit | BD Biosciences | 554714 | Fixation/Permeabilization. Permeabilization/Wash solution, store at 4 °C. |
| Hemacytometer | Fisher | 49105161 | |
| Trypan Blue | Fisher | 15250061 | To access cell viability. |
| Refrigerated Microcentrifuge, 5430R | Eppendorf | A14H172200 | |
| Forma Steri-Cycle CO2 Incubator | Fisher | 370 | |
| Laboratory Platform Rocker | Fisher | 545034 | |
| Water Bath | VWR | 89032-216 | |
| BD FACSARIA III | BD Biosciences | 648282 | Flow cytometer. |
| FlowJo Software v10 | FlowJo | FlowJo v10 Dongle | For data analysis. |
Referanslar
- Delisle, B. P., Anson, B. D., Rajamani, S., January, C. T. Biology of Cardiac Arrhythmias: Ion Channel Protein Trafficking. Circ. Res. 94, 1418-1428 (2004).
- Birault, V., Solari, R., Hanrahan, J., Thomas, D. Y. Correctors of the basic trafficking defect of the mutant F508del-CFTR that causes cystic fibrosis. Curr Opin Chem Biol. 17, 353-360 (2013).
- Balijepalli, S. Y., Anderson, C. L., Lin, E. C., January, C. T. Rescue of Mutated Cardiac Ion Channels in Inherited Arrhythmia Syndromes. J. Cardiovas Pharm. 56, 113-122 (2010).
- Gargus, J. J. Unraveling Monogenic Channelopathies and Their Implications for Complex Polygenic Disease. Am. J. Hum. Genet. 72, 785-803 (2003).
- Abriel, H., Zaklyazminskaya, E. V. Cardiac channelopathies: Genetic and molecular mechanisms. Gene. 517, 1-11 (2013).
- Behr, E. R., et al. Sudden arrhythmic death syndrome: familial evaluation identifies inheritable heart disease in the majority of families. Eur Heart J. 29, 1670-1680 (2008).
- Catterall, W. A. Structure and regulation of voltage-gated Ca2+ channels. Annu. Rev. Cell Dev.Biol. 16, 521-555 (2000).
- Peterson, B. Z., DeMaria, C. D., Adelman, J. P., Yue, D. T. Calmodulin is the Ca2+ sensor for Ca2+ -dependent inactivation of L- type calcium channels. Neuron. 22, 549-558 (1999).
- Dolphin, A. C. Calcium channel diversity: multiple roles of calcium channel subunits. Curr.Opin.Neurobiol. 19, 237-244 (2009).
- Dai, S., Hall, D. D., Hell, J. W. Supramolecular assemblies and localized regulation of voltage-gated ion channels. Physiol Rev. 89, 411-452 (2009).
- Gao, T., et al. Identification and subcellular localization of the subunits of L-type calcium channels and adenylyl cyclase in cardiac myocytes. J. Biol. Chem. 272, 19401-19407 (1997).
- Carl, S. L., et al. Immunolocalization of sarcolemmal dihydropyridine receptor and sarcoplasmic reticular triadin and ryanodine receptor in rabbit ventricle and atrium. J. Cell Biol. 129, 673-682 (1995).
- Abriel, H., Rougier, J. S., Jalife, J. Ion Channel Macromolecular Complexes in Cardiomyocytes: Roles in Sudden Cardiac Death. Circ. Res. 116, 1971-1988 (2015).
- Bourdin, B., et al. Molecular Determinants of the Cavb-induced Plasma Membrane Targeting of the Cav1.2 Channel. J. Biol. Chem. 285, 22853-22863 (2010).
- Raybaud, A., et al. The Role of the GX9GX3G Motif in the Gating of High Voltage-activated Calcium Channels. J. Biol. Chem. 281, 39424-39436 (2006).
- Burashnikov, E., et al. Mutations in the cardiac L-type calcium channel associated with inherited J-wave syndromes and sudden cardiac death. Heart Rhythm. 7, 1872-1882 (2010).
- Hennessey, J. A., et al. A CACNA1C Variant Associated with Reduced Voltage-Dependent Inactivation, Increased Cav1.2 Channel Window Current, and Arrhythmogenesis. PLoS ONE. 9, e106982 (2014).
- Adan, A., Alizada, G., Kiraz, Y., Baran, Y., Nalbant, A. Flow cytometry: basic principles and applications. Crit Rev Biotechnol. , 1-14 (2016).
- Graham, M. D. The Coulter Principle: Foundation of an Industry. J. Lab. Autom. 8, 72-81 (2003).
- Baumgarth, N., Roederer, M. A practical approach to multicolor flow cytometry for immunophenotyping. J. Immunol. Methods. 243, 77-97 (2000).
- Rothe, G., Sack, U., Tarnok, A., Rothe, G. . Cellular Diagnostics. Basics, Methods and Clinical Applications of Flow Cytometry. , 53-88 (2009).
- Bourdin, B., et al. Functional Characterization of Cavalpha2delta Mutations Associated with Sudden Cardiac Death. J. Biol. Chem. 290, 2854-2869 (2015).
- Tetreault, M. P., et al. Identification of glycosylation sites essential for surface expression of the Cavalpha2delta1 subunit and modulation of the cardiac Cav1.2 channel activity. J. Biol. Chem. 291, 4826-4843 (2016).
- Senatore, A., Boone, A. N., Spafford, J. D. Optimized Transfection Strategy for Expression and Electrophysiological Recording of Recombinant Voltage-Gated Ion Channels in HEK-293T Cells. J Vis Exp. (47), (2011).
- Herzenberg, L. A., Tung, J., Moore, W. A., Herzenberg, L. A., Parks, D. R. Interpreting flow cytometry data: a guide for the perplexed. Nat.Immunol. 7, 681-685 (2006).
- Shakeri, B., Bourdin, B., Demers-Giroux, P. O., Sauve, R., Parent, L. A quartet of Leucine residues in the Guanylate Kinase domain of Cavbeta determines the plasma membrane density of the Cav2.3 channel. J Biol Chem. 287, 32835-32847 (2012).
- Morton, R. A., Baptista-Hon, D. T., Hales, T. G., Lovinger, D. M. Agonist- and antagonist-induced up-regulation of surface 5-HT3A receptors. Br. J. Pharmacol. 172, 4066-4077 (2015).
- Hoffmann, C., et al. Fluorescent labeling of tetracysteine-tagged proteins in intact cells. Nat. Protocols. 5, 1666-1677 (2010).
- Cockcroft, C. J., Gamper, N. . Ion Channels: Methods and Protocols. , 233-241 (2013).
- Gonzalez-Gutierrez, G., Miranda-Laferte, E., Neely, A., Hidalgo, P. The Src Homology 3 Domain of the beta-Subunit of Voltage-gated Calcium Channels Promotes Endocytosis via Dynamin Interaction. J. Biol.Chem. 282, 2156-2162 (2007).
- Galizzi, J. P., Borsotto, M., Barhanin, J., Fosset, M., Lazdunski, M. Characterization and photoaffinity labeling of receptor sites for the Calcium channel inhibitors d-cis-diltiazem, (+/-)-bepridil, desmethoxyverapamil, and (+)-PN 200-110 in skeletal muscle transverse tubule membranes. J. Biol.Chem. 261, 1393-1397 (1986).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiol.Rev. 80, 555-592 (2000).
- Sigworth, F. J. The variance of sodium current fluctuations at the node of Ranvier. J Physiol. 307, 97-129 (1980).
- Bailey, M. A., Grabe, M., Devor, D. C. Characterization of the PCMBS-dependent modification of KCa3.1 channel gating. J. Gen. Physiol. 136, 367-387 (2010).
- Fletcher, P. A., Scriven, D. R., Schulson, M. N., Moore, E. D. Multi-Image Colocalization and Its Statistical Significance. Biophys. J. 99, 1996-2005 (2010).
- Lizotte, E., Tremblay, A., Allen, B. G., Fiset, C. Isolation and characterization of subcellular protein fractions from mouse heart. Anal. Biochem. 345, 47-54 (2005).
- Mattheyses, A. L., Simon, S. M., Rappoport, J. Z. Imaging with total internal reflection fluorescence microscopy for the cell biologist. J. Cell Sci. 123, 3621-3628 (2010).
- Yamamura, H., Suzuki, Y., Imaizumi, Y. New light on ion channel imaging by total internal reflection fluorescence (TIRF) microscopy. J. Pharmacol. Sci. 128, 1-7 (2015).
- Wible, B. A., et al. HERG-Lite-R: A novel comprehensive high-throughput screen for drug-induced hERG risk. J. Pharmacol. Toxicol. Methods. 52, 136-145 (2005).
- Wilde, A. A. M., Brugada, R. Phenotypical Manifestations of Mutations in the Genes Encoding Subunits of the Cardiac Sodium Channel. Circ. Res. 108, 884-887 (2011).
- Milano, A., et al. Sudden Cardiac Arrest and Rare Genetic Variants in the Community. Circ Cardiovasc Genet. , (2016).
- Schnell, U., Dijk, F., Sjollema, K. A., Giepmans, B. N. G. Immunolabeling artifacts and the need for live-cell imaging. Nat. Meth. 9, 152-158 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır