需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
3D全心脏心肌组织分析
摘要
这个协议描述了用于与MRI全心脏心肌组织的3D比较的新方法。这是专为心肌内注射的心肌梗死的慢性猪模型的梗死边缘区的准确评估。
摘要
心脏再生疗法的目的是保护和治疗缺血性心脏疾病修复受伤的心脏。通过注入的干细胞或增强血管造影或血管入梗死边缘区(IBZ)其他生物,组织灌注得到改善,并且心肌可以免受进一步损伤的保护。为了获得最大的治疗效果,这是假设,再生剂最好交付给IBZ。这需要精确的注射,并导致新的注射技术的发展。为了验证这些新的技术,我们已经基于心肌组织分析设计验证协议。这个协议包括全心脏心肌组织处理,使详细的二维(2D)和心脏解剖和心肌内注射的三维(3D)分析。在猪,心肌梗死是由左前降冠状动脉的90分钟闭塞创建。 4周后,一个mixt超顺磁性氧化铁颗粒(SPIOs)和荧光珠的水凝胶的URE用微创心内膜的方法在IBZ注入。在注射过程后1个小时,猪安乐死,和心脏切下并包埋在琼脂糖(琼脂)。琼脂凝固后,进行磁共振成像(MRI),心脏的切片,和荧光成像。图像后处理后,进行三维分析,以评估IBZ定位精度。这个协议提供了心肌内注射的靶向精度进IBZ的评估结构化和可再现的方法。该协议可以期望瘢痕组织和/或整个心脏的喷射精度的验证的处理时,可以容易地使用。
引言
缺血性心脏疾病一直是世界领先的死亡原因为过去几十年中1。心肌梗死后急性治疗的目的是通过经皮冠状动脉介入或冠状动脉旁路移植术恢复血流到心肌。在严重的脑梗塞,心肌大面积是伤痕累累,而这些情况往往导致缺血性心脏衰竭(HF)2。为HF注重预防和心脏功能的保存对于心衰患者目前的治疗方案,但不是再生。
在过去的十年中,心脏再生疗法已被研究作为HF 3的一种治疗选择。此治疗的目的是提供生物制剂,例如干细胞或生长因子,直接将损伤心肌,以诱导血管再生,心肌保护,分化和生长4。为了获得最佳的治疗效果,据推测,生物必须在梗死边缘区(IBZ)被喷射到促进良好的组织灌注的生物的生存和用于向所述目标区5,6最佳的效果。多种技术已被开发来执行IBZ的识别和可视化,以引导心肌内注射7,8,9,10,11。除了IBZ的识别和可视化,所述输送也依赖于所使用的生物材料和注射导管。为了验证的递送技术的喷射精度,需要精确的和可重现的定量方法。
我们已经开发了能够提供二维(2D)的全心脏心肌组织处理和三dimensio协议纳尔(3D)成像,其可用于定性和定量研究的目的。该协议覆盖的嵌入过程和数字图像分析。在本文中,我们证明了在心肌内IBZ注射的定位的准确性慢性心肌梗死的大猪模型评估的协议。
研究方案
体内实验按照指南的护理和使用的实验动物研究所的准备实验动物进行。实验批准由当地动物实验委员会。
1.可注射的和嵌入溶液的制备
- 准备注射的凝胶。
- 按照制备1毫升脲基-嘧啶酮(UPy)凝胶的到先前描述的方案12,13。
- 添加超顺磁性氧化铁颗粒(SPIOs)到该溶液中以获得15微克/ mL的浓度,并搅拌5分钟,使均匀分布的混合物。
- 荧光微珠添加到溶液中以获得万个珠/ mL的浓度,并搅拌5分钟,使均匀分布的混合物。
- 存储在黑暗环境中在室温下将得到的混合物。温暖和涡流或搅拌吨他在注射过程前不久的解决方案。
- 准备嵌入解决方案。
- 用自来水开始在室温下,加入琼脂糖(琼脂)4重量%的浓度。
- 慢慢升温到溶液使用微波炉的沸点和在加热期间频繁搅拌。在到达沸点,存储和保持在70℃以上的琼脂溶液2小时,以允许截留的空气至地面。
- 允许琼脂在室温下50和60℃之间冷却到温度直到嵌入的时间。
2.注射过程
- 术前用药执行(抗心律失常剂,抗血小板疗法,和止痛药),麻醉,静脉通路,和插管,如前所述14。
- 执行使用心肌内注射导管( 材料的表 )注射。每次注射,0。2毫升混合物,在一个剂量的在使用注射装置的约0.3毫升/分钟的恒定速率注入。将注射沿着IBZ 12不同的位置。
- 管理的基于钆的造影剂15分钟0.2毫升/公斤(1.0毫摩尔/毫升)实施安乐死动物之前。
- 辖20毫升的7.5%氯化钾静脉内安乐死动物。
- 以下协议安全纵隔访问步骤8.2 - 8.3,如由Koudstaal 等人描述。 14。从右心房切开下腔静脉5厘米,除去流出的血液与抽吸装置。切除心脏,并在室温下0.9%的生理盐水冲洗。
3.嵌入程序
- 准备心脏。
- 同时保持心房和心室完好无损从心脏中取出心包。解剖升主动脉使用克林肯伯格主动脉瓣以上±1厘米剪刀。切下腔静脉±1厘米的心房,以及用于肺静脉这样做。
- 缝合心脏的心尖到塑料容器嵌入(17×15×15厘米,宽x宽x高),使用2-0缝合线,以防止嵌入期间心脏的漂浮( 图1A)的底部。
- 缝合主动脉使用2-0容器的边缘的剩余部分,在确认心脏居中和不接触容器( 图1B)的壁上。
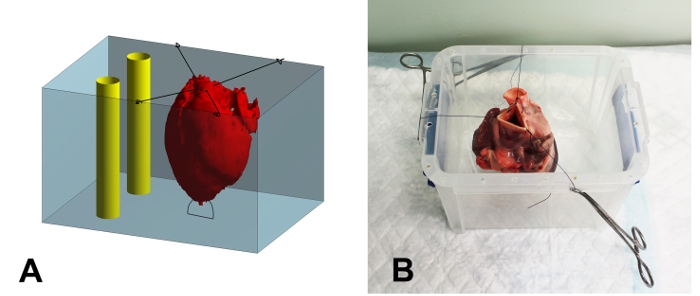
图1:原理概述和嵌入集装箱的照片。 (A)的嵌入处理的示意性概述。心脏(红色)是用缝线固定在容器(蓝色)。与琼脂液填充心脏后,心脏周围的空间被填满。最后,两个刚性塑料管(黄色)被定位在容器中,毗邻但不接触心脏,以用作图像注册过程中的参考。固定在嵌入容器心脏的(B)的照片。缝合线被夹紧到使用蚊夹具的容器的边缘。 请点击此处查看该图的放大版本。
- 在舒张末期般的几何形状嵌入心脏。
注:气泡形成的预防是必要的。如果大气泡存在于琼脂溶液,保持琼脂在40℃下,使气泡的表面。- 夹紧下腔静脉用蚊子夹。慢慢使用在右心房的50mL注射器经由上腔静脉,直到两个右心房和心室被完全填充注入液体琼脂上。
- 使用钳的mosquit肺静脉Ø夹。轻轻通过主动脉逆行阀传递的琼脂填充50毫升的注射器中。缓缓注入左心室(LV),直到LV和左心房被完全填充的溶液中。填充LV后,夹住主动脉保持琼脂在LV。
- 倒入剩余的琼脂倒入容器,直至心脏被完全覆盖。放置嵌入容器内的两个刚性的塑料管,以作为稍后的图像配准( 图1A)的参考结构。确保管不接触容器或心脏壁。
- 让琼脂固化在2 - 7℃。
4.图像采集
- 执行嵌入在容器中的心脏的横向体外 MRI扫描。
- 放置在容器与头部线圈内部的嵌入式心脏( 材料的表 )。
- 棱平行于容器底部的切片。使用相同的取向和角度中的每个体外 MRI序列。
- 为了显现心肌,执行液体衰减反转恢复(FLAIR)序列使用以下参数:重复时间[TR] /回波时间[TE] = 10秒/ 140毫秒,翻转角= 90°,像素尺寸= 0.5×0.5毫米,视[FOV] = 169 X 169毫米字段,320×320矩阵,和3毫米切片厚度。
- 为了显现心肌梗塞,执行后期钆增强(LGE)序列使用以下参数:[TR] / [TE] = 5.53毫秒/ 1.69毫秒,翻转角= 25°,像素尺寸= 1.0×1.0毫米,[ FOV] = 169 X 169毫米,176×176矩阵,和3毫米切片厚度。
- 为了显现SPIOs,执行T2 *加权梯度回波序列使用以下参数:[TR] / [TE] = 88.7毫秒/ 15的范围内的1.9等距分布的TE - 24.6毫秒,翻转角= 15°,像素尺寸= 0.5×0.5毫米,[FOV] = 169 X 169毫米,320×320矩阵,和3毫米切片厚度。
- 组织PROCES唱
- 打开箱子倒了一下,并允许琼脂和容器侧面之间的空气,以去除固体琼脂溶液,包括心脏,从容器。从固体琼脂中取出的塑料杆。
- 部分从顶点到使用切肉机心脏的基含有5毫米切片心脏中的琼脂块。通过切割平行于琼脂块的底部保持切割片一样在所获取的MR图像的角度。
- 染色琼脂切片(包括心脏)中15分钟,溶解于0.9%盐水中2,3,5-三苯基四唑(TTC)的1%(重量)在37℃下,并从一垂直视图拍摄两侧的片( 图2A)。接下来,仔细冲洗在0.9%的生理盐水切片。
注意:在此研究中,我们使用一个相机的设置与适当的透镜/物镜,三脚架,且均匀的照明。然而,这些照片仅提供作为瘢痕区域的评估控制,所以我们可以使用不同的设置。
- 荧光成像
注意:根据荧光微珠的激发和发射波长,选择适当的过滤块和激发激光器( 例如,这里所使用的红色微珠分别具有580纳米和605纳米,激发和发射波长,因此,所选择的激励激光和带通滤波器设定为532纳米,三十零分之五百八十零nm和三十零分之六百十纳米,分别地)。- 在可变模式扫描器选择荧光模式成像。设置在光电倍增管到430伏或等同的且在像素尺寸为100×100微米。选择一个激励激光器(532纳米)最接近荧光微珠的激发波长。
- 对于第一个过滤器块中,选择与所注入的荧光珠(信道1)的发射波长重叠的带通滤波器(三十零分之五百八十○纳米)。选择用于E外侧的第二滤波器块(三十零分之六百十)的带通滤波器任务波长(信道2)。
注意:第二过滤器块用作阴性对照,以去除自发荧光,同时保持注射部位不变。 - 扫描琼脂片的两侧使用两个信道的可变模式激光扫描器的荧光模式。确保每个片都完全扫描,包括基准孔。
5.后处理
注:在图像处理后的第一步是使用内部开发的脚本来跟踪内切和心外膜边界,以及注射部位心肌的手动分割。这是MRI和荧光扫描相同。
- 段在MRI扫描心肌。
- 段在FLAIR序列MRI图像的心内膜和心外膜维·博德斯。
- 所述LV分割从步骤5.1.1疤痕复制到LGE-MRI数据集和段上LGE MRI序列。
- 从步骤5.1.1心肌分段复制到T2 *加权的数据集和段SPIO沉积在LV心肌。
- 处理所述荧光图像,并执行分割。
- 加载从可变模式扫描仪获得的文件和使每个截面心脏切片的单独图像。
- 翻转该被扫描在基部到顶点的方向和对于被定向从顶点到基地两个通道的荧光图像成堆叠排序的切片。
- 段心内膜和外膜维·博德斯上的荧光图像。
- 段手动疤痕上的荧光图像,并使用所述LGE-MRI扫描和照片确认瘢痕形态。
- 从信道1的图像堆栈中减去信道2的图像栈排除自体荧光。手动段荧光微珠沉积和使用T2 *图像进行确认。
- 创造解剖学-正确的3D几何形状,基于所述参考结构(由刚性管形成的孔)中的图像堆栈进行切片的刚性配准。计算和存储每个图像的应用平移和旋转。
- 应用存储转换的图像栈和分割。线性插入切片的两侧的分割重构原始切片厚度和创建数据的3D模型。
6.分析
- 进行注射位点的中心和IBZ之间的距离的2D和/或3D测量以评估喷射精度。测量沿LV分割的心内膜边界的距离。在图2C和2F中,2D和3D测量的一个例子是由红色线表示。
结果
组织包埋
通过嵌入过程,舒张末期般的几何成立。成功地附着于心脏组织,使组织中的琼脂上以在与等于切片厚度( 图2A和2C)的所需角度进行切片。
Scar-和注射部位评估
对于每个成像模态,梗塞和喷射位置的评估...
讨论
全心脏根据该协议3D心肌组织处理提供能够使梗塞,所述IBZ,并相对于心脏解剖结构的执行的注射的三维分析的结构化方法。心脏的灌装量取决于所需的分析。在这项研究中,以评估注射的准确性,我们的目的是填补心脏,以尽可能地类似于舒张末期的几何形状。为了执行此,左心室尖被固定到所述容器的底部和LV充满琼脂而肺静脉被夹紧。当LV被填充,主动脉被夹紧以及,防止琼脂流出LV和作为?...
披露声明
作者什么都没有透露。
致谢
笔者想感谢马利贾恩·詹森,霍伊塞·葳瑟和马亭面包车Nieuwburg他们与动物实验的援助。我们非常感谢的Martijn Froeling和安克·沃辛克他们与MRI成像援助。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | Braun | ||
| Agarose | Roche Diagnostics | Scientific grade multipurpose agar | |
| Biomolecular fluorescence scanner Typhoon 9410 | GE Healthcare | ||
| Embedding container | Plastic, dimensions 17 x 14.5 x 14 cm | ||
| FluoSpheres Polystyrene Microspheres | Invitrogen | F8834 | red, 10 µm |
| Gadolinium | Gadovist | 1.0 mmol/mL | |
| dS 32 channel head coil | Philips | Or similar | |
| Matlab | Mathworks | To insure compatability 2015a or newer | |
| Meat slicer | Berkel | ||
| Myostar injection catheter | Biosense Webster | ||
| Super paramagnetic iron oxide particles | Sinerem | ||
| Triphenyl-tetrazolium chloride | Merck | ||
| UPy-PEG10k | |||
| Vicryl 2-0 | Ethicon |
参考文献
- Nowbar, A. N., Howard, J. P., Ja Finegold, ., Asaria, P., Francis, D. P. 2014 global geographic analysis of mortality from ischaemic heart disease by country, age and income: statistics from World Health Organisation and United Nations. Int J Cardiol. 174 (2), 293-298 (2014).
- Kannel, W. B., Belanger, A. J. Epidemiology of heart failure. Am Heart J. 121 (3), 951-957 (1991).
- Ibáñez, B., Heusch, G., Ovize, M., Van De Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 65 (14), 1454-1471 (2015).
- Bartunek, J., Vanderheyden, M., Hill, J., Terzic, A. Cells as biologics for cardiac repair in ischaemic heart failure. Heart. 96 (10), 792-800 (2010).
- Orlic, D., Kajstura, J., et al. Bone marrow cells regenerate infarcted myocardium. Nature. 410 (6829), 701-705 (2001).
- Nguyen, P. K., Lan, F., Wang, Y., Wu, J. C. Imaging: Guiding the Clinical Translation of Cardiac Stem Cell Therapy. Circ Res. 109 (8), 962-979 (2011).
- Psaltis, P. J., Worthley, S. G. Endoventricular electromechanical mapping-the diagnostic and therapeutic utility of the NOGA XP Cardiac Navigation System. J Cardiovasc Transl Res. 2 (1), 48-62 (2009).
- Tomkowiak, M. T., Klein, A. J., et al. Targeted transendocardial therapeutic delivery guided by MRI-x-ray image fusion. Catheter Cardiovasc Interv. 78 (3), 468-478 (2011).
- Dauwe, D. F., Nuyens, D., et al. Three-dimensional rotational angiography fused with multimodal imaging modalities for targeted endomyocardial injections in the ischaemic heart. Eur Heart J Cardiovasc Imaging. 15 (8), 900-907 (2014).
- van Slochteren, F. J., van Es, R., et al. Multimodality infarct identification for optimal image-guided intramyocardial cell injections. Neth Heart J. 22 (11), 493-500 (2014).
- van Slochteren, F. J., van Es, R., et al. Three dimensional fusion of electromechanical mapping and magnetic resonance imaging for real-time navigation of intramyocardial cell injections in a porcine model of chronic myocardial infarction. Int J Cardiovasc Imaging. 32 (5), 833-843 (2016).
- Pape, a. C. H., Bakker, M. H., et al. An Injectable and Drug-loaded Supramolecular Hydrogel for Local Catheter Injection into the Pig Heart. J Vis Exp. (100), (2015).
- Bastings, M. M. C., Koudstaal, S., et al. A fast pH-switchable and self-healing supramolecular hydrogel carrier for guided, local catheter injection in the infarcted myocardium. Adv Healthc Mater. 3 (1), 70-78 (2014).
- Koudstaal, S., Jansen of Lorkeers, S. J., et al. Myocardial infarction and functional outcome assessment in pigs. J. Vis. Exp. (86), (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。