Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
3D entier coeur Myocardial analyse des tissus
Dans cet article
Résumé
Ce protocole décrit une nouvelle méthode pour la comparaison 3D du tissu myocardique tout cœur avec l'IRM. Il est conçu pour l'évaluation précise des injections intramyocardiaques dans la zone frontalière de Infarctus d'un modèle porcin chronique d'un infarctus du myocarde.
Résumé
les thérapies régénératives cardiaques visent à protéger et réparer le cœur blessé chez les patients souffrant d'une maladie cardiaque ischémique. En injectant des cellules souches ou d'autres substances biologiques qui améliorent ou angio vasculogenèse dans la zone frontalière de Infarctus (IBZ), la perfusion tissulaire est améliorée, et le myocarde peut être protégé contre d'autres dommages. Pour un effet thérapeutique maximale, il est émis l'hypothèse que la substance régénératrice est mieux livré au IBZ. Cela nécessite des injections précises et a conduit au développement de nouvelles techniques d'injection. Pour valider ces nouvelles techniques, nous avons conçu un protocole de validation basé sur l'analyse des tissus du myocarde. Ce protocole comprend le traitement des tissus du myocarde entier coeur qui permet une analyse détaillée en deux dimensions (2D) et en trois dimensions (3D) de l'anatomie cardiaque et les injections intramyocardiques. Dans un porc, un infarctus du myocarde a été créé par une occlusion de 90 min de la partie antérieure gauche artère coronaire descendante. Quatre semaines plus tard, un mixture d'un hydrogel avec des particules superparamagnétiques d'oxyde de fer (SPIOs) et des billes fluorescentes a été injecté dans le IBZ endocardique en utilisant une approche mini-invasive. 1 h après la procédure d'injection, le porc a été euthanasiés, et le coeur a été excisé et noyée dans de l'agarose (gélose). Après la solidification de la gélose, l'imagerie par résonance magnétique (IRM), le tranchage du cœur, et l'imagerie par fluorescence ont été réalisées. Après l'image post-traitement, l'analyse 3D a été réalisée pour évaluer la précision de ciblage IBZ. Ce protocole fournit une méthode structurée et reproductible pour l'évaluation de la précision du ciblage des injections intramyocardiaques dans le IBZ. Le protocole peut être facilement utilisé lorsque le traitement de tissu cicatriciel et / ou la validation de la précision de l'injection de tout le coeur est souhaitée.
Introduction
La cardiopathie ischémique a été la principale cause de décès dans le monde au cours des dernières décennies 1. Un traitement aigu après un infarctus du myocarde vise à restaurer le flux sanguin vers le myocarde par une intervention coronarienne percutanée ou une greffe de pontage de l' artère. Dans de graves infarctus, une grande surface du myocarde est meurtrie, et ces cas aboutissent souvent à une insuffisance cardiaque ischémique (HF) 2. options de traitement actuelles de mise au point HF sur la prévention et la préservation de la fonction cardiaque pour les patients HF, mais pas sur la régénération.
Dans la dernière décennie, les thérapies régénératives cardiaques ont été étudiés comme option de traitement pour HF 3. Cette thérapie vise à offrir des produits biologiques, telles que les cellules souches ou des facteurs de croissance, directement à la blessure pour induire myocarde revascularisation, la protection des cardiomyocytes, la différenciation et la croissance 4. pour optimaleeffet thérapeutique, on suppose que le biologique doit être injecté dans la zone de bordure de l' infarctus (IBZ) pour faciliter une bonne perfusion tissulaire pour la survie du biologique et pour un effet optimal à la zone cible 5, 6. De multiples techniques ont été développées pour réaliser l' identification et la visualisation de la IBZ pour guider les injections intramyocardiques 7, 8, 9, 10, 11. En plus de l'identification et la visualisation de l'IBZ, la livraison se fonde également sur les biomatériaux et des cathéters d'injection utilisés. Pour valider la précision d'injection des techniques de livraison, une méthode de quantification précise et reproductible est nécessaire.
Nous avons mis au point un protocole pour le traitement des tissus du myocarde tout-cœur qui offre à deux dimensions (2D) et trois Dimensional (3D) formation d'image, qui peut être utilisé pour l'étude qualitative et quantitative vise. Le protocole couvre le processus d'enrobage et l'analyse d'image numérique. Dans cet article, nous démontrons un protocole pour l'évaluation de la précision du ciblage des injections intramyocardiaques dans le IBZ dans un grand modèle porcin d'infarctus du myocarde chronique.
Protocole
L'expérience in vivo a été réalisée conformément au Guide pour les soins et l' utilisation des animaux de laboratoire par l'Institut du laboratoire de recherche animale. L'expérience a été approuvée par le Comité des expériences animales locales.
1. Préparation de la solution injectable et Embedding
- Préparer le gel injectable.
- Préparer 1 ml de gel uréido-pyrimidinone (UPY) conformément à des protocoles précédemment décrits 12, 13.
- Ajouter des particules superparamagnétiques d'oxyde de fer (SPIOs) à la solution pour obtenir une concentration de 15 ug / mL et on agite le mélange pendant 5 min pour une distribution uniforme.
- Ajouter les microbilles fluorescentes à la solution pour obtenir une concentration de 10.000 perles / ml et agiter le mélange pendant 5 minutes pour une distribution uniforme.
- Stocker le mélange obtenu à la température ambiante dans un environnement sombre. Chaud et vortex ou agitation tpeu de temps, il solution avant la procédure d'injection.
- Préparer la solution d'enrobage.
- Commencer avec l'eau du robinet à la température ambiante et ajouter agarose (gélose) à une concentration de 4% en poids.
- chauffer lentement la solution au point d'ébullition à l'aide d'un four à micro-ondes et remuer souvent pendant le chauffage. Après avoir atteint le point d'ébullition, de stocker et maintenir la solution d'agar supérieur à 70 ° C pendant 2 heures pour permettre à l'air piégé à la surface.
- Laisser l'agar refroidir à température ambiante à une température comprise entre 50 et 60 ° C jusqu'au moment de l'enrobage.
2. Injection Procédure
- Effectuer une prémédication (agents anti-arythmiques, un traitement anti-plaquettaire, et les médicaments de la douleur), l' anesthésie, l' accès veineux, et l' intubation, comme décrit précédemment 14.
- Effectuer des injections en utilisant un cathéter d'injection intramyocardique (Table des Matières). Pour chaque injection, 0.2 ml du mélange est injecté dans un bol à une vitesse constante d'environ 0,3 mL / min en utilisant un dispositif d'injection. Placez les injections à différentes positions le long du IBZ 12.
- Administrer 0,2 mL / kg (1,0 mmol / mL) d'un agent de contraste à base de gadolinium 15 min avant l'euthanasie de l'animal.
- Administrer 20 ml de 7,5% de chlorure de potassium par voie intraveineuse à l'animal euthanasie.
- Accès sécurisé médiastinale suivant les étapes protocole 8.2 à 8.3, comme décrit par Koudstaal et al. 14. Couper la veine cave inférieure à 5 cm de l'oreillette droite et retirer le sang d'un dispositif qui s'écoule d'aspiration. Exciser le cœur et le rincer avec 0,9% de solution saline à la température ambiante.
3. Procédure Embedding
- Préparer le coeur.
- Retirez le péricarde du cœur tout en gardant le ventricules et intact atriums. On dissèque l'aorte ascendante ± 1 cm au-dessus de la valve aortique en utilisant Klinkenbergles ciseaux. Couper la veine cave inférieure ± 1 cm de l'atrium, et faire la même chose pour les veines pulmonaires.
- Suturer la pointe du cœur au fond d'un récipient enrobage en matière plastique (17 x 15 x 15 cm, L x P x H) en utilisant une suture 2-0 pour empêcher la flottaison du coeur pendant l' enrobage (figure 1A).
- Suturer la partie restante de l'aorte aux bords du récipient à l' aide de 2-0, en veillant à ce que le coeur est centré et ne pas toucher les parois du récipient (figure 1B).
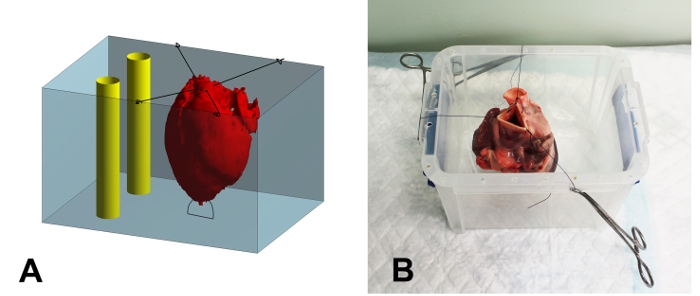
Figure 1: Vue d' ensemble schématique et la photographie du Embedding Container. (A) Vue d'ensemble schématique du processus d'intégration. Le coeur (rouge) est fixé dans le récipient (bleu) à l'aide de sutures. Après avoir rempli le cœur de la solution d'agar, l'espace autour du coeur est rempli. Finalement,deux tubes en plastique rigides (jaune) sont placés dans le récipient, à côté de, mais ne touche pas le cœur, pour servir de référence lors de l'enregistrement de l'image. (B) Photographie d'un cœur fixé dans le récipient d'enrobage. Les sutures sont serrées au bord du récipient à l'aide des pinces de moustiques. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
- Incorporer le coeur dans une géométrie de fin de diastole en forme.
NOTE: La prévention de la création de bulles d'air est nécessaire. Si un grand bulles d'air présentes dans la solution de gélose, maintenir la gélose à 40 ° C, ce qui permet aux bulles d'air à la surface.- Fixer la veine cave inférieure à l'aide des pinces de moustiques. Injecter lentement l'agar liquide à l'aide d'une seringue de 50 ml dans l'oreillette droite par la veine cave supérieure jusqu'à ce que les deux l'oreillette droite et le ventricule sont complètement remplis.
- Serrer les veines pulmonaires en utilisant mosquitpinces o. Doucement passer une seringue de 50 ml d'agar-rempli par les valves par voie rétrograde de l'aorte. Injecter lentement la solution dans le ventricule gauche (VG) jusqu'à ce que le LV et l'oreillette gauche sont complètement remplis. Après avoir rempli le LV, serrer l'aorte pour maintenir la gélose dans le VG.
- Verser l'agar-agar restant dans le récipient jusqu'à ce que le coeur est entièrement couvert. Placer deux tubes en matière plastique rigide à l' intérieur du récipient enrobage pour servir de structures de référence pour un enregistrement ultérieur d'image (Figure 1A). Assurez-vous que les tubes ne touchent pas les parois du récipient ou le cœur.
- Laissez l'agar se solidifier à 2 - 7 ° C.
4. Acquisition d'images
- Effectuer ex vivo transversales IRM du coeur qui est incorporé dans le récipient.
- Placer le récipient avec le coeur incorporé à l' intérieur d' une bobine de tête (Table des Matières).
- Angulate les tranches parallèles au fond du récipient. Utilisationla même orientation et angulation dans chaque séquence IRM ex vivo.
- Pour visualiser le myocarde, effectuer une séquence de récupération inverse (FLAIR) atténué de fluide avec les paramètres suivants: temps de répétition [TR] / temps d'écho [Te] = 10 s / 140 ms, angle de bascule = 90 °, taille de pixel = 0,5 x 0,5 mm, champ de vision [FOV] = 169 x 169 mm, 320 x 320 matrice, et l'épaisseur de coupe de 3 mm.
- Pour visualiser l'infarctus du myocarde, effectuer une séquence renforcée de fin de gadolinium (LGE) avec les paramètres suivants: [TR] / [TE] = 5,53 ms / 1,69 ms, angle de bascule = 25 °, taille de pixel = 1,0 x 1,0 mm, [ FOV] = 169 x 169 mm, 176 x 176 matrice, et l'épaisseur de coupe de 3 mm.
- Pour visualiser SPIOs, effectuer un T2 * de séquence d'écho de gradient weighted avec les paramètres suivants: [TR] / [TE] = 88,7 ms / 15 TE également distribués avec une gamme de 1,9 - 24,6 ms, retournement angle = 15 °, pixel size = 0,5 x 0,5 mm, [FOV] = 169 x 169 mm, 320 x 320 matrice, et l'épaisseur de coupe de 3 mm.
- procesus de tissuschanter
- Mettez le récipient à l'envers et laisser l'air entre l'agar-agar et les côtés du récipient pour éliminer la solution d'agar solide, y compris le cœur, du récipient. Retirer les tiges en matière plastique à partir de la gélose solide.
- Section du bloc agar contenant le coeur en tranches de 5 mm du sommet à la base du cœur en utilisant une trancheuse à viande. Gardez l'angulation des tranches coupées les mêmes que dans les images acquises MR en coupant parallèlement au fond du bloc d'agar.
- Colorer les tranches de gélose (y compris le coeur) pendant 15 min à 1% en poids de 2,3,5-triphenyltetrazoliumchloride (TTC) dissous dans une solution saline à 0,9% à 37 ° C, et photographier les tranches des deux côtés d'une vue perpendiculaire (Figure 2A). Ensuite, rincez soigneusement les tranches de 0,9% du sérum physiologique.
NOTE: Dans cette étude, nous avons utilisé une configuration de reflex numérique avec une lentille / objectif approprié, un trépied et un éclairage uniforme. Cependant, les photographies ont servi seulement en tant que contrôle pour l'évaluation de la région de cicatrice,de sorte que nous aurions pu utiliser une configuration différente.
- L'imagerie par fluorescence
NOTE: En fonction de l'excitation et les longueurs d' onde d' émission de microbilles fluorescentes, sélectionner les lasers de bloc de filtre appropriés et d' excitation (par exemple, les microbilles rouges utilisés ici ont des longueurs d' onde d'excitation et d' émission de 580 nm et 605 nm, respectivement, par conséquent, le laser d'excitation sélectionné et des filtres passe-bande ont été fixées à 532 nm, 580/30 nm et 610/30 nm, respectivement).- Sélectionnez l'imagerie en mode de fluorescence sur le scanner en mode variable. Réglez le tube photomultiplicateur à 430 V ou équivalent et la taille de pixel de 100 x 100 pm. Sélectionnez un laser d'excitation (532 nm) le plus proche de la longueur d'onde d'excitation des microbilles fluorescentes.
- Pour le premier bloc de filtre, sélectionner un filtre passe-bande (580/30 nm) qui chevauche la longueur d'onde d'émission des billes de fluorescence injectées (voie 1). Sélectionner un filtre passe-bande pour le deuxième bloc de filtre (610/30) en dehors de l'elongueur d'onde de mission (canal 2).
NOTE: Le deuxième bloc de filtre sert de contrôle négatif et pour éliminer la fluorescence automatique tout en gardant les sites d'injection intacte. - Numériser les deux côtés des tranches de gélose dans le mode de fluorescence du scanner laser variable mode à l'aide des deux canaux. Assurez-vous que chaque tranche est complètement numérisé, y compris les trous de référence.
5. Le post-traitement
NOTE: La première étape de post-traitement d'image est la segmentation manuelle du myocarde en utilisant des scripts développés en interne pour tracer les frontières et endo épicardique, ainsi que les sites d'injection. C'est la même pour les deux IRM et les fluorescence.
- Segmenter le myocarde l'IRM.
- Segment le endocardique et épicardique LV frontières sur les images de séquences d'IRM FLAIR.
- Copier la segmentation de l'étape LV 5.1.1 à l'ensemble de données LGE-IRM et le segment de la cicatrice sur la séquence IRM LGE.
- Copier la segmentation du myocarde de l'étape 5.1.1 pour le T2 * ensemble de données weighted et segmenter les dépôts SPIO dans le myocarde VG.
- Traiter les images de fluorescence et effectuer des segmentations.
- Charger les fichiers obtenues à partir du scanner variable de mode et de faire une image séparée de chaque tranche de coeur en coupe transversale.
- Retourner les tranches qui ont été analysés dans la base au sommet d'orientation et de trier les images de fluorescence dans une pile pour les deux canaux qui est orienté du sommet à la base.
- Segment endocardique et épicardique frontières LV sur les images de fluorescence.
- Segment la cicatrice manuellement sur les images de fluorescence et utiliser le balayage LGE-IRM et les photos pour confirmer la morphologie de cicatrice.
- Soustraire la pile d'images de la voie 2 de la pile d'images du canal 1 pour exclure la fluorescence de l'automobile. segmenter manuellement les dépôts de microbilles fluorescentes et utiliser les images T2 * pour confirmation.
- Créerune géométrie 3D anatomiquement correcte, effectuer un recalage rigide des tranches dans la pile d'images sur la base des structures de référence (les trous créés par les tubes rigides). Calculer et stocker la translation et la rotation appliquée de chaque image.
- Appliquer les transformations enregistrées aux piles d'images et les segmentations. Interpoler linéairement les segmentations des deux côtés des tranches de reconstituer l'épaisseur de tranche d'origine et pour créer un modèle 3D des données.
6. Analyse
- Effectuer 2D et / ou 3D mesures de la distance entre les centres des sites d'injection et la IBZ pour évaluer la précision de l'injection. Mesurez la distance le long de la frontière endocardique de la segmentation LV. Sur la figure 2C et 2F, par exemple , des mesures 2D et 3D est indiquée par la ligne rouge.
Résultats
Embedding tissulaire
Grâce au processus d'incorporation, une géométrie de fin de diastole en forme a été établie. L'agar collé avec succès au tissu cardiaque, ce qui permet au tissu d'être tranché à l'angulation souhaitée avec des épaisseurs de tranches égales (figure 2A et 2C).
Évaluation SCAR et site d'...
Discussion
Whole-coeur 3D de traitement de tissu myocardique selon ce protocole fournit un procédé structuré qui permet l'analyse 3D de l'infarctus, le IBZ, et les injections effectuées par rapport à l'anatomie cardiaque. Le volume de remplissage du cœur dépend de l'analyse souhaitée. Dans cette étude, pour évaluer la précision de l'injection, nous avons cherché à remplir le cœur pour ressembler à la géométrie télédiastolique aussi près que possible. Pour ce faire, elle pointe LV est fixé a...
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Les auteurs tiennent à remercier Marlijn Jansen, Joyce Visser et Martijn van Nieuwburg pour leur aide aux expérimentations animales. Nous remercions grandement Martijn Froeling et Anke Wassink pour leur aide à l'imagerie IRM.
matériels
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | Braun | ||
| Agarose | Roche Diagnostics | Scientific grade multipurpose agar | |
| Biomolecular fluorescence scanner Typhoon 9410 | GE Healthcare | ||
| Embedding container | Plastic, dimensions 17 x 14.5 x 14 cm | ||
| FluoSpheres Polystyrene Microspheres | Invitrogen | F8834 | red, 10 µm |
| Gadolinium | Gadovist | 1.0 mmol/mL | |
| dS 32 channel head coil | Philips | Or similar | |
| Matlab | Mathworks | To insure compatability 2015a or newer | |
| Meat slicer | Berkel | ||
| Myostar injection catheter | Biosense Webster | ||
| Super paramagnetic iron oxide particles | Sinerem | ||
| Triphenyl-tetrazolium chloride | Merck | ||
| UPy-PEG10k | |||
| Vicryl 2-0 | Ethicon |
Références
- Nowbar, A. N., Howard, J. P., Ja Finegold, ., Asaria, P., Francis, D. P. 2014 global geographic analysis of mortality from ischaemic heart disease by country, age and income: statistics from World Health Organisation and United Nations. Int J Cardiol. 174 (2), 293-298 (2014).
- Kannel, W. B., Belanger, A. J. Epidemiology of heart failure. Am Heart J. 121 (3), 951-957 (1991).
- Ibáñez, B., Heusch, G., Ovize, M., Van De Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 65 (14), 1454-1471 (2015).
- Bartunek, J., Vanderheyden, M., Hill, J., Terzic, A. Cells as biologics for cardiac repair in ischaemic heart failure. Heart. 96 (10), 792-800 (2010).
- Orlic, D., Kajstura, J., et al. Bone marrow cells regenerate infarcted myocardium. Nature. 410 (6829), 701-705 (2001).
- Nguyen, P. K., Lan, F., Wang, Y., Wu, J. C. Imaging: Guiding the Clinical Translation of Cardiac Stem Cell Therapy. Circ Res. 109 (8), 962-979 (2011).
- Psaltis, P. J., Worthley, S. G. Endoventricular electromechanical mapping-the diagnostic and therapeutic utility of the NOGA XP Cardiac Navigation System. J Cardiovasc Transl Res. 2 (1), 48-62 (2009).
- Tomkowiak, M. T., Klein, A. J., et al. Targeted transendocardial therapeutic delivery guided by MRI-x-ray image fusion. Catheter Cardiovasc Interv. 78 (3), 468-478 (2011).
- Dauwe, D. F., Nuyens, D., et al. Three-dimensional rotational angiography fused with multimodal imaging modalities for targeted endomyocardial injections in the ischaemic heart. Eur Heart J Cardiovasc Imaging. 15 (8), 900-907 (2014).
- van Slochteren, F. J., van Es, R., et al. Multimodality infarct identification for optimal image-guided intramyocardial cell injections. Neth Heart J. 22 (11), 493-500 (2014).
- van Slochteren, F. J., van Es, R., et al. Three dimensional fusion of electromechanical mapping and magnetic resonance imaging for real-time navigation of intramyocardial cell injections in a porcine model of chronic myocardial infarction. Int J Cardiovasc Imaging. 32 (5), 833-843 (2016).
- Pape, a. C. H., Bakker, M. H., et al. An Injectable and Drug-loaded Supramolecular Hydrogel for Local Catheter Injection into the Pig Heart. J Vis Exp. (100), (2015).
- Bastings, M. M. C., Koudstaal, S., et al. A fast pH-switchable and self-healing supramolecular hydrogel carrier for guided, local catheter injection in the infarcted myocardium. Adv Healthc Mater. 3 (1), 70-78 (2014).
- Koudstaal, S., Jansen of Lorkeers, S. J., et al. Myocardial infarction and functional outcome assessment in pigs. J. Vis. Exp. (86), (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon