Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
3D цельнозерновой сердца Инфаркт Анализ тканей
В этой статье
Резюме
Этот протокол описывает новый метод для сравнения 3D цельной сердечной ткани миокарда с МРТ. Она предназначено для точной оценки интрамиокардиальных инъекций в пограничной зоне инфаркта хронической модели свиньи инфаркт миокарда.
Аннотация
Сердечные регенеративные терапии направлены на защиту и ремонт травмированного сердца у пациентов с ишемической болезнью сердца. Вводя стволовые клетки или другие биологические препараты, которые повышают ангио- или васкулогенез в пограничной зону инфаркта (IBZ), тканевая перфузия улучшается, и миокард может быть защищена от дальнейшего повреждения. Для достижения максимального терапевтического эффекта, он выдвинул гипотезу о том, что регенеративное вещество лучше всего поставлено на IBZ. Это требует точных инъекций и привел к разработке новых методов инъекций. Для проверки этих новых методов, мы разработали протокол проверки на основе анализа ткани миокарда. Этот протокол включает в себя целое сердце обработки ткани миокарда, которая позволяет подробный двумерный (2D) и трехмерной (3D) анализ сердечной анатомии и интрамиокардиальных инъекций. В свинью, инфаркт миокарда был создан 90-минутной окклюзии левой передней нисходящей коронарной артерии. Четыре недели спустя, микстЮр гидрогель с суперпарамагнитными частицами оксида железа (SPIOs) и флуоресцентными шариками вводили в IBZ с использованием минимально-инвазивным эндокардом подхода. 1 ч после процедуры инъекции, свинья была умерщвлены, и сердце вырезали и помещали в агарозе (агар). После затвердевания агара, были проведены магнитно-резонансная томография (МРТ), нарезка сердца и визуализация флуоресценции. После того, как изображение после обработки, 3D-анализ был проведен для оценки точности ориентации IBZ. Этот протокол обеспечивает структурированный и воспроизводимый метод для оценки точности ориентации интрамиокардиальных инъекций в IBZ. Протокол может быть легко использован, когда обработка рубцовой ткани и / или проверки точности впрыска всего сердца желательно.
Введение
Ишемическая болезнь сердца является ведущей в мире причина смерти в течение последних десятилетий 1. Острое лечение после инфаркта миокарда является восстановление кровотока в миокарде с помощью чрескожного коронарного вмешательства или коронарного шунтирования. В тяжелых инфарктов, большая площадь миокарда шрамы, и эти случаи часто приводят к ишемической сердечной недостаточности (СН) 2. Современные варианты лечения ВЧ внимание профилактике и сохранению функции сердца для пациентов с СН, но не на регенерацию.
В течение последнего десятилетия, сердечная регенеративная терапия была исследована как вариант лечения для HF 3. Эта терапия стремится поставлять биопрепараты, такие как стволовые клетки или факторы роста, непосредственно травмированный миокард , чтобы вызвать реваскуляризации, защиту кардиомиоцитов, дифференцировку и рост 4. Для оптимальнойтерапевтический эффект, она выдвинута гипотеза о том , что биологическое должен быть введен в зону инфаркта границы (IBZ) для облегчения хорошей тканевой перфузии для выживания биологического и для оптимального эффекта в целевой зоне 5, 6. Несколько методы были разработаны , чтобы выполнить идентификацию и визуализацию IBZ , чтобы направлять интрамиокардиальную инъекцию 7, 8, 9, 10, 11. Помимо идентификации и визуализации IBZ, доставка также опирается на биоматериалов и нагнетательных катетеров, используемых. Для проверки точности впрыска методов доставки, требуется точный и воспроизводимый метод количественного определения.
Мы разработали протокол для целого сердца обработки ткани миокарда, который предлагает двумерный (2D) и трех-dimensioNAL (3D) изображения, которые могут быть использованы для качественного и количественного анализа целей. Протокол охватывает процесс встраивания и анализ цифрового изображения. В данной работе мы демонстрируем протокол для оценки точности ориентации интрамиокардиальных инъекций в IBZ в большом свиных модель хронического инфаркта миокарда.
протокол
Эксперимент в естественных условиях был проведен в соответствии с Руководством по уходу и использованию лабораторных животных , подготовленных Институтом лабораторных исследований животных. Эксперимент был одобрен Комитетом местного Эксперименты на животных путем.
1. Подготовка и внедрение инъекционными Solution
- Подготовьте инъекционный гель.
- Подготовить 1 мл уреидо-пиримидинона (UPy) гель в соответствии с ранее описанными протоколами 12, 13.
- Добавить суперпарамагнитных частицы оксида железа (SPIOs) к раствору, чтобы получить концентрацию 15 мкг / мл и перемешивали смесь в течение 5 мин для равномерного распределения.
- Добавьте флуоресцентные микрошарик к раствору, чтобы получить концентрацию 10000 бусин / мл и перемешивали смесь в течение 5 мин для равномерного распределения.
- Хранить полученную смесь при комнатной температуре в темном помещении. Теплый и вихревым или размешать тон раствор незадолго до процедуры инъекции.
- Приготовьте раствор вложенности.
- Начну с водопроводной водой при комнатной температуре и добавляют агарозов (агар) до концентрации 4% масс.
- Медленно нагревать раствор до температуры кипения с использованием микроволновой печи и часто перемешивают во время нагревания. При достижении точки кипения, хранить и держать агар раствора выше 70 ° С в течение 2 ч, чтобы захваченный воздух к поверхности.
- Разрешить агар не остыть при комнатной температуре до температуры в диапазоне от 50 до 60 & deg; С до времени внедрения.
Процедура 2. Инъекции
- Выполните премедикацию (антиаритмические агент, анти-тромбоциты терапию и обезболивающую), анестезию, венозный доступ и интубацию, как описано выше 14.
- Выполнение инъекции с использованием катетера интрамиокардиальной инъекции (таблица материалов). Для каждой инъекции, 0.2 мл смеси вводят в один болюс с постоянной скоростью приблизительно 0,3 мл / мин с использованием устройства для инъекций. Поместите инъекции в различных положениях вдоль IBZ 12.
- Администрирование 0,2 мл / кг (1,0 ммоль / мл) в гадолиний-контрастный агент на основе 15 мин до эвтаназии животных.
- Администрирование 20 мл 7,5% хлорида калия внутривенно эвтаназии животных.
- Безопасный медиастинальная доступ в соответствии с протоколом шаги 8.2 - 8.3, как описано Koudstaal и соавт. 14. Обрежьте нижнюю полую вену 5 см от правого предсердия и удалить вытекания крови с всасывающим устройством. Акцизный сердце и промыть его с 0,9% физиологическим раствором при комнатной температуре.
3. Порядок Встраивание
- Подготовьте сердце.
- Удалить перикард из сердца, сохраняя предсердия и желудочки нетронутыми. Рассеките восходящую аорту ± 1 см выше аортального клапана с использованием Клинкенберганожницы. Обрежьте нижнюю полую вену ± 1 см от предсердия, и сделать то же самое для легочных вен.
- Шовная верхушку сердца к нижней части пластикового контейнера встраивания (17 х 15 х 15 см, Ш х Г х В ) с помощью 2-0 шва , чтобы предотвратить плавучесть сердца во время погружения (Рисунок 1А).
- Шовный оставшуюся часть аорты на краях контейнера с использованием 2-0, убедившись , что сердце центрируется и не касаясь стенок контейнера (Фиг.1В).
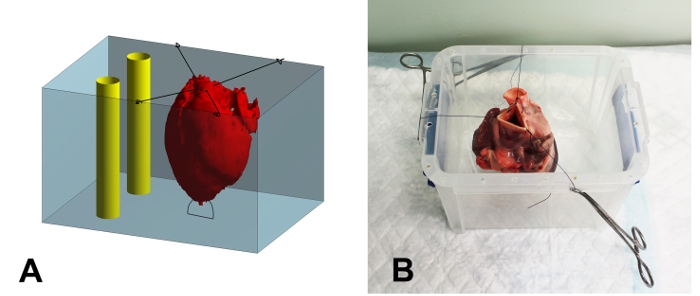
Рисунок 1: Схема и фотография Встраивание контейнера. (А) Схематический обзор процесса погружения. Сердце (красный) закреплено в контейнере (синий) с помощью наложения швов. После заполнения сердца раствора агара, пространство вокруг сердца заполнено. В заключение,две жесткие пластиковые трубы (желтые) расположены в контейнере, рядом, но не касаясь сердца, чтобы служить в качестве эталона при регистрации изображений. (В) Фотографии сердца , обеспеченном в контейнере вложения. Швы прижимаются к ободу емкости с использованием противомоскитных зажимов. Пожалуйста , нажмите здесь , чтобы посмотреть увеличенную версию этой фигуры.
- Встраивание сердца в конечной диастолическом типе геометрии.
ПРИМЕЧАНИЕ: Предотвращение создания пузырьков воздуха необходимо. Если большие воздушные пузырьки присутствуют в растворе агара, держать агар при 40 ° С, что позволяет пузырьки воздуха к поверхности.- Зажмите нижней полой вены с помощью москитных зажимов. Медленно вводит жидкий агар с помощью шприца 50 мл в правом предсердии через верхнюю полую вену, пока оба правое предсердие и желудочек не полностью заполнены.
- Хомут легочных вен с использованием Москитуплотнительные зажимы. Осторожно пройти агар заполненных 50-мл шприцев ретроградны через аортальные клапаны. Медленно вводит раствор в левом желудочке (ЛЖ) до левого желудочка и левого предсердия было полностью заполнены. После заполнения LV, зажим аорту, чтобы держать агар в ЛЖ.
- Влить оставшийся агар в контейнер, пока сердце не будет полностью покрыто. Поместите два жестких пластиковые трубы внутри контейнера вложения , чтобы служить в качестве опорных структур для последующей регистрации изображений (рис 1А). Убедитесь, что трубки не касаться стенок контейнера или сердца.
- Пусть агар затвердевать при 2 - 7 ° C.
4. Получение изображения
- Выполнение поперечной бывшей естественных условий МРТ сердца, внедренная в контейнере.
- Поместите контейнер со встроенным сердцем внутри головки катушки (таблица материалов).
- Угловыми ломтики параллельно нижней части контейнера. использованиета же ориентация и углы в каждой экс виво последовательности МРТ.
- Для визуализации миокарда, выполнить жидкости ослабленной обратной восстановления (FLAIR) последовательности со следующими параметрами: повторение раз [TR] / эхо времени [TE] = 10 с / 140 мс, флип угол = 90 °, размер пиксела = 0,5 х 0,5 мм, поле обзора FOV [] = 169 х 169 мм, 320 х 320 матрицы, а также 3-мм толщина среза.
- Для того, чтобы визуализировать инфаркт миокарда, выполнить позднюю-гадолиний расширенной (LGE), последовательность со следующими параметрами: [TR] / [ТЕ] = 5,53 мс / 1,69 мс, флип угол = 25 °, размер пиксела = 1,0 х 1,0 мм, [ FOV] = 169 х 169 мм, 176 176 матрицы, а также 3-мм толщина среза.
- Для того, чтобы визуализировать SPIOs, выполнить Т2 * -weighted градиент эхо последовательности со следующими параметрами: [TR] / [ТЕ] = 88,7 мс / 15 одинаково распределенных СПЭ с диапазоном 1,9 - 24,6 мс, флип угол = 15 °, пиксель размер = 0,5 х 0,5 мм, [FOV] = 169 х 169 мм, 320 х 320 матрицы, а также 3-мм толщина среза.
- Тканевые процеспеть
- Переверните контейнер вверх дном и позволить воздуху между агара и стенками контейнера для удаления твердого раствора агара, в том числе сердца, из контейнера. Удалите пластиковые стержни из твердого агара.
- Раздел агар блок, содержащий сердце в 5-мм кусочки от вершины к основанию сердца с помощью резки мяса. Хранить ангуляцию из разрезанных ломтиков такие же, как в полученных изображениях МРА путем разрезания параллельно нижнюю частью агара блока.
- Пятно агар ломтиков ( в том числе сердца) в течение 15 мин в 1% масс 2,3,5-triphenyltetrazoliumchloride (TTC) , растворенного в 0,9% солевом растворе при 37 ° C, и сфотографировать ломтики с обеих сторон от перпендикулярного зрения (рис 2А). Затем, тщательно промыть ломтики в 0,9% солевом растворе.
Примечание: В данном исследовании мы использовали установку цифровой зеркальной камеры с соответствующей линзы / объектива, штатив, и равномерное освещение. Тем не менее, фотографии служили только в качестве контроля для оценки области рубца,таким образом, мы могли бы использовать различные настройки.
- флуоресцентные изображения
Примечание: В зависимости от возбуждения и излучения длин волн флуоресцентных микрогранул, выберите соответствующий блок фильтра и возбуждения лазеров (например, красные микросферы , используемые здесь , имеют возбуждения и эмиссии длинами волн 580 нм и 605 нм, соответственно, поэтому выбранный лазер возбуждения и полосовые фильтры были установлены на 532 нм, 580/30 нм и 610/30 нм, соответственно).- Выберите флуоресцентной режим формирования изображения на сканере с переменным режимом. Установите фотоэлектронный умножитель до 430 В или эквивалентном и размер пикселя до 100 х 100 мкм. Выбор лазерного возбуждения (532 нм), ближе всего к длине волны возбуждения флуоресцентных микрогранул.
- Для первого блока фильтров, выберите полосовой фильтр (580/30 нм), который перекрывается с длиной волны излучения инжектированных бусин флуоресценции (канал 1). Выберите полосовой фильтр для блока второго фильтра (610/30) вне еДлина волны миссии (канал 2).
Примечание: Второй блок фильтра служит в качестве отрицательного контроля и удаление автофлуоресценции при сохранении инъекции сайтов нетронутыми. - Сканирование обоего сторон агаровых срезов в режиме флуоресценции лазерного сканера с переменным режимом с использованием двух каналов. Убедитесь, что каждый кусочек полностью сканируется, в том числе опорных отверстий.
5. Последующая обработка
Примечание: первый шаг в изображении после обработки является ручной сегментацией миокарда с использованием собственной разработкой сценариев для отслеживания эндо- и эпикардиальные границ, а также в местах инъекций. Это же как для МРТ и флуоресцентного сканирования.
- Сегмент миокард в МРТ.
- Сегментация эндокарда и эпикарда Лв Бордерс на изображение последовательности FLAIR МРТ.
- Скопируйте сегментацию LV с шага 5.1.1 к набору данных LGE-МРТ и сегмента рубца на последовательности LGE МРТ,
- Скопируйте сегментацию миокарда, начиная с шага 5.1.1 Т2 * -weighted набора данных и сегментировать отложений Spio в миокарде ЛЖ.
- Процесс флуоресценции изображений и выполнения сегментирования.
- Загрузите файлы, полученные от сканера переменного режима и сделать отдельное изображение каждого поперечного сечение среза сердца.
- Флип ломтики, которые были отсканированы в основания к вершине ориентации и сортировки флуоресцентных изображений в стеке для обоих каналов, которые ориентированы от вершины к основанию.
- Сегментация эндокарда и эпикарда Лв Бордерс на изображениях флуоресценции.
- Сегмент рубец вручную на изображении флуоресцентного и использовать LGE-МРТ и фотографии, чтобы подтвердить рубцовую морфологию.
- Вычтите стек изображения канала 2 из стека изображения канала 1, чтобы исключить автоматическую флуоресценцию. сегмент вручную флуоресцентное микросферическое осаждение и использовать T2 * изображения для подтверждения.
- Создаватьанатомически-правильное 3D геометрии, выполнить жесткую регистрацию срезов в стеке изображения на основании опорных структур (отверстий, созданных жестких трубок). Рассчитать и хранить прикладной сдвиг и поворот каждого изображения.
- Применить сохраненные преобразования для изображения стеки и сегментирования. Линейно интерполировать сегментирование обоего сторон ломтиков, чтобы восстановить первоначальную толщину среза и создать 3D модель данных.
6. Анализ
- Провести измерения 2D и / или 3D расстояния между центрами в местах инъекций и IBZ для оценки точности впрыска. Измерьте расстояние вдоль границы эндокарда сегментации ЛЖ. На фигуре 2C и 2F, пример измерений 2D и 3D обозначается красной линией.
Результаты
Ткань Встраивание
С помощью процесса погружения, была создана конечно-диастолический типа геометрии. Агар успешно приклеен к ткани сердца, что позволяет ткань , чтобы быть нарезан на желаемой ангуляции с равными срезами толщиной (р...
Обсуждение
Всего-сердце 3D обработки ткани миокарда в соответствии с этим протоколом обеспечивает структурированный метод, который позволяет 3D-анализ миокарда, в IBZ и выполненные инъекций по отношению к сердечной анатомии. Объем наполнения сердца зависит от желаемого анализа. В данном исследован...
Раскрытие информации
Авторы не имеют ничего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Марлижн Янсен, Джойс Виссер и Martijn ван Nieuwburg за помощь при проведении экспериментов на животных. Мы очень признаем Martijn Froeling и Анк Вассинк за помощь с МРТ.
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | Braun | ||
| Agarose | Roche Diagnostics | Scientific grade multipurpose agar | |
| Biomolecular fluorescence scanner Typhoon 9410 | GE Healthcare | ||
| Embedding container | Plastic, dimensions 17 x 14.5 x 14 cm | ||
| FluoSpheres Polystyrene Microspheres | Invitrogen | F8834 | red, 10 µm |
| Gadolinium | Gadovist | 1.0 mmol/mL | |
| dS 32 channel head coil | Philips | Or similar | |
| Matlab | Mathworks | To insure compatability 2015a or newer | |
| Meat slicer | Berkel | ||
| Myostar injection catheter | Biosense Webster | ||
| Super paramagnetic iron oxide particles | Sinerem | ||
| Triphenyl-tetrazolium chloride | Merck | ||
| UPy-PEG10k | |||
| Vicryl 2-0 | Ethicon |
Ссылки
- Nowbar, A. N., Howard, J. P., Ja Finegold, ., Asaria, P., Francis, D. P. 2014 global geographic analysis of mortality from ischaemic heart disease by country, age and income: statistics from World Health Organisation and United Nations. Int J Cardiol. 174 (2), 293-298 (2014).
- Kannel, W. B., Belanger, A. J. Epidemiology of heart failure. Am Heart J. 121 (3), 951-957 (1991).
- Ibáñez, B., Heusch, G., Ovize, M., Van De Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 65 (14), 1454-1471 (2015).
- Bartunek, J., Vanderheyden, M., Hill, J., Terzic, A. Cells as biologics for cardiac repair in ischaemic heart failure. Heart. 96 (10), 792-800 (2010).
- Orlic, D., Kajstura, J., et al. Bone marrow cells regenerate infarcted myocardium. Nature. 410 (6829), 701-705 (2001).
- Nguyen, P. K., Lan, F., Wang, Y., Wu, J. C. Imaging: Guiding the Clinical Translation of Cardiac Stem Cell Therapy. Circ Res. 109 (8), 962-979 (2011).
- Psaltis, P. J., Worthley, S. G. Endoventricular electromechanical mapping-the diagnostic and therapeutic utility of the NOGA XP Cardiac Navigation System. J Cardiovasc Transl Res. 2 (1), 48-62 (2009).
- Tomkowiak, M. T., Klein, A. J., et al. Targeted transendocardial therapeutic delivery guided by MRI-x-ray image fusion. Catheter Cardiovasc Interv. 78 (3), 468-478 (2011).
- Dauwe, D. F., Nuyens, D., et al. Three-dimensional rotational angiography fused with multimodal imaging modalities for targeted endomyocardial injections in the ischaemic heart. Eur Heart J Cardiovasc Imaging. 15 (8), 900-907 (2014).
- van Slochteren, F. J., van Es, R., et al. Multimodality infarct identification for optimal image-guided intramyocardial cell injections. Neth Heart J. 22 (11), 493-500 (2014).
- van Slochteren, F. J., van Es, R., et al. Three dimensional fusion of electromechanical mapping and magnetic resonance imaging for real-time navigation of intramyocardial cell injections in a porcine model of chronic myocardial infarction. Int J Cardiovasc Imaging. 32 (5), 833-843 (2016).
- Pape, a. C. H., Bakker, M. H., et al. An Injectable and Drug-loaded Supramolecular Hydrogel for Local Catheter Injection into the Pig Heart. J Vis Exp. (100), (2015).
- Bastings, M. M. C., Koudstaal, S., et al. A fast pH-switchable and self-healing supramolecular hydrogel carrier for guided, local catheter injection in the infarcted myocardium. Adv Healthc Mater. 3 (1), 70-78 (2014).
- Koudstaal, S., Jansen of Lorkeers, S. J., et al. Myocardial infarction and functional outcome assessment in pigs. J. Vis. Exp. (86), (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены