È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
3D Whole-cuore Analisi tessuto miocardico
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo descrive un nuovo metodo per il confronto 3D del tessuto miocardico con tutto il cuore con la risonanza magnetica. Questo è progettato per la valutazione accurata di iniezioni intramiocardici nella zona infartuata confine di un modello suino cronica di infarto miocardico.
Abstract
Cardiaci terapie rigenerative hanno lo scopo di proteggere e riparare il cuore danneggiato nei pazienti con cardiopatia ischemica. Iniettando le cellule staminali o altre biologici che migliorano angio- o vasculogenesi nella zona infartuata confine (IBZ), perfusione tissutale è migliorata, e il miocardio può essere protetto da ulteriori danni. Per il massimo effetto terapeutico, si ipotizza che la sostanza rigenerativa è meglio consegnato al IBZ. Ciò richiede iniezioni accurate e ha portato allo sviluppo di nuove tecniche di iniezione. Per convalidare queste nuove tecniche, abbiamo progettato un protocollo di validazione basato sull'analisi del tessuto miocardico. Questo protocollo include tutto-cuore elaborazione tessuto miocardico che consente dettagliata bidimensionale (2D) e tridimensionali (3D) analisi dell'anatomia cardiaca e iniezioni intramiocardici. In un maiale, infarto del miocardio è stato creato da un 90-min occlusione della discendente anteriore sinistra dell'arteria coronaria. Quattro settimane più tardi, un mixture di un idrogel con particelle superparamagnetiche di ossido di ferro (SPIOs) e perline fluorescenti è stata iniettata nel IBZ utilizzando un approccio endocardico minimamente invasivo. 1 h dopo la procedura di iniezione, il maiale è stata eutanasia, e il cuore è stato asportato e incorporato in agarosio (agar). Dopo la solidificazione del agar, la risonanza magnetica (MRI), affettare del cuore, e imaging di fluorescenza sono state eseguite. Dopo immagine di post-trattamento, l'analisi 3D è stata effettuata per valutare la precisione di targeting IBZ. Questo protocollo fornisce un metodo strutturato e riproducibile per la valutazione della precisione di targeting di iniezioni intramiocardica nella IBZ. Il protocollo può essere facilmente utilizzato quando il trattamento di tessuto cicatriziale e / o la convalida della precisione iniezione di tutto il cuore è desiderato.
Introduzione
Cardiopatia ischemica è la principale causa di morte nel mondo negli ultimi decenni 1. Trattamento acuto dopo infarto miocardico mira a ripristinare il flusso di sangue al miocardio mediante angioplastica coronarica o bypass coronarico. In infarti gravi, una vasta area del miocardio è sfregiato, e questi casi spesso portare a insufficienza cardiaca ischemica (HF) 2. opzioni di trattamento attuali per concentrarsi HF sulla prevenzione e la conservazione della funzione cardiaca per i pazienti con scompenso cardiaco, ma non sulla rigenerazione.
Negli ultimi dieci anni, cardiaci terapie rigenerative sono state studiate come opzione di trattamento per le HF 3. Questa terapia mira a fornire biologici, come le cellule staminali o fattori di crescita, direttamente al miocardio danneggiato per indurre rivascolarizzazione, protezione dei cardiomiociti, la differenziazione e la crescita 4. per ottimaleeffetto terapeutico, si ipotizza che il biologico deve essere iniettato nella zona infartuata confine (IBZ) per facilitare una buona perfusione tissutale per la sopravvivenza del biologico e per effetto ottimale alla zona target 5, 6. Molteplici tecniche sono state sviluppate per eseguire l'identificazione e visualizzazione del IBZ per guidare iniezioni intramiocardici 7, 8, 9, 10, 11. Oltre identificazione e visualizzazione del IBZ, la consegna basa anche sui biomateriali e cateteri utilizzati iniezione. Per convalidare l'accuratezza iniezione delle tecniche di consegna, è necessario un metodo di quantificazione accurata e riproducibile.
Abbiamo sviluppato un protocollo per intero-cuore elaborazione tessuto miocardico che offre bidimensionali (2D) e tridimnal (3D), che può essere utilizzato per lo studio qualitativo e quantitativo mira. Il protocollo riguarda il processo di incorporazione e l'analisi di immagine digitale. In questo lavoro, dimostriamo un protocollo per la valutazione della precisione di targeting di iniezioni intramiocardica nel IBZ in un grande modello suino di infarto miocardico cronico.
Protocollo
L'esperimento in vivo è stato condotto in conformità con la Guida per la cura e l'uso di animali da laboratorio preparati dall'Istituto di Research Laboratory Animal. L'esperimento è stato approvato dal Comitato di esperimenti sugli animali locale.
1. Preparazione di iniettabili ed Embedding Solution
- Preparare il gel iniettabile.
- Preparare 1 mL di ureido-pyrimidinone gel (UpY) secondo protocolli precedentemente descritte 12, 13.
- Aggiungere particelle di ossido di ferro superparamagnetiche (SPIOs) alla soluzione per ottenere una concentrazione di 15 ug / ml e agitare la miscela per 5 minuti per la distribuzione uniforme.
- Aggiungere le microsfere fluorescenti per la soluzione per ottenere una concentrazione di 10.000 perline / mL e mescolare l'impasto per 5 minuti per la distribuzione uniforme.
- Conservare la miscela risultante a temperatura ambiente in un ambiente buio. Caldo e vortex o mescolare tegli soluzione poco prima della procedura di iniezione.
- Preparare la soluzione incorporamento.
- Iniziare con acqua di rubinetto a temperatura ambiente ed aggiungere agarosio (agar) ad una concentrazione di 4% in peso.
- Lentamente scaldare la soluzione al punto di ebollizione utilizzando un forno a microonde e mescolare spesso durante il riscaldamento. Dopo aver raggiunto il punto di ebollizione, memorizzare e mantenere la soluzione di agar superiore a 70 ° C per 2 ore per consentire all'aria intrappolata di superficie.
- Consentire l'agar raffreddare a temperatura ambiente ad una temperatura tra 50 e 60 ° C fino al momento di incorporamento.
Procedura 2. Iniezione
- Eseguire premedicazione (agenti anti-aritmici, terapia anti-piastrine, e antidolorifici), l'anestesia, accesso venoso, e l'intubazione, come descritto in precedenza 14.
- Eseguire le iniezioni utilizzando un catetere iniezione intramiocardico (Table of Materials). Per ogni iniezione, 0.2 mL della miscela viene iniettato in un bolo ad una velocità costante di circa 0,3 ml / min usando un dispositivo di iniezione. Posizionare le iniezioni in posizioni differenti lungo l'IBZ 12.
- Somministrare 0,2 ml / kg (1,0 mmol / mL) di un agente di contrasto a base di gadolinio 15 minuti prima eutanasia dell'animale.
- Somministrare 20 ml di cloruro di potassio 7,5% per via endovenosa a eutanasia dell'animale.
- Accesso sicuro mediastino seguente protocollo passaggi 8,2-8,3, come descritto da Koudstaal et al. 14. Tagliare la vena cava inferiore 5 cm dall'atrio destro e rimuovere effluente sangue con un dispositivo di aspirazione. Accise cuore e risciacquare con soluzione fisiologica 0,9% a temperatura ambiente.
3. Procedura Embedding
- Preparare il cuore.
- Rimuovere il pericardio dal cuore, mantenendo intatto l'atri e ventricoli. Sezionare l'aorta ascendente ± 1 cm sopra la valvola aortica utilizzando Klinkenbergforbici. Tagliare la vena cava inferiore ± 1 cm dall'atrio, e fare lo stesso per le vene polmonari.
- Suturare la punta del cuore al fondo di un contenitore di plastica incorporamento (17 x 15 x 15 cm, L x H x D) usando una sutura 2-0 per impedire il galleggiamento del cuore durante incorporamento (Figura 1A).
- Suturare la restante parte dell'aorta ai cerchioni del contenitore usando 2-0, assicurandosi che il cuore sia centrato e non toccare le pareti del contenitore (Figura 1B).
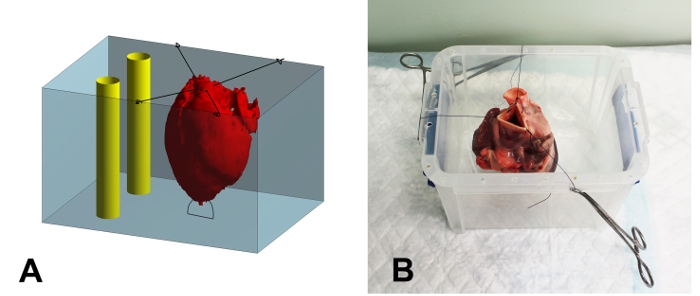
Figura 1: Schema e fotografico della Embedding contenitore. (A) Schema del processo di inclusione. Il cuore (rosso) è fissato nel contenitore (blu) con punti di sutura. Dopo aver riempito il cuore con la soluzione di agar, lo spazio intorno al cuore è pieno. Finalmente,due tubi di plastica rigida (giallo) sono posizionati nel contenitore, vicino a, ma non toccare il cuore, per servire come riferimento durante la registrazione dell'immagine. (B) Fotografia di un cuore fissato nel contenitore embedding. Le suture sono fissati sul bordo del contenitore con fascette zanzara. Si prega di cliccare qui per vedere una versione più grande di questa figura.
- Incorporare il cuore in una geometria telediastolica-like.
NOTA: La prevenzione della creazione bolla d'aria è necessaria. Se bolle presente nella soluzione di agar grande aria, mantenere l'agar a 40 ° C, permettendo alle bolle d'aria di superficie.- Bloccare la vena cava inferiore con fascette di zanzara. Iniettare lentamente l'agar liquido con una siringa da 50 ml nell'atrio destro attraverso la vena cava superiore fino a quando sia l'atrio destro e ventricolo sono completamente pieni.
- Bloccare le vene polmonari mediante mosquito morsetti. passare delicatamente una siringa riempita agar-50 mL retrograda attraverso le valvole aortica. Lentamente iniettare la soluzione nel ventricolo sinistro (LV) fino LV e l'atrio sinistro sono completamente riempiti. Dopo aver riempito il LV, bloccare l'aorta per mantenere l'agar nella LV.
- Versare l'agar restante nel contenitore fino a quando il cuore è completamente coperto. Inserire due tubi di plastica rigidi entro il contenitore incorporamento per servire come strutture di riferimento per la registrazione dell'immagine successiva (Figura 1A). Assicurarsi che i tubi non toccare le pareti del contenitore o il cuore.
- Lasciate che l'agar solidificare a 2-7 ° C.
4. Acquisizione di immagini
- Eseguire trasversali ex vivo risonanza magnetica del cuore che è incorporato nel contenitore.
- Posizionare il contenitore con il cuore incastonato all'interno di una bobina di testa (Table of Materials).
- Angulate le fette parallelo al fondo del contenitore. Usolo stesso orientamento e l'angolazione in ogni sequenza ex vivo MRI.
- Per visualizzare miocardio, eseguire un fluido attenuato recupero inverso (FLAIR) sequenza con i seguenti parametri: tempo di ripetizione [TR] / tempo di eco [TE] = 10 s / 140 ms, flip angle = 90 °, dimensioni pixel = 0.5 x 0.5 mm, campo di vista [FOV] = 169 x 169 mm, 320 x 320 matrice e spessore di strato 3 mm.
- Per visualizzare l'infarto miocardico, effettuare un late-gadolinio avanzata (LGE) sequenza con i seguenti parametri: [TR] / [TE] = 5,53 ms / 1,69 ms, flip angle = 25 °, dimensioni pixel = 1,0 x 1,0 mm, [ FOV] = 169 x 169 mm, 176 x 176 matrice e 3 mm spessore di strato.
- Per visualizzare SPIOs, eseguire un T2 * gradient echo pesate con i seguenti parametri: [TR] / [TE] = 88,7 ms / 15 TE equamente distribuiti con una gamma di 1,9 - 24,6 ms, flip angle = 15 °, pixel size = 0,5 x 0,5 mm, [FOV] = 169 x 169 mm, 320 x 320 matrice e 3 mm spessore di strato.
- proces Tissuecantare
- Girare il contenitore a testa in giù e lasciare aria tra l'agar ed i lati del contenitore per rimuovere la soluzione di agar solida, compreso il cuore, dal contenitore. Rimuovere le aste di plastica dal agar solido.
- Sezione del blocco di agar contenente il cuore a fette di 5 mm dal vertice alla base del cuore con un'affettatrice. Mantenere l'angolazione delle fette tagliate lo stesso come nelle immagini RM acquisite tagliando parallelo al fondo del blocco agar.
- Macchiare le fette di agar (compreso il cuore) per 15 min a 1% in peso di 2,3,5-triphenyltetrazoliumchloride (TTC) sciolti in 0,9% di soluzione salina a 37 ° C, e fotografare le fette su entrambi i lati da una vista perpendicolare (Figura 2A). Poi, lavare accuratamente le fette in salina allo 0,9%.
NOTA: In questo studio, abbiamo usato una messa a punto DSLR con un appropriato obiettivo / obiettivo, un treppiedi, e l'illuminazione uniforme. Tuttavia, le fotografie servivano solo come controllo per la valutazione della regione cicatrice,così abbiamo potuto usare una configurazione diversa.
- imaging di fluorescenza
NOTA: a seconda delle eccitazione e di emissione delle microsfere fluorescenti, selezionare il blocco di filtro e di eccitazione laser appropriati (per esempio, le microperle rosso qui utilizzati hanno eccitazione e di emissione di 580 nm e 605 nm, rispettivamente, pertanto, il laser di eccitazione selezionata e filtri passabanda sono stati impostati a 532 nm, 580/30 nm e 610/30 nm, rispettivamente).- Selezionare imaging di fluorescenza-mode sullo scanner in modalità variabile. Impostare il tubo fotomoltiplicatore a 430 V o equivalente e la dimensione dei pixel di 100 x 100 um. Selezionare un laser di eccitazione (532 nm) più vicino alla lunghezza d'onda di eccitazione delle microsfere fluorescenti.
- Per il primo blocco di filtraggio, selezionare un filtro passa-banda (580/30 nm) che si sovrappone con la lunghezza d'onda di emissione delle perline fluorescenza iniettati (canale 1). Selezionare un filtro passa-banda per il blocco secondo filtro (610/30) e al di fuori dellunghezza d'onda missione (canale 2).
NOTA: Il secondo blocco di filtraggio serve come controllo negativo e rimuovere autofluorescenza mantenendo intatte le siti di iniezione. - Acquisire entrambi i lati delle fettine di agar in modalità fluorescenza dello scanner laser modalità variate mediante i due canali. Assicurarsi che ogni fetta è completamente digitalizzato, inclusi i fori di riferimento.
5. Post-processing
NOTA: Il primo passo per l'immagine di post-elaborazione è la segmentazione manuale del miocardio mediante script in-house sviluppato per tracciare l'endo- ed epicardici confini, così come i siti di iniezione. Questo è lo stesso sia per risonanza magnetica e scansioni fluorescenza.
- Segmento del miocardio nelle scansioni MRI.
- Segmento del endocardica e LV borders epicardici sulle immagini della sequenza FLAIR MRI.
- Copiare la segmentazione LV dal punto 5.1.1 al dataset LGE-MRI e segmentare la cicatrice sulla sequenza LGE MRI.
- Copiare la segmentazione miocardio dal punto 5.1.1 al T2 * pesate set di dati e di segmento le deposizioni SPIO nel miocardio LV.
- Elaborare le immagini a fluorescenza ed eseguire segmentazioni.
- Caricare i file ottenuti dallo scanner modalità variabile e rendere un'immagine separata di ogni fetta cuore in sezione trasversale.
- Capovolgere le fette scandite in base all'apice orientamento e ordinare le immagini di fluorescenza in una pila per entrambi i canali che è orientato dall'apice alla base.
- Segmento del endocardica e LV borders epicardici sulle immagini di fluorescenza.
- Segmento la cicatrice manualmente sulle immagini a fluorescenza e utilizzare il LGE-risonanza magnetica e le fotografie per confermare la morfologia cicatrice.
- Sottrarre la pila del canale 2 dalla pila immagine del canale 1 per escludere auto-fluorescenza. segmento manualmente le deposizioni microsfere fluorescenti e utilizzare il T2 * immagini per la conferma.
- Creareuna geometria 3D anatomicamente corretta, eseguire una registrazione rigida delle fette nella pila immagine a seconda delle strutture di riferimento (i fori creati dai tubi rigidi). Calcolare e memorizzare la definizione applicata e la rotazione di ciascuna immagine.
- Applicare le trasformazioni memorizzati per le pile di immagini e le segmentazioni. Linearmente interpolare le segmentazioni di entrambi i lati delle fettine di ricostruire lo spessore della fetta originale e per creare un modello 3D dei dati.
6. Analisi
- Effettuare misurazioni 2D e / o 3D della distanza tra i centri dei siti di iniezione e l'IBZ di valutare la precisione di iniezione. Misurare la distanza lungo il confine endocardico della segmentazione LV. Nella figura 2C e 2F, un esempio delle misurazioni 2D e 3D è indicato dalla linea rossa.
Risultati
Tissue Embedding
Attraverso il processo di inclusione, è stata stabilita una geometria telediastolica-like. L'agar aderito con successo al tessuto cardiaco, permettendo il tessuto da tagliare alla angolazione desiderata con spessori fetta uguali (Figura 2A e 2C).
Valutazione Scar- e al sito di iniezione
Discussione
Intero-cuore elaborazione tessuto miocardico 3D secondo questo protocollo fornisce un metodo strutturato che permette l'analisi 3D dell'infarto, l'IBZ, e le iniezioni attuate rispetto alla anatomia cardiaca. Il volume di riempimento del cuore dipende dalla analisi desiderata. In questo studio, di valutare la precisione di iniezione, abbiamo voluto riempire il cuore per assomigliare alla geometria telediastolico il più fedelmente possibile. Per imporre questo, l'apice LV è fissato al fondo del contenito...
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori desiderano ringraziare Marlijn Jansen, Joyce Visser, e Martijn van Nieuwburg per la loro assistenza con gli esperimenti su animali. Abbiamo molto riconosciamo Martijn Froeling e Anke Wassink per la loro assistenza con la risonanza magnetica per immagini.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | Braun | ||
| Agarose | Roche Diagnostics | Scientific grade multipurpose agar | |
| Biomolecular fluorescence scanner Typhoon 9410 | GE Healthcare | ||
| Embedding container | Plastic, dimensions 17 x 14.5 x 14 cm | ||
| FluoSpheres Polystyrene Microspheres | Invitrogen | F8834 | red, 10 µm |
| Gadolinium | Gadovist | 1.0 mmol/mL | |
| dS 32 channel head coil | Philips | Or similar | |
| Matlab | Mathworks | To insure compatability 2015a or newer | |
| Meat slicer | Berkel | ||
| Myostar injection catheter | Biosense Webster | ||
| Super paramagnetic iron oxide particles | Sinerem | ||
| Triphenyl-tetrazolium chloride | Merck | ||
| UPy-PEG10k | |||
| Vicryl 2-0 | Ethicon |
Riferimenti
- Nowbar, A. N., Howard, J. P., Ja Finegold, ., Asaria, P., Francis, D. P. 2014 global geographic analysis of mortality from ischaemic heart disease by country, age and income: statistics from World Health Organisation and United Nations. Int J Cardiol. 174 (2), 293-298 (2014).
- Kannel, W. B., Belanger, A. J. Epidemiology of heart failure. Am Heart J. 121 (3), 951-957 (1991).
- Ibáñez, B., Heusch, G., Ovize, M., Van De Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 65 (14), 1454-1471 (2015).
- Bartunek, J., Vanderheyden, M., Hill, J., Terzic, A. Cells as biologics for cardiac repair in ischaemic heart failure. Heart. 96 (10), 792-800 (2010).
- Orlic, D., Kajstura, J., et al. Bone marrow cells regenerate infarcted myocardium. Nature. 410 (6829), 701-705 (2001).
- Nguyen, P. K., Lan, F., Wang, Y., Wu, J. C. Imaging: Guiding the Clinical Translation of Cardiac Stem Cell Therapy. Circ Res. 109 (8), 962-979 (2011).
- Psaltis, P. J., Worthley, S. G. Endoventricular electromechanical mapping-the diagnostic and therapeutic utility of the NOGA XP Cardiac Navigation System. J Cardiovasc Transl Res. 2 (1), 48-62 (2009).
- Tomkowiak, M. T., Klein, A. J., et al. Targeted transendocardial therapeutic delivery guided by MRI-x-ray image fusion. Catheter Cardiovasc Interv. 78 (3), 468-478 (2011).
- Dauwe, D. F., Nuyens, D., et al. Three-dimensional rotational angiography fused with multimodal imaging modalities for targeted endomyocardial injections in the ischaemic heart. Eur Heart J Cardiovasc Imaging. 15 (8), 900-907 (2014).
- van Slochteren, F. J., van Es, R., et al. Multimodality infarct identification for optimal image-guided intramyocardial cell injections. Neth Heart J. 22 (11), 493-500 (2014).
- van Slochteren, F. J., van Es, R., et al. Three dimensional fusion of electromechanical mapping and magnetic resonance imaging for real-time navigation of intramyocardial cell injections in a porcine model of chronic myocardial infarction. Int J Cardiovasc Imaging. 32 (5), 833-843 (2016).
- Pape, a. C. H., Bakker, M. H., et al. An Injectable and Drug-loaded Supramolecular Hydrogel for Local Catheter Injection into the Pig Heart. J Vis Exp. (100), (2015).
- Bastings, M. M. C., Koudstaal, S., et al. A fast pH-switchable and self-healing supramolecular hydrogel carrier for guided, local catheter injection in the infarcted myocardium. Adv Healthc Mater. 3 (1), 70-78 (2014).
- Koudstaal, S., Jansen of Lorkeers, S. J., et al. Myocardial infarction and functional outcome assessment in pigs. J. Vis. Exp. (86), (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon