A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
כל 3D-לב בדיקת רקמות שריר הלב
In This Article
Summary
פרוטוקול זה מתאר שיטה חדשה השוואת 3D של רקמת שריר לב כולו-לב עם MRI. זה נועד עבור ההערכה המדויקת של זריקות intramyocardial באזור הגבול האוטם של מודל חזירי כרוני של אוטם שריר לב.
Abstract
טיפולים רגנרטיבית לב שואפים להגן ולתקן את הלב הפצוע בחולים עם מחלת לב איסכמית. באמצעות הזרקת תאי גזע או ביולוגיות אחרות שמשפרות angio- או vasculogenesis לאזור הגבול האוטם (IBZ), זלוף רקמות משתפרת, ואת שריר הלב יכול להיות מוגן מפני נזק נוסף. לקבלת האפקט הטיפולי מקסימלית, משערים כי החומר רגנרטיבית מועבר הטוב ביותר אל IBZ. זה דורש זריקות מדויקות הוביל את הפיתוח של טכניקות הזרקה חדשות. כדי לאמת את הטכניקות החדשות הללו, עצבנו פרוטוקול אימות מבוסס על בדיקת רקמות שריר לב. פרוטוקול זה כולל עיבוד רקמות שריר הלב כולו-לב המאפשר דו-מימדי (2D) מפורט תלת ממדי (3D) ניתוח של האנטומיה של הלב ואת זריקות intramyocardial. בשנת חזיר, אוטם שריר הלב נוצר על ידי חסימת 90-min של השמאלי הקדמי היורד לב כלילית. ארבעה שבועות מאוחר יותר, mixtיור של הידרוג'ל עם חלקיקי תחמוצת ברזל פאראמגנטי (SPIOs) וחרוזים פלורסנט היה מוזרק IBZ באמצעות גישה endocardial מינימלית פולשנית. 1 שעות לאחר הליך ההזרקה, היה מורדמים החזיר, והלב היה נכרת מוטבע agarose (אגר). לאחר התמצקות של אגר, הדמיה בתהודה מגנטית (MRI), חיתוך של לב, ו דימות פלואורסצנטי בוצעו. לאחר עיבוד תמונה להודעה, ניתוח 3D בוצע כדי להעריך את דיוק מיקוד IBZ. פרוטוקול זה מספק שיטה מובנית ודיר להערכת דיוק המיקוד של זריקות intramyocardial לתוך IBZ. הפרוטוקול יכול לשמש בקלות כאשר העיבוד של רקמת צלקת ו / או אימות של דיוק הזרקת הלב כולו רצוי.
Introduction
מחלת לב איסכמית הייתה הגורם המוביל בעולם של מוות עבור העשורים האחרונים 1. הטיפול האקוטי לאחר אוטם שריר הלב שואפת לשחזר את זרימת הדם לשריר הלב באמצעות התערבות כלילית מלעורית או השתלת מעקפים. בשנת אוטם חריף, שטח גדול של שריר הלב הוא מצולק, ומקרים אלה לעתים לגרום לאי ספיקת לב איסכמית (HF) 2. אפשרויות טיפול שוטף עבור הפוקוס HF על מניעה ושימור בתפקוד הלב לחולים HF, אבל לא על התחדשות.
בעשור האחרון, טיפולים רגנרטיבית לב נחקרו כאפשרות טיפול HF 3. טיפול זה נועד לספק ביולוגיות, כגון תאי גזע או גורמי גדילה, ישירות לשריר הלב הפצוע לגרום וסקולריזציה, גינת cardiomyocyte, בידול, וצמיחה 4. עבור אופטימליאפקט תרפויטי, משער כי ביולוגי חייבים להיות מוזרק באזור הגבול האוטם (IBZ) כדי להקל זלוף רקמות טוב להישרדות ביולוגית עבור אפקט אופטימלי לאזור היעד 5, 6. טכניקות מרובות פותחו כדי לבצע זיהוי להדמיה של IBZ להנחות זריקות intramyocardial 7, 8, 9, 10, 11. מלבד זיהוי להדמיה של IBZ, המשלוח גם מסתמך על החומרים הביולוגיים צנתרי הזרקה בשימוש. כדי לאמת את דיוק ההזרקה של הטכניקות המסירות, שיטת כימות מדויקת לשחזור נדרשה.
פתחנו פרוטוקול לעיבוד רקמות שריר לב כולו-לב, אשר מציע דו-ממדי (2D) ותלת dimensioהדמיה הסופית (3D), אשר ניתן להשתמש בהם למחקר איכותני וכמותי שואפת. הפרוטוקול מכסה את תהליך ההטבעה ואת ניתוח תמונה הדיגיטלי. במאמר זה, אנו מדגימים פרוטוקול הערכת דיוק המיקוד של זריקות intramyocardial ב IBZ במודל חזירי גדול של אוטם שריר לב כרוני.
Protocol
ניסוי vivo ב נערך בהתאם המדריך לטיפול ושימוש בחי מעבדה שהוכנו על ידי מכון מחקר בחיות מעבדה. הניסוי אושר על ידי ועדת ניסויים בבעלי החיים המקומית.
1. הכנת תמיסה להזרקה והטבעה
- הכן את ג'ל להזרקה.
- הכן 1 מ"ל של ureido-pyrimidinone (UPy) ג'ל בהתאם לפרוטוקולים-תיאר בעבר 12, 13.
- חלקיקי תחמוצת ברזל פאראמגנטי להוסיף (SPIOs) לפתרון לקבל ריכוז של 15 מיקרוגרם / מ"ל ומערבבים את התערובת במשך 5 דקות עבור התפלגות אחידה.
- מוסיפים את microbeads פלורסנט לפתרון לקבל ריכוז של 10,000 חרוזים / מ"ל ומערבבים את התערובת במשך 5 דקות עבור התפלגות אחידה.
- אחסן את התערובת המתקבלת בטמפרטורת החדר בסביבה חשוכה. חם מערבולת או ומערבבים tהוא פתרון זמן קצר לפני הליך ההזרקה.
- הכן את פתרון הטבעה.
- התחל עם מי ברז בטמפרטורת החדר ולהוסיף agarose (אגר) לריכוז של 4% WT.
- לאט לחמם הפתרון לנקודת הרתיחה באמצעות במיקרוגל ומערבבים לעיתים קרובות במהלך החימום. בהגיעו טמפ'רתיחה, חנות ולשמור הפתרון אגר מעל 70 מעלות צלזיוס למשך 2 שעות כדי לאפשר אוויר לכוד על פני השטח.
- אפשר אגר להתקרר בטמפרטורת החדר לטמפרטורה שבין 50 ו 60 מעלות צלזיוס עד למועד הטבעה.
2. הליך ההזרקה
- בצע premedication (סוכנים אנטי בקצב לא סדירים, טיפול אנטי טסיות, משככי כאבים), הרדמה, גישת ורידים, אינטובציה, כפי שתואר לעיל 14.
- בצעו זריקות באמצעות קטטר הזרקת intramyocardial (לוח של חומרים). עבור כל זריקה, 0.2 מ"ל של תערובת מוזרק בולוס אחד בקצב קבוע של כ 0.3 מ"ל / דקה באמצעות מכשיר הזרקה. מניח את הזריקות שהוצבו בנקודות שונות לאורך IBZ 12.
- נהל 0.2 מ"ל / ק"ג (1.0 מילימול / מ"ל) של דקות 15 חומר ניגוד המבוסס גדוליניום לפני והרדמת חסד בבעלי חיים.
- נהל 20 מ"ל של אשלגן כלורי 7.5% לווריד להרדימו.
- גישה mediastinal Secure בעקבות פרוטוקול צעדים 8.2 - 8.3, כפי שתואר על ידי Koudstaal ואח. 14. חותך את הווריד caval הנח 5 סנטימטר מן העלייה הימנית ולהסיר הנשפכת דם עם מכשיר יניקה. ובלו הלב לשטוף אותו עם מי מלח 0.9% בטמפרטורת חדר.
3. נוהל הטבעה
- הכן את הלב.
- הסר את קרום הלב מהלב, תוך שמירה על הפרוזדורים חדרים ללא פגע. לנתח האאורטה עולה ± 1 ס"מ מעל מסתם אאורטלי באמצעות Klinkenbergמספריים. חותך את הווריד caval הנח ± 1 סנטימטר מן אטריום, ולעשות את אותו הדבר עבור הוורידים ריאתי.
- לתפור את שיאו של הלב אל החלק התחתון של מיכל הטבעה פלסטיק (17 x 15 x 15 ס"מ, W x ע x ג) באמצעות תפר 2-0 כדי למנוע ציפה של הלב במהלך הטבעה (איור 1 א).
- לתפור את החלק הנותר של אבי העורקים אל שוליהן של מיכל באמצעות 2-0, מוודא כי הלב הוא מרוכז ולא לגעת בקירות של מיכל (1B איור).
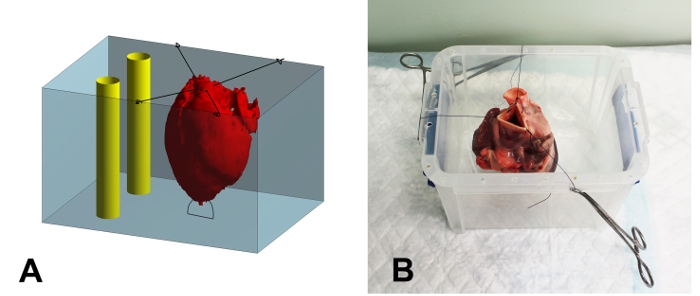
איור 1: סקירה סכמטי ולצלם של מיכל הטמעה. (א) סקירה סכמטי של תהליך ההטבעה. הלב (אדום) מאובטח בתוך המיכל (כחול) באמצעות תפרים. לאחר מילוי הלב עם הפתרון אגר, את המרחב סביב הלב מתמלא. סוף כל סוף,שני צינורות פלסטיק קשיחים (צהוב) ממוקמים בתוך המכל, ליד אבל לא נוגעים ללב, כדי לשמש כנקודת התייחסות במהלך הרשמת תמונה. (ב) צילום של לב המאובטח בתוך מכל ההטבעה. התפרים הם הידק אל השוליים של מיכל באמצעות מלחציים יתושים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של דמות זו.
- שבץ לב גיאומטריה סוף-דיאסטולי דמוי.
הערה: מניעת יצירת בועות אוויר נחוצה. אם אוויר גדול בועות נוכח הפתרון אגר, לשמור על אגר ב 40 מעלות צלזיוס, מה שמאפשר את בועות האוויר על פני השטח.- הצמד את caval הנחה וריד באמצעות מלחציים יתושים. לאט לאט להזריק את אגר נוזלים באמצעות מזרק 50 מ"ל ב אטריום ימין דרך וריד caval מעולה עד שני אטריום החדר הימני מלאים לחלוטין.
- הצמד את הוורידים ריאתי באמצעות mosquitמלחציים o. בעדינות לעבור מזרק אגר מלאות 50 מ"ל retrogradely דרך שסתומי העורקים. לאט לאט להזריק את הפתרון בחדר השמאלי (LV) עד LV ו אטריום שמאל מלא לחלוטין. לאחר מילוי LV, מהדק את אבי העורקים לשמור על אגר ב LV.
- יוצק את אגר הנותר לתוך המכל עד הלב מכוסה במלואן. מניח שני צינורות פלסטיק נוקשים בתוך מיכל ההטבעה לשמש מבני התייחסות לרישום תמונה מאוחר יותר (איור 1 א). ודא צינורות לא לגעת בקירות של מיכל או בלב.
- תנו אגר לחזק 2 - 7 ° C.
4. Image Acquisition
- בצע סריקות MRI vivo לשעבר אלכסונית של הלב כי הוא מוטבע בתוך המכל.
- מניח את המכל עם הלב המשובץ בתוך סליל ראש (לוח של חומרים).
- Angulate פרוסות במקביל לחלק התחתון של המיכל. להשתמשאוריינטציה הִזדַוּוּת אותו בכל רצף MRI vivo לשעבר.
- כדי להמחיש שריר הלב, לבצע שחזור הפוך- נחלש נוזל (פלייר) רצף עם הפרמטרים הבאים: זמן החזרה [TR] / שעה הד [TE] = 10 s / 140 ms, זווית להעיף = 90 °, גודל פיקסל = 0.5 x 0.5 מ"מ, שדה ראייה [FOV] = 169 x 169 מ"מ, 320 x 320 מטריקס, ואת העובי פרוס 3 מ"מ.
- כדי להמחיש את אוטם שריר הלב, לבצע משופרת מאוחר גדוליניום (LGE) רצף עם הפרמטרים הבאים: [TR] / [TE] = 5.53 ms / 1.69 ms, זווית להעיף = 25 °, גודל פיקסל = 1.0 x 1.0 מ"מ, [ FOV] = 169 x 169 מ"מ, 176 x 176 מטריקס, ואת עובי פרוסה 3 מ"מ.
- כדי להמחיש SPIOs, לבצע T2 * רצף הד שיפוע משוקלל עם הפרמטרים הבאים: [TR] / [TE] = 88.7 ms / 15 TES שווה-מופץ עם מגוון של 1.9 - 24.6 ms, זווית להעיף = 15 °, פיקסל size = 0.5 x 0.5 מ"מ, [FOV] = 169 x 169 מ"מ, 320 x 320 מטריקס, ואת עובי פרוסה 3 מ"מ.
- למחזור רקמותלָשִׁיר
- סובב את המיכל הפוך ולאפשר אוויר בין אגר ואת הדפנות של המיכל כדי להסיר את הפתרון אגר מוצק, כולל הלב, מן המיכל. הסר את מוטות פלסטיק מן אגר מוצק.
- סעיף הבלוק אגר המכיל את הלב בפרוסות 5 מ"מ מן הקודקוד לבסיס של הלב באמצעות מבצעה בשר. שמרו על זווית של פרוסות חתך זהה בתמונות MR נרכשה על ידי חיתוך במקביל התחתון של הבלוק אגר.
- כתם הפרוס אגר (כולל הלב) עבור 15 דק 'ב 1% WT של 2,3,5-triphenyltetrazoliumchloride (TTC) מומסים מלוח 0.9% ב 37 מעלות צלזיוס, ולצלם את הפרוסות משני הצדדים מנקודת מבט בניצב (איור 2A). בשלב הבא, יש לשטוף את פרוסות בקפידה מלוחים 0.9%.
הערה: במחקר זה, השתמשתי התקנת DSLR עם עדשה / אובייקטיבי מתאימות, חצובה, תאורה אחידה. עם זאת, הצילומים שמשו רק כביקורת על ההערכה של אזור הצלקת,כדי שנוכל השתמש התקנה שונה.
- דימות פלואורסצנטי
הערה: בהתאם אורכי גל עירור ופליטה של microbeads פלורסנט, בחר לייזרים מסנן בלוק עירור המתאים (למשל, microbeads אדום משמש כאן יש אורכי גל עירור ופליטה של 580 ננומטר ו 605 ננומטר, בהתאמה; ולכן, עירור הלייזר שנבחרו ומסננים bandpass נקבעו ל 532 ננומטר, 580/30 ננומטר 610/30 ננומטר, בהתאמה).- דימות פלואורסצנטי-mode בחר בסורק משתנה-mode. הגדר את הצינור המכפיל ל 430 V או שווה ערך ואת גודל פיקסל 100 x 100 מיקרומטר. בחר לייזר עירור (532 ננומטר) הקרוב ביותר גל עירור של microbeads פלורסנט.
- עבור בלוק המסנן הראשון, לבחור מסנן bandpass (580/30 ננומטר) שחופף עם אורך גל הפליטה של חרוזי קרינה המוזרקים (ערוץ 1). בחר מסנן bandpass עבור בלוק המסנן השני (610/30) מחוץ eגל משימה (ערוץ 2).
הערה: הבלוק המסנן השני משמש כביקורת שלילית וכדי להסיר קרינה אוטומטית תוך שמירת המוזרקים שלמות. - סרוק משני צידי פרוסות אגר במצב הקרינה של סורק הלייזר משתנה-mode באמצעות שני ערוצים. ודא כי כל פרוסה נסרקה לחלוטין, כולל חורי ההפניה.
5. לאחר עיבוד
הערה: השלב הראשון שלאחר עיבוד תמונה הוא הפילוח הידני של שריר הלב באמצעות בתוך בית סקריפטים פותחו כדי לעקוב אחר פְּנִים וגבולות epicardial, כמו גם באתרי ההזרקה. זה זהה עבור MRI היא סריקות פלואורסצנטי.
- קטע שריר הלב ב סריקות MRI.
- לפלח את endocardial וגבולות LV epicardial על תמונות ברצף FLAIR MRI.
- העתק את פילוח LV משלב 5.1.1 מערך הנתונים LGE-MRI מגזר הצלקת על רצף MRI LGE.
- העתק את פילוח שריר הלב משלב 5.1.1 ל T2 * נתוני מגזר משוקללים תצהירי SPIO ב שריר לב LV.
- לעבד את תמונות הקרינה ולבצע בפילוחים.
- טען את הקבצים מתקבלים הסורק משתנה-mode ולעשות דמות נפרדת כל פרוסת לב חתך.
- תהפכו את פרוסות שנסרקו בבסיס עד לקודקוד אוריינטציה למיין את התמונות הקרינה לתוך ערימה של שני הערוצים מכוונת מן הקודקוד לבסיס.
- לפלח את endocardial וגבולות LV epicardial על תמונות הקרינה.
- קטע הצלקת באופן ידני על תמונות הקרינה ולהשתמש LGE-MRI לסרוק את התמונות כדי לאשר מורפולוגיה צלקת.
- הפחת את ערימת התמונה של ערוץ 2 מערימת התמונה של ערוץ 1 להדיר קרינה אוטומטית. ידני קטע תצהירי microbead פלורסנט ולהשתמש T2 * תמונות עבור אישור.
- ליצורגיאומטרית 3D אנטומית-נכונה, לבצע רישום נוקשה של הפרוסות בערימת התמונה על סמך מבני ההפניה (החורים שנוצרו על ידי הצינורות הקשיחים). חישוב ולאחסן את התרגום מיושם וסיבוב של כל תמונה.
- החל את השינויים מאוחסנים על ערימות תמונה ואת בפילוחים. באופן ליניארי לשרבב בפילוחים של שני הצדדים של הפרוסות לשחזר את עובי הפרוסה המקורי כדי ליצור מודל 3D של הנתונים.
6. ניתוח
- בצע מדידות 2D ו / או 3D של המרחק בין המרכזים של המוזרקים ואת IBZ להעריך את דיוק ההזרקה. מדדו את המרחק לאורך הגבול endocardial של פילוח LV. באיור 2C ו 2F, דוגמא של מדידות 2D and 3D מצוינת על ידי הקו האדום.
תוצאות
הטבעת רקמות
באמצעות תהליך ההטבעה, גיאומטריה סוף-דיאסטולי דמוי הוקמה. אגר דבק בהצלחת רקמת הלב, מה שמאפשר הרקמה להיות פרוס על זִוּוּת הרצוי עם עוביים פרוסים שווים (איור 2 א ו 2C).
...Discussion
כל 3D-לב עיבוד רקמות שריר לב פי פרוטוקול זה מספק שיטה מובנית המאפשרת ניתוח 3D של האוטם, את IBZ, ואת הזריקות בצעו ביחס האנטומיה של הלב. נפח המילוי של הלב תלוי בניתוח הרצוי. במחקר זה, כדי להעריך את דיוק ההזרקה, אנו מכוונים כדי למלא את הלב להידמות הגיאומטריה דיאסטולי-סוף ככל הא...
Disclosures
החוקרים אין לחשוף.
Acknowledgements
המחברים מבקשים להודות Marlijn ינסן, ג'ויס ויסר, ו Martijn ואן Nieuwburg על עזרתם עם ניסויים בבעלי חיים. אנחנו מאוד מודים Martijn Froeling ואנקה Wassink על עזרתם עם הדמיה MRI.
Materials
| Name | Company | Catalog Number | Comments |
| 0.9% Saline | Braun | ||
| Agarose | Roche Diagnostics | Scientific grade multipurpose agar | |
| Biomolecular fluorescence scanner Typhoon 9410 | GE Healthcare | ||
| Embedding container | Plastic, dimensions 17 x 14.5 x 14 cm | ||
| FluoSpheres Polystyrene Microspheres | Invitrogen | F8834 | red, 10 µm |
| Gadolinium | Gadovist | 1.0 mmol/mL | |
| dS 32 channel head coil | Philips | Or similar | |
| Matlab | Mathworks | To insure compatability 2015a or newer | |
| Meat slicer | Berkel | ||
| Myostar injection catheter | Biosense Webster | ||
| Super paramagnetic iron oxide particles | Sinerem | ||
| Triphenyl-tetrazolium chloride | Merck | ||
| UPy-PEG10k | |||
| Vicryl 2-0 | Ethicon |
References
- Nowbar, A. N., Howard, J. P., Ja Finegold, ., Asaria, P., Francis, D. P. 2014 global geographic analysis of mortality from ischaemic heart disease by country, age and income: statistics from World Health Organisation and United Nations. Int J Cardiol. 174 (2), 293-298 (2014).
- Kannel, W. B., Belanger, A. J. Epidemiology of heart failure. Am Heart J. 121 (3), 951-957 (1991).
- Ibáñez, B., Heusch, G., Ovize, M., Van De Werf, F. Evolving therapies for myocardial ischemia/reperfusion injury. J Am Coll Cardiol. 65 (14), 1454-1471 (2015).
- Bartunek, J., Vanderheyden, M., Hill, J., Terzic, A. Cells as biologics for cardiac repair in ischaemic heart failure. Heart. 96 (10), 792-800 (2010).
- Orlic, D., Kajstura, J., et al. Bone marrow cells regenerate infarcted myocardium. Nature. 410 (6829), 701-705 (2001).
- Nguyen, P. K., Lan, F., Wang, Y., Wu, J. C. Imaging: Guiding the Clinical Translation of Cardiac Stem Cell Therapy. Circ Res. 109 (8), 962-979 (2011).
- Psaltis, P. J., Worthley, S. G. Endoventricular electromechanical mapping-the diagnostic and therapeutic utility of the NOGA XP Cardiac Navigation System. J Cardiovasc Transl Res. 2 (1), 48-62 (2009).
- Tomkowiak, M. T., Klein, A. J., et al. Targeted transendocardial therapeutic delivery guided by MRI-x-ray image fusion. Catheter Cardiovasc Interv. 78 (3), 468-478 (2011).
- Dauwe, D. F., Nuyens, D., et al. Three-dimensional rotational angiography fused with multimodal imaging modalities for targeted endomyocardial injections in the ischaemic heart. Eur Heart J Cardiovasc Imaging. 15 (8), 900-907 (2014).
- van Slochteren, F. J., van Es, R., et al. Multimodality infarct identification for optimal image-guided intramyocardial cell injections. Neth Heart J. 22 (11), 493-500 (2014).
- van Slochteren, F. J., van Es, R., et al. Three dimensional fusion of electromechanical mapping and magnetic resonance imaging for real-time navigation of intramyocardial cell injections in a porcine model of chronic myocardial infarction. Int J Cardiovasc Imaging. 32 (5), 833-843 (2016).
- Pape, a. C. H., Bakker, M. H., et al. An Injectable and Drug-loaded Supramolecular Hydrogel for Local Catheter Injection into the Pig Heart. J Vis Exp. (100), (2015).
- Bastings, M. M. C., Koudstaal, S., et al. A fast pH-switchable and self-healing supramolecular hydrogel carrier for guided, local catheter injection in the infarcted myocardium. Adv Healthc Mater. 3 (1), 70-78 (2014).
- Koudstaal, S., Jansen of Lorkeers, S. J., et al. Myocardial infarction and functional outcome assessment in pigs. J. Vis. Exp. (86), (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved