需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
透射电镜 hFOB 1.19 和 Saos-2 细胞产生的能量色散 X 射线显微分析
摘要
我们提出一个协议, 以比较的矿物质在囊泡释放的两个人骨细胞系: hFOB 1.19 和 Saos-2。利用茜素红 s (AR) 染色、紫外 (紫外) 光可视化、透射电镜 (TEM) 成像和能量色散 X 射线显微分析 (EDX) 对其成矿剖面进行了研究。
摘要
本视频介绍了利用透射电镜与能量色散 X 射线微分析 (TEM-EDX) 比较的矿物质在囊泡释放的两个人骨细胞线: hFOB 1.19 和 Saos-2。这些细胞系, 经抗坏血酸 (AA) 和β甘油 (β GP) 治疗后, 经过完全成骨分化, 从增殖到成矿, 产生基质泡 (mv), 触发磷灰石成核在细胞外基质 (ECM)。
基于茜素红 s (AR) 染色, 利用透射电镜成像和 EDX 定量和离子图谱对细胞裂解物中的矿物质组成进行分析, 并对其进行了研究, 得出了 Saos-2 和成骨肉瘤hFOB 1.19 细胞显示出明显的矿化剖面。Saos-2 细胞比 hFOB 1.19 细胞矿化更有效, 并产生较大的矿床, 在紫外光下不可见, 但与羟基磷灰石 (HA) 相似, 因为它们有更多的钙和 F 替代物。
利用这些技术得到的结果使我们得出结论, 矿化过程的不同取决于细胞类型。我们建议, 在细胞层面上, 囊泡的起源和性质预先确定了矿物质的类型。
引言
骨是由两部分组成的结缔组织: 有机 (细胞和胶原纤维) 和矿物质 (钙和磷酸盐化合物)。骨中主要矿物成分为磷灰石1。不同类型的成矿能力的细胞在骨 (成骨细胞), 在牙齿 (成牙本质细胞) 和软骨 (软骨细胞) 通过产生细胞外基质 (ECM) 和释放基质的蛋白质来调节矿化的初始步骤囊泡 (mv) (图 1)。100-300 毫微米直径囊泡, 积累钙和磷酸促进磷灰石成核, 随后绑定到胶原蛋白2,3。然后, 磷灰石释放到胞外培养基中。磷灰石继续与胶原纤维接触, 形成骨基质。矿化由 Pi和钙2 +在胞外培养基中的恒定供给维持。最近发布的一些数据支持我们的模型4,5。软组织在生理条件下不矿化。然而, 异位钙化可能发生在病理条件下, 如血管钙化3。获得成骨细胞表型的血管细胞可产生诱导磷灰石的核化, 并在血管壁内侧和内膜层启动成矿作用。由于异位钙化类似于正常的软骨矿化3, 了解骨细胞和软骨细胞成矿作用的分子机制, 应为软组织异位钙化提供一些线索。形成。
骨骼组织的发育受各种酶、生长因子、成矿作用的促进剂或抑制剂的调节。组织非特异性碱性磷酸酶 (TNAP) 的拮抗作用 (图 1) 和 ectonucleotide 焦磷酸酶/磷酸二酯化 I (NPP1), 连同锚蛋白 (谢谢), 控制无机焦磷酸盐 (PPI) 浓度6. PPi, 一种有效的 HA 形成抑制剂, 由 TNAP 水解;NPP1 水解核苷酸 triphosphates 形成 ppi , 而谢谢出口 ppi从细胞到 ECM。Pi/PPi 比率可能调控磷灰石形成7,8以可能的病理后果9。
MV 膜富含离子传输蛋白, 在核过程中促进了钙和磷酸盐的初始沉淀 (图 1)。磷酸盐传送器 1 (坑) 帮助合并 Pi生成在 perivesicular 空间入10,11。Annexins 可能涉及 Ca2 +的结合和运输, 以及在 MV 腔12,13中启动矿化的生物物理过程中。我们赞成早些时候提出的假说, 即在其在 ECM14、15中传播之前, 在 MV 内的磷灰石内部成核的胞质囊泡中的矿化。体外建模证实了从 PS 和 AnxA516的 proteoliposomes 中诱导的钙2 +/Pi复合物的形成。这可能表明, 钙2 +, Pi, AnxA5 和 PS 配合物在微绒毛状的 membranesrepresent 中的核核 (NC) 在 M 的 Annexins 和 TNAP也具有胶原结合可能有助于在胶原纤维上放置 mv, 并在促进电解质中的矿化传播方面的能力。牛胎球蛋白 A 和骨桥蛋白 (OPN)17, 被称为磷灰石形成抑制剂, 可能减慢矿化在胶原支架上的传播。成核和传播是不同的事件, 前者前, 两者可能与病理成矿过程有关。
为了发现磷酸钙络合物的化学物质如何改变生理成矿作用和异位钙化, 有必要确定细胞产生的矿物质。磷灰石是一组含有矿物质的钙和磷酸盐, 一般晶体单元细胞配方钙10(PO4)6X2, 其中 X = Cl, F, OH。分类如下18: 氟磷灰石 (FA) 钙10(PO4)6F2, chlorapatite (ca) Ca10(PO4)6Cl2和羟基磷灰石 (HA) 钙10(po4)6(OH)2。
由于每一个细胞系都呈现出明显的矿化特征, 因此选择成骨细胞系诱导矿物形成是至关重要的。在这份报告中, 我们比较了两个选定的人体细胞模型的矿物成核: 成骨 hFOB 1.19 细胞和骨肉瘤 Saos-2 细胞。骨肉瘤衍生细胞通常被用作成骨模型, Saos-2 细胞保存了最成熟的成骨19 , 而未分化的人胎儿 hFOB 细胞作为正常成骨模型被广泛使用。分化20。用不同的方法分析了它们的成矿剖面: 茜素红 s (AR) 染色、紫外 (紫外) 光可视化、透射电镜 (TEM) 成像、能量色散 X 射线微分析 (EDX) 定量和离子映射。EDX 在以往研究中使用的替代技术的优势在于, 它给出了4、5、21磷灰石晶体中离子置换的定量和定性结果。利用 TEM EDX 的总体目标是在成矿过程的不同阶段, 寻找一种简单的方法, 用于成像和定量的各种矿物中的钙、F 和 Cl 离子的分布。该方法成功地用于监测锌纳米粒子与共存化学物质的相互作用及其对水生生物的联合作用22。在另一项研究中, 用电感耦合等离子体发射光谱 (ICP)、N2 储 (注)、XRD、紫外-比 DRS、红外光谱、拉曼光谱等方法, 对钛材料在水溶液中的铜光催化剂进行了广泛的表征。光谱学, 透射电镜 EDX 和光电测量23。我们的目的是比较两个细胞系中的囊泡和矿物质的来源和性质, 以了解在骨分化过程中控制成矿作用的机制。
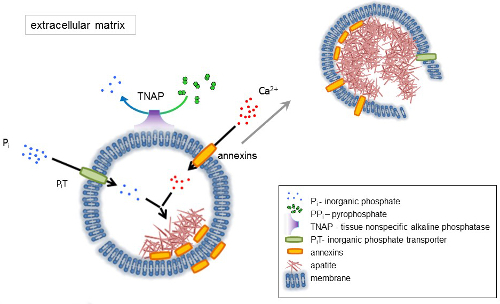
图 1.从膜中合成细胞外基质 (ECM) 蛋白和释放基质泡 (mv) 的骨细胞中初始化的步骤方案。通过钙结合蛋白、annexins 和磷酸酯的作用, 通过无机磷酸盐转运体 (坑) 的作用, 通过组织非特异碱性磷酸酶 (TNAP) 的活性来积累钙, dephosphorylatesPPi对 Pi, 从而促进磷灰石成核。然后, 磷灰石分解并释放出细胞外培养基。矿化由 Pi和 Ca2 +在胞外介质4,5的恒定供应维持。请单击此处查看此图的较大版本.
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 细胞培养和治疗
- 将所有必要的材料放在层流罩下, 并在紫外线照射下消毒。文化媒介是: 1:1 混合火腿的 F12 和 DMEM 培养基与2.5 毫米 l-谷氨酰胺补充100的 u/毫升青霉素, 100 U/毫升链霉素, 0.3 毫克/毫升 G418 和10% 胎牛血清 (v/v) 为人类胎儿 hFOB 1.19 SV40 大 T 抗原转染成骨细胞, 和麦考伊的5A 培养基与1.5 毫米 l-谷氨酰胺补充 100 u/毫升青霉素, 100 u/毫升链霉素和15% 血清 (v/v) 的人骨肉瘤 Saos-2 细胞。
- 文化 hFOB 1.19 个细胞在34°c 在 5% co2和 Saos-2 细胞的大气在37°c 在 5% co 2 的大气中.转移细胞培养, 无论是 hFOB 1.19 或 Saos-2 细胞, 从孵化器到层流罩, 并改变培养基到10毫升的新鲜培养基与血清。
- 孵化细胞无刺激 (休息细胞) 或刺激他们与50µg/毫升抗坏血酸 (AA), 其次是7.5 毫米β-甘油 (β GP), 早在超纯水制备和过滤通过0.22 µm 注射器过滤器。将刺激从塑料离心管添加到培养基表面。轻轻搅动培养皿, 孵育7天。
2. 钙矿物的检测
- 用磷酸盐缓冲盐水冲洗细胞培养物 (PBS: 125 毫米氯化钠, 5 毫米氯化钾, 10 毫米 Na2HPO4, 1 毫米,2 PO4, pH 7.0)。
- 在 PBS 中加入5毫升的 2% (g:100 毫升) AR, pH 5.0, 并孵化出30分钟的板材以染色矿物质。
- 用 PBS 洗3次。小心地将 PBS 添加到碟壁上, 尽量不要破坏矿物质。
- 在倒置光显微镜下观察钙矿物, 并拍摄图像。
3. 紫外光下探头的可视化
- 对于细胞裂解物, 治疗细胞培养, 无论是休息或刺激7天, 根据胶原酶消化协议24。
- 从细胞培养中收集培养基, 用 PBS 冲洗细胞。
- 在0.25 米蔗糖、0.12 米氯化钠、0.01 米氯化钾和0.02 米三盐酸缓冲液中, 用3毫升 500 U/毫升胶原酶的细胞消化, pH 7.45, 在37摄氏度为 3 h。
- 机械刮细胞, 转移到塑料离心管, 并通过10次1毫升 40 U 注射器与 0.5 x 16 针。
- 离心样品在 500 x g 5 分钟。
- 在500µL 合成软骨淋巴中丢弃上清和悬浮细胞颗粒 (SCL, 100 毫米氯化钠, 12.7 毫米氯化钾, 0.57 毫米氯化镁2, 1.83 毫米 NaHCO3, 0.57 毫米 NaH2PO4, 5.5 毫米 d-葡萄糖, 63 毫米蔗糖, 16.5 毫米 Hepes, pH 7.4)。
- 将羟基磷灰石 (HA)、氟磷灰石 (FA) 和 chlorapatite (CA) 粉从 UV transilluminator 上的瓶子中转移到刮刀上, 并作为控制剂使用。
- 将细胞裂解物从塑料管中转移到塑料尖上, 并小心地放在 UV transilluminator 上。
- 在可见光和紫外线照射下拍摄图像。
4. EDX 探针的制备
- 用于阴性染色的矿物质的制备
- 悬浮2.5 毫克综合生产 HA, CA 和 FA 矿物25在500µL 的去离子水和孵化在37°c 在一个大气 5% CO2为 1 h。
- 将 Formvar/碳300网格镍网从盒中带抗静电钳, 放置在瓷质多孔板上, 在网格上放置10µL 的 HA、CA 和 FA 悬浮液。
- 在室温下将样品干燥30分钟。
- 嵌入26的静止和受激细胞的制备
- 从细胞培养中收集培养基, 用生理脱敏 (PD) 培养基 (125 毫米氯化钠, 5 毫米氯化钾, 10 毫米 NaHCO3, 1 毫米的 HEPES,2 厘米, 4 毫米葡萄糖, 10 毫米, pH 20) 冲洗细胞。
- 固定细胞与5毫升的混合物 3% (g:100 毫升) paraformaldehyde/1% (g:100 毫升) 戊二醛在100毫米磷酸钠缓冲, pH 7.2, 为 1 h 在室温下的通风罩。
- 用5毫升100毫米磷酸钠缓冲液冲洗细胞, 洗涤后轻轻取出缓冲液。
- 在暗室中, 将样品与2毫升 1% (g:100 毫升) 锇毒气在100毫米磷酸钠缓冲液中, pH 为 7.2, 在室温下为20分钟的烟罩。
- 除去锇毒气并利用它。
- 用5毫升100毫米磷酸钠缓冲液冲洗细胞。
- 然后, 在室温下, 在5毫升的乙醇溶液系列的整除数中脱水样品: 25% (按卷) 为5分钟, 50% (按卷) 为10分钟, 75% (按卷) 为15分钟, 90% (按卷) 为20分钟。最后使用绝对乙醇两次, 孵育30分钟和12小时。
- 机械刮伤细胞从塑料培养皿, 收集成塑料离心管和离心机的样品在 130 x g 1 分钟。
- 将 LR 白色树脂和绝对乙醇混合物的1毫升中的细胞上清液, 并将其悬浮在1:2 的体积比上。
- 在使用前混合好玻璃管的含量, 室温下孵育30分钟。
- 离心样品在 130 x g 1 分钟。
- 去除上清液, 重复前一步骤使用1毫升的1:1 混合物的 LR 白色树脂和绝对乙醇。
- 在室温下拌匀, 孵育30分钟。
- 离心样品在 130 x g 1 分钟。
- 删除上清液。
- 最后, 将1毫升纯 LR 白树脂加入样品两次, 在室温下在塑料管中孵育1小时。
- 将每个样品的500µL 到明胶胶囊中。
注: 样品用一小张纸和一支铅笔标记, 这样树脂就不会破坏标签。 - 关闭明胶胶囊, 放入塑料离心管和离心机, 在 130 x g 1 分钟的摆动转子。
- 使用真空泵从塑料管上取出胶囊。
- 将样品移动到烤箱, 聚合56摄氏度, 48 小时。
- 将这些块装入支架并将它们修剪到金字塔上。
- 将持有者放入 ultramicrotome 中, 附着金刚石超45°刀, 并用去离子水填充;记得要清洁刀片的附带气泡。
- 然后切割部分 (700 Å) 使用钻石刀到去离子水浴。
- 使用牛睫毛设置废料, 并将它们放在 Formvar/碳300网状镍网的光亮面上晾干。
- 在黑烟罩下, 用绝对乙醇制备 2.5% (按卷) 醋酸铀。把醋酸铀放在铅容器里, 记住不要捡起沉淀物。
- 在黑暗的房间里, counterstain 了合成磷灰石和细胞样本的网格, 用 2.5% (由卷) 醋酸铀在乙醇中的20分钟室温下在通风罩下。
- 用50% 乙醇 (按卷) 清洗网格, 然后在去离子水中, 室温干燥24小时。最后, 把网格放进盒子里。
5. TEM-EDX 分析
- 透射电子显微镜 (tem) 配全量程能量色散 X 射线显微分析 (EDX) 系统和11像素摄像头的 tem 成像
- 准备一个铍持有人观察矿物和细胞。使用抗静电工具。
- 卸下双螺钉, 将铍板和铍垫圈从固定器的其余部分提起。
- 登上网格, 闪亮的一面, 在持有人。
- 小心地放置铍垫圈和铍板, 拧紧螺钉。
- 把支架放进真空室, 打开真空泵。
- 一旦真空达到, 轻轻地将支架插入成像腔并打开光束。
- 在荧光显示器上, 设置显微镜的孔径参数。执行图像散光校正;设置缩放、焦点和框架;并采取透射电镜图像放大50,000X。
- 用于光谱和成分分析的茎显像和 X 射线微透析
- 将能量色散 X 射线 (EDX) 探测器插入扫描透射电镜 (脑干) 成像室。
- 调整焦点模式中图像的锐度。
- 以15,000X 的放大倍数拍摄茎图。
- 在样本中选择一个点, 用于 X 射线微量分析和收集光谱。
- 通过对样本中周期表中所有元素的所有原子权重求和 (如 100%) 来获取数据, 并表示所选元素的内容: Ca、F、Cl 和 P (如 atomic%)。然后, 计算每个样品的钙、F 或 Cl 对 P 的比值。
- 离子映射
- 选取钙、氟、氯、磷等元素进行离子映射, 并对样品中所选元素进行 EDX 映射。
- 通过指示分析元素的本地化: ca、f、Cl 和 P (作为原子%) 来获取数据, 并计算每个样本的 ca、f 或 Cl 的协定位 (%)。
Access restricted. Please log in or start a trial to view this content.
结果
EDX 允许在体外成像的基质囊泡 (mv) 释放的矿化细胞和矿物生产的 MVs.利用该技术得到的结果表明, 矿化过程可能会有不同的进展。在不同类型的细胞中。两个细胞系接受相同的成骨细胞转分化治疗, 但刺激 Saos-2 单元矿化更有效地比 hFOB 1.19 成骨细胞, 由 AR 染色证明 (图 2)。这可能是由于更成熟的成骨细胞表型的 Saos-2 单元19
Access restricted. Please log in or start a trial to view this content.
讨论
在本文中, 我们描述了 AR 染色的协议, 氟磷灰石的紫外光识别和透射电镜-EDX 的体外成像中的矿化细胞和磁气产生的矿物质.通过遵循一些常见的故障排除步骤, 可以解决上述所有方法。为了获得最佳结果, 应该仔细地执行几个关键步骤。首先, 最好添加 AA (酸性), 其次是β GP (碱性), 以保持培养基的 pH 值7.4。其次, 经过 AR 染色后, 染色的钙沉积物非常脆弱, 细胞应小心清洗, 以防止在添加 ...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者声明他们没有利益冲突。
致谢
MK 和要求执行手工操作和 LB 准备的图纸和制作的电影。问写的手稿, LB 写的剧本和 MK 准备的表。SM、RB 和 SP 认真阅读了表、剧本和手稿。作者感谢汉娜 Chomontowska 为 ultramicrotomy 以及叔父 Suski 和亨瑞 Bilski 提供了出色的协助, 他们对 TEM EDX 分析提供了出色的帮助。作者要感谢帕特里克林博士的专业英语语言更正和芭芭拉 Sobiak 记录的指示。
这项工作得到波兰科学和高等教育部赠款 N N401 140639 的支持, 由国家科学中心提供赠款, 波兰 2016/23/n/NZ4/03313 至磅和 2016/23/n/NZ1/02449 至 MK, 欧盟 FP7 项目 BIOIMAGINE: 生物成像在研究创新和教育, GA 264173, 和由 Nencki 实验生物学研究所的法定资金, 波兰科学院。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D | for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
参考文献
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -L., Chien, C. -C., Chiu, I. -M., Huang, H. -I., Chen, Y. -C., Hu, H. -I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O'Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O'Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。