このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
HFOB 1.19 によって生成される鉱物と Sao 2 セルを使用して透過型電子顕微鏡エネルギー分散型 x 線微小分析での分析
要約
小胞の 2 つの人間の骨細胞によって放出における鉱物の状態を比較するためのプロトコルを提案する: hFOB 1.19 と Sao 2。自分の鉱化作用のプロファイルによってアリザリン赤-S (イオウ) 染色, 紫外線 (UV) 光可視化、伝達電子顕微鏡検査 (TEM) イメージング、エネルギー分散型 x 線微小分析 (EDX) を行った。
要約
このビデオは、エネルギー分散型 x 線微小分析 (TEM EDX) 小胞の 2 つの人間の骨細胞によって放出における鉱物の状態を比較すると透過型電子顕微鏡の使用を提示: hFOB 1.19 と Sao 2。アスコルビン酸 (AA) と β-グリセロリン酸 (β-GP)、治療後、これらの細胞株における鉱化完全な骨増殖から分化転換を受けるし、アパタイト核生成をトリガーするマトリックスの小胞 (MVs) を生成、細胞外マトリックス (ECM)。
アリザリン赤 S (イオウ) の染色と紫外線 (UV) を使用してセル lysates または続いて EDX 定量とイオン マッピング TEM 画像を用いたベシクルの鉱物組成の分析に基づいて、我々 はその骨肉腫を推論できる Sao 2 及び骨芽細胞hFOB 1.19 セルでは、異なる鉱化作用プロファイルを明らかにします。Sao 2 セル hFOB 1.19 細胞よりもより効率的に石化し、は紫外線の下で見えないがであるより多くの Ca と F の置換ハイドロキシアパ タイト (HA) に類似しているより大きい鉱物沈殿物を作り出します。
これらの技術を使用して得られた結果は、鉱化作用のプロセスがセルの種類によって異なることを結論することできます。細胞レベルでは、小胞の起源性事前鉱物の種類を提案します。
概要
骨は 2 つの部分から成る結合組織の種類: 有機性 (細胞と膠原線維) とミネラル (カルシウムとリン酸の化合物)。骨の主な無機成分は、アパタイト1です。骨 (骨芽細胞)、歯 (象牙芽細胞) および軟骨 (軟骨) の鉱化作用有能なセルの種類鉱化作用の初期の段階を調節する細胞外マトリックス (ECM) の蛋白質を生産し、行列を離すこと小胞 (MVs) (図 1)。MVs は 100-300 nm 径小胞カルシウムとアパタイト核生成を促進するリン酸を蓄積し、その後コラーゲン2,3にバインドします。その後、細胞外媒体にアパタイトを解放する MVs が崩壊します。アパタイトは、コラーゲン線維と接触して成長し、骨マトリックスを形成し続けます。石灰化は、P は私と Ca2 +細胞中の一定した供給によって支えられています。いくつかの最近公開されたデータは、当社モデル4,5をサポートします。軟部組織は生理学的条件下で石化しません。ただし、異所性石灰化は、血管石灰化3など病理学的条件下で生じる。血管の細胞、骨芽細胞の表現型を取得は、アパタイトの核形成を誘導し、血管の壁の内側と内膜層の鉱化作用を開始して MVs を生成できます。異所性石灰化以来正常軟骨石灰化3、骨細胞の石灰化の分子機構の解明に似ており、軟骨、軟組織の異所性石灰化のいくつかの手がかりを提供形成されます。
骨格組織の開発は、様々 な酵素、成長因子、プロモーターや鉱化作用の阻害剤によって調整されます。拮抗作用組織非特異型アルカリホスファターゼ (TNAP) (図 1) と ectonucleotide ピロホスファターゼ/ホスホジエステラーゼの私 (NPP1)、アンキリン (アンク) と制御 (PP私) 無機ピロリン酸濃度6TNAP; で加水分解 PP私、ハ形成の強力な阻害剤。NPP1 では、アンクがセルから ECM に PP は私をエクスポート中 PP は私を形成するヌクレオチド三リン酸塩を加水分解します。Pi/PPi 比は、アパタイト形成7,8可能な病理学的結果9を調整するかもしれない。
MV の膜は、イオン輸送タンパク質核形成過程 (図 1) 中のカルシウムとリン酸、MVs の中の初期析出を促進することで濃縮されています。リン酸輸送体 1 (PiT) は、P私MVs10、11perivesicular 空間の生成を組み込むのに役立ちます。アネキシンは、バインドし、Ca2 +の輸送と MV ルーメン12,13の鉱化作用を開始する生物物理プロセスにかかわることも。述べましたが、ECM14,15中を伝搬する前に MV の中のアパタイトの内部の核細胞質内小胞内鉱化作用の仮説を支持します。In vitroモデルは、Ca2 +/P私錯体形成16PS と AnxA5 から作られたプロテオリポソームの誘導を確認しました。その蓄積可能性がありますの Ca2 +P私、微絨毛のような membranesrepresent M対アネキシンと TNAP 内アパタイトの核生成コア (NC) の脂質ラフトの AnxA5 と PS の錯体は、コラーゲン結合をまた所有しています。コラーゲン線維に沿って MVs を配置して、ECM の鉱化作用の伝播を刺激することで役立つことができる能力。フェツイン、オステオポンチン (OPN)17は膠原線維の足場に鉱化作用の伝播が遅くアパタイト形成の阻害剤として知られています。核生成と伝播が異なるイベント、上記後者の元と両方が病理学的無機化プロセスに関連する可能性があります。
カルシウム複合体の化学的性質がどのように変化生理的石灰化と異所性石灰化を発見し、細胞によって生成される鉱物を識別するために必要です。アパタイト カルシウムとリン酸鉱物、一般的な結晶単位セル数式 Ca10(PO4)6X2のグループは、ここで、X = Cl, F, オハイオ。18次のように分類されます: アパタイト (FA) Ca ハイドロキシアパ タイト (HA) Ca10(PO4アパタイト (CA) Ca10(PO4)6Cl2 10(PO4)6F2)6(OH)2。
鉱物の形成を誘導する骨芽細胞のセルラインの選択は、各セルライン鉱化作用の異なるプロファイルを表わすので、重要です。本報告では、鉱化作用の 2 つの選択したひと細胞モデルによる鉱物の核形成を比較: 1.19 骨芽細胞 hFOB 細胞と細胞骨肉腫 Sao 2。骨肉腫由来細胞の骨芽細胞のモデルとして使われ、Sao 2 細胞は未分化のヒトの胎児 hFOB 細胞は骨芽細胞の通常のモデルとして幅広く使われている間最も成熟した骨芽細胞の文字19を維持してきた分化20。鉱化作用のプロファイルは、さまざまな方法によって分析された: アリザリン赤 S (イオウ) の染色、紫外線 (UV) 光の可視化、透過電子顕微鏡 (TEM) イメージング、エネルギー分散 x 線 (EDX) の微量分析の定量、およびイオンマッピング。以前の研究で使用される代替技術上の TEM EDX の利点は、アパタイト結晶4,5,21イオン交換の定量的および定性的な結果を与えるということです。TEM EDX を使用しての全体的な目標は、イメージングおよび石灰化過程の異なる段階で細胞の種類から様々 なミネラル Ca、F および Cl イオンの分布の定量化のため簡単な方法を見つけることだった。このメソッドが正常に使用されて、たとえば、共存する化学物質と亜鉛ナノ粒子との結合に及ぼす水生生物22の相互作用を監視するため。別の研究で銅触媒水溶液中でのチタン材料を広く誘導結合プラズマ発光分光分析法 (ICP-OES) N2 物理吸着 (ベット) によって特徴付けられた XRD, 紫外-可視 DRS、FT-IR、ラマン分光法、電子顕微鏡 EDX、および光電気化学測定23。私たちの目的は、小胞および石灰化骨分化を制御するメカニズムを理解する 2 つのセルラインの鉱物の性質と起源を比較しました。
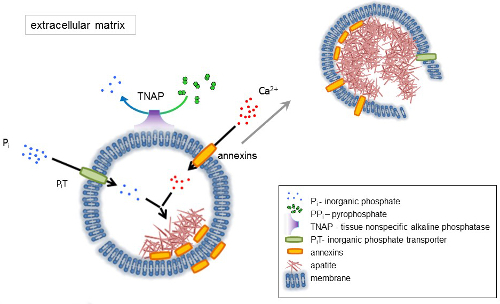
図 1.骨細胞の細胞外マトリックス (ECM) 蛋白質合成と膜からマトリックスの小胞 (MVs) のリリースにおける鉱化作用の初期の段階の。MVs は、リン酸、無機リン酸トランスポーター (PiT) の作用により組織非特異的アルカリホスファターゼ (TNAP) 脱する活動が続く、アネキシン カルシウム結合蛋白質の作用によりカルシウムを蓄積します。PP私P は私、それによってアパタイト核生成を促進します。その後、MVs は崩壊して細胞外媒体にアパタイトをリリースします。石灰化は、P は私と Ca2 +細胞外媒体4、5の安定供給によって支えられています。この図の拡大版を表示するのにはここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. 細胞の培養と治療
- 層流フードの下で必要なすべての材料を入れ、紫外線の下でそれらを殺菌します。文化メディア: 1:1 の混合物ハムの F12 と DMEM メディア 2.5 mM L グルタミンを添加した 100 U/mL ペニシリン、100 U/mL ストレプトマイシン、0.3 mg/mL G418、10% ウシ胎児血清 (FBS) (v/v) 胎児 hFOB 1.19 SV40 large T 抗原の導入のため骨芽細胞と 1.5 mm L グルタミン 100 U/mL ペニシリン、100 U/mL ストレプトマイシン、15% を添加したマッコイの 5 a 媒体 Sao 2 ひと骨肉腫細胞の FBS (v/v)。
- 5% CO2の雰囲気の中で 34 ° C で hFOB 1.19 細胞と 5% の雰囲気の中で 37 ° C で Sao 2 細胞文化 CO2.層流フードのインキュベーターから細胞培養、hFOB いずれか 1.19 または Sao 2 のセルを転送し、媒体を FBS で新鮮な培養液 10 mL に変更します。
- (静止期細胞) を刺激することがなくセルを孵化させなさいまたは 50 μ G/ml アスコルビン酸 (AA) 7.5 mM β-グリセロリン酸 (β-GP)、純水で前準備し、0.22 μ m シリンジ フィルターで濾過後にそれらを刺激します。培地の表面にプラスチック遠心管から刺激を追加します。優しく培養皿をかき混ぜるし、7 日間インキュベートします。
2. カルシウム鉱物の検出
- リン酸バッファー生理食塩水で細胞培養を洗う (PBS: 125 mM NaCl、KCl、5 mM 10 mM ナ2HPO4、1 mM KH2PO4、pH 7.0)。
- 2% (g:100 mL) 5 mL を加える PBS、pH 5.0 で AR S と鉱物を染色する 30 分の版を孵化させなさい。
- 3 回を PBS で洗浄します。慎重に、皿の壁に PBS を追加鉱物を破壊しないようにします。
- 倒立顕微鏡下でカルシウム鉱物を観察し、画像を撮影します。
3. 紫外線の下でプローブの可視化
- セル lysates のコラゲナーゼの消化力のプロトコルの24によると、安静時または 7 日間の刺激、細胞培養を扱います。
- 培養細胞から媒体を収集し、PBS のセルを洗浄します。
- 3 ml の溶液 0.25 M ショ糖、0.12 M NaCl 0.01 M KCl と 0.02 M トリス塩酸バッファー pH 7.45、3 h の 37 ° C で 500 U/mL コラゲナーゼの細胞を消化します。
- 機械的に細胞をこすり、プラスチック遠心管に移して、0.5 × 16 針で 1 mL 40 U シリンジを 10 回渡します。
- (500 g) × 5 分のサンプルを遠心します。
- 上澄みを廃棄し、合成の軟骨リンパ (SCL、100 mM の NaCl、12.7 mM KCl、0.57 mM MgCl2、1.83 NaHCO3、0.57 mM NaH2PO4、5.5 mM 63 mM ショ糖、16.5 mM Hepes、pH 7.4 D-グルコース) を 500 μ l 添加の細胞ペレットを中断します。
- UV transilluminator のボトルからヘラでハイドロキシアパ タイト (HA)、アパタイト (FA) とアパタイト (CA) 粉末を転送し、コントロールとして使用します。
- プラスチックのヒント プラスチック チューブからセル lysates を転送、UV transilluminator に慎重に。
- 可視画像と UV 光を取る。
4. 電子顕微鏡 EDX のプローブの準備
- 否定的な汚損のためミネラルの準備
- 500 μ L の脱イオン水で HA, CA, FA ミネラルを総合的に生産25 2.5 mg を中断し、37 ° c 1 時間 5% CO2の大気中でインキュベートします。
- 静電気防止ピンセットでボックスからホルムバール/カーボン 300 メッシュ Ni グリッドを取る、磁器のウェル プレート上に配置し、グリッドに HA, CA, FA の懸濁液の 10 μ L をドロップします。
- 室温で 30 分間試料を乾燥させます。
- 安静時の準備、 26の埋め込みのための細胞を刺激
- 培養細胞から媒体を収集し、(125 mM の NaCl、KCL、10 mM NaHCO35 mM、1 mM KH2PO4、10 mM グルコース、20 mM HEPES、pH 7.4) の生理学的脱感作 (PD) 培地で細胞を洗浄します。
- 5 ml の 100 mM リン酸ナトリウム緩衝、pH 7.2、ヒューム フードの下で室温で 1 時間に 3% (g:100 mL) paraformaldehyde/1% (g:100 mL) グルタルアルデヒドの混合物のセルを修正します。
- 100 mM リン酸ナトリウム緩衝の 5 mL の細胞を洗浄し、洗浄後、バッファーを慎重に取り外します。
- 暗い部屋で 100 mM リン酸ナトリウム緩衝、pH 7.2、ヒューム フードの下で室温で 20 分間の 1% (g:100 mL) 四酸化オスミウムの 2 ml サンプルを後置します。
- 四酸化オスミウムを削除し、それを利用します。
- 5 ml の 100 mM リン酸ナトリウム緩衝のセルを洗浄します。
- その後、室温で傾斜エタノール ソリューション シリーズの因数を 5 mL のサンプルを脱水: 5 分 (体積) 25%、10 分間 (体積) 50%、15 分間 (体積) 75%、20 分間 (体積) 90%。最後に無水エタノールを 2 回使用し、30 分と 12 時間孵化させなさい。
- 機械的プラスチック シャーレ文化から細胞をこすりプラスチック遠心管に収集し、遠心分離機の 130 x グラムで 1 分のサンプル。
- 培養上清を削除し、LR ホワイト樹脂と無水エタノールを容積比で 1:2 の混合物の 1 mL の細胞を中断します。
- 使用前にガラス管の内容をよく混合し、室温で 30 分間インキュベートします。
- 130 x グラムで 1 分のサンプルを遠心します。
- 培養上清を削除し、LR ホワイト樹脂とエタノールの 1:1 混合物の 1 つの mL を使用して前の手順を繰り返します。
- よく混合し、室温で 30 分間インキュベートします。
- 130 x グラムで 1 分のサンプルを遠心します。
- 培養上清を削除します。
- 最後に、サンプルに 1 mL の純粋な LR ホワイト樹脂を 2 回追加し、プラスチック製のチューブに室温で 1 時間インキュベートします。
- ゼラチン カプセルに 500 μ L の各サンプルを配置します。
注: サンプルは樹脂ラベルを破壊しないので、紙と鉛筆の小さなシートを使用して表示されます。 - ゼラチン カプセルを閉じプラスチック遠心管に入れてスイング アウト ローターで 1 分間 130 × g で遠心分離します。
- 真空ポンプを使用してプラスチック製のチューブからカプセルを削除します。
- オーブンにサンプルを移動し、48 h 56 ° C で重合します。
- ホルダーにマウントしてピラミッドにトリミングしてブロックを準備します。
- ウルトラミクロトームにホルダーを入れ、ダイヤモンド超 45 ° ナイフを添付し、脱イオン水でそれを埋める付随的空気の泡からブレードをきれいにしてください。
- それから風呂の脱イオン水にダイヤモンド ナイフを使用してセクション (700 Å) を切った。
- 牛のまつげと場所ホルムバール/カーボン 300 の光沢のある面にはメッシュを使用してスクラップ Ni グリッドを設定して、乾燥させる.
- ヒューム フードの下で暗闇の中で無水エタノールに酢酸ウラン (体積) 2.5% を準備します。鉛の容器で酢酸ウランを保つし、堆積物をピックアップしていない覚えています。
- 暗い部屋で合成アパタイトとヒューム フードの下で室温で 20 分間エタノールに酢酸ウラニウム (体積) 2.5% 細胞サンプルのグリッドを counterstain します。
- 50% エタノールでグリッド (巻) で、脱イオン水で洗って 24 時間常温乾燥します。最後に、ボックスに、グリッドを置きます。
5. 電子顕微鏡 EDX 分析
- 透過型電子顕微鏡 (TEM) による電子顕微鏡イメージング装備フルレンジ エネルギー分散型 x 線微小分析 (EDX) システムと 11 メガピクセル カメラ
- ミネラル、細胞観察のためのベリリウム ホルダーを用意します。帯電防止ツールを使用します。
- ネジのペアを外し、ベリリウム板と押さえの残りの部分からベリリウム洗濯機。
- グリッドは、光沢のある面をホルダーにマウントします。
- 慎重に洗濯機ベリリウムとベリリウム板を置き、固定ねじをしっかりと。
- ホルダーを入れ真空チャンバーと真空ポンプをオンに。
- 真空が達成されれば優しくイメージングの商工会議所にホルダーを挿入し、ビーム入れます。
- 蛍光モニターに顕微鏡の絞り値パラメーターを設定します。実行イメージ非点収差補正。ズーム、フォーカス、およびフレームを設定します。50 の倍率で TEM 画像を取ると 000 X。
- 幹の画像とスペクトルと化学組成分析のための x 線の微量分析
- スキャン伝達電子顕微鏡 (茎) イメージング室にエネルギー分散 x 線 (EDX) 検出器を挿入します。
- フォーカス モードで画像のシャープネスを調整します。
- 15 の倍率で幹の画像を取る 000 X。
- X 線微量分析のためのサンプル点を選択し、スペクトルを収集します。
- (100%) としてサンプルでは周期表のすべての要素のすべての原子の重さを合計し、選択した要素の内容を示すデータを取得: Ca、F、Cl、P (として原子 %)。各サンプルの Ca、F や P に Cl の比率を計算します。
- イオン マッピング
- カルシウム、フッ素、塩素イオン マッピングおよびサンプルの選択した要素の EDX マップを行うのためのリンなどの要素を選択します。
- 分析要素の局在を示すことによってデータを取得: Ca、F、Cl、P (原子 %) として、各サンプルの Ca は、F または P と Cl の (%) の共局在を計算。
Access restricted. Please log in or start a trial to view this content.
結果
TEM EDX 行列小胞 (MVs) の石灰化細胞によって放出・ M対このテクニックを使用して得られた結果を示す無機化プロセス可能性があります異なる進むことによって生成されるミネラルの体外イメージングが可能になります細胞の様々 なタイプ。2 つのセルの行が、同じ骨芽細胞分化転換治療を受け、まだ AR S によって証明されるよう刺激 Sao 2 細胞鉱 hFOB より?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
現在の紙の AR s 染色、フルオロアパ タイトの UV 光識別プロトコルについて述べるし、MVs.によって生成される電子顕微鏡 EDX体外イメージング細胞の石灰化が発表した MVs と鉱物いくつかの一般的なトラブルシューティングの手順に従うことによって上記のすべてのメソッドに対応することが可能です。最適な結果を得るためにいくつかの重要な手順を慎重に実行する必要があり?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は、利害の対立があるないことを宣言します。
謝辞
MK と ASK が手動操作を実行して映画を作った LB 図面を準備します。ASK は原稿、LB はスクリプトを書いたし、MK は、表を作成しました。SM, RB, SP は批判的にテーブル、スクリプト、原稿を読みます。著者らは、超と彼女の優れた支援のためハンナ Chomontowska と同様、シモン十五夜とヘンリク Bilski TEM EDX 分析優秀な援助のために感謝したいと思います。著者は、dr プロ英語補正のためパトリック畑とバーバラ Sobiak の手順を記録するために感謝したいと思います。
この作品は、LB と 2016/23/N/NZ1/02449 MK、EU FP7 プロジェクト BIOIMAGINE に国立科学センター、ポーランド 2016年/23/N/NZ4/03313 から助成金を付与依頼、するポーランド科学高等教育省から N N401 140639 によって支えられました。: バイオ イメージング技術革新の研究と教育、GA 号 264173 と法定資金の Nencki 研究所の実験生物学、ポーランド科学アカデミー。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D | for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
参考文献
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -L., Chien, C. -C., Chiu, I. -M., Huang, H. -I., Chen, Y. -C., Hu, H. -I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O'Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O'Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved