Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Analyse des minéraux produits par hFOB 1.19 et Saos-2 cellules à l’aide de microscopie électronique à Transmission avec Energy Dispersive x-ray Microanalysis
Dans cet article
Résumé
Nous présentons un protocole pour comparer l’état de minéraux dans les vésicules, sortis deux lignées de cellules d’os humains : hFOB 1.19 et Saos-2. Leurs profils de minéralisation ont été analysés par l’alizarine rouge-S (AR-S), de coloration, ultraviolette visualisation de lumière (UV), imagerie de microscopie électronique (met) de transmission et microanalyse à rayons x dispersive en énergie (EDX).
Résumé
Cette vidéo présente l’utilisation de la microscopie électronique à transmission avec microanalyse à rayons x dispersive en énergie (TEM-EDX) de comparer l’état de minéraux dans les vésicules, sortis deux lignées de cellules d’os humains : hFOB 1.19 et Saos-2. Ces lignées cellulaires, après le traitement avec l’acide ascorbique (AA) et β-glycérophosphate (β-GP), subir une complète transdifférenciation ostéogénique de prolifération à la minéralisation et produire des vésicules de matrice (MVs) qui déclenchent la nucléation d’apatite dans le matrice extracellulaire (MEC).
Après coloration alizarine rouge-S (AR-S) et analyse de la composition des minéraux dans les lysats cellulaires à l’aide de la lumière ultraviolette (UV) ou dans les vésicules en utilisant l’imagerie TEM suivie de quantification EDX et cartographie de l’ion, nous pouvons en déduire qu’ostéosarcome HRA-2 et ostéoblastique hFOB 1.19 cellules révèlent des profils distincts de la minéralisation. HRA-2 cellules minéralisent plus efficacement que les cellules hFOB 1.19 et produisent les plus grands gisements de minéraux qui ne sont pas visibles sous une lumière UV mais sont semblables au hydroxyapatite (HA) qu’ils ont des substitutions plus Ca et F.
Les résultats obtenus à l’aide de ces techniques nous permettent de conclure que le processus de minéralisation diffère selon le type de cellule. Nous proposons que, au niveau cellulaire, l’origine et les propriétés des vésicules de prédéterminent le type de minéraux.
Introduction
L’OS est un type de tissu conjonctif composé de deux parties : organique (les cellules et les fibres de collagène) et minéraux (composés de calcium et de phosphate). Les principaux éléments minéraux dans les os sont apatites1. Différents types de cellules capables de minéralisation osseuse (ostéoblastes), dans les dents (odontoblastes) et dans le cartilage (chondrocytes) réglementent les étapes initiales de la minéralisation en produisant des protéines de la matrice extracellulaire (ECM) et en relâchant la matrice vésicules (MVs) (Figure 1). MVs sont 100-300 nm de diamètre vésicules qui s’accumulent de calcium et phosphate facilitant la nucléation d’apatite et par la suite se lient au collagène2,3. Puis, MVs se désagrègent pour relâcher les apatites dans le milieu extracellulaire. Les apatites continuent de croître en contact avec les fibres de collagène et de former la matrice osseuse. La minéralisation est soutenue par l’apport constant de Pj’ai et Ca2 + dans le milieu extracellulaire. Certaines données publiées récemment soutiennent notre modèle4,5. Tissus mous minéraliser pas dans des conditions physiologiques. Cependant, les calcifications ectopiques peuvent survenir dans des conditions pathologiques telles que la calcification vasculaire3. Les cellules vasculaires qui acquièrent le phénotype ostéoblastique peuvent produire MVs qui induisent la nucléation des apatites et initient la minéralisation dans les couches médianes et intima de la paroi des vaisseaux sanguins. Depuis les calcifications ectopiques ressemblent à des normales endochondrale minéralisation3, comprendre les mécanismes moléculaires de la minéralisation des cellules osseuses et chondrocytes devrait fournir quelques indices sur la calcification des tissus mous qui sont ectopique formé.
Le développement des tissus osseux est régi par diverses enzymes, des facteurs de croissance et des promoteurs ou des inhibiteurs de minéralisation. L’action antagoniste du tissu non-spécifique à la phosphatase alcaline (SERVT) (Figure 1) et ectonucleotide pyrophosphatase/phosphodiestérase j’ai (NPP1), ainsi que de l’ankyrin (ANK), contrôle concentration pyrophosphate inorganique (PPj’ai) 6. PPj’ai, un puissant inhibiteur de la formation de HA, est hydrolysé par SERVT ; NPP1 hydrolyse triphosphates de nucléotides pour former PPj’ai tandis que ANK PP j’exporte de la cellule à l’ECM. Le ratio de Pi/PPi peut réglementer apatite formation7,8 , avec des conséquences pathologiques possibles9.
La membrane de MV est enrichie en protéines de transport des ions qui facilitent la précipitation initiale du calcium et du phosphate à l’intérieur de la VM au cours du processus de nucléation (Figure 1). Le transporteur de phosphate 1 (PiT) permet d’intégrer Pj’ai généré dans l’espace perivesicular dans le MVs10,11. ANNEXINES peuvent être impliqués dans la liaison et transport de Ca2 + et dans le processus biophysique qui initie la minéralisation dans le MV lumen12,13. Nous sommes favorables à l’hypothèse, suggéré plus tôt, pour la minéralisation dans les vésicules intracytoplasmiques de nucléation interne d’apatite dans le MV avant sa propagation dans l’ECM14,15. In vitro de modélisation a confirmé l’induction de Ca2 +/ pje complexes formation en protéoliposomes fait du PS et AnxA516. Cela peut indiquer que l’accumulation de Ca2 +, Pi, AnxA5 et PS complexes en radeaux lipidiques des microvillosités-comme membranesrepresent le noyau de la nucléation (NC) d’apatite dans Mvs ANNEXINES et SERVT possèdent également liant le collagène capacités qui peuvent être utiles en plaçant MVs le long des fibres de collagène et en stimulant la propagation de la minéralisation de la MEC. Fetuin A et ostéopontine (OPN)17, sont connus comme inhibiteurs de la formation d’apatite qui peuvent ralentir la propagation de la minéralisation à l’échafaud collagénique. Nucléation et propagation sont des événements distincts, le premier qui précède ce dernier, et les deux peuvent être pertinents pour le processus de minéralisation pathologique.
Pour découvrir comment la chimie des complexes de phosphate de calcium peut changer minéralisation physiologique et calcification ectopique, il est nécessaire d’identifier les minéraux produits de cellules. Apatites sont un groupe de calcium et de phosphate contenant des minéraux avec le cristal générales unité cellulaire formule Ca10(PO4)6X2, où X = Cl, F, OH. Ils sont classés comme suit18: fluorapatite (FA) Ca10(PO4)6F2, chlorapatite (CA) Ca10(PO4)6Cl2 et hydroxyapatite (HA) Ca10(PO4 )6(OH)2.
Le choix des lignées de cellules ostéoblastes à induire la formation de minéraux est crucial, puisque chaque lignée cellulaire montre un profil distinct de minéralisation. Dans ce rapport, nous avons comparé la nucléation des minéraux par deux modèles de cellule humaine de minéralisation : cellules ostéoblastique hFOB 1.19 et ostéosarcome HRA-2. Cellules dérivées d’ostéosarcome sont couramment utilisés comme modèles ostéoblastique et la Saos-2 cellules ont conservé le plus mature de caractère ostéoblastique19 tandis que les cellules indifférenciées hFOB foetale humaine sont largement utilisés comme modèle pour la normale ostéoblastique 20de différenciation. Leurs profils de minéralisation ont été analysés par différentes méthodes : alizarine rouge-S (AR-S) coloration, ultraviolette visualisation de lumière (UV), imagerie de microscopie électronique (met) de transmission, énergie dispersive x-ray microanalysis (EDX) quantification et ion cartographie. L’avantage de TEM-EDX sur les autres techniques utilisées dans les études précédentes est qu’il donne des résultats quantitatifs et qualitatifs de remplacement ion en apatite cristaux4,5,21. L’objectif global de l’utilisation de TEM-EDX était de trouver une méthode simple pour l’imagerie et la quantification de la répartition des ions Ca, F et Cl dans divers minéraux de différents types de cellules au cours des étapes distinctes du processus de minéralisation. Cette méthode a été utilisée avec succès, par exemple, pour surveiller l’interaction des nanoparticules de zinc avec des produits chimiques coexistantes et leurs effets combinés sur les organismes aquatiques,22. Dans une autre étude, un PHOTOCATALYSEUR cuivre sur matériaux titane en solution aqueuse a été largement caractérisée par spectrométrie d’émission optique de plasma à couplage inductif (ICP-OES), N2 physisorption (BET), XRD, DRS UV-vis, FT-IR, Raman spectroscopie, TEM-EDX et photoélectrochimiques mesures23. Notre but était de comparer l’origine et les propriétés de vésicules et de minéraux dans les deux lignées cellulaires pour comprendre le mécanisme qui contrôle la minéralisation durant la différenciation osseuse.
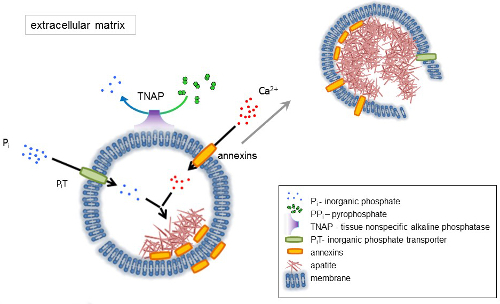
Figure 1 . Schéma des étapes initiales de la minéralisation dans les cellules osseuses impliquant la synthèse des protéines de la matrice extracellulaire (ECM) et la libération des vésicules (MVs) de la matrice de la membrane. MVs accumulent calcium grâce à l’action des protéines liant le calcium, d’ANNEXINES et de phosphate, par l’action d’un transporteur de phosphate inorganique (PiT) suivi de l’activité du tissu non spécifiques à la phosphatase alcaline (SERVT), qui dephosphorylates PPj’ai Pje, facilitant ainsi la nucléation d’apatite. Ensuite, MVs se désintègrent et libérer des apatites dans le milieu extracellulaire. La minéralisation est soutenue par l’apport constant de Pj’ai et Ca2 + dans le milieu extracellulaire4,5. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Culture et traitement des cellules
- Mettre tout le matériel nécessaire sous la hotte à flux laminaire et stériliser leur sous la lumière UV. Les milieux de culture sont : un mélange 1:1 de jambon de médias F12 et DMEM avec 2,5 mM de L-glutamine additionné de 100 U/mL de pénicilline, 100 U/mL de streptomycine, 0,3 mg/mL G418 et 10 % sérum fœtal (SVF) (v/v) d’antigène de foetus humain hFOB 1.19 SV40 grand T transfectées les ostéoblastes et milieu de McCoy 5 a 1,5 mM de L-glutamine additionné de 100 U/mL de pénicilline, 100 U/mL de streptomycine et 15 % SVF (v/v) pour les cellules humaines ostéosarcome HRA-2.
- Culture de cellules hFOB 1.19 à 34 ° C dans une atmosphère de 5 % de CO2 et Saos-2 à 37 ° C dans une atmosphère de 5 % CO2. Transfert des cultures de cellules, soit hFOB 1,19 ou HRA-2 cellules, de l’incubateur à la hotte à flux laminaire et modifier le milieu à 10 mL de milieu de culture frais avec le SVF.
- Incuber les cellules sans stimulateurs (cellules au repos) ou inciter à 50 µg/mL d’acide ascorbique (AA) suivie de 7,5 mM β-glycérophosphate (β-GP), établi plus tôt dans l’eau ultrapure et filtré à l’aide de filtres de seringue 0,22 µm. Ajouter les stimulateurs de tubes de microcentrifuge en plastique sur la surface du bouillon de culture. Doucement, remuer la boîte de Petri et incuber pendant 7 jours.
2. détection des minéraux de Calcium
- Laver les cultures cellulaires avec tampon de Phosphate salin (PBS : 125 mM NaCl, KCl, 5 mM 10 mM Na2HPO4mM 1 KH2PO4, pH 7,0).
- Ajouter 5 mL de 2 % (g:100 mL) AR-S dans du PBS, pH 5.0 et incuber les boîtes pendant 30 min colorer les minéraux.
- Laver 3 fois avec du PBS. Soigneusement ajouter PBS au mur plat, essayez de ne pas détruire les minéraux.
- Observer des minéraux calcium sous un microscope inversé léger et prendre des images.
3. visualisation des sondes sous la lumière UV
- Pour les lysats cellulaires, traiter les cultures de cellules, soit au repos ou stimulées pendant 7 jours, après la digestion de collagénase protocole24.
- Recueillir au moyen de cultures cellulaires et laver les cellules avec du PBS.
- Digérer les cellules avec 3 mL de 500 collagénase U/mL dans une solution de 0,25 M saccharose, 0,12 M NaCl, 0,01 M de KCl et tampon de 0,02 M Tris-HCl, pH 7,45, à 37 ° C pendant 3 h.
- Mécanique gratter les cellules, transférez-les sur tubes de microcentrifuge plastique et passez-les 10 fois un 1 mL 40 U une seringue avec l’aiguille 0,5 × 16.
- Centrifuger les échantillons à 500 × g pendant 5 min.
- Jeter le surnageant et le culot de suspendre dans 500 µL de la lymphe de Cartilage synthétique (SCL, NaCl, KCl, 0,57 mM MgCl2, 1,83 mM NaHCO3, 0,57 mM NaH2PO4, D-glucose, saccharose de 63 mM, 16,5 mM Hepes, pH 7,4 5,5 mM 12,7 mM 100 mM).
- Transférer l’hydroxyapatite (HA), fluorapatite (FA) et poudres de chlorapatite (CA) des bouteilles sur le transilluminateur UV avec une spatule et utiliser comme témoins.
- Transférer les lysats de cellules provenant des tubes en plastique avec embouts en plastique et placez délicatement sur le transilluminateur UV.
- Prendre des images dans le visible et UV légère.
4. préparation des sondes pour TEM-EDX
- Préparation des minéraux pour une coloration négative
- Suspendre les 2,5 mg de produit synthétiquement HA, CA et FA minéraux25 500 µL d’eau désionisée et incuber à 37 ° C dans une atmosphère de 5 % de CO2 pendant 1 h.
- Extraire des grilles Formvar/carbone 300 Mesh Ni de la zone avec une pince antistatique, placer sur une plaque multipuits porcelaine et déposer 10 µL de suspension HA, CA et FA sur les grilles.
- Faire sécher les échantillons pendant 30 min à température ambiante.
- Préparation au repos et stimule les cellules pour l’enrobage 26
- Recueillir des moyennes de cultures cellulaires et laver les cellules avec moyen de désensibilisation physiologique (DP) (125 mM NaCl, KCL, 10 mM NaHCO3à 5 mM, 1 mM KH2PO4, glucose de 10 mM, 20 mM HEPES, pH 7,4).
- Fixer les cellules avec 5 mL d’un mélange de 3 % (g:100 mL) paraformaldehyde/1% (g:100 mL) de glutaraldéhyde dans un tampon phosphate de sodium 100 mM, pH 7,2, pendant 1 h à température ambiante sous la hotte.
- Laver les cellules avec 5 mL de tampon phosphate de sodium de 100 mM et retirer doucement le tampon après le lavage.
- Dans la chambre noire, postfix les échantillons avec 2 mL de tétroxyde d’osmium (g:100 mL) de 1 % dans un tampon phosphate de sodium 100 mM, pH 7,2, pendant 20 min à température ambiante sous la hotte.
- Supprimer le tétroxyde d’osmium et l’utiliser.
- Laver les cellules avec 5 mL de tampon phosphate de sodium de 100 mM.
- Puis, déshydrater les échantillons dans 5 ml d’une série de solution d’éthanol graduées à température ambiante : 25 % (par vol.) pendant 5 min, 50 % (par vol.) pendant 10 min, 75 % (par vol.) pendant 15 min, 90 % (par vol.) pendant 20 min. Enfin, utiliser l’éthanol absolu à deux reprises et incuber pendant 30 minutes et 12 h.
- Mécaniquement, gratter les cellules de la plastique Pétri de culture, recueillir dans des tubes de microcentrifuge plastique et centrifuger les échantillons à 130 g pendant 1 min.
- Retirez les surnageants et suspendre les cellules dans 1 mL d’un mélange de la résine White LR et l’éthanol absolu à un rapport de volume de 1:2.
- Bien mélanger le contenu des tubes verre avant utilisation et incuber 30 min à température ambiante.
- Centrifuger les échantillons à 130 g pendant 1 min.
- Retirez les surnageants et répétez l’étape précédente en utilisant 1 mL d’un mélange de 1:1 de résine LR blanc et éthanol absolu.
- Bien mélanger et laisser incuber 30 min à température ambiante.
- Centrifuger les échantillons à 130 g pendant 1 min.
- Supprimer les surnageants.
- Enfin, ajouter 1 mL de résine de LR blanc pur aux échantillons deux fois et incuber pendant 1 heure à température ambiante dans des tubes en plastique.
- Placer 500 µL de chaque échantillon dans des capsules de gélatine.
Remarque : Les exemples sont étiquetés à l’aide d’une petite feuille de papier et un crayon pour que la résine ne détruit pas les étiquettes. - Fermer les capsules de gélatine, mettez-les dans des tubes de microcentrifuge plastique et centrifuger à 130 g pendant 1 min dans un rotor à balancier.
- Retirer les capsules des tubes en plastique à l’aide d’une pompe à vide.
- Déplacer les échantillons au four et se polymérisent à 56 ° C pendant 48 h.
- Préparer les blocs par leur montage dans le support et les tailler à la pyramide.
- Mettre le titulaire dans l’ultramicrotome, fixer le couteau Ultra 45° de diamant et remplissez-la d’eau déionisée ; n’oubliez pas de nettoyer la lame de bulles d’air accidentelle.
- Puis couper des sections (700 Å) en utilisant le couteau diamant sur le bain d’eau désionisée.
- Mettre les morceaux à l’aide de cils bovine et place que les sur le côté brillant du 300 Formvar/Carbon mesh grille Ni et séchez-les.
- Préparer l’acétate d’uranyle 2,5 % (par vol) dans l’éthanol absolu dans l’obscurité sous une hotte aspirante. Gardez l’acétate d’uranyle dans un conteneur de plomb et n’oubliez ne pas de ramasser les sédiments.
- Dans la chambre noire, contre-coloration les grilles des apatites synthétiques et des échantillons cellulaires avec l’acétate d’uranyle 2,5 % (par vol) dans l’éthanol pendant 20 min à température ambiante sous la hotte.
- Laver les grilles dans l’éthanol à 50 % (par vol), puis dans l’eau désionisée et sécher à température ambiante pendant 24 h. Enfin, mettez les grilles dans la boîte.
5. TEM-EDX analyse
- L’imagerie TEM par un microscope électronique à transmission (TEM) équipé de microanalyse x Dispersive en énergie de toute la gamme système (EDX) et 11 mégapixels appareil photo
- Préparer un support de béryllium pour l’observation des minéraux et des cellules. Utiliser des outils antistatiques.
- Retirez les deux vis et soulevez la plaque de béryllium et la rondelle de béryllium loin du reste du mandat.
- Monter la grille, côté brillant vers le haut, sur le support.
- Placez la rondelle de béryllium et la plaque de béryllium délicatement et vissez les vis de fixation.
- Mettre le titulaire dans la chambre à vide et tourner sur la pompe à vide.
- Une fois que le vide est créé, doucement Insérez le support dans la chambre d’imagerie et tourner sur la poutre.
- Sur l’écran fluorescent, définissez les paramètres d’ouverture du microscope. Effectuer la correction de l’astigmatisme d’image ; régler le zoom, mise au point et le cadre ; et prendre des images de TEM à un grossissement de 50, 000 X.
- Imagerie et microanalyse aux rayons x pour l’analyse spectrale et de composition de la tige
- Insérez le détecteur de rayons x (EDX) dispersive en énergie dans la chambre d’imagerie de balayage transmission electron Microscopy (tige).
- Régler la netteté de l’image dans le mode de mise au point.
- Prendre des images de tige à un grossissement de 15, 000 X.
- Sélectionnez un point de l’échantillon pour la microanalyse aux rayons x et collecter des spectres.
- Obtenir des données en additionnant tous les poids atomiques de tous les éléments du tableau périodique dans l’échantillon (comme 100 %) et signifiant le contenu des éléments sélectionnés : Ca, F, Cl et P (en% atomique). Puis, calculer les ratios de Ca, F ou Cl à l’envers pour chaque échantillon.
- Cartographie de l’ion
- Sélectionnez des éléments tels que le calcium, fluor, chlore et de phosphore pour faire la cartographie de l’ion et effectuer des cartes EDX des éléments sélectionnés dans les échantillons.
- Obtenir des données en indiquant la localisation des éléments analysés : Ca, F, Cl et P (en% atomique) et calculer la co-localisation (en %) du Ca, F ou Cl avec P pour chaque échantillon.
Access restricted. Please log in or start a trial to view this content.
Résultats
TEM-EDX permettant l’imagerie in vitro des vésicules de matrice (MVs) publiés par minéralisation des cellules et des minéraux produit de Mvs les résultats obtenus à l’aide de cette technique démontrent que le processus de minéralisation peut procéder différemment dans divers types de cellules. Les deux lignées ont reçu le même traitement de transdifférenciation ostéoblastique, mais stimulés HRA-2 cellules minéralisé plus efficacement que hFOB 1,19 o...
Access restricted. Please log in or start a trial to view this content.
Discussion
Dans le présent document, nous avons décrit les protocoles pour AR-S, coloration, identification de lumière UV de fluorapatite et TEM-EDX in vitro imagerie de MVs publiés par minéralisation des cellules et des minéraux produits par MVs. Il est possible d’aborder toutes les méthodes mentionnées ci-dessus en suivant quelques étapes de dépannage courantes. Afin d’obtenir des résultats optimaux, plusieurs étapes critiques doivent être effectuées avec soin. Tout d’abord, il est préférab...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun conflit d’intérêts.
Remerciements
MK et ASK a effectué des opérations manuelles et LB préparé dessins et fait le film. ASK a écrit le manuscrit, LB a écrit le scénario et MK préparé la table. SM, RB et SP critique lire la table, le scénario et le manuscrit. Les auteurs aimeraient remercier Hanna Chomontowska pour son excellente aide avec ultramicrotomy ainsi que Szymon Suski et Henryk Bilski pour leur aide excellente analyse TEM-EDX. Les auteurs aimeraient remercier dr Patrick oliveraies pour la correction de la langue anglaise professionnelle et Barbara Sobiak pour les instructions d’enregistrement.
Ce travail a été soutenu par grant N N401 140639 du Ministère polonais de la Science et de l’enseignement supérieur à l’ASK, grâce à des subventions du Centre National des sciences, Pologne 2016/23/N/NZ4/03313 LB et 2016/23/N/NZ1/02449 à MK, EU FP7 projet BIOIMAGINE : BIO-imagerie en recherche l’INnovation et l’éducation, GA no 264173 et par les fonds statutaires de la Nencki Institut de biologie expérimentale, Académie polonaise des Sciences.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D | for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
Références
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -L., Chien, C. -C., Chiu, I. -M., Huang, H. -I., Chen, Y. -C., Hu, H. -I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O'Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O'Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon