É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Análise de minerais produzidos por hFOB 1.19 e Saos-2 células usando microscopia eletrônica de transmissão com energia dispersiva microanálise de raios-x
Neste Artigo
Resumo
Apresentamos um protocolo para comparar o estado de minerais em vesículas lançadas por duas linhas de células de osso humano: hFOB 1.19 e Saos-2. Seus perfis de mineralização foram analisados por alizarina Red-S (AR-S) coloração, visualização de luz ultravioleta (UV), imagem de microscopia eletrônica (TEM) de transmissão e microanálise de raios-x energia dispersiva (EDX).
Resumo
Este vídeo apresenta o uso da microscopia eletrônica de transmissão com microanálise de raios-x energia dispersiva (EDX-TEM) para comparar o estado de minerais em vesículas lançadas por duas linhas de células de osso humano: hFOB 1.19 e Saos-2. Estas linhas de celular, após o tratamento com ácido ascórbico (AA) e β-glicerofosfato (β-GP), submetido a completa transdiferenciação celular osteogênico de proliferação de mineralização e produzir vesículas de matriz (MVs) que desencadeiam a nucleação de apatita na matriz extracelular (ECM).
Com base na coloração de vermelho de alizarina-S (AR-S) e análise da composição dos minerais em lisados celulares usando luz ultravioleta (UV) ou em vesículas utilizando imagens TEM seguida por íon mapeamento e quantificação de EDX, podemos inferir que osteossarcoma Saos-2 e osteoblásticas células hFOB 1.19 revelaram perfis distintos de mineralização. SAOS-2 células mineralize mais eficientemente do que as células hFOB 1.19 e produzem maiores depósitos minerais que não são visíveis sob luz UV, mas são semelhantes a hidroxiapatita (HA), em que eles têm mais Ca e F substituições.
Os resultados obtidos com estas técnicas nos permitem concluir que o processo de mineralização difere dependendo do tipo de célula. Propomos que, a nível celular, a origem e as propriedades das vesículas predeterminar o tipo de minerais.
Introdução
Osso é um tipo de tecido conjuntivo composto de duas partes: orgânico (células e fibras colágenas) e mineral (compostos de cálcio e fosfato). Os principais componentes minerais nos ossos são apatites1. Diferentes tipos de células competentes de mineralização no osso (osteoblastos), dentes (odontoblastos) e cartilagem (condrócitos) regulam os passos iniciais da mineralização através da produção de proteínas da matriz extracelular (ECM) e liberando a matriz vesículas (MVs) (Figura 1). MVs são vesículas de diâmetro de nm de 100-300 que acumulam cálcio e fosfato, facilitando a nucleação de apatita e posteriormente vincular a colágeno2,3. Em seguida, MVs desintegrar-se para liberar apatites para o meio extracelular. Os apatites continuam a crescer em contato com as fibras de colágeno e formam a matriz óssea. A mineralização é sustentada pela oferta constante de Peu e Ca2 + no meio extracelular. Alguns dados publicados recentemente apoiar nosso modelo4,5. Tecidos moles não mineralize sob condições fisiológicas. No entanto, calcificação ectópica pode ocorrer sob condições patológicas como calcificação vascular3. Células vasculares que adquirem o fenótipo de osteoblastos podem produzir MVs que induzem a nucleação de apatites e iniciar a mineralização nas camadas da parede medial e da íntima dos vasos sanguíneos. Desde calcificação ectópica se assemelham a endocondral normal mineralização3, compreender os mecanismos moleculares da mineralização das células ósseas e condrócitos devem fornecer algumas pistas sobre gravidez ectópica calcificação dos tecidos moles que são formada.
O desenvolvimento dos tecidos esqueléticos é regulado por diversas enzimas, fatores de crescimento e promotores ou inibidores de mineralização. A ação antagonista de tecido-inespecíficos da fosfatase alcalina (TNAP) (Figura 1) e ectonucleotide pyrophosphatase/fosfodiesterase eu (NPP1), juntamente com ankyrin (ANK), controla a concentração de pirofosfato inorgânico (PPeu) 6. PPeu, um potente inibidor da formação de HA, é hidrolisado por TNAP; NPP1 hidrolisa trifosfatos de nucleotídeos para formar PPeu enquanto ANK exporta-PPeu da célula para o ECM. A proporção de Pi/PPi pode regular apatita formação7,8 , com possíveis consequências patológicas9.
A membrana de MV é rico em proteínas de transporte de íons que facilitam a precipitação inicial do cálcio e fosfato dentro os MVs durante o processo de nucleação (Figura 1). O transportador de fosfato 1 (PiT) ajuda a incorporar Peu gerados no espaço perivesicular para o MVs10,11. Anexinas podem estar envolvidas na ligação e transporte de Ca2 + e no processo de Biofísica que inicia a mineralização na MV lúmen12,13. Favorecemos a hipótese, sugerida anteriormente, para mineralização dentro de vesículas intracitoplasmática de nucleação interna de apatita dentro o MV antes de sua propagação na ECM14,15. Modelagem em vitro confirmou a indução de Ca2 +/ peu complexos formação em proteoliposomes feitas de PS e AnxA516. Isso pode indicar que a acumulação de Ca2 +, Peu, AnxA5 e PS complexos em balsas lipídicas de membranesrepresent microvilli-como o núcleo de nucleação (NC) de apatita dentro Mvs anexinas e TNAP também possuem ligação de colágeno capacidades que podem ser úteis na colocação de MVs ao longo de fibras de colagénio e, para estimular a propagação da mineralização em ECM. Fetuin A e osteopontin (OPN)17, são conhecidos como inibidores da formação de apatita que pode abrandar a propagação de mineralização no cadafalso colágenas. Nucleação e propagação são eventos distintos, o primeiro anterior a último, e ambos podem ser relevantes para o processo de mineralização patológica.
Para descobrir como a química de complexos de fosfato de cálcio pode alterar mineralização fisiológica e calcificação ectópica, é necessário identificar os minerais produzidos por células. Apatites são um grupo de cálcio e fosfato contendo minerais com cristal geral unidade célula fórmula Ca10(PO4)6X2, onde X = Cl, F, OH. Eles são classificados como segue18: fluorapatita (FA) Ca10(PO4)6F2, chlorapatite (CA) Ca10(PO4)6Cl2 e hidroxiapatita (HA) Ca10(PO4 )6(OH)2.
A escolha de linhas de células osteoblast para induzir a formação de minerais é crucial, pois cada linha celular apresenta um perfil distinto de mineralização. Neste relatório, nós comparamos a nucleação de minerais por dois modelos de célula selecionada humana de mineralização: células osteoblásticas hFOB 1.19 e osteossarcoma Saos-2 células. Osteossarcoma-derivado de células são comumente usadas como modelos osteoblásticas e Saos-2 células têm preservado o caráter osteoblástica mais maduro19 enquanto células indiferenciadas hFOB fetal humano são amplamente utilizadas como um modelo para o normal osteoblástica diferenciação de20. Seus perfis de mineralização foram analisados por métodos diferentes: coloração vermelho de alizarina-S (AR-S), ultravioleta (UV) luz visualização, imagem de microscopia eletrônica (TEM) de transmissão, energia dispersiva raio-x (EDX) de microanálise quantificação da e íon mapeamento. A vantagem da temperatura-EDX sobre alternativas técnicas utilizadas em estudos anteriores é que dá resultados quantitativos e qualitativos de substituição iônica em cristais de apatita a4,5,21. O objetivo geral de usar TEM-EDX foi encontrar um método simples para geração de imagens e quantificação da distribuição dos íons Ca, F e Cl em vários minerais de diferentes tipos de células durante estágios distintos do processo de mineralização. Este método tem sido utilizado com sucesso, por exemplo, para monitorar a interação de nanopartículas de zinco com produtos químicos coexistentes e seus efeitos combinados em organismos aquáticos22. Em outro estudo, um photocatalyst cobre em materiais de titânio em solução aquosa foi extensivamente caracterizado por espectrometria de emissão óptica de plasma indutivo (ICP-OES), physisorption N2 (BET), XRD, DRS UV-vis, FT-IR, Raman espectroscopia, TEM-EDX e photoelectrochemical medidas23. Nosso objetivo foi comparar a origem e propriedades de vesículas e minerais em duas linhas de celular para entender o mecanismo que controla a mineralização durante a diferenciação óssea.
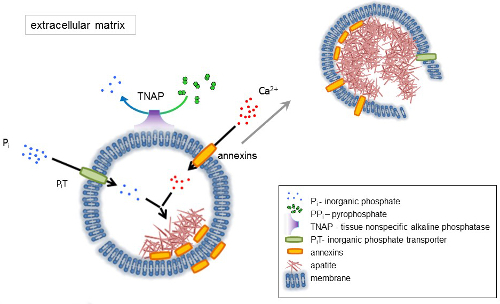
Figura 1 . Esquema das etapas iniciais de mineralização em células ósseas envolvendo a síntese de proteínas da matriz extracelular (ECM) e a liberação das vesículas de matriz (MVs) da membrana. MVs acumulam cálcio através da ação de proteínas de ligação de cálcio, anexinas e fosfato, através da ação do transportador de fosfato inorgânico (PiT) seguido pela actividade de tecido não-específica da fosfatase alcalina (TNAP), que dephosphorylates PPeu Peu, facilitando assim a nucleação de apatita. Em seguida, MVs desintegrar-se e liberar apatites para o meio extracelular. A mineralização é sustentada pela oferta constante de Peu e Ca2 + no meio extracelular4,5. Clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. cultura e tratamento da pilha
- Coloque todo o material necessário, sob a capa de fluxo laminar e esterilizá-los sob luz UV. Os meios de cultura são: uma mistura 1:1 de presunto é mídia F12 e DMEM com 2,5 mM L-glutamina suplementado com 100 penicilina U/mL, 100 U/mL estreptomicina, 0,3 mg/mL G418 e 10% de soro Fetal bovino (FBS) (v/v) para antígeno grande do T de feto humano hFOB 1.19 SV40 transfectadas osteoblastos e meio de 5A McCoy com 1,5 mM L-glutamina suplementado com 100 penicilina U/mL, 100 U/mL Estreptomicina e 15% FBS (v/v) para as células humanas osteossarcoma Saos-2.
- Cultura de células hFOB 1.19 34 ° c numa atmosfera de 5% de CO2 e células Saos-2 a 37 ° C numa atmosfera de 5% CO2. Transferência de culturas de células, células de 1.19 ou Saos-2 ou hFOB, da incubadora para o bairro de fluxo laminar e mudar o médio a 10 mL de meio de cultura fresco com FBS.
- Incubar as células sem estimuladores (células de descanso) ou estimulá-los com 50 µ g/mL ácido ascórbico (AA) seguido de 7,5 mM β-glicerofosfato (β-GP), preparado anteriormente em água ultrapura e filtrada através de filtros de seringa 0,22 µm. Adicione os estimuladores de tubos de plástico microcentrifuga sobre a superfície do meio de cultura. Suavemente agitar o prato de cultura e incubar durante 7 dias.
2. detecção de minerais de cálcio
- Lave as culturas de células com salina de tampão fosfato (PBS: 125 mM de NaCl, 5 mM KCl, 10 mM Na2HPO4, 1mm KH2PO4, pH 7,0).
- Adicionar 5 mL de 2% (g:100 mL) AR-S em PBS, pH 5,0 e incubar as placas durante 30 min manchar os minerais.
- Lavar 3 vezes com PBS. Cuidadosamente adicionar PBS para a parede de prato, não tente destruir os minerais.
- Observar minerais cálcio sob um microscópio invertido e tirar fotos.
3. visualização das sondas sob luz UV
- Para lisados celulares, trate as culturas de células, ou descansando ou estimulada por 7 dias, de acordo com a digestão de colagenase protocolo24.
- Coletar o meio de culturas de células e lavar as células com PBS.
- Digeri as células com 3 mL de 500 colagenase U/mL em uma solução de 0,25 M de sacarose, 0.12 M NaCl, 0,01 M KCl e buffer de 0,02 M Tris-HCl, pH 7,45, a 37 ° C por 3 h.
- Raspar as células mecanicamente, transferi-los para tubos de plástico microcentrifuga e passá-las 10 vezes através de uma seringa de U 1 mL 40 com 0,5 × 16 de agulha.
- Centrifugar as amostras a 500 × g por 5 min.
- Desprezar o sobrenadante e suspender o centrifugado em 500 µ l de linfa de cartilagem sintética (SCL, 100 mM de NaCl, 12,7 mM KCl, 0,57 mM MgCl2, 1,83 mM NaHCO3, 0,57 mM NaH2PO4, 5,5 mM D-glicose, sacarose 63mm, 16,5 mM Hepes, pH 7,4).
- Transferir a hidroxiapatita (HA), fluorapatita (FA) e chlorapatite (CA) pós de garrafas em transiluminador de UV com uma espátula e utilizar como controles.
- Transferir os lisados celulares dos tubos de plástico com pontas de plástico e coloque cuidadosamente o transiluminador UV.
- Tire fotos sob visível e UV luz.
4. preparação de sondas de temperatura-EDX
- Preparação de minerais para a coloração negativa
- Suspender a 2,5 mg de produzido sinteticamente minerais HA, CA e FA25 em 500 µ l de água deionizada e incubar a 37 ° C numa atmosfera de 5% de CO2 por 1h.
- Tirar grades Formvar/carbono 300 Mesh Ni da caixa com pinça antiestática, coloque em um prato de porcelana multi bem e soltar 10 µ l de suspensões HA, CA e FA nas grades.
- Seca as amostras por 30 min à temperatura ambiente.
- Preparação de descansar e estimulou as células para a incorporação de 26
- Coletar o médio das culturas de células e lavar as células com o meio de dessensibilização fisiológicos (PD) (125 mM de NaCl, 5 mM KCL, 10mm NaHCO3, 1mm KH2PO4, glicose 10 mM, 20 mM HEPES, pH 7,4).
- Fixe as células com 5 mL de uma mistura de 3% (g:100 mL) paraformaldehyde/1% (g:100 mL) de glutaraldeído em tampão de fosfato de sódio de 100 mM, pH 7,2, por 1h à temperatura ambiente sob a coifa.
- Lavar as células com 5 mL de tampão de fosfato de sódio de 100 mM e com cuidado, remova o tampão após a lavagem.
- No quarto escuro, o postfix as amostras com 2 mL de tetróxido de ósmio (g:100 mL) 1% em tampão de fosfato de sódio de 100 mM, pH 7,2, por 20 min em temperatura ambiente sob a coifa.
- Remover o tetróxido de ósmio e utilizá-lo.
- Lave as células com 5 mL de tampão de fosfato de sódio de 100 mM.
- Então, desidrata-se as amostras em alíquotas de 5 mL de uma série de solução gradual do etanol à temperatura ambiente: 25% (Vol.) por 5 min, 50% (Vol.) por 10 min, 75% (Vol.) por 15 min, 90% (Vol.) por 20 min. Finalmente, usar etanol absoluto duas vezes e incube por 30 min e 12 h.
- Mecanicamente, raspar as células desde os plástico Petri pratos de cultura, coletar em tubos de plástico microcentrifuga e centrifugar as amostras a 130 x g por 1 min.
- Remover os sobrenadantes e suspender as células em 1 mL de uma mistura de resina de LR White e etanol absoluto em uma relação de volume de 1:2.
- Misture bem o conteúdo dos tubos de vidro antes do uso e incube por 30 min à temperatura ambiente.
- Centrifugar as amostras a 130 x g por 1 min.
- Remover os sobrenadantes e repita a etapa anterior usando 1 mL de uma mistura 1:1 de resina LR White e etanol absoluto.
- Misture bem e incube por 30 min à temperatura ambiente.
- Centrifugar as amostras a 130 x g por 1 min.
- Remova os sobrenadantes.
- Finalmente, adicionar 1 mL de resina pura LR White para as amostras de duas vezes e incubar por 1h à temperatura ambiente em tubos de plástico.
- Coloque 500 µ l de cada amostra em cápsulas de gelatina.
Nota: As amostras são etiquetadas usando uma pequena folha de papel e um lápis para que a resina não destrói os rótulos. - Fechar as cápsulas de gelatina, coloque-os em tubos de plástico microcentrifuga e centrifugar a 130 x g por 1 min em um rotor basculante.
- Remova as cápsulas dos tubos de plástico usando uma bomba de vácuo.
- Mover as amostras para o forno e polimerizar a 56 ° C por 48 h.
- Prepare os blocos montá-los no suporte e apará-los para a pirâmide.
- Colocar o suporte a ultramicrotome, anexar a faca Ultra 45° de diamante e preenchê-lo com água desionizada; Lembre-se de limpar a lâmina de bolhas de ar incidentais.
- Então corte seções (700 Å) usando a faca de diamante para o banho de água desionizada.
- Definir as sobras usando cílios bovina e lugá-los no lado brilhante da Formvar/carbono 300 malha grade Ni e secá-las.
- Prepare o acetato de uranilo 2.5% (Vol.) em etanol absoluto no escuro sob uma coifa. Manter o acetato de uranilo em um recipiente de chumbo e lembre-se de não pegar o sedimento.
- No quarto escuro, counterstain as grades de apatites sintéticos e amostras de células com 2,5% (Vol.) acetato de uranilo em etanol por 20 min em temperatura ambiente sob a coifa.
- Lavar as grades em etanol a 50% (Vol.), em seguida em água desionizada e secar em temperatura ambiente por 24 h. Finalmente, coloque as grelhas na caixa.
5. TEM EDX-análise
- Imagem latente TEM por um microscópio eletrônico de transmissão (TEM) equipado com microanálise de raios x dispersiva energia gama completa (EDX) sistema e 11 Megapixel câmera
- Prepare-se para a observação de minerais e células um titular de berílio. Use ferramentas antiestáticas.
- Remover o par de parafusos e levantar a placa de berílio e a arruela de berílio longe do resto do retentor.
- Monte a grade, lado brilhante, no suporte.
- Cuidadosamente coloque a arruela de berílio e placa de berílio e Dane-se firmemente os parafusos de fixação.
- Coloque o suporte para a câmara de vácuo e ligue a bomba de vácuo.
- Depois de um vácuo é alcançado, delicadamente, encaixe o suporte da câmara de imagem e ligue o feixe.
- No monitor fluorescente, defina os parâmetros de abertura do microscópio. Realizar correção de astigmatismo de imagem; definir o zoom, foco e quadro; e tirar fotos TEM em uma ampliação de 50, 000 X.
- Imagem latente do tronco e microanálise de raios-x para análise espectral e composição
- Insira o detector de raios-x (EDX) energia dispersiva na microscopia eletrônica (tronco) de imagens câmara de varredura transmissão.
- Ajuste a nitidez da imagem no modo de foco.
- Tirar fotos de haste em uma ampliação de 15, 000 X.
- Selecione um ponto da amostra para microanálise de raios-x e coletar espectros.
- Obter dados, somando todos os pesos de atômica para todos os elementos da tabela periódica na amostra (como 100%) e significando o conteúdo de elementos selecionados: Ca, F, Cl e P (como % atômica). Em seguida, calcule os rácios de Ca, F ou Cl de P para cada amostra.
- Mapeamento de íon
- Selecione elementos como cálcio, flúor, cloro e fósforo para fazer o mapeamento de íon e executar mapas EDX dos elementos selecionados nas amostras.
- Obter dados indicando a localização dos elementos analisados: Ca, F, Cl e P (como % atômica) e calcular a localização co (em %) do Ca, F ou Cl com P para cada amostra.
Access restricted. Please log in or start a trial to view this content.
Resultados
Temperatura-EDX permite obter a imagem em vitro das vesículas de matriz (MVs) lançadas pela mineralização de células e de minerais produzidos por Mvs. os resultados obtidos usando esta técnica demonstram que o processo de mineralização pode proceder de forma diferente em vários tipos de células. As linhas de duas células receberam o mesmo tratamento de transdiferenciação celular osteoblástica, ainda estimulados Saos-2 células mais eficientemente do que hFO...
Access restricted. Please log in or start a trial to view this content.
Discussão
No jornal atual, descrevemos os protocolos de coloração, identificação de luz UV de fluorapatita AR-S e TEM-EDX em vitro imagem de MVs lançados pela mineralização de células e de minerais produzidos por MVs. É possível abordar todos os métodos mencionados acima, seguindo algumas etapas de solução de problemas comuns. A fim de obter resultados óptimos, vários passos críticos devem ser realizados com cuidado. Primeiro, é melhor adicionar AA (que é ácida) seguido por β-GP (que é alcali...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram que não têm nenhum conflito de interesses.
Agradecimentos
MK e ASK executadas operações manuais e LB preparou desenhos e fez o filme. ASK escreveu o manuscrito, LB escreveu o roteiro e MK preparou a mesa. SM, RB e SP ler criticamente a tabela, o script e o manuscrito. Os autores gostaria de agradecer a Hanna Chomontowska pela sua excelente assistência com Ultramicrotomia bem como Szymon Suski e Henryk Bilski pela excelente assistência com análise TEM-EDX. Os autores gostaria de agradecer o dr Patrick bosques para correção profissional de língua inglesa e Barbara Sobiak para gravar as instruções.
Este trabalho foi apoiado pela concessão N N401 140639 do Ministério da ciência e do ensino superior polonês ao perguntar, por subvenções do centro nacional de ciência, Polónia 2016/23/N/NZ4/03313 LB e 2016/23/N/NZ1/02449 para MK, UE FP7 projeto BIOIMAGINE : BIO-imagem latente em investigação, inovação e educação, GA n. º 264173 e pelos fundos estatutários do Instituto Nencki Instituto de Biologia Experimental, polonês Academia de Ciências.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D | for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
Referências
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -L., Chien, C. -C., Chiu, I. -M., Huang, H. -I., Chen, Y. -C., Hu, H. -I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O'Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O'Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados