Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Mineraller hFOB 1.19 tarafından üretilen ve SAO'lar-2 hücreleri kullanarak transmisyon elektron mikroskobu ile enerji dağıtıcı x-ışını Microanalysis Analizi
Bu Makalede
Özet
Biz iki kemiğin insan hücre hatları ile yayımlanan veziküller mineraller durumunu karşılaştırmak için bir iletişim kuralı mevcut: hFOB 1.19 ve SAO'lar-2. Qafqaz profillerini Alizarin Red-boyama, ultraviyole (UV) ışık görselleştirme, transmisyon elektron mikroskobu (TEM) görüntüleme ve enerji dağıtıcı x-ışını microanalysis (EDX) tarafından S (AR-S) analiz edildi.
Özet
Bu video enerji dağıtıcı x-ışını microanalysis (TEM-EDX) iki kemiğin insan hücre hatları ile yayımlanan veziküller mineraller durumunu karşılaştırmak için iletim elektron mikroskobu kullanımını sunar: hFOB 1.19 ve SAO'lar-2. Askorbik asit (AA) ve β-gliserofosfat (β-GP) ile tedavi sonrası bu hücre satırları Qafqaz için nükleer silahların yayılmasına karşı gelen tam osteojenik transdifferentiation geçmesi ve apatit çekirdekleşme tetiklemek matris veziküller (MVs) üretmek hücre dışı matriks (ECM).
Alizarin Red-S (AR-S) boyama ve mineraller ultraviyole (UV) ışık kullanarak hücre lysates veya veziküller ardından EDX Nefelometri ve iyon eşleme TEM Imaging'i kullanma kompozisyon analizi dayalı, biz o osteosarkom sonucuna SAO'lar-2 ve osteoblastik hFOB 1.19 hücreler ayrı Qafqaz profilleri ortaya koyuyor. SAO'lar-2 hücreleri hFOB 1.19 hücreleri daha verimli bir şekilde mineralize ve UV ışığı altında görünür olmayan ancak onlar-si olmak daha fazla Ca ve F oyuncu değişikliği hidroksiapatit (HA) açısından benzerdirler büyük maden yatakları üretmek.
Bu teknikleri kullanarak elde edilen sonuçları Qafqaz sürecinin hücre türüne bağlı olarak farklı olduğunu sonuçlandırmak sağlamak. Hücresel düzeyde, kökeni ve veziküller özelliklerini mineraller türünü kazanmakla, öneriyorum.
Giriş
Kemik bağ dokusu iki kısımdan oluşur bir türüdür: organik (hücreleri ve kollajen lifler) ve mineral (kalsiyum ve fosfat bileşikleri). Ana mineral kemikleri apatitler1bileşenleridir. Qafqaz yetkili hücreler kemik (dokusunu), diş (odontoblasts) ve kıkırdak (kondrosit) farklı türde hücre dışı matriks (ECM) proteinler üreten ve matris bırakmadan Qafqaz ilk adımları düzenleyen veziküller (MVs) (Şekil 1). MVs kalsiyum ve fosfat apatit çekirdekleşme kolaylaştırmak biriken ve daha sonra bağlamak kollajen2,3' e 100-300 nm çapında veziküller vardır. Sonra hücre dışı ortama apatitler serbest bırakmak için MVs parçalanır. Apatitler kollajen lifleri ile temas halinde büyümeye ve kemik matris oluşturmak devam. Qafqaz Pben ve Ca2 + ekstraselüler ortamda sürekli tedarik tarafından sürekli. Kısa bir süre önce bazı veriler bizim model4,5desteği. Yumuşak dokular fizyolojik koşullar altında mineralize değil. Ancak, ektopik kalsifikasyon vasküler kalsifikasyon3gibi patolojik şartlar altında meydana gelebilir. Osteoblast fenotip elde damar hücreleri apatitler çekirdekleşme teşvik ve kan damarlarının duvar medial ve intimal katmanlarındaki Qafqaz başlatmak MVs üretebilir. Ektopik kalsifikasyon beri normal endochondral Qafqaz3Qafqaz kemik hücreleri moleküler mekanizmaları anlama, benzer ve kondrosit bazı ipuçları vardır yumuşak dokuların ektopik önkol kemiğinde kireçlenme. sağlamalıdır kurdu.
İskelet doku gelişimi çeşitli enzimler, büyüme faktörleri ve rehberleri veya Qafqaz inhibitörleri tarafından düzenlenir. Uzlaşmaz eylem doku ettiren alkalen fosfataz (TNAP) (Şekil 1) ve ectonucleotide pyrophosphatase/fosfodiesteraz ben (NPP1), ankyrin (ANK), ile birlikte inorganik pirofosfat (PPben) konsantrasyonu kontrol eder 6. PPben, HA oluşumu, güçlü bir inhibitörü TNAP; hidrolize NPP1 nükleotit trifosfatlar arasında ANK PPben için ECM hücreden verir iken PPben oluşturmak üzere hidrolize. Pi/ÜFE oranı apatit oluşumu7,8 olası patolojik sonuçları9ile düzenleyen.
MV membran çekirdekleşme sürecinde (Şekil 1) kalsiyum ve fosfat MVs içinde yağış ilk kolaylaştırmak iyon taşıma proteinlerde zenginleştirilmiştir. Fosfat ışınlama 1 (çukur) MVs10,11perivesicular uzayda oluşturulan Pben dahil etmek için yardımcı olur. Annexins bağlama ve Ca2 + ulaşım ve Qafqaz MV lümen12,13' te başlattığı biyofiziksel süreç içinde tutulabilir. Biz daha önce apatit ECM14,15dakika sonra onun yayılma önce MV içinde iç çekirdekleşme intrasitoplazmik keseleri içinde Qafqaz için önerilen hipotez, iyilik. Vitro modelleme indüksiyon Ca2 +/Pben kompleksleri oluşumu PS ve AnxA516yapılan proteoliposomes doğruladı. Bu o birikimi gösteriyor olabilir sahip Ca2 +, Pben, lipid sallar, microvilli gibi membranesrepresent (NC) çekirdekleşme özünü apatit MVs. Annexins ve TNAP içinde AnxA5 ve PS kompleksleri ayrıca kollajen bağlayıcı kapasiteleri MVs kollajen lifleri boyunca koyarak ve ECM Qafqaz yayılmasını teşvik edici olarak yararlı olabilir. Fetuin A ve osteopontin (OPN)17, Qafqaz kolajen iskele üzerinde yayılmasını yavaşlatmak apatit oluşumu inhibitörleri olarak bilinir. Çekirdekleşme ve yayılma farklı olaylar, ikincisi, önceki eski vardır ve her ikisi de patolojik Qafqaz işlemi için uygun olmayabilir.
Kalsiyum fosfat kompleksleri Kimya fizyolojik Qafqaz ve ektopik kalsifikasyon nasıl değişebilir keşfetmek için hücreleri tarafından üretilen mineraller tanımlamak gereklidir. Apatitler kalsiyum ve fosfat genel kristal birim hücre formülü Ca10(PO4)6X2ile mineraller içeren bir grup, burada X = Cl, F, OH. 18aşağıdaki gibi sınıflandırılır: fluorapatite (FA) Ca10(PO4)6F2, chlorapatite (CA) Ca10(PO4)6Cl2 ve hidroksiapatit (HA) Ca10(PO4 )6(OH)2.
Her hücre kültürünü Qafqaz ayrı bir profil sergileyen bu yana osteoblast hücre hatları seçimi mineral oluşumu ikna etmek için çok önemlidir. Bu raporda, Qafqaz iki insan hücre modelleri tarafından mineraller çekirdekleşme karşılaştırıldığında: osteoblastik hFOB 1.19 hücreleri ve SAO'lar-2 osteosarkom hücreleri. Osteosarkom kaynaklı hücreler osteoblastik modelleri olarak yaygın olarak kullanılır ve farklılaşmamış insan fetal hFOB hücreler yaygın olarak normal osteoblastik bir model olarak kullanılır iken SAO'lar-2 hücreleri en olgun osteoblastik karakter19 korunmuş farklılaşma20. Qafqaz profillerini farklı yöntemlerle analiz edildi: Alizarin Red-S (AR-S) boyama, ultraviyole (UV) ışık görselleştirme, transmisyon elektron mikroskobu (TEM) görüntü, enerji dağıtıcı x-ışını microanalysis (EDX) Nefelometri ve iyon eşleme. TEM-EDX avantaj önceki çalışmalarda kullanılan alternatif teknikleri bu apatit kristallerinin4,5,21' iyon değiştirme nicel ve nitel sonuçlar veren şeydir. TEM-EDX kullanarak genel amacı görüntüleme ve miktar hücreler farklı türdeki çeşitli mineraller Ca, F ve Cl iyonu dağıtım Qafqaz sürecin farklı aşamalarında için basit bir yöntem bulmak oldu. Bu yöntem başarılı bir şekilde, örneğin, coexisting kimyasallar ile çinko nano tanecikleri ve Sucul organizmalar22kombine etkileri etkileşimi izlemek için kullanılmıştır. Başka bir çalışmada, bir bakır photocatalyst sulu çözüm titanyum malzemeleri hakkında kapsamlı İndüktif Eşleşmiş Plazma optik emisyon spektrometresi (ICP-OES), N2 physisorption (bahis), ile karakterize edildi XRD, UV-vis DRS, FT-IR, Raman Spektroskopi, TEM-EDX ve fotoelektrokimyasal ölçümler23. Amacımız kökeni ve veziküller ve mineraller Qafqaz kemik farklılaşma sırasında kontrol mekanizmasını anlamak için iki hücre satırı özelliklerini karşılaştırmak için oldu.
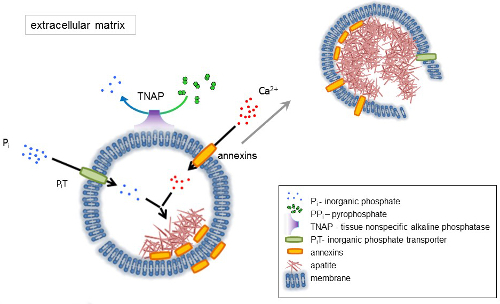
Resim 1 . Qafqaz kemik hücreleri içeren hücre dışı matriks (ECM) protein sentezi ve membran matris veziküller (MVs) sürümünden ilk adımların düzenini. MVs kalsiyum kalsiyum bağlayıcı proteinler, annexins ve inorganik fosfat ışınlama (çukur) eylem yoluyla hangi dephosphorylates doku non-spesifik alkalen fosfataz (TNAP), etkinlik tarafından takip fosfat eylem yoluyla birikir PPben böylece apatit çekirdekleşme kolaylaştırmak Pben. O zaman, MVs parçalanır ve hücre dışı ortama apatitler bırakın. Qafqaz Pben ve Ca2 + hücre dışı orta4,5sabit tedarik tarafından sürekli. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.
Access restricted. Please log in or start a trial to view this content.
Protokol
1. hücre kültür ve tedavi
- Laminar akış başlık altında tüm gerekli malzemeleri koymak ve onları UV ışık altında sterilize. Kültür Medya: 1:1 karışımı insan fetusu hFOB 1.19 SV40 büyük T antijen transfected için jambon F12 ve DMEM medya ile 2.5 mM L-glutamin 100 U/mL penisilin, 100 U/mL streptomisin, 0.3 mg/mL G418 ve % 10 ile Fetal sığır Serum (FBS) (v/v) desteklenen değil dokusunu ve 1.5 mM L-glutamin 100 U/mL penisilin, 100 U/mL streptomisin ve % 15 ile takviye ile McCoy'un 5A orta FBS (v/v) insan osteosarkom SAO'lar-2 hücreleri için.
- Kültür bir atmosferde % 5 CO2 34 ° C'de hFOB 1.19 hücreleri ve SAO'lar-2 hücreleri 37 ° c % 5'lik bir atmosferde CO2. Kuluçka makinesi laminar akış hood için hücre kültürleri, her iki hFOB 1.19 veya SAO'lar-2 hücreleri, transfer ve orta 10 mL taze kültür orta FBS ile değiştirin.
- Uyarıcılar (resting hücreleri) olmayan hücreler kuluçkaya veya onları 50 µg/mL askorbik asit (AA) 7.5 mM β-Ultrasaf Su daha önce hazırlanan ve 0,22 µm şırınga filtreler aracılığıyla filtre gliserofosfat (β-GP), ardından ile teşvik. Plastik microcentrifuge tüpler kültür ortamının yüzeyine gelen uyarıcılar ekleyin. Yavaşça kültür çanak karıştırın ve 7 gün boyunca kuluçkaya.
2. kalsiyum mineraller tespiti
- Hücre kültürleri fosfat tampon tuzlu su ile yıkamak (PBS: 125 mM NaCl, 5 mM KCl, 10 mM Na2HPO4, 1 mM KH2PO4, pH 7,0).
- %2 (g:100 mL) 5 mL ekleyin AR-S PBS, pH 5,0 ve plakalar mineraller leke 30 dk için kuluçkaya.
- 3 kez PBS ile yıkayın. Dikkatle PBS çanak duvara ekleyin, mineraller yok değil çalışın.
- Kalsiyum mineraller bir ters ışık mikroskobu altında gözlemlemek ve fotoğraf çekmek.
3. görsel olarak UV ışık altında probları
- Hücre lysates için hücre kültürleri, dinlenme ya da 7 gün için uyarılmış göre collagenase sindirim Protokolü24tedavi.
- Orta hücre kültürleri toplamak ve PBS hücrelerle yıkayın.
- 3 mL 500 U/mL collagenase 0.25 M sukroz, 0,12 M NaCl, 0.01 M KCl ve 0,02 M Tris-HCl tampon, pH 7,45, 37 ° c 3 h için bir çözümde hücrelerle sindirmek.
- Mekanik olarak hücreleri kazımak, onları plastik microcentrifuge tüpler için aktarmak ve 0,5 × 16 iğne ile 1 mL 40 U şırınga ile 10 kat geçirin.
- 500 × g 5 min için de örnekler santrifüj kapasitesi.
- Süpernatant atın ve hücre Pelet sentetik kıkırdak lenf (SCL, 100 mM NaCl, 12,7 mM KCl, 0,57 mM MgCl2, 1.83 mM NaHCO3, 0,57 mM NaH2PO4, 5.5 mM D-glikoz, 63 mM sukroz, 16.5 mM Hepes, pH 7,4) 500 µL içinde askıya alma.
- Hidroksiapatit (HA), fluorapatite (FA) ve chlorapatite (CA) tozlar UV transilluminator şişe bir spatula ile aktarmak ve denetimleri kullanın.
- Hücre lysates plastik ipuçları ile Plastik tüpler aktarmak ve dikkatle UV transilluminator yer.
- Görüntü altında görünür ve UV ışık al.
4. probları TEM-EDX için hazırlanması
- Mineraller negatif boyama için hazırlanması
- Sentetik üretilen HA, CA ve SK mineraller25 2,5 mg deiyonize su 500 µL içinde askıya alma ve % 5 CO2 1 h için bir ortamda 37 ° C'de kuluçkaya.
- Formvar/karbon 300 Ni kafes ızgaralar kutusundan statik olmayan forseps ile almak, bir porselen çok iyi tabağa yerleştirin ve HA, CA ve SK süspansiyonlar 10 µL ızgaralar üzerinde bırak.
- Örnekleri, oda sıcaklığında 30 dk için kuru.
- İstirahat hazırlık ve teşvik hücreleri 26 katıştırma için
- Orta hücre kültürleri toplamak ve fizyolojik Desensitizasyon (PD) Orta (125 mM NaCl, 5 mM KCL, 10 mM NaHCO3, 1 mM KH2PO4, 10 mM glikoz, 20 mM HEPES, pH 7,4) hücrelerle yıkayın.
- 5 mL % 3 (g:100 mL) paraformaldehyde/1% (g:100 mL) oxazolidin 100 mM sodyum fosfat tampon pH 7.2, duman başlık altında oda sıcaklığında 1 h için karışımı ile hücreleri tamir.
- 5 mL 100 mM sodyum fosfat tampon de hücrelerle yıkama ve arabellek yıkandıktan sonra yavaşça çıkarın.
- Karanlık odada 2 mL % 1 (g:100 mL) osmiyum tetroxide 100 mM sodyum fosfat tampon pH 7.2, duman başlık altında oda sıcaklığında 20 dakika örnekleriyle postfix.
- Osmiyum tetroxide kaldırın ve kullanmak o.
- 5 mL 100 mM sodyum fosfat tampon de hücrelerle yıkayın.
- Sonra 5 mL aliquots oda sıcaklığında bir kademeli etanol çözüm serisinin örneklerinde kurutmak: % 25 (VOL) 5 min için % 50 oranında (VOL) 10 dakika için % 75 (VOL) 15 dakika, % 90 (VOL) 20 dk için. Son olarak mutlak etanol iki kez kullanmanız ve 30 dk ve 12 h için kuluçkaya.
- Mekanik olarak hücreleri plastik Petri kültür yemeklerini kazımak, plastik microcentrifuge tüpler içine toplamak ve 130 x g 1 dk. için de örnekler santrifüj kapasitesi.
- Supernatants kaldırın ve LR beyaz reçine ve hacim oranı 1:2, mutlak etanol karışımından 1 mL hücrelerde askıya alma.
- Cam tüpler kullanımdan önce içeriği karıştırın ve oda sıcaklığında 30 dk için kuluçkaya.
- 130 x g 1 dk. için de örnekler santrifüj kapasitesi.
- Supernatants çıkarın ve 1 mL LR beyaz reçine ve mutlak etanol 1:1 karışımı kullanarak önceki adımı yineleyin.
- Mix iyi ve oda sıcaklığında 30 dk için kuluçkaya.
- 130 x g 1 dk. için de örnekler santrifüj kapasitesi.
- Supernatants kaldırın.
- Son olarak, 1 mL saf LR beyaz reçine örnekleri için iki kez ekleyin ve Plastik tüpler içinde oda sıcaklığında 1 h için kuluçkaya.
- Her örneğinin 500 µL jelatin kapsül yerleştirin.
Not: Örnekleri reçine etiketleri yok etmez küçük bir yaprak kağıt ve bir kalem kullanılarak etiketlenir. - Jelatin kapsül kapatın, plastik microcentrifuge tüpler içine koydum ve 130 x g 1dk swing-out Open End için de santrifüj kapasitesi.
- Kapsüller bir vakum pompası ile Plastik tüpler kaldırın.
- Örnekleri için fırın taşımak ve 48 h için 56 ° C'de polimerize.
- Bloklar onları yuvasına montaj ve onları Piramide süsleme hazırlayın.
- Sahibi ultramicrotome koymak, elmas Ultra 45 ° bıçak eklemek ve deiyonize su ile doldurun; arızi hava kabarcıkları gelen bıçak temiz unutmayın.
- Sonra deiyonize su banyosu üzerine elmas bıçak kullanma bölümlerine (700 Å) kesti.
- Ni ızgara sığır kirpik ve onları Formvar/karbon 300 parlak tarafında mesh yer kullanarak artıkları ayarla ve onları kurutun.
- 2.5 oranında (VOL) uranyl asetat içinde belgili tanımlık karanlık bir duman başlık altında mutlak etanol içinde hazırlamak. Uranyl asetat kurşun kabında tutun ve tortu açmamanı unutmayın.
- Karanlık odada, ızgaralar, sentetik apatitler ve hücre örnekleri ile 2.5 oranında (VOL) uranyl asetat etanol duman başlık altında oda sıcaklığında 20 dakika içinde counterstain.
- Kılavuzlar içinde % 50 etanol (vol. tarafından), sonra deiyonize suyla yıkayın ve 24 saat için oda sıcaklığında kuru. Son olarak, ızgaralar ve metin kutusuna koy.
5. TEM-EDX Analizi
- TEM görüntüleme bir transmisyon elektron mikroskobu (TEM) ile donatılmış tam kapsamlı enerji dağıtıcı x-ışını microanalysis ile (EDX) sistem ve 11 megapiksel kamera
- Bir berilyum tutucu mineraller ve hücreleri gözlem için hazırlayın. Antistatik araçları kullanın.
- Vida çifti kaldırın ve Asansör berilyum plaka ve berilyum yıkayıcı hizmetkar kalan uzak.
- Kılavuz, parlak tarafı, tutucu üzerinde binin.
- Dikkatle berilyum yıkayıcı ve berilyum tabak yerleştirin ve sabitleme vidaları sıkıca vidalayın.
- Sahibi vakum odanın içine koymak ve vakum pompası üzerinde açın.
- Bir kez bir vakum elde, yavaşça sahibi görüntüleme odanın içine takın ve denge aletinin üstüne açın.
- Floresan monitörde mikroskop diyafram parametrelerini ayarlamak. Görüntü astigmat düzeltmesi gerçekleştirmek; Zum, odaklama ve çerçeve ayarla; ve 50, büyütme oranında TEM fotoğraf çekmek 000 X.
- KÖK görüntüleme ve x-ışını microanalysis spektral ve kompozisyon analizi için
- Enerji dağıtıcı x-ışını (EDX) dedektörü tarama transmisyon elektron mikroskobu (kök) görüntüleme odanın içine yerleştirin.
- Odak modu görüntü keskinliğini ayarlamak.
- KÖK görüntüler 15, büyütme oranında tutar 000 X.
- X-ışını microanalysis için örnek bir nokta seçin ve spectra toplamak.
- Örnek (% 100) olarak periyodik tabloda tüm öğeler için tüm atom ağırlıklarının özetliyor ve seçili öğeleri içeriğini belirten veri elde etmek: Ca, F, Cl ve P (olarak atomik %). Sonra her örnek için Ca, F veya Cl p oranları hesaplamak.
- İyon eşleme
- Kalsiyum, Flor, klor ve iyon eşleme yapmak ve EDX haritalar seçilen öğelerin örnekleri gerçekleştirmek için fosfor gibi öğeleri seçin.
- Verileri analiz öğeleri lokalizasyonu belirtmek suretiyle elde etmek: Ca, F, Cl ve P (olarak atomik %) ve Co lokalizasyonu (% olarak) Ca, F veya Cl P ile her örnek için hesaplar.
Access restricted. Please log in or start a trial to view this content.
Sonuçlar
TEM-EDX matris veziküller (MVs) hücreleri mineralizing tarafından yayımlanan ve Qafqaz sürecinin farklı şekilde devam edebilirsiniz bu tekniği kullanarak elde edilen sonuçları göstermek Mvs tarafından üretilen mineral vitro görüntüleme sağlar hücreleri çeşitli türleri. İki hücre satırları aynı osteoblastik transdifferentiation tedavi alınan henüz AR-S tarafından kanıtlanan uyarılan SAO'lar-2 hücreleri 1,19 dokusunu, hFOB çok daha etkili b...
Access restricted. Please log in or start a trial to view this content.
Tartışmalar
Geçerli kağıt AR-S için boyama, UV ışık fluorapatite tanımlaması iletişim kurallarını açıkladığımız ve TEM-EDX vitro görüntüleme hücreleri mineralizing tarafından yayımlanan MVs ve minerallerin MVs. tarafından üretilen Tüm yöntemleri ortak bazı sorun giderme adımlarını takip ederek yukarıda belirtilen adrese mümkündür. En iyi sonuçları elde etmek için birkaç önemli adımlar dikkatle yapılmalıdır. İlk olarak, (asidik olan) AA kültür ortamının pH 7.4 koruma...
Access restricted. Please log in or start a trial to view this content.
Açıklamalar
Yazarlar onlar hiçbir çıkar çatışması var bildirin.
Teşekkürler
MK ve ASK manuel işlemler yapıldı ve LB çizimleri hazır ve film yaptı. ASK LB yazdı makale yazdı ve MK tablo hazırladı. SM, RB ve SP eleştirel tablo, komut dosyası ve el yazması okuyun. Yazarlar Hanna Chomontowska onun mükemmel hakkında yardım almak için ultramicrotomy yanı sıra Szymon Suski ve Henryk Bilski TEM-EDX analizi ile mükemmel onların yardım için teşekkür etmek istiyorum. Yazarlar dr Patrick bahçeleri mesleki İngilizce dil düzeltme ve Barbara Sobiak talimatları kayıt için teşekkür etmek istiyorum.
Bu eser hibe N N401 140639 bilim ve Yükseköğretim Lehçe Bakanlığından ASK, LB ve 2016/23/N/NZ1/02449 MK, AB FP7 projesi BIOIMAGINE için Ulusal Bilim Merkezi, Polonya 2016/23/N/NZ4/03313 gelen hibe tarafından desteklenmiştir : BIO-görüntüleme araştırma yenilik ve eğitim, GA No 264173 ve Nencki Enstitüsü, Deneysel Biyoloji, yasal fon tarafından Polonya Bilimler Akademisi.
Access restricted. Please log in or start a trial to view this content.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D | for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
Referanslar
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -L., Chien, C. -C., Chiu, I. -M., Huang, H. -I., Chen, Y. -C., Hu, H. -I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O'Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O'Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).
Access restricted. Please log in or start a trial to view this content.
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır