JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
미네랄 hFOB 1.19에 의해 생산 및 Saos-2 세포를 사용 하 여 전송 전자 현미경 에너지 흩어진 엑스레이 Microanalysis와 분석
요약
선물이 두 인간의 뼈 세포 선으로 발표 하는 소포에 미네랄의 상태를 비교 하는 프로토콜: hFOB 1.19와 Saos-2. 그들의 강화 프로 파일에 의해 알리자린 레드-S (아칸소-S) 얼룩, 자외선 (UV) 빛 시각화, 전송 전자 현미경 (TEM) 이미징 및 에너지 흩어진 엑스레이 microanalysis (EDX)을 분석 했다.
초록
이 비디오 전송 전자 현미경 검사 법의 사용 에너지 흩어진 엑스레이 microanalysis을 소포 두 인간의 뼈 세포 라인에 의해 발표에서 미네랄의 상태를 비교할 (가장 EDX) 선물: hFOB 1.19와 Saos-2. Ascorbic 산 (AA)와 β-glycerophosphate (β-GP), 치료 후 이러한 셀 라인 강화를 확산에서 완전 한 osteogenic transdifferentiation를 받아야 매트릭스 소포 (MVs)에서 인회석 nucleation 트리거하는 생산 하 고는 세포 외 매트릭스 (ECM)입니다.
알리자린 레드-S (아칸소-S) 얼룩 및 미네랄 자외선 (UV)를 사용 하 여 세포 lysates 또는 소포 편 이미징 EDX 정량 및 이온 매핑을 사용 하 여 구성의 분석을 바탕으로, 우리가 그 다리를 유추할 수 Saos-2 그리고 osteoblastic hFOB 1.19 셀 별개 강화 프로필 공개. Saos-2 셀 hFOB 1.19 셀 보다 더 효율적으로 형성할 고 생산 자외선 아래 표시 되지 않습니다 하지만 비슷합니다 hydroxyapatite (HA) 들은 더 많은 Ca와 F 대체에 큰 무기물 예금.
이러한 기술을 사용 하 여 얻은 결과 수 결론 강화 작용 과정 세포 유형에 따라 다릅니다. 우리는, 세포 수준에서 기원과 vesicles의 속성 미리 미네랄의 종류를 제안 합니다.
서문
뼈는 두 부분으로 구성 된 결합 조직: 유기 (세포와 콜라겐 섬유)과 미네랄 (칼슘, 인산 화합물). 뼈에 주요 미네랄 구성 요소는 apatites1. 다른 종류의 강화 유능한 세포 뼈 (osteoblasts), 치아 (odontoblasts)와 연골 (chondrocytes) 규제 강화의 초기 단계는 세포 외 기질 (ECM)의 단백질을 생산 하 고 매트릭스를 발표 하 여 소포 (MVs) (그림 1). MVs는 100-300 nm 직경 소포 칼슘과 인회석 nucleation 촉진 인산 축적 하 고 그 후 콜라겐2,3를 바인딩할. 다음, MVs extracellular 매체에 apatites를 풀어 분해. apatites 계속 콜라겐 섬유 접촉 성장과 뼈 매트릭스를 형성 합니다. 강화 작용은 P나 및 캘리포니아2 + 세포 외 매체에서의 일정 한 공급에 의해 지속 됩니다. 최근 게시 된 데이터 지원 우리의 모델4,5. 부드러운 조직 생리 적인 조건 하에서 형성할 하지 않습니다. 그러나, 소성 석 회화는 혈관 석 회화3같은 병 적인 조건 하에서 발생할 수 있습니다. 혈관 세포 osteoblast 형 취득 apatites의 nucleation 유발 하 고 혈관 벽의 중간과 내 층에서 강화 작용을 시작 하는 MVs를 생성할 수 있습니다. 소성 석 회화부터 정상적인 endochondral 강화3, 뼈가 있는 세포의 강화 작용의 분자 메커니즘을 이해와 chondrocytes는 부드러운 조직의 소성 석 회화에 몇 가지 단서를 제공 한다 형성.
골격 조직 개발은 다양 한 효소, 성장 요인, 발기인 또는 강화 작용의 억제제에 의해 통제 된다. 반목 행동 조직-특이 현상 알칼리 성 인산 가수분해 효소 (TNAP) (그림 1)와 ectonucleotide pyrophosphatase/포스의 난 (NPP1), 함께 ankyrin (ANK), 제어 (PPi) 무기 파이 인산 농도 6. PP나, 하 대형의 강력한 억제제 TNAP;에 의해 분해 되 NPP1 hydrolyzes 뉴클레오티드 PP나 ANK ECM에 PP나 를 셀에서 수출 하는 동안 형성 된. Pi/PPi 비율 인회석 형성7,8 병 적인 결과9를 조절할 수 있습니다.
MV 막 nucleation 프로세스 (그림 1) 중 칼슘과 인산 염 MVs 안쪽의 초기 강수량을 용이 하 게 이온 수송 단백질 농축입니다. 인산 염 운송업 자 1 (구 덩이) P나 MVs10,11perivesicular 공간에 생성을 통합 하는 데 도움이 됩니다. Annexins는 MV 루멘12,13강화 작용을 시작 하는 생물 과정에서 바인딩 및 캘리포니아2 + 의 전송에 관련 될 수 있습니다. 우리는 가설, 이전, ECM14,15에서 전파 하기 전에 뮤직 비디오 안에 인회석의 내부 nucleation의 intracytoplasmic 소포 내에서 강화에 대 한 제안 부탁. 생체 외에서 모델링 캘리포니아2 +/P나 단지 형성 PS 및 AnxA516에서 만든 proteoliposomes에서의 유도를 확인 했다. 이 그 축적을 나타낼 수 있습니다의 캘리포니아2 +, P나, microvilli 같은 membranesrepresent M대 Annexins와 TNAP는 인회석의 nucleation 코어 (NC)의 지질 뗏목에서 AnxA5 및 PS 단지 또한 콜라겐 바인딩 보유 강화는 ECM에서의 전파를 자극, 그리고 콜라겐 섬유를 따라 MVs에 도움이 될 수 있는 용량 Fetuin A와 osteopontin (OPN)17, collagenous 비 계에 강화 작용의 전파를 저하 시킬 수 있습니다 인회석 형성 억제제로 알려져 있습니다. Nucleation 및 전파는 고유한 이벤트, 후자, 앞 전 고 모두 병 적인 강화 작용의 과정에 대 한 관련성이 있을 수 있습니다.
어떻게 칼슘 인산 염 복합물의 화학 생리 강화 및 소성 석 회화 변경 될 수 있습니다 발견, 그것은 세포에 의해 생산 하는 광물을 식별 하는 데 필요한. Apatites 칼슘 및 인산 염 무기물 일반 크리스탈 단위 셀 수식 Ca10(PO4)6X2를 포함 하는 그룹, 어디 X = Cl, F, 오하이오. 그들은18를 다음과 같이 분류 된다: fluorapatite (FA) Ca10(PO4)6F2, chlorapatite (CA) Ca10(PO4)6Cl2 , hydroxyapatite (HA) Ca10(포4 )6(OH)2.
광물의 형성을 유발 하 osteoblast 셀 라인의 선택은 각 셀 라인 강화 작용의 독특한 프로필을 전시 하기 때문에 중요 한. 이 보고서에서 우리는 강화 작용의 두 가지 선택 된 인간 세포 모델에 의해 미네랄의 nucleation 비교: osteoblastic hFOB 1.19 셀과 다리 Saos-2 셀. Osteosarcoma 파생 셀 osteoblastic 모형으로 상용 되 고 Saos-2 셀 가장 성숙한 osteoblastic 문자19 보존 undifferentiated 인간의 태아 hFOB 세포는 정상 osteoblastic 모델로 널리 사용 감 별 법20. 다른 방법으로 그들의 강화 프로 파일 분석 했다: 알리자린 레드-S (아칸소-S) 얼룩, 자외선 (UV) 빛 시각화, 전송 전자 현미경 (TEM) 이미징, 에너지 흩어진 엑스레이 microanalysis (EDX) 정량, 및 이온 매핑. 이전 연구에서 사용 되는 대체 기술 가장 EDX의 이점을 준다는 것 이온 교체의 양적 및 질적 결과 인회석 결정4,,521입니다. 가장 EDX를 사용 하 여 전반적인 목표 이미징 및 강화 프로세스의 고유 단계 동안 다른 종류의 세포에서 다양 한 미네랄에서 Ca, F 및 Cl 이온의 분포의 정량화에 대 한 간단한 방법을 찾으려고 했다. 이 메서드는 성공적으로 사용 되었습니다, 예를 들어 공존 화학 물질과 아연 나노 입자 및 수생 생물22에 그들의 결합된 효과의 상호 작용을 모니터링. 또 다른 연구에서는 구리 촉매 용액에서 티타늄 소재에 광범위 하 게 유도 결합된 플라즈마 광 방출 분 광 분석 (ICP OES), N2 physisorption (내기)에 의해 특징 이었다 XRD, UV에 대 한 DRS FT-적외선, 라만 분광학, 편-EDX, 및 화학적 측정23. 우리의 목표는 근원 및 소포 및 미네랄 뼈가 있는 차별화 동안 강화 작용을 제어 하는 메커니즘을 이해 하 두 셀 라인의 속성을 비교 했다.
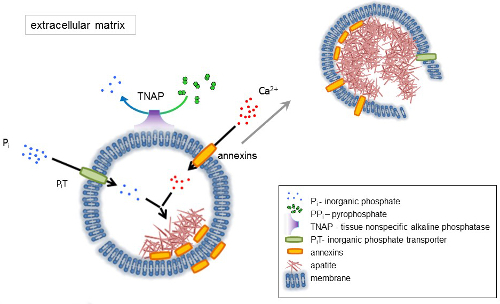
그림 1 . 뼈가 있는 세포 외 기질 (ECM) 단백질의 종합 및 막에서 매트릭스 소포 (MVs)의 출시에에서 강화의 초기 단계의 계획. MVs 칼슘 묶는 단백질, annexins 및 인산, 무기 인산 염 운송업 자 (구 덩이)의 행동을 통해 조직의 일반적인 알칼리 성 인산 가수분해 효소 (TNAP), dephosphorylates는의 활동에 의해 다음의 행동을 통해 칼슘 축적 PP나 를 P나, 따라서 인회석 nucleation 촉진. 그런 다음, MVs 분해 하 고 extracellular 매체에 apatites를 출시. 강화 작용은 P나 및 캘리포니아2 + extracellular 매체4,5에서 일정 한 공급에 의해 지속 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 세포 배양 및 치료
- 층 류 두건 아래 모든 필요한 자료를 넣고 아래 자외선 소독. 문화 미디어는: 1:1 혼합물 햄의 F12 및 DMEM 미디어 2.5 m L-글루타민 보충 100 U/mL 페니실린와 100 U/mL 스, 0.3 mg/mL G418 10% 소 태아 혈 청 (FBS) (v/v) 인간 태아 hFOB 1.19 SV40 큰 T 항 원 페에 대 한 osteoblasts, 그리고 맥 코이 5A 매체 1.5 m L-글루타민 보충과 100 U/mL 페니실린, 100 U/mL 스 15 %FBS (v/v) 인간의 다리 Saos-2 셀.
- 5% CO2 의 분위기에서 34 ° C에서 hFOB 1.19 셀과 5%의 분위기 속에서 37 ° C에서 Saos-2 셀 문화 공동2. 층 류 두건에 인큐베이터에서 세포 배양, 어느 hFOB 1.19 또는 Saos-2 셀을 전송 하 고 매체 FBS와 신선한 문화 매체의 10 mL에 변경 합니다.
- 자극 (휴식 셀) 없이 셀을 품 어 또는 50 µ g/mL Ascorbic 산 (AA) 7.5 m m β-Glycerophosphate (β-GP), 초순 앞부분에서 준비와 0.22 μ m 주사기 필터를 통해 필터링 된 다음 그들을 자극 합니다. 문화 매체의 표면에 플라스틱 microcentrifuge 관에서는 자극 제를 추가 합니다. 부드럽게 문화 요리를 저 어 하 고 7 일 동안 품 어.
2입니다. 칼슘 미네랄의 탐지
- 인산 염 버퍼 식 염 수와 세포 배양을 세척 (PBS: 125 mM NaCl, 5mm KCl, 10mm 나2HPO4, 1mm KH2포4, pH 7.0).
- 추가 2% (g:100 mL)의 5 mL PBS, pH 5.0에에서 아칸소-S 및 미네랄 얼룩을 30 분 동안 접시를 품 어.
- PBS로 3 회 세척. 신중 하 게, 접시 벽에 PBS를 추가 미네랄을 파괴 하지 않으려고.
- 칼슘 미네랄 거꾸로 가벼운 현미경을 관찰 하 고 이미지.
3입니다. UV 빛에서 프로브의 시각화
- 세포 lysates 콜라 소화 프로토콜24에 따르면 셀 문화, 휴식 또는 7 일에 대 한 자극을 처리 합니다.
- 세포 배양에서 매체를 수집 하 고 PBS로 세포 세척.
- 0.25 M 자당, 0.12 M NaCl, 0.01 M KCl, 그리고 0.02 M Tris HCl 버퍼, pH 7.45, 3 h 37 ° C에서의 솔루션에 500 U/mL 콜라의 3 mL로 세포를 소화.
- 기계적으로 긁어 셀, 플라스틱 microcentrifuge 튜브에 그들을 전송 고 통과 그들 10 번 1 mL 40 U 주사기 0.5 × 16 바늘.
- 5 분 동안 500 × g에서 샘플 원심
- 삭제는 상쾌한 고 합성 연골 림프 (SCL, 100 m m NaCl, 12.7 m m KCl, 0.57 m m MgCl2, 1.83 m m NaHCO3, 0.57 m m NaH2포4, 5.5 m m D-포도 당, 자당 63mm, 16.5 mM Hepes, pH 7.4)의 500 µ L에 셀 펠 릿을 중단.
- 주걱으로 UV transilluminator에 병에서 hydroxyapatite (HA), fluorapatite (FA) 및 chlorapatite (CA) 분말을 전송 및 컨트롤 사용.
- 플라스틱 팁 플라스틱 튜브에서 세포 lysates 전송 하 고 신중 하 게 UV transilluminator에 놓습니다.
- 받아 아래 보이는 이미지 자외선 빛.
4. 가장 EDX에 대 한 조사 준비
- 미네랄의 부정적인 얼룩이 지기에 대 한 준비
- 이온된 수의 500 µ L에서 합성으로 생성된 하, CA 및 FA 미네랄25 의 2.5 mg을 일시 중단 하 고 1 시간에 5% CO2 의 분위기 속에서 37 ° C에서 품 어.
- 가지고 Formvar/탄소 300 그물눈 니켈 격자 상자에서 정전기 방지 겸 도자기 다 잘 접시에 놓고 10 µ L HA, CA 및 FA 정지의 격자에 드롭.
- 건조 실 온에서 30 분에 대 한 샘플.
- 휴식의 준비 26 포함을 위한 세포를 자극 하 고
- 세포 배양에서 매체를 수집 하 고 생리 둔감 (PD) 매체 (125 m m NaCl, KCL, 10mm NaHCO35mm, 1mm KH2포4, 10 m m 포도 당, 20 mM HEPES, pH 7.4)와 셀을 세척.
- 3% (g:100 mL) paraformaldehyde/1% (g:100 mL)도 100 m m 나트륨 인산 염 버퍼, pH 7.2, 연기 후드 실 온에서 1 h의 혼합물의 5 mL와 함께 셀을 수정 합니다.
- 100mm 나트륨 인산 염 버퍼의 5 mL로 세포 세척 하 고 부드럽게 세척 후 버퍼를 제거.
- 어두운 방에서 100 m m 나트륨 인산 염 버퍼, pH 7.2, 연기 후드 실 온에서 20 분에에서 1% (g:100 mL) 오스뮴 tetroxide의 2 mL과 샘플을 후 위.
- 오스뮴 tetroxide를 제거 하 고 그것을 활용.
- 100mm 나트륨 인산 염 버퍼의 5 mL로 세포 세척.
- 그런 다음 실 온에서 등급된 에탄올 솔루션 시리즈의 5 mL aliquots에서 샘플을 탈수: 90% (vol.) 20 분, 75% (vol.) 15 분, 50% (vol.) 10 분, 25% (vol.) 5 분. 마지막으로 두 번 절대 에탄올을 사용 하 고 30 분 및 12 h 품 어.
- 기계적으로 플라스틱 문화 접시에서 세포를 긁어, 플라스틱 microcentrifuge 튜브에 수집 하 고 1 분 130 x g에서 샘플 원심.
- supernatants 제거 하 고 셀 LR 화이트 수 지와 볼륨 비율 1: 2의 절대 에탄올의 혼합물의 1 mL에 중단.
- 사용 하기 전에 유리 튜브의 내용을 잘 혼합 하 고 실 온에서 30 분 동안 품 어.
- 샘플 1 분 130 x g에서 원심
- supernatants를 제거 하 고 LR 화이트 수 지와 절대 에탄올의 1:1 혼합물의 1 mL를 사용 하 여 이전 단계를 반복 합니다.
- 잘 혼합 하 고 실 온에서 30 분 동안 품 어.
- 샘플 1 분 130 x g에서 원심
- supernatants 제거 합니다.
- 마지막으로, 샘플에 순수한 LR 화이트 수 지의 1 mL를 두 번 추가 하 고 플라스틱 튜브에 실 온에서 1 h에 품 어.
- 500 µ L 각 샘플의 젤라틴 캡슐에 넣으십시오.
참고: 샘플 수 지 라벨을 파괴 하지 않는다 그래야 종이 연필의 작은 시트를 사용 하 여 레이블이 지정 됩니다. - 젤라틴 캡슐, microcentrifuge 플라스틱 튜브에 넣어 닫고 스윙 아웃으로 터에서 1 분 130 x g에서 원심.
- 진공 펌프를 사용 하 여 플라스틱 튜브에서 캡슐을 제거 합니다.
- 오븐에 샘플을 이동 하 고 48 h 56 ° C에서 유해.
- 홀더에 장착 하 고 피라미드를 트리밍 하 여 블록을 준비 합니다.
- 소유자는 ultramicrotome, 다이아몬드 울트라 45 ° 칼 첨부 고 이온된 수; 그것을 채울합니다 부수적 기포에서 잎을 청소 하는 기억.
- 다음 섹션 (700 Å) 이온된 물 목욕에 다이아몬드 칼을 사용 하 여 잘라.
- Ni 그리드 소 속눈썹 및 장소 Formvar/탄소 300의 반짝이 면에 메쉬를 사용 하 여 스크랩을 설정 하 고 그들을 건조.
- 증기 두건 아래 어둠 속에서 절대 에탄올에 2.5% (vol.) 의해 uranyl 아세테이트를 준비 합니다. Uranyl 아세테이트 리드 컨테이너에 유지 하 고는 토사를 데리 러 하지 않는 것을 기억.
- 어두운 방에서 합성 apatites 및 에탄올 증기 두건에서 실 온에서 20 분에 2.5% (vol.) 의해 uranyl 아세테이트와 셀 샘플 격자를 counterstain.
- 다음 이온된 수에서 50% 에탄올에 격자 (vol.)에 의해 세척 하 고 24 시간 실 온에서 건조. 마지막으로, 상자에 격자를 넣어.
5. 가장 EDX 분석
- 전송 전자 현미경 (TEM)에 의해 가장 이미징 갖춘 전체 범위 에너지 흩어진 엑스레이 microanalysis (EDX) 시스템 11 메가 픽셀 카메라
- 미네랄과 세포의 관찰에 대 한 베릴륨 홀더를 준비 합니다. 정전기 방지 도구를 사용 합니다.
- 나사의 쌍을 제거 하 고 베릴륨 플레이트 들어올린 보유자의 나머지에서 베릴륨 세탁기.
- 그리드, 반짝이 면을, 소유자에 탑재 합니다.
- 조심 스럽게 베릴륨 세탁기와 베릴륨 접시 놓고 단단히 죔 나사를 나사.
- 진공 챔버에 홀더를 넣고 진공 펌프를 켭니다.
- 진공 달성 되 면 부드럽게 이미징 챔버에 홀더를 삽입 하 고 광선을 켭니다.
- 형광 모니터에는 현미경의 조리개 매개 변수를 설정 합니다. 이미지 난시 교정; 설정 확대/축소, 초점, 및 프레임; 50, 배율 TEM 이미지를 하는 고 000 X.
- 이미징 및 x 선 스펙트럼 및 구성 분석을 위한 microanalysis 줄기
- 스캐닝 전송 전자 현미경 (줄기) 이미징 챔버에 에너지 흩어진 엑스레이 (EDX) 검출기를 삽입 합니다.
- 초점 모드에서 이미지의 선명도 조정 합니다.
- 15, 확대 줄기 이미지를 000 X.
- X 선 microanalysis에 대 한 샘플에서 점을 선택 하 고 스펙트럼을 수집 합니다.
- 모든 원자 량 (100%)로 샘플에서 주기율표의 모든 요소에 대 한 요약 및 선택 된 요소의 콘텐츠를 나타내는 데이터를 가져옵니다: Ca, F, Cl, 및 (원자 %)으로 P. 그런 다음, 각 샘플에 대 한 Ca, F 또는 Cl p의 비율을 계산 합니다.
- 이온 매핑
- 칼슘, 불 소, 염소, 이온 매핑을 만들고 샘플에서 선택 된 요소의 EDX 지도 수행 인 등의 요소를 선택 합니다.
- 분석 된 요소의 지역화를 지정 하 여 데이터를 가져올: Ca, F, Cl, 및 P (원자 %)로 계산 하는 각 샘플에 대 한 Ca, F 또는 P와 Cl의 (%)에서 공동 지역화 하 고.
Access restricted. Please log in or start a trial to view this content.
결과
가장 EDX 체 외에 이미징 매트릭스 소포 (MVs) 셀 mineralizing 발표와 M대 강화 작용의 과정을 다르게 진행할 수 있습니다이 기술을 사용 하 여 얻은 결과 입증 하 여 생산 하는 미네랄의 수 에 셀의 다양 한 종류. 두 셀 라인 같은 osteoblastic transdifferentiation 치료를 받은 아직 자극된 Saos-2 셀 mineralized hFOB 보다 더 효율적으로 1.19 osteoblasts 아칸소-S에 의해 입증으로 얼룩...
Access restricted. Please log in or start a trial to view this content.
토론
현재 신문에서 우리에 대 한 아칸소-얼룩, fluorapatite의 UV 빛 식별 프로토콜을 설명 하 고 가장 EDX 체 외에 이미징 MVs 셀 mineralizing 발표와 미네랄의 MVs. 에 의해 생산 그것은 몇 가지 일반적인 문제 해결 단계에 따라 위에서 언급 한 모든 메서드를 해결 수 있습니다. 최적의 결과 얻으려면 몇 가지 중요 한 단계는 신중 하 게 수행 되어야 한다. 첫째, 그것은 AA (산 성) 인 β-GP (알칼리 성) ?...
Access restricted. Please log in or start a trial to view this content.
공개
저자 들은 전혀 상충 선언 합니다.
감사의 말
MK 및 요청 수동 작업을 수행 하는 파운드 그림을 준비 하 고 만든 영화. ASK 쓴 원고, 파운드 쓴 스크립트와 MK 준비 테이블. SM, RB 및 SP는 비판적으로 테이블, 스크립트 및 원고 읽기. 저자 ultramicrotomy와 그녀의 훌륭한 지원에 대 한 한 나 Chomontowska로 Szymon Suski와 헨리크 Bilski 가장 EDX 분석 그들의 훌륭한 지원에 대 한 감사 하 고 싶습니다. 저자는 전문 영어 교정 패트릭 나무와 지시를 기록 하기 위한 바바라 Sobiak 박사 감사 하 고 싶습니다.
이 일 파운드 및 2016/23/N/NZ1/02449 MK, EU FP7 프로젝트 BIOIMAGINE에 국립 과학 센터, 폴란드 2016/23/N/NZ4/03313에서 교부 금에 의해 물어, 과학 및 고 등 교육의 폴란드어 사역에서 N N401 140639 그랜트에 의해 지원 되었다 : 바이오 이미징 연구 혁신 및 교육, 조지아 No. 264173, 그리고 법정 자금의 Nencki 연구소의 실험 생물학, 아카데미 과학의 폴란드어.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Ham’s DMEM/F12 media mixture | PAA | E15-813 | 1:1, for human fetus hFOB 1.19 SV40 large T antigen transfected osteoblasts (ATCC CRL-11372) |
| McCoy’s 5A medium | PAA | E82312-0025 | for human osteosarcoma Saos-2 cells (ATCC HTB-85) |
| Antibiotics mixture (penicillin/streptomycin) | Sigma | P0781-100ML | 100 U/mL each |
| G-418 | Sigma | 68168 | 0.3 mg/mL |
| FBS | Gibco | 10270 | 10% for hFOB 1.19 and 15% for Saos-2 |
| AA | Sigma | A-5960 | 50 µg/mL |
| ß-GP | Sigma | G9422-100G | 7.5 mM |
| Bio-Gel HTP Gel | Bio-Rad | 130-0420 | for HA |
| FA | synthesized by us | ||
| CA | synthesized by us | ||
| Sodium phosphate buffer Na2HPO4/NaH2PO4 mixture | Sigma | S7907/S8282 | 0.1 M, pH 7.2 |
| PBS | pH 7.0, prepared by us | ||
| AR-S in PBS | Sigma | A5533-25G | 0.5 g/100 mL, pH 5.0 |
| Collagenase type IA | Sigma | C2674 | 500 U/mL |
| SCL buffer | prepared by us | ||
| Deionized wather | produced by us | ||
| Ethanol | POCh | BA6480111 | absolut 99.8% and solutions 25, 50, 75, 90% |
| Uranyl acetate in 50% ethanol | Polysciences Inc. | 21447-25 | 0.25 g/10 mL |
| PD medium | pH 7.4, prepared by us | ||
| Fixation mixture (paraformaldehyde/glutaraldehyde) | Sigma | 158127/G-6257 | 3%:1% |
| Post-fixation OsO4 | Sigma | 75633 | 1% |
| LR White resin in ethanol | Polysciences Inc. | 17411-MUNC 500g | 1:2, 1:1, 100% |
| Acetone | CHEMPUR | 111024800 | pure |
| Tool | |||
| Cryogenic vials | Corning Inc. | 430487 | 1.2 mL |
| Plastic Petri culture dishes | Falcon | 353003 | 100 mm |
| Plastic tubes | Falcon | 352096 and 352070 | 15 and 50 mL |
| Serological pipettes | Falcon and VWR | 357521 and 612-3700 | 1 and 10 mL |
| Plastic microcentrifuge tubes | Sigma | Z688312 and Z628034 | 1.5 mL black and 2 mL transparent |
| Plastic tips | VWR | 613-0364, 613-0239 and 613-1050 | 0.1-10 µL natural, 1-200 µL yellow and 200-1000 µL blue |
| Plastic racks | Light Labs | A-7055-Z, A-7053-C | green for tubes, orange for micro tubes and blue for TEM probes |
| Laminar Hera Save | Thermo Scientific Co. | KS12 | HEPA filter (H14 according to DIN EN 1822) |
| Incubators Hera Cell | Thermo Scientific Co. | 150 | 34°C for hFOB 1.19 and 37°C for Saos-2 |
| Fume hood | POLON | WCS-2 | for TEM stainings |
| Glass bottles | SIMAX | 1632414501050 and 1632414501100 | 50 and 100 mL |
| Quartz glass tubes | SIMAX | 638422010100 | Ø 10 mm, L 100 mm |
| Pump | IBS Integra Biosciences | VACUSAFE comfort | for vacuum |
| Oven | Memmert | UNE 400 | 56°C |
| Porcelain multi-well plate | Rosenthal technik | 229/12 | 12 wells |
| Glass beakers | SIMAX | 632417010025 | 25 mL |
| Glass bottles | Pocord | DIN22 | 10 mL |
| Plastic box | Agar Scientific Ltd. | for darkness | |
| Snap Fit Gelatin Capsules | Agar Scientific Ltd. | G3741 | size 1 |
| Formvar/Carbon 300 Mesh Ni grids in box | Agar Scientific Ltd. | S162N3 | film on the shiny side |
| Silicon cell scraper | Sigma | SIAL0010-100EA | size 1.8/25 cm |
| Syringe with needle | BogMark | 007 | syringe 1 mL 40 U, needle 0.5 x 16 |
| Syringe | Chirana | CH005L | 5 mL |
| Centrifuge | MPW Medical Instruments | MPW-350R | 130 x g and 500 x g |
| UV transluminator | UVP | M-20 | for visible and UV light |
| Ultramicrotome | LKB | NOVA | 700Å sections |
| Block holder | LKB | E6711 | round shape |
| Diamond knife | DiATOME | Ultra 45° | size 3 |
| Eyelash holder | bovine, prepared by us | ||
| Forceps | ROTH | 2855.1 | antistatic for grids |
| Spatulas set | ROTH | E286.1 | antistatic for powders |
| Imaging | |||
| Inverted Light Microscope | Zeiss with Canon | AxioObserver Z1 equipped with PowerShot G9 | Phase contrast, Transmitted light, 20 x objective, RGB filters |
| Transmission Electron Microscope | TEM Jeol Co. with Oxford Instruments and SiS-Olympus | JEM-1400 TEM equipped with full range INCA Energy Dispersive X-ray microanalysis (EDX) System and 11 Megapixel MORADA G2 camera | magnification 50,000X for TEM and 15,000X for STEM and EDX |
| Camera body and lenses | Nikon | Nikon D7100 Nikkor AF Micro 105 mm f/2.8D Nikkor AF-S 50 mm f/1.8G Nikkor AF 28 mm f/2.8D | for movie recordings |
| Microphone | MXL Mics | Tempo | for voice recordings |
참고문헌
- Buckwalter, J. A., Cooper, R. R. Bone structure and function. Instr. Course Lect. 36, 27-28 (1987).
- Anderson, H. C. Molecular biology of matrix vesicles. Clin. Orthop. Relat. Res. 314, 266-280 (1995).
- Anderson, H. C. Matrix vesicles and calcification. Curr Rheumatol. 5 (3), 222-226 (2003).
- Bolean, M., Simão, A. M. S., Barioni, M. B., Favarin, B. Z., Sebinelli, H. G., Veschi, E. A., Janku, T. A. B., Bottini, M., Hoylaerts, M. F., Itri, R., Millán, J. L., Ciancaglini, P. Biophysical aspects of biomineralization. Biophys Rev. 9 (5), 747-760 (2017).
- Bottini, M., Mebarek, S., Anderson, K. L., Strzelecka-Kiliszek, A., Bozycki, L., Simão, A. M. S., Bolean, M., Ciancaglini, P., Bandorowicz Pikula, J., Pikula, S., Magne, D., Volkmann, N., Hanein, D., Millán, J. L., Buchet, R. Matrix vesicles from chondrocytes and osteoblasts: Their biogenesis, properties, functions and biomimetic models. Biochim Biophys Acta. 1862 (3), 532-546 (2018).
- Hessle, L., Johnson, K. A., Anderson, H. C., Narisawa, S., Sali, A., Goding, J. W., Terkeltaub, R., Millan, J. L. Tissue-nonspecific alkaline phosphatase and plasma cell membrane glycoprotein-1 are central antagonistic regulators of bone mineralization. Proc. Natl. Acad. Sci. U. S. A. 99 (14), 9445-9449 (2002).
- Garimella, R., Bi, X., Anderson, H. C., Camacho, N. P. Nature of phosphate substrate as a major determinant of mineral type formed in matrix vesicle-mediated in vitro mineralization: An FTIR imaging study. Bone. 38 (6), 811-817 (2006).
- Thouverey, C., Bechkoff, G., Pikula, S., Buchet, R. Inorganic pyrophosphate as a regulator of hydroxyapatite or calcium pyrophosphate dihydrate mineral deposition by matrix vesicles. Osteoarthr. Cartil. 17, 64-72 (2009).
- Terkeltaub, R. A. Inorganic pyrophosphate generation and disposition in pathophysiology. Am. J. Phys. 281 (1), 1-11 (2001).
- Guicheux, J., Palmer, G., Shukunami, C., Hiraki, Y., Bonjour, J. P., Caverzasio, J. A novel in vitro culture system for analysis of functional role of phosphate transport in endochondral ossification. Bone. 27 (1), 69-74 (2000).
- Yadav, M. C., Bottini, M., Cory, E., Bhattacharya, K., Kuss, P., Narisawa, S., Sah, R. L., Beck, L., Fadeel, B., Farquharson, C., Millán, J. L. Skeletal mineralization deficits and impaired biogenesis and function of chondrocyte-derived matrix vesicles in Phospho1(-/-) and Phospho1/Pi t1 double-knockout mice. J. Bone Miner. Res. 31 (6), 1275-1286 (2016).
- Thouverey, C., Malinowska, A., Balcerzak, M., Strzelecka-Kiliszek, A., Buchet, R., Dadlez, M., Pikula, S. Proteomic characterization of biogenesis and functions of matrix vesicles released from mineralizing human osteoblast-like cells. J. Proteome. 74 (7), 1123-1134 (2011).
- Wang, W., Xu, J., Kirsch, T. Annexin-mediated Ca2+ influx regulates growth plate chondrocyte maturation and apoptosis. J. Biol. Chem. 278 (6), 3762-3769 (2003).
- Nollet, M., Santucci-Darmanin, S., Breuil, V., et al. Autophagy in osteoblasts is involved in mineralization and bone homeostasis. Autophagy. 10 (11), 1965-1977 (2014).
- Boonrungsiman, S., Gentleman, E., Carzaniga, R., Evans, N. D., McComb, D. W., Porter, A. E., Stevens, M. M. The role of intracellular calcium phosphate in osteoblast-mediated bone apatite formation. Proc. Natl. Acad. Sci. U. S. A. 109 (35), 14170-14175 (2012).
- Genge, B. R., Wu, L. N., Wuthier, R. E. In vitro modeling of matrix vesicle nucleation: synergistic stimulation of mineral formation by annexin A5 and phosphatidylserine. J. Biol. Chem. 282 (36), 26035-26045 (2007).
- Jahnen-Dechent, W., Schäfer, B., Ketteler, M., McKee, M. D. Mineral chaperones: a role for fetuin-A and osteopontin in the inhibition and regression of pathologic calcification. J. Mol. Med. (Berl). 86 (4), 379-389 (2008).
- Suchanek, W., Yoshimura, M. Processing and properties of hydroxyapatite-based biomaterials for use as hard tissue replacement implants. J. Miner. Res. 13 (1), 94-117 (1998).
- Pautke, C., Schieker, M., Tischer, T., Kolk, A., Neth, P., Mutschler, W., Milz, S. Characterization of osteosarcoma cell lines MG-63, Saos-2 and U-2 OS in comparison to human osteoblasts. Anticancer Res. 24 (6), 3743-3748 (2004).
- Yen, M. -L., Chien, C. -C., Chiu, I. -M., Huang, H. -I., Chen, Y. -C., Hu, H. -I., Yen, B. L. Multilineage differentiation and characterization of the human fetal osteoblastic 1.19 cell line: a possible in vitro model of human mesenchymal progenitors. Stem Cells. 25 (1), 125-131 (2007).
- Brittle, S. W., Foose, D. P., O'Neil, K. A., Sikon, J. M., Johnson, J. K., Stahler, A. C., Ryan, J. D., Higgins, S. R., Sizemore, I. E. A raman-based imaging method for characterizing the molecular adsorption and spatial distribution of silver nanoparticles to hydrated mineral surfaces. Environ Sci Technol. , (2018).
- Liu, N., Wang, Y., Ge, F., Liu, S., Xiao, H. Antagonistic effect of nano-ZnO and cetyltrimethyl ammonium chloride on the growth of Chlorella vulgaris: Dissolution and accumulation of nano-ZnO. Chemosphere. 196, 566-574 (2018).
- Tasbihi, M., Kočì, K., Troppová, I., Edelmannová, M., Reli, M., Čapek, L., Schomäcker, R. Photocatalytic reduction of carbon dioxide over Cu/TiO2 photocatalysts. Environ Sci Pollut Res Int. , (2017).
- Chen, N. X., O'Neill, K. D., Chen, X., Moe, S. M. Annexin-Mediated Matrix Vesicle Calcification in Vascular Smooth Muscle Cells. J. Bone Miner. Res. 23 (11), 1798-1805 (2008).
- Strzelecka-Kiliszek, A., Bozycki, L., Mebarek, S., Buchet, R., Pikula, S. Characteristics of minerals in vesicles produced by human osteoblasts hFOB 1.19 and osteosarcoma Saos-2 cells stimulated for mineralization. J. Inorg. Bioch. 171, 100-107 (2017).
- Thouverey, C., Strzelecka-Kiliszek, A., Balcerzak, M., Buchet, R., Pikula, S. Matrix vesicles originate from apical membranę microvilli of mineralizing osteoblast-like Saos-2 cells. J. Cell. Biochem. 106 (1), 127-138 (2009).
- Cazalbou, S., Eichert, D., Ranz, X., Drouet, C., Combes, C., Harmand, M. F., Rey, C. Ion exchanges in apatites for biomedical application. J. Mater. Sci. Mater. Med. 16 (5), 405-409 (2005).
- Kraus, D. Consolidated data analysis and presentation using an open-source add-in for the Microsoft Excel® spreadsheet software. Med. Writ. 23 (1), 25-28 (2014).
- Kawasaki, K., Buchanan, A. V., Weiss, K. M. Biomineralization in humans: making the hard choices in life. Annu. Rev. Genet. 43, 119-142 (2009).
- Bonucci, E. Bone mineralization. Front. Biosci. 17, 100-128 (2012).
- Veis, A., Dorvee, J. R. Biomineralization mechanisms: A new paradigm for crystal nucleation in organic matrices. Calcif. Tissue Int. 93 (4), 307-315 (2013).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A., Sone, E. D. In vitro models of collagen biomineralization. J. Struct. Biol. 183 (2), 258-269 (2013).
- Alliston, T. Biological regulation of bone quality. Curr. Osteoporos. Rep. 12 (3), 366-375 (2014).
- Wang, W., Kirsch, T. Retinoic acid stimulates annexin-mediated growth plate chondrocyte mineralization. J. Cell Biol. 157 (6), 1061-1069 (2002).
- Wang, W., Xu, J., Kirsh, T. Annexin V and terminal differentiation of growth plate chondrocytes. Exp. Cell Res. 305 (1), 156-165 (2005).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유