需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
生物聚合物添加剂中碳酸钙的形成
摘要
我们描述了在生物聚合物存在的情况下形成的碳酸钙晶体的沉淀和表征方案。
摘要
生物矿化是在有机分子存在的情况下形成矿物质,通常与生物体的功能和/或结构作用有关。这是一个复杂的过程,因此,需要一个简单的体外系统来了解分离分子对生物矿化过程的影响。在许多情况下,生物矿化是由细胞外基质中的生物聚合物引导的。为了评价分离生物聚合物在体外对方解石的形态和结构的影响,我们采用蒸汽扩散法对碳酸钙、扫描电子显微镜和微拉曼进行表征,和紫外线可见光(UV/Vis)的吸收度,用于测量晶体中生物聚合物的数量。在这种方法中,我们将溶解在氯化钙溶液中的分离生物聚合物暴露于来自碳酸固体铵分解的气态氨和二氧化碳中。在达到碳酸钙溶解度产物的条件下,形成碳酸钙沉淀物和晶体。碳酸钙具有不同的多态性,其热力学稳定性不同:非晶碳碳酸钙、大石、阿拉贡石和方解石。在没有生物聚合物的情况下,在清洁条件下,碳酸钙主要以方解石的形式存在,这是碳酸钙最热力学稳定多态的。该方法考察了生物聚合物添加剂对碳酸钙晶体形态和结构的影响。在这里,我们通过研究细胞外细菌蛋白TapA,来演示碳酸钙晶体的形成。具体来说,我们专注于实验设置和表征方法,如光学和电子显微镜以及拉曼光谱学。
引言
生物矿化是在有机分子存在的情况下形成矿物质,通常与生物体的功能和/或结构作用有关。生物矿化可以是细胞内,如在磁化细菌1或细胞外形成磁铁矿,如在海胆尖峰2中形成碳酸钙,与胶原蛋白相关的羟基磷灰石骨骼3和与牙齿4中的阿美激素相关的釉质。生物矿化是一个复杂的过程,它依赖于生物体中的许多参数。因此,为了简化所研究的系统,有必要评估单独组件对过程的影响。在许多情况下,生物矿化是由细胞外生物聚合物的存在引起的。这里介绍的方法的用途如下:(1)利用蒸汽扩散方法在体外存在分离的生物聚合物的情况下形成碳酸钙晶体。(2)研究生物聚合物对碳酸钙形态和结构的影响。
在有机添加剂存在的情况下,在体外沉淀碳酸钙的三种主要方法采用5,6。第一种方法,我们将称为溶液方法,是基于混合可溶性盐的钙(例如,CaCl 2)与碳酸盐的可溶性盐(如碳酸钠)。混合过程可以通过多种方式进行:在反应器内,有三个细胞,由多孔膜7分离。在这里,每个外层细胞都含有可溶性盐,而中心细胞包含一种溶液,其添加剂需要测试。当钙和碳酸盐的浓度超过其溶解度产物时,钙和碳酸盐从外部扩散到中细胞,导致低溶性碳酸钙沉淀,Ksp = [Ca2]CO32-*另一种混合方法是双喷射程序8。在这种方法中,每个可溶性盐从单独的注射器注射到含有添加剂的搅拌溶液中,其中碳酸钙沉淀。在这里,注射,因此混合速率得到了很好的控制,与以前的混合由扩散控制的方法相反。
第二个用于结晶CaCO3的方法是北野方法9。此方法基于碳酸盐/碳酸氢平衡 (2HCO3- (aq) + Ca 2+(aq) 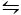 CaCO3 (s) + CO 2(g) + H2O (l)。在这里,CO2以固体形式冒泡成含有 CaCO3的溶液,将平衡向左移动,从而溶解碳酸钙。未溶解的碳酸钙被过滤,所需添加剂被添加到富含碳酸氢酸盐的溶液中。然后允许CO2蒸发,从而将反应向右移动,在添加剂的存在下形成碳酸钙。
CaCO3 (s) + CO 2(g) + H2O (l)。在这里,CO2以固体形式冒泡成含有 CaCO3的溶液,将平衡向左移动,从而溶解碳酸钙。未溶解的碳酸钙被过滤,所需添加剂被添加到富含碳酸氢酸盐的溶液中。然后允许CO2蒸发,从而将反应向右移动,在添加剂的存在下形成碳酸钙。
第三种碳酸钙结晶方法,我们将在这里描述,是蒸汽扩散法10。在此设置中,溶解在氯化钙溶液中的有机添加剂以粉末形式放置在靠近碳酸铵的封闭室中。当碳酸铵粉末分解成二氧化碳和氨时,它们扩散到含有钙离子的溶液中(例如CaCl2),碳酸钙沉淀(见图1为图)。 碳酸钙晶体可以通过缓慢降水或快速沉淀生长。对于缓慢沉淀,将含有CaCl2溶液中的添加剂的溶液放置在碳酸铵粉末旁边的干燥器中。在协议中描述的长度的快速沉淀中,添加剂溶液和碳酸铵都放在一个多孔板中。慢降水方法会产生更少的成核中心和更大的晶体,而快速沉淀将导致更多的成核中心和更小的晶体。
上述方法的技术复杂性、控制水平和降水过程速率各不相同。混合方法需要双射流和三芯系统的特殊设置 6。在混合方法中,其他可溶性计数器离子(例如,Na +、Cl-)6的存在是不可避免的,而在 Kitano 方法中,钙和(碳酸)碳酸盐是溶液中唯一的离子,并且不涉及附加离子的存在计数器离子(例如,Na=, Cl-)。此外,混合方法需要相对较大的体积,因此不适合使用昂贵的生物聚合物。双喷头的优点是可以控制溶液注入速率,与其他方法相比,它是一个快速的过程。
Kitano 方法和蒸汽扩散法的优点是碳酸钙的形成通过 CO2扩散成/出 CaCl2溶液,从而可以探测较慢的成核和沉淀过程11,12.此外,通过CO2扩散形成的碳酸钙可能类似于体内13、14、15的钙化过程。在这种方法中,形成定义良好和分离的晶体16。最后,可以测试单个或多个生物聚合物对碳酸钙形成的影响。这使得系统研究一系列添加剂浓度对碳酸钙形成的影响,以及生物聚合物混合物的研究 - 所有这些都以受控方式进行。该方法适用于大量浓度和大量添加剂。使用的最低体积约为50μL,因此,当可用生物聚合物数量有限时,这种方法是有利的。最大体积取决于更大的孔板的可访问性,或将包含 CaCl2的板或烧杯插入的干燥器。下面描述的方法已经优化,在96孔板中工作,生物聚合物被选为蛋白质TapA17。
研究方案
1. 碳酸钙结晶
- 控制准备和优化
- 准备干净的玻璃片。使用相同的清洁程序清洁玻璃器皿。
- 使用钻石笔切割玻璃显微镜幻灯片,使其适合 96 孔板的井。
注:5 毫米 x 5 毫米件应适合。 - 将玻璃片放入装有三重蒸馏水 (TDW) 的烧杯中,以便水覆盖玻璃滑梯,并在浴缸声波器中声波 10 分钟。
- 将水浸上,加入乙醇以覆盖玻璃滑梯,并在沐浴声波器中声波10分钟。
- 用氮气干燥滑梯和玻璃器皿,并将其放入空气等离子清洗器中,在 130 W 下放置 10 分钟。
- 使用钻石笔切割玻璃显微镜幻灯片,使其适合 96 孔板的井。
- 优化在所需实验条件下进行的钙化实验中使用的 CaCl2的浓度,以获得富含光滑面方解石晶体的样品(没有或至少具有稀少数量的 vaterite晶体)。
- 用碳酸铵粉填充96孔板角落的孔,并用铝箔密封板;用石蜡薄膜盖住箔片。使用氮气清洁任何残余碳酸铵。
注意:碳酸铵会刺激鼻子和肺部;仅在烟罩内使用。 - 准备 0.5 M CaCl2的库存溶液 。此库存溶液将用于制备多孔板中 CaCl2溶液浓度梯度。
注:10 mL 库存溶液足以用于整个实验。 - 将先前切割和清洁的玻璃片放入五个不同的井中。使用离中心最近的井。
- 用 100 μL 的 CaCl2溶液16填充每口带玻璃片的玻璃片。混合 TDW 和 0.5 M CaCl 2(库存),实现不同油井中 CaCl2的浓度梯度增加。如果使用不同尺寸的孔板,请调整 CaCl2的浓度以实现单独的方解石晶体(步骤 1.1.2.10,请参阅讨论部分)。
注:此协议使用单独的井中增加的 CaCl2梯度 10、20、30、40、50 mM 浓度。要增加浓度范围或测试的浓度数量,请使用额外的井。 - 用针刺穿每口含有碳酸铵3倍的井盖。
- 放回盖子,用石蜡薄膜密封边界,并将其保持在18°C的培养箱中20小时。
- 孵育后,小心地打开通风罩内的盖子,用回路去除在水/空气界面上形成的晶体。
- 使用钳子将玻璃片转移到含有双蒸馏水 (DDW) 的烧杯中。从烧杯中取出样品,并使用双面胶带将玻璃片固定在培养皿底部。
- 用纸巾擦干过多的水接触滑道的边界。盖上培养皿,放在干燥器中24小时。
- 观察用立体镜(3.5倍放大倍数)和/或直立光学显微镜(10x-40倍放大倍数)在玻璃片上形成的晶体。如果控制溶液是干净的,用光学显微镜观察菱形晶体(最有可能是方解石)(图2A)。
- 如果除了菱形晶体外,该控制还包含球状晶体(很可能是黄铁矿,图2B),或者如果扫描电子显微镜(SEM)图像显示带粗糙而不是光滑表面的菱形晶体(图 3A,B,重复结晶协议,确保清洁步骤(1.1.1)正确执行。此外,要更好地注意,除了专用井之外,板上没有碳酸铵。否则,继续执行下一步。
- 用碳酸铵粉填充96孔板角落的孔,并用铝箔密封板;用石蜡薄膜盖住箔片。使用氮气清洁任何残余碳酸铵。
- 准备干净的玻璃片。使用相同的清洁程序清洁玻璃器皿。
- 在添加剂存在的情况下结晶
- 为了研究添加剂对CaCO3结晶的影响,建立了含有(不同孔)的多孔板、不含添加剂的控制CaCl2溶液和含有添加剂的CaCl2溶液。在实验中使用第 1.1.2 节中找到的 CaCl2的最佳浓度。
注:下面的协议使用最佳条件,如上一项研究16中报告的条件。 - 重复步骤 1.1.2.2。
- 如步骤 1.1.2.1 所述,将碳酸铵粉末放在板的角落。
- 在每口将发生降水的井中,放置一块被切割和清洁的玻璃片,如第 1.1.1 节所述。
- 要准备控制井,将 90 μL 的 TDW 移液器放入控制井。准备每个井中至少一个副本,包括控件。如果使用的添加剂在缓冲液中,则移液器 90 μL 的缓冲液而不是 TDW 水。
- 准备含添加剂的井。在水中加入90μL的添加剂溶液,重复步骤1.2.5。如果添加剂位于缓冲液中(而不是 TDW),则用缓冲液预先调整添加剂的浓度,以满足所需的最终浓度。保持总体积为90μL;移液器首先添加,然后是缓冲器。
注:本协议使用10mM NaCl中10μM蛋白质TapA的最终浓度,25 mM Tris pH 8.0缓冲液16。 - 将 10 μL 的 0.5 M CaCl2库存溶液(在步骤 1.2.2 中准备)添加到对照组和含添加剂的井中,最终浓度达到 50 mM CaCl2。
- 重复步骤 1.1.2.5-1.1.2.9。
- 为了研究添加剂对CaCO3结晶的影响,建立了含有(不同孔)的多孔板、不含添加剂的控制CaCl2溶液和含有添加剂的CaCl2溶液。在实验中使用第 1.1.2 节中找到的 CaCl2的最佳浓度。
2. 碳酸钙晶体的特性
- 使用扫描电子显微镜,观察在添加剂中形成的碳酸钙晶体,其分辨率高于光学显微镜获得的决议(参见步骤 1.1.2.10)。
- 将含有晶体的玻璃片安装在铝根上,并带有双面碳胶带。
- 涂上一层Au/Pd,为40-50s。
- 在 5 kV 加速度电压下获取图像。
注:图3A显示了在适当的对照实验中形成的碳酸钙晶体的代表性SEM图像,而图4显示了在蛋白质TapA存在的情况下形成的碳酸钙晶体的代表性图像.
- 执行微拉曼光谱,以确定碳酸钙多态形成。微型拉曼允许从单个晶体而不是从整个粉末收集拉曼光谱。
- 使用显微镜的 20 倍目标选择感兴趣的晶体。
- 使用 514 nm 的龙激光器收集 100~3200cm-1范围内的拉曼光谱。
注:图5显示了方解石(A)和瓦泰石(B)的代表性光谱。关于阿拉贡石的光谱,请参阅参考18。
-
CaCO3沉淀中添加剂质量百分比的量化
- 验证/测量所用添加剂的消光系数(+)。蛋白质的灭绝系数可以通过在线服务器给出19。如果消光系数未知,则测量不同浓度的添加剂的吸收率,绘制吸收度与浓度,并从曲线的斜率计算消光系数。
- 称量晶体形成处的玻璃片,最好使用微平衡。
- 将玻璃上的晶体刮入 1.2 mL 的 0.1M 醋酸溶液中,涡旋并声波样品。将样品在室温下储存24小时。
注意:在皮肤或眼睛接触的情况下,醋酸是非常危险的;谨慎处理,并按照规定处理。 - 刮掉晶体后称量玻璃滑块。
- 测量溶液的紫外线/透光度(A)光谱。如果添加剂是蛋白质,则使用比尔-兰伯特方程测量 280 nm 处的吸光度并计算其浓度(C):
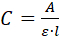
在那里,我就是比色皿内的光学路径。 - 使用 2.3.5 中的浓度(C)和使用体积(V = 1.2 mL) 来计算晶体中/晶体上添加剂的质量(m)。如果浓度为mg/mL,则使用方程C = V = m。
- 如果浓度为摩尔/L,则计算应用C = V = n的摩尔(n)。 然后使用分子量(Mw)计算添加剂的质量(m) (m = n = Mw)。
- 使用等式计算晶体中/晶体中添加剂的重量百分比:,
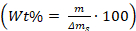 其中m是添加剂的质量,μm s是从玻璃上报废的碳酸钙晶体的质量件。
其中m是添加剂的质量,μm s是从玻璃上报废的碳酸钙晶体的质量件。
结果
实验设置的示意图如图1所示。简单地说,利用扩散法在96孔板中形成碳酸钙晶体,并测试生物聚合物对碳酸钙晶体形态和结构的影响。在这些实验中,碳酸铵被分解成氨和CO2,扩散成碳酸钙溶液,导致碳酸钙晶体的形成(图1和图2)。
通过比较使用(控制)添加剂和无(控制)的碳酸钙晶体,评估生物聚合物的效果。?...
讨论
本文介绍的方法旨在以有机添加剂的存在形成碳酸钙晶体,并评估有机生物聚合物对碳酸钙晶体在体外形态和结构的影响。该方法基于在有机添加剂存在时形成的晶体与控制实验中形成的方解石晶体的比较。我们已经展示了如何使用扩散方法形成碳酸钙晶体,如何使用光学和电子显微镜来描述其形态,如何使用拉曼光谱来描述其结构,以及如何确定有机含量(重量/重量百分比)的晶体。
披露声明
作者没有什么可透露的。
致谢
作者感谢利亚·阿达迪教授、乔纳森·埃雷兹教授和Yael Politi博士进行了富有成果的讨论。这项研究得到了以色列科学基金会(ISF)的支持,赠款1150/14。
材料
| Name | Company | Catalog Number | Comments |
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
参考文献
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。