Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Biyopololitik katkı maddelerinin varlığında kalsiyum karbonat oluşumu
Bu Makalede
Özet
Biz biopolymers varlığı şeklinde kalsiyum karbonat kristalleri yağış ve karakterizasyonu için bir protokol açıklanmaktadır.
Özet
Biomineralizasyon, sıklıkla yaşayan organizmalarda fonksiyonel ve/veya yapısal roller ile ilgili organik moleküllerin varlığında minerallerin oluşumudur. Kompleks bir süreçtir ve bu nedenle basit, in vitro, izole moleküllerin biomineralizasyon sürecinde etkisini anlamak için sistem gereklidir. Birçok durumda, biomineralizasyon, ekstrasellüler matrisinde biyopolimerler tarafından yönlendirilir. İzole biopolymlerin Morfoloji ve kalsit in vitro yapısı üzerinde etkisini değerlendirmek için, kalsiyum karbonat yağlaması için buharı difüzyon yöntemi kullandık, Tarama elektron mikroskobu ve mikro Raman karakterizasyonu için, ve ultraviyole-görünür (UV/vis) kristallerin bir biyopolimer miktarını ölçmek için emici. Bu yöntem, biz izole biopolymers açığa, bir kalsiyum klorür çözeltisi içinde çözünmüş, gazlı amonyak ve karbon dioksit, katı amonyum karbonat debileşimi kaynaklanan. Kalsiyum karbonatın çözünürlük ürününün ulaşabileceği koşullarda, kalsiyum karbonat çökme ve kristaller oluşur. Kalsiyum karbonat, termodinamik istikrarında farklılık gösteren farklı polimorf vardır: amorf kalsiyum karbonat, vaterit, aragonit, ve kalsit. Biopolymers yokluğunda, temiz koşullar altında, kalsiyum karbonat çoğunlukla kalsiyum karbonat en termodinamik istikrarlı polimorf olan kalsit formunda mevcut. Bu yöntem, biyofolymeric katkı maddelerinin kalsiyum karbonat kristallerinin Morfoloji ve yapısına etkisini inceler. Burada, iletişim kuralını, kalsiyum karbonat kristalleri oluşumunda, ekstrüler bir bakteriyel protein, TapA, çalışma yoluyla gösteriyoruz. Özellikle, deneysel olarak ayarlanmış ve optik ve Elektron Mikroskopisi ve Raman spektroskopisi gibi karakterizasyon yöntemlerini odaklanıyoruz.
Giriş
Biomineralizasyon, sıklıkla yaşayan organizmalarda fonksiyonel ve/veya yapısal roller ile ilgili organik moleküllerin varlığında minerallerin oluşumudur. Biomineralizasyon hücre içi olabilir, manyetit içindeki manyetit oluşumunda olduğu gibi1, veya ekstrüküler, deniz atası sivri kalsiyum karbonat oluşumunda olduğu gibi2, içinde kollajen ile ilgili hidroksiapatit kemikler3 ve diş amolgenin ile ilişkili emaye4. Biomineralization, yaşayan organizmadaki birçok parametreye bağlı karmaşık bir süreçtir. Bu nedenle, çalışma altında sistemi basitleştirmek için, işlem üzerinde ayrı bileşenlerin etkisini değerlendirmek gereklidir. Birçok durumda, biomineralizasyon ekstrasellüler biopolymers varlığı ile indüklenir. Burada sunulan yöntemin amacı aşağıdaki gibidir: (1) izole biyopolimerler in vitro varlığını kalsiyum karbonat kristalleri oluşturmak için, bir buhar difüzyon yöntemi kullanarak. (2) biyopolimerler kalsiyum karbonat Morfoloji ve yapısı üzerinde etkisini incelemek için.
Organik katkı maddelerinin varlığına kalsiyum karbonat in vitro çöktmek için üç temel yöntem5,6kullanılır. Çözüm yöntemi olarak atıfta olduğumuz ilk yöntem, çözünür tuz kalsiyum (örn., CaCl2) ile çözünür bir karbonat tuzu (örn., sodyum karbonat) ile karıştırılmaya dayanmaktadır. Karıştırma işlemi çeşitli şekillerde gerçekleştirilebilir: gözenekli membranlarla ayrılan üç hücreli bir reaktör içinde7. Burada, dış hücrelerin her biri çözünür bir tuz içerir ve merkezi hücre, test edilecek katkı maddesi ile bir çözüm içerir. Kalsiyum ve karbonat dış orta hücreye diffuz, daha az çözünür kalsiyum karbonat yağış sonuçlanan zaman kalsiyum ve karbonat konsantrasyonları kendi çözünürlük ürün aşan, KSP = [CA2 +] [Co3 2-]. Ek bir karıştırma yöntemi çift jet prosedürü8' dir. Bu yöntemle, her çözünür tuz, kalsiyum karbonat çöktülür katkı içeren bir karıştırıcı çözüm için ayrı bir şırınga enjekte edilir. Burada, enjeksiyon ve bu nedenle karıştırma oranı iyi kontrollü, karışım difüzyon tarafından kontrol edildiği önceki yöntem aksine.
CaCO3 kristalize için kullanılan Ikinci yöntem Kitano Yöntem9' dir. Bu yöntem karbonat/hidrojen karbonat dengesine dayanmaktadır (2hco3- (aq) + CA2 +(aq) 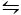 caco3 (s) + Co2 (g) + H2O (l)). Burada, CO2 , katı bir formda caco3 içeren bir çözelti içine bubbled, sol ve bu nedenle kalsiyum karbonat çözünmesi denge kayması. Çözünmemiş kalsiyum karbonat filtrelenir ve istenilen katkı maddeleri bikarbonat zengin çözüme eklenir. CO2 daha sonra buharlığa izin, böylece katkı varlığı içinde kalsiyum karbonat oluşturan, sağa reaksiyon kayması.
caco3 (s) + Co2 (g) + H2O (l)). Burada, CO2 , katı bir formda caco3 içeren bir çözelti içine bubbled, sol ve bu nedenle kalsiyum karbonat çözünmesi denge kayması. Çözünmemiş kalsiyum karbonat filtrelenir ve istenilen katkı maddeleri bikarbonat zengin çözüme eklenir. CO2 daha sonra buharlığa izin, böylece katkı varlığı içinde kalsiyum karbonat oluşturan, sağa reaksiyon kayması.
Burada açıklayacağız kalsiyum karbonat kristalizasyonu, üçüncü yöntem, buharı difüzyon yöntemi10. Bu ayarda, kalsiyum klorür çözeltisi içinde çözünen organik katkı maddesi, bir toz formunda Amonyum karbonat yakınında kapalı bir odaya yerleştirilir. Amonyum karbonat tozu karbondioksit ve amonyak haline geldiğinde, kalsiyum iyonlarının (örn. CaCl2) içeren çözeltisi içine yayılır ve kalsiyum karbonat çöktürülmüştür (bkz. Şekil 1 ). Kalsiyum karbonat kristalleri yavaş yağış veya hızlı yağış ile büyüyebilir. Yavaş yağış için, CaCl2 çözeltisi içinde katkı içeren bir çözüm Amonyum karbonat tozu yanında bir kurutucu yerleştirilir. Protokolde uzunluk olarak açıklanan hızlı yağış, hem katkı çözeltisi hem de Amonyum karbonat çok iyi bir plaka içinde birlikte daha yakın yerleştirilir. Yavaş yağış yöntemi daha az çekirdekleme merkezleri ve daha büyük kristaller üretecek ve hızlı yağış daha çekirdekleme merkezleri ve küçük kristaller neden olur.
Yukarıda açıklanan yöntemler, teknik karmaşıklığı, kontrol düzeyinde ve yağış süreci oranı farklıdır. Karıştırma yöntemi, hem çift Jet hem de üç hücreli sistem için özel bir set-up6 gerektirir. Karıştırma yönteminde, diğer çözünür sayaç iyonlarının varlığı (örn., na+, CL-)6 kaçınılmaz, Kitano yöntemi ise, kalsiyum ve (bi) karbonat çözeltinin tek iyonlarının ve ek varlığı içermez (örn., na+, CL-). Ayrıca, karıştırma yöntemi nispeten büyük hacimli gerektirir ve bu nedenle pahalı biopolymers ile çalışmak için uygun değildir. Çift jetin avantajı, çözüm enjeksiyonu oranını kontrol etmek ve diğer yöntemlere kıyasla hızlı bir süreçtir.
Kitano yöntemi ve buhar difüzyon yönteminin avantajı, kalsiyum karbonat oluşumunun, CO2 ' nin bir CAcl2 çözeltisi içine/dışına yayılması ile kontrol edilmesi, böylece daha yavaş çekirdeklenme ve yağış süreçleri için izin verilmesi 11 ' i , 12. Ayrıca, Co2 difüzyon ile kalsiyum karbonat oluşumu vivo13,14,15içinde kalsifikasyon süreçleri benzer olabilir. Bu yöntemle, iyi tanımlanmış ve ayrılmış kristaller16oluşturulur. Son olarak, tek veya birden fazla biyopolimerler kalsiyum karbonat oluşumu üzerinde etkisi test edilebilir. Bu da, bir dizi katkı konsantrasyonunun kalsiyum karbonat oluşumuna etkisinin yanı sıra biyopolimerler karışımlarının bir çalışma-tüm kontrollü bir şekilde gerçekleştirilen bir sistematik çalışma sağlar. Bu yöntem, geniş bir yelpazede konsantrasyonları ve hacimleri katkı maddeleri ile kullanılmak için uygundur. Kullanılan en az birim yaklaşık 50 μL 'dir ve bu nedenle sınırlı miktarda kullanılabilir biopolymers olduğunda bu yöntem avantajlıdır. Maksimal hacim, daha büyük bir iyi plakanın erişilebilirliğine veya CaCl2 içeren plaka veya pancarı yerleştirecek olan kurutucu bağlıdır. Aşağıda açıklanan yöntem bir 96-iyi plaka ile çalışma için optimize edilmiştir protein TapA17olarak seçilmiş bir biyopolimer ile.
Protokol
1. kalsiyum karbonat kristalizasyonu
- Kontrol hazırlığı ve optimizasyonu
- Temiz cam parçaları hazırlayın. Cam temizlemek için aynı temizleme prosedürü kullanın.
- Bir cam mikroskop slayt parçaları kesmek için bir elmas kalem kullanın, böylece bir iyi bir 96-Well plaka uygun.
Not: 5 mm x 5 mm 'lik parçalar büyük ölçüde sığmalıdır. - Su cam slaytlar kapsar ve 10 dakika için bir banyo sonicator sonikat böylece üç distile su (TDW) ile bir kabı cam parçaları yerleştirin.
- Su decant, cam slaytlar kapsayacak şekilde etanol eklemek ve 10 dakika boyunca bir banyo sonicator sonikat.
- Bir azot gazı akışı ile slaytlar ve cam kuru ve 130 W at 10 dakika için bir hava plazma temizleyici yerleştirin.
- Bir cam mikroskop slayt parçaları kesmek için bir elmas kalem kullanın, böylece bir iyi bir 96-Well plaka uygun.
- Pürüzsüz-Faceted kalsit kristalleri ile zengin bir örnek elde etmek için istenilen deneysel koşullar altında gerçekleştirilen kalsifikasyon deneylerinde kullanılan CaCl2 konsantrasyonunu optimize (olmadan veya en azından vaterite bir sayı ile kristalleri).
- Amonyum karbonat tozu ile 96-Well plaka köşelerinde kuyuları doldurun ve alüminyum folyo kullanarak plaka mühür; Parafin filmi ile folyo kapak. Azot Gazı kullanarak herhangi bir kalıntı Amonyum karbonat temizleyin.
DIKKAT: Amonyum karbonat burun ve akciğerleri tahriş eder; Sadece duman kaputu içinde kullanın. - 0,5 M CaCl2' nin stok çözümünü hazırlayın. Bu stok çözümü, çoklu kuyu plakasında CaCl2 çözeltileri konsantrasyonlarının degradasyonunu hazırlamak için kullanılacaktır.
Not: 10 mL 'Lik bir stok çözümü tüm deney için yeterlidir. - Daha önce kesilmiş ve temizlenmiş cam parçaları beş farklı kuyuya yerleştirin. Merkeze en yakın kuyuları kullan.
- Her iyi bir cam parça ile doldurun 100 bir CaCl2 çözüm16μL ile. Mix TDW ve 0,5 M CaCl2 (stok) farklı kuyular arasında CAcl2 artan konsantrasyon gradyan elde etmek. Farklı boyutta bir iyi plaka kullanılırsa, ayrı kalsit kristalleri elde etmek için CaCl2 konsantrasyonunu ayarlayın (adım 1.1.2.10 ve tartışma bölümüne bakın).
Not: Bu protokolde artan bir CaCl2 gradyan 10, 20, 30, 40, 50 mm konsantrasyonlarda ayrı kuyularda kullanılır. Konsantrasyon aralığını veya test edilen konsantrasyonların sayısını artırmak için ek kuyular kullanın. - Amonyum karbonat 3x içeren kuyuların her birinin kapağında iğne ile delinmesi.
- Kapağı geri koyun, kenarlıkları parafin filmi ile mühürleyin ve 20 saat boyunca bir kuluçte 18 °C ' de saklayın.
- Kuluçkalı sonra, bir duman başlığı içinde dikkatle kapağı açın ve bir döngü ile su/hava arayüzünde oluşan kristalleri çıkarın.
- Cam parçaları çift destile su (DDW) içeren bir kabı içine aktarmak için bir cımbız kullanın. Örnekleri kabı çıkarın ve Petri tabak alt üzerine cam parçaları düzeltmek için çift taraflı bant kullanın.
- Kuru aşırı su, doku mendilleri ile slayt kenarlarına dokunmadan. Petri tabağı kapağı ve 24 saat için bir kurutucu yerleştirin.
- Bir stereokapsam (3,5 x büyütme) ve/veya dik optik mikroskop (10X-40X büyütme) ile cam parçaları üzerinde oluşan kristalleri gözlemlemek. Kontrol çözümleri temiz ise, rombohedral kristaller (büyük olasılıkla kalsit) optik mikroskop ile gözlenir (Şekil 2A).
- Rhombohedral kristallerin yanı sıra, kontrol Küresel kristaller içerir (büyük olasılıkla vaterit, Şekil 2B), ya da tarama elektron mikroskop (SEM) görüntüleri sert yerine pürüzsüz yüzler ile rhombohedral kristalleri göstermek ( Şekil 3 A, B), temizleme adımının (1.1.1) doğru şekilde gerçekleştirildiğinden emin olmak için kristalizasyon protokolünü tekrarlayın. Ayrıca, özel kuyular dışında plaka alanlarda hiçbir Amonyum karbonat olduğunu daha iyi dikkatli olun. Aksi takdirde, sonraki adıma geçin.
- Amonyum karbonat tozu ile 96-Well plaka köşelerinde kuyuları doldurun ve alüminyum folyo kullanarak plaka mühür; Parafin filmi ile folyo kapak. Azot Gazı kullanarak herhangi bir kalıntı Amonyum karbonat temizleyin.
- Temiz cam parçaları hazırlayın. Cam temizlemek için aynı temizleme prosedürü kullanın.
- Katkı maddelerinin varlığında kristalizasyon
- Katkı maddelerinin CaCO3kristalizasyonu üzerindeki etkisini incelemek için, katkı maddeleri olmadan (farklı kuyularda), bir kontrol CAcl2 çözeltisi ve katkı maddeleri ile CAcl2 çözümleri içeren çok iyi bir plaka ayarlayın. Deneme için Bölüm 1.1.2 bulunan CaCl2 optimum konsantrasyon kullanın.
Not: aşağıdaki protokol, önceki bir çalışmada16bildirilen olarak en uygun koşulları kullanır. - 1.1.2.2 adım yineleyin.
- Adım 1.1.2.1 açıklandığı gibi plaka köşelerinde Amonyum karbonat tozu yerleştirin.
- Her iyi nerede yağış ortaya çıkar, Bölüm 1.1.1 açıklandığı gibi kesilmiş ve temizlenmiş bir cam parça yerleştirin.
- Kontrol kuyuları hazırlamak için, pipet 90 μL TDW kontrol kuyuları içine. Denetim dahil olmak üzere her iyi en az bir çoğaltır hazırlayın. Kullanılan katkı maddesi bir tampon çözümünde ise, TDW suyu yerine 90 μL tamponu pipet.
- Katkı maddesi içeren kuyuları hazırlayın. Adım 1.2.5 ' yi su içinde katkı çözeltisi 90 μL ekleyerek yineleyin. Eğer katkı tampon (TDW yerine) ise, istenilen son konsantrasyon karşılamak için tampon ile katkı konsantrasyonu önceden ayarlayın. 90 μL toplam hacmini koru; Pipet önce katkı, sonra tampon.
Not: 100 mM NaCl 'de protein TapA 10 μM son konsantrasyon, 25 mM Tris pH 8,0 tampon16 Bu protokolde kullanılır. - 50 mM CaCl2' nin son konsantrasyonuna ulaşmak için hem kontroller hem de katkı maddeleri içeren kuyular Için 10 μl 0,5 M CAcl2 stok çözeltisi (1.2.2. adımda hazırlanmıştır) ekleyin.
- 1.1.2.5-1.1.2.9 adımlarını yineleyin.
- Katkı maddelerinin CaCO3kristalizasyonu üzerindeki etkisini incelemek için, katkı maddeleri olmadan (farklı kuyularda), bir kontrol CAcl2 çözeltisi ve katkı maddeleri ile CAcl2 çözümleri içeren çok iyi bir plaka ayarlayın. Deneme için Bölüm 1.1.2 bulunan CaCl2 optimum konsantrasyon kullanın.
2. kalsiyum karbonat kristalleri karakterizasyonu
- Bir tarama elektron mikroskop ile, optik mikrokopya ile elde daha yüksek bir çözünürlükte katkılar varlığı oluşan kalsiyum karbonat kristalleri gözlemlemek (bkz. Adım 1.1.2.10).
- Çift taraflı karbon teyp ile bir alüminyum saplama kristalleri içeren cam parçaları monte edin.
- 40-50 s için au/PD tabakası ile Coat.
- 5 kV ivme voltajında görüntüleri kazanın.
Not: Şekil 3a uygun bir kontrol deneyi oluşan kalsiyum karbonat KRISTALLERI bir temsili SEM görüntü gösterir, Şekil 4 protein TapA varlığında oluşan kalsiyum karbonat kristalleri temsili görüntüleri gösterir iken .
- Oluşturulan kalsiyum karbonat polimortros belirlemek için mikro Raman spektroskopisi gerçekleştirin. Micro Raman, bir Raman spektrumunun tam bir tozdan ziyade tek kristallerden toplanması sağlar.
- İlgi kristal seçmek için mikroskop bir 20X amacı kullanın.
- 514 nm argon lazer kullanarak Raman spektrumunu 100 − 3200 cm-1 aralığında toplayın.
Not: Şekil 5 , kalsit (A) ve vaterit (B) temsili spektrumunu gösterir. Aragonit spektrum için, referans18bakın.
-
CaCO3 ' teki katkı maddelerinin kütle yüzdesini ölçmek
- Kullanılan katkın yok etme katsayısı (ε) doğrulayın/ölçün. Bir proteinin yok olma katsayısı online sunucular tarafından verilebilir19. Yok olma katsayısı bilinmiyorsa, farklı konsantrasyonlarda katkı emici emilimini ölçmek, emilme vs konsantrasyon arsa ve eğri eğiminin yok olma katsayısı hesaplayın.
- Kristallerin oluşturduğu cam parçalarını tartın, tercihen bir mikrodenge kullanın.
- 0,1 M asetik asit çözeltisi, Vortex ve numune sonikat 1,2 mL içine cam kapalı kristalleri hurda. Örneği 24 saat oda sıcaklığında saklayın.
DIKKAT: deri veya göz teması durumunda asetik asit çok tehlikelidir; dikkatli bir şekilde ele almakta ve düzenlemeleri takip ediniz. - Kristaller kazıldıktan sonra cam slayt tartmak.
- Çözeltinin UV/Vis emici (A) spektrumunu ölçün. Eğer katkı maddesi bir protein ise, 280 nm 'de emici ölçümü yapın ve Beer-Lambert denklemini kullanarak konsantrasyonu (C)hesaplayın:
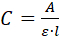
nerede l küvet içinde optik yoludur. - İçinde bulunan konsantrasyon (C) kullanın 2.3.5 ve kullanılan hacim (V = 1,2 ml) kristallerin/üzerindeki katkı maddelerinin kütlesini (m) hesaplamak için. Konsantrasyon mg/ml ise, C denklemi kullanın ● V = m.
- Konsantrasyon mol/L içinde ise, o zaman (n) C uygulama k ● V = nhesaplayın. Ardından, katkı maddelerinin kütlesini ( m) hesaplamak için moleküler ağırlığı (MW) kullanın (m = n ● MW).
- Denklem kullanarak kristallerin/üzerinde katkı maddeleri ağırlığı yüzdesini hesaplayın:
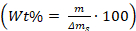 , m katkı kitlesi olduğu, ve δms cam kapalı hurdaya edildi kalsiyum karbonat kristallerin kütlesi Parça.
, m katkı kitlesi olduğu, ve δms cam kapalı hurdaya edildi kalsiyum karbonat kristallerin kütlesi Parça.
Sonuçlar
Deneysel ayarlanan bir şematik Şekil 1' de gösterilir. Kısaca, difüzyon yöntemi 96-Well plakaları kalsiyum karbonat kristalleri oluşturmak ve kalsiyum karbonat kristalleri Morfoloji ve yapısı üzerinde biyopolimerler etkisini test etmek için kullanılır. Bu deneylerde, Amonyum karbonat, kalsiyum karbonat çözümlerine yayılan, kalsiyum karbonat kristalleri oluşumuna neden olan amonyak ve CO2' ye bölünmüştür (Şekil 1 ve
Tartışmalar
Burada açıklanan yöntem, organik katkı maddelerinin varlığında kalsiyum karbonat kristalleri oluşturma ve organik biyopolymerlerin Morfoloji ve kalsiyum karbonat kristallerinin yapı üzerindeki etkisini değerlendirmek amaçlanmaktadır. Bu yöntem, kontrol deneyinde oluşan kalsit kristalleri için organik katkı maddelerinin varlığını oluşturduğu kristallerin karşılaştırılması üzerine kurulmuştur. Kalsiyum karbonat kristalleri oluşturmak için difüzyon yönteminin nasıl kullanılacağını, op...
Açıklamalar
Yazarların ifşa etmesi gereken hiçbir şey yok.
Teşekkürler
Yazarlar, Prof. Lia Addadi, Prof. Jonathan erez ve Dr. Yael Politi 'ye verimli tartışmalar için teşekkür etmek ister. Bu araştırma Israil Bilim Vakfı (ıSF), Grant 1150/14 tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
Referanslar
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır