Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Formación de carbonato de calcio en presencia de aditivos biopoliméricos
En este artículo
Resumen
Describimos un protocolo para la precipitación y caracterización de cristales de carbonato de calcio que se forman en presencia de biopolímeros.
Resumen
La biomineralización es la formación de minerales en presencia de moléculas orgánicas, a menudo relacionadas con funciones funcionales y/o estructurales en organismos vivos. Es un proceso complejo y por lo tanto se requiere un sistema simple, in vitro, para entender el efecto de las moléculas aisladas en el proceso de biomineralización. En muchos casos, la biomineralización está dirigida por biopolímeros en la matriz extracelular. Con el fin de evaluar el efecto de los biopolímeros aislados en la morfología y estructura de la calcita in vitro, hemos utilizado el método de difusión de vapor para la precipitación de carbonato de calcio, microscopía electrónica de barrido y micro Raman para la caracterización, y la absorbancia ultravioleta-visible (UV/Vis) para medir la cantidad de un biopolímero en los cristales. En este método, exponemos los biopolímeros aislados, disueltos en una solución de cloruro de calcio, a amoníaco gaseoso y dióxido de carbono que se originan a partir de la descomposición del carbonato de amonio sólido. En las condiciones donde se alcanza el producto solubilidad de carbonato de calcio, se precipita el carbonato de calcio y se forman cristales. El carbonato de calcio tiene diferentes polimorfos que difieren en su estabilidad termodinámica: carbonato de calcio amorfo, vaterita, aragonita y calcita. En ausencia de biopolímeros, en condiciones limpias, el carbonato de calcio está presente principalmente en la forma de calcita, que es el polimorfo más estable termodinámicamente del carbonato de calcio. Este método examina el efecto de los aditivos biopoliméricos en la morfología y estructura de los cristales de carbonato de calcio. Aquí, demostramos el protocolo a través del estudio de una proteína bacteriana extracelular, TapA, sobre la formación de cristales de carbonato de calcio. Específicamente, nos centramos en la configuración experimental y los métodos de caracterización, como la microscopía óptica y electrónica, así como la espectroscopia De Raman.
Introducción
La biomineralización es la formación de minerales en presencia de moléculas orgánicas, a menudo relacionadas con funciones funcionales y/o estructurales en organismos vivos. La biomineralización puede ser intracelular, como en la formaciónde magnetita dentro de las bacterias magnetotácticas 1, o extracelulares, como en la formación de carbonato de calcio en las espigas de erizo de mar2, de hidroxiapatita que está relacionada con el colágeno en huesos3 y de esmalte que se asocia con amelogenina en los dientes4. La biomineralización es un proceso complejo que depende de muchos parámetros en el organismo vivo. Por lo tanto, para simplificar el sistema en estudio, es necesario evaluar el efecto de componentes separados en el proceso. En muchos casos, la biomineralización es inducida por la presencia de biopolímeros extracelulares. El propósito del método aquí presentado es el siguiente: (1) Formar cristales de carbonato de calcio en presencia de biopolímeros aislados in vitro, utilizando un método de difusión de vapor. (2) Estudiar el efecto de los biopolímeros en la morfología y estructura del carbonato de calcio.
Se utilizan tres métodos principales para precipitar el carbonato de calcio in vitro en presencia de aditivos orgánicos5,6. El primer método, al que nos referiremos como método de solución, se basa en mezclar una sal soluble de calcio (por ejemplo, CaCl2) con una sal soluble de carbonato (por ejemplo, carbonato sódico). El proceso de mezcla se puede realizar de varias maneras: dentro de un reactor con tres células separadas por membranas porosas7. Aquí, cada una de las células externas contiene una sal soluble y la célula central contiene una solución con el aditivo que se va a probar. Calcio y carbonato difuso desde el exterior hasta la célula media, lo que resulta en la precipitación del carbonato de calcio menos soluble cuando las concentraciones de calcio y carbonato exceden su producto de solubilidad, Ksp á [Ca2+][CO3 2-]. Un método de mezcla adicionales el procedimiento de doble chorro 8. En este método, cada sal soluble se inyecta de una jeringa separada a una solución agitada que contiene el aditivo, donde se precipita el carbonato de calcio. Aquí, la inyección y por lo tanto la velocidad de mezcla está bien controlada, en contraste con el método anterior donde la mezcla se controla por difusión.
El segundo método utilizado para cristalizar CaCO3 es el método Kitano9. Este método se basa en el equilibrio de carbonato/hidrógeno (2HCO3- (aq) + Ca2+(aq) 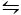 CaCO 3(s) + CO 2(g) + H2O (l)). Aquí, el CO2 se burbujea en una solución que contiene CaCO3 en una forma sólida, desplazando el equilibrio a la izquierda y por lo tanto disolviendo el carbonato de calcio. El carbonato de calcio no disuelto se filtra y los aditivos deseados se añaden a la solución rica en bicarbonato. A continuación, se permite que el CO2 se evapore, desplazando así la reacción a la derecha, formando carbonato de calcio en presencia de los aditivos.
CaCO 3(s) + CO 2(g) + H2O (l)). Aquí, el CO2 se burbujea en una solución que contiene CaCO3 en una forma sólida, desplazando el equilibrio a la izquierda y por lo tanto disolviendo el carbonato de calcio. El carbonato de calcio no disuelto se filtra y los aditivos deseados se añaden a la solución rica en bicarbonato. A continuación, se permite que el CO2 se evapore, desplazando así la reacción a la derecha, formando carbonato de calcio en presencia de los aditivos.
El tercer método de cristalización de carbonato de calcio, que describiremos aquí, es el método de difusión de vapor10. En esta configuración, el aditivo orgánico, disuelto en una solución de cloruro de calcio, se coloca en una cámara cerrada cerca del carbonato de amonio en forma de polvo. Cuando el polvo de carbonato de amonio se descompone en dióxido de carbono y amoníaco, se difunden en la solución que contiene iones de calcio (por ejemplo, CaCl2) y se precipita el carbonato de calcio (véase la figura 1 para la ilustración). Los cristales de carbonato de calcio pueden crecer por precipitación lenta o por precipitación rápida. Para la precipitación lenta, una solución que contiene el aditivo en la solución CaCl2 se coloca en un desecador junto al polvo de carbonato de amonio. En la precipitación rápida, descrita en longitud en el protocolo, tanto la solución aditiva como el carbonato de amonio se colocan más cerca en una placa de varios pocillos. El método de precipitación lenta producirá menos centros de nucleación y cristales más grandes, y la precipitación rápida resultará en más centros de nucleación y cristales más pequeños.
Los métodos descritos anteriormente difieren en su complejidad técnica, en el nivel de control y en la velocidad del proceso de precipitación. El método de mezcla requiere una configuración especial6 tanto para el doble chorro como para el sistema de tres celdas. En el método de mezcla, la presencia de otros iones de contador solubles (por ejemplo, Na+, Cl-)6 es inevitable, mientras que en el método Kitano, calcio y (bi) carbonato son los únicos iones en solución y no implica la presencia de contraiones (por ejemplo, Na+, Cl-). Además, el método de mezcla requiere volúmenes relativamente grandes y por lo tanto no es adecuado para trabajar con biopolímeros caros. La ventaja del doble chorro es que es posible controlar la velocidad de inyección de la solución y que es un proceso rápido en comparación con otros métodos.
La ventaja del método Kitano y el método de difusión de vapor es que la formación de carbonato de calcio se controla mediante la difusión de CO2 hacia/fuera de una solución CaCl2, lo que permite sondear procesos de nucleación y precipitación más lentos 11 , 12. Además, la formación de carbonato de calcio por difusión de CO2 puede parecerse a los procesos de calcificación in vivo13,14,15. En este método, se forman cristales bien definidos y separados16. Por último, se puede probar el efecto de uno o varios biopolímeros en la formación de carbonato de calcio. Esto permite un estudio sistemático del efecto de una serie de concentraciones aditivas en la formación de carbonato de calcio, así como un estudio de mezclas de biopolímeros - todos realizados de manera controlada. Este método es adecuado para su uso con una amplia gama de concentraciones y volúmenes de aditivos. El volumen mínimo utilizado es de aproximadamente 50 l y, por lo tanto, este método es ventajoso cuando hay una cantidad limitada de los biopolímeros disponibles. El volumen máximo depende de la accesibilidad de una placa de pozo más grande, o del desecador en el que se va a insertar la placa o vaso de precipitados que contiene CaCl2. El método descrito a continuación ha sido optimizado para trabajar en una placa de 96 pocillos con un biopolímero elegido para ser la proteína TapA17.
Protocolo
1. Cristalización de carbonato de calcio
- Preparación y optimización del control
- Prepare piezas de vidrio limpias. Utilice el mismo procedimiento de limpieza para limpiar la cristalería.
- Utilice una pluma de diamantes para cortar trozos de un portaobjetos de microscopio de vidrio para que quepan en un pozo de una placa de 96 pocillos.
NOTA: Las piezas de 5 mm x 5 mm deben encajar en gran medida. - Coloque las piezas de vidrio en un vaso de precipitados con agua destilada triple (TDW) para que el agua cubra los toboganes de vidrio y sonice en un sonicador de baño durante 10 minutos.
- Decantar el agua, añadir etanol para cubrir los toboganes de vidrio, y sonicar en un sonicador de baño durante 10 min.
- Seque los portaobjetos y la cristalería con una corriente de gas nitrógeno y colóquelos en un limpiador de plasma de aire durante 10 minutos a 130 W.
- Utilice una pluma de diamantes para cortar trozos de un portaobjetos de microscopio de vidrio para que quepan en un pozo de una placa de 96 pocillos.
- Optimizar la concentración del CaCl2 utilizado en los experimentos de calcificación realizados en las condiciones experimentales deseadas para lograr una muestra rica en cristales de calcita de facetas suaves (sin o al menos con un número escaso de vaterita cristales).
- Llenar los pozos en las esquinas de una placa de 96 pocillos con polvo de carbonato de amonio y sellar la placa usando papel de aluminio; cubrir la lámina con película de parafina. Limpie cualquier carbonato de amonio residual con gas nitrógeno.
ADVERTENCIA: El carbonato de amonio irrita la nariz y los pulmones; utilizar sólo dentro de la campana de humos. - Prepare una solución de stock de 0.5 M CaCl2. Esta solución de stock se utilizará para preparar un gradiente de concentraciones de soluciones CaCl2 en la placa multi-pozo.
NOTA: Una solución de stock de 10 ml es suficiente para todo el experimento. - Coloque las piezas de vidrio previamente cortadas y limpiadas en cinco pozos diferentes. Utilice los pozos más cercanos al centro.
- Llene cada pocil con una pieza de vidrio con 100 ml de una solución de CaCl2 16. Mezclar TDW y 0,5 M CaCl2 (stock) para lograr un gradiente de concentración creciente de CaCl2 a través de los diferentes pozos. Si se utiliza una placa de pozo de diferente tamaño, ajuste la concentración de CaCl2 para lograr cristales de calcita separados (paso 1.1.2.10 y consulte la sección Discusión).
NOTA: En este protocolo se utiliza un gradiente CaCl2 creciente de concentraciones de 10, 20, 30, 40,50 mM en pozos separados. Para aumentar el rango de concentración o el número de concentraciones probadas, utilice pozos adicionales. - Perforar la cubierta de cada uno de los pozos que contienen carbonato de amonio 3x con una aguja.
- Vuelva a colocar la tapa, selle los bordes con película de parafina y manténgala a 18oC en una incubadora durante 20 h.
- Después de la incubación, abra la tapa cuidadosamente dentro de una campana de humos y retire los cristales formados en la interfaz agua /aire con un lazo.
- Utilice una pinza para transferir las piezas de vidrio en un vaso de precipitados que contenga agua destilada doble (DDW). Retire las muestras del vaso de precipitados y utilice una cinta adhesiva de doble cara para fijar las piezas de vidrio en la parte inferior de la placa Petri.
- Seque el agua excesiva tocando los bordes del portaobjetos con toallitas de tejido. Cubrir el plato de petri y colocarlo en un desecador durante 24 horas.
- Observe los cristales formados en las piezas de vidrio con un estereoscopio (aumento de 3,5x) y/o un microscopio óptico vertical (aumento de 10x-40x). Si las soluciones de control están limpias, se observarán cristales rombódricos (probablemente calcita) con un microscopio óptico (Figura2A).
- Si además de los cristales rombofdrales, el control contiene cristales esféricos (probablemente vaterita, Figura 2B), o si las imágenes del microscopio electrónico de barrido (SEM) muestran cristales rombofdrales con caras ásperas en lugar de lisas ( Figura 3 A,B), repita el protocolo de cristalización asegurándose de que el paso de limpieza (1.1.1) se realiza correctamente. Además, tenga mejor cuidado de que no haya carbonato de amonio en áreas de la placa que no sean los pozos dedicados. De lo contrario, continúe con el paso siguiente.
- Llenar los pozos en las esquinas de una placa de 96 pocillos con polvo de carbonato de amonio y sellar la placa usando papel de aluminio; cubrir la lámina con película de parafina. Limpie cualquier carbonato de amonio residual con gas nitrógeno.
- Prepare piezas de vidrio limpias. Utilice el mismo procedimiento de limpieza para limpiar la cristalería.
- Cristalización en presencia de los aditivos
- Para estudiar el efecto de los aditivos enla cristalización de CaCO 3, configure una placa multi-pozo que contenga (en diferentes pozos), una solución de control CaCl2 sin los aditivos, y soluciones CaCl2 con los aditivos. Utilice la concentración óptima de CaCl2 que se encuentra en la sección 1.1.2 para el experimento.
NOTA: El siguiente protocolo utiliza condiciones óptimas como las indicadas en un estudio anterior16. - Repita el paso 1.1.2.2.
- Coloque el polvo de carbonato de amonio en las esquinas de la placa como se describe en el paso 1.1.2.1.
- En cada pozo donde se producirá nalprecipitación, coloque una pieza de vidrio que se cortó y limpió como se describe en la sección 1.1.1.
- Para preparar los pozos de control, pipeta 90 l de TDW en los pozos de control. Prepare al menos una réplica de cada pozo, incluido el control. Si el aditivo utilizado está en una solución tampón, entonces pipetea 90 l de tampón en lugar de agua TDW.
- Prepare los pozos que contienen aditivos. Repita el paso 1.2.5 añadiendo 90 s de la solución aditiva en agua. Si el aditivo está en tampón (en lugar de TDW), ajuste previamente la concentración del aditivo con tampón para cumplir con la concentración final deseada. Mantener un volumen total de 90 l; pipeta primero el aditivo, luego el tampón.
NOTA: En este protocolo se utiliza una concentración final de 10 m de la proteína TapA en 100 mM de NaCl, un buffer16 de 25 mM Tris pH 16. - Añadir 10 l de la solución en stock de 0,5 M CaCl2 (preparada en el paso 1.2.2) tanto a los controles como a los pozos que contienen aditivos para alcanzar una concentración final de 50 mM CaCl2.
- Repita los pasos 1.1.2.5-1.1.2.9.
- Para estudiar el efecto de los aditivos enla cristalización de CaCO 3, configure una placa multi-pozo que contenga (en diferentes pozos), una solución de control CaCl2 sin los aditivos, y soluciones CaCl2 con los aditivos. Utilice la concentración óptima de CaCl2 que se encuentra en la sección 1.1.2 para el experimento.
2. Caracterización de cristales de carbonato de calcio
- Con un microscopio electrónico de barrido, observe los cristales de carbonato de calcio formados en presencia de los aditivos a una resolución más alta que la obtenida mediante microcopia óptica (ver paso 1.1.2.10).
- Monte las piezas de vidrio que contienen los cristales en un talón de aluminio con cinta de carbono de doble cara.
- Escudo con una capa de Au/Pd para 40-50 s.
- Adquiera las imágenes a una tensión de aceleración de 5 kV.
NOTA: La Figura 3A muestra una imagen SEM representativa de los cristales de carbonato de calcio formados en un experimento de control adecuado, mientras que la Figura 4 muestra imágenes representativas de los cristales de carbonato de calcio formados en presencia de la proteína TapA .
- Realizar espectroscopia micro Raman para determinar los polimorfos de carbonato de calcio formados. Micro Raman permite la colección de un espectro Raman a partir de cristales individuales en lugar de un polvo entero.
- Utilice un objetivo 20x del microscopio para elegir el cristal de interés.
- Recoger el espectro Raman en un rango de 100-3200 cm-1 usando un láser de argón de 514 nm.
NOTA: La Figura 5 muestra espectros representativos de calcita (A) y vaterita (B). Para el espectro de aragonita, consulte la referencia18.
-
Cuantificación del porcentaje de masa de los aditivos en el CaCO3 precipita
- Verificar/medir el coeficiente de extinción (o) del aditivo utilizado. El coeficiente de extinción de una proteína puede ser dado por los servidores en línea19. Si se desconoce el coeficiente de extinción, mida la absorbancia del aditivo a diferentes concentraciones, trazar la absorbancia frente a la concentración y calcular el coeficiente de extinción a partir de la pendiente de la curva.
- Pesar las piezas de vidrio donde se formaron los cristales, preferiblemente utilizar un microbalance.
- Desechar los cristales del vidrio en 1,2 ml de solución de ácido acético de 0,1 M, vórtice y sonicar la muestra. Conservar la muestra a temperatura ambiente durante 24 horas.
ADVERTENCIA: El ácido acético es muy peligroso en caso de contacto con la piel o los ojos; tratar con precaución y desechar de seguir las regulaciones. - Pesar el portacristales después de raspar los cristales.
- Mida el espectro de absorción UV/vis (A) de la solución. Si el aditivo es una proteína, mida la absorbancia a 280 nm y calcule su concentración (C),utilizando la ecuación Beer-Lambert:
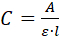
donde l es la trayectoria óptica dentro de la cubeta. - Utilice la concentración (C) que se encuentra en 2,3,5 y el volumen utilizado (V a 1,2 ml) para calcular la masa (m) de los aditivos en/ en los cristales. Si la concentración se realiza en mg/ml, utilice la ecuación C - V a m.
- Si la concentración se encuentra en mol/L, calcule los lunares (n) aplicando C á V a n. A continuación, utilice el peso molecular (Mw) para calcular la masa (m) de los aditivos (m á n - Mw).
- Calcular el porcentaje de peso de los aditivos en
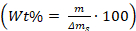 / en los cristales utilizando la ecuación: , donde m es la masa de los aditivos, y ms es la masa de los cristales de carbonato de calcio que fueron desechados del vidrio Pieza.
/ en los cristales utilizando la ecuación: , donde m es la masa de los aditivos, y ms es la masa de los cristales de carbonato de calcio que fueron desechados del vidrio Pieza.
Resultados
En la Figura 1se muestra un esquema de la configuración experimental. Brevemente, el método de difusión se utiliza para formar cristales de carbonato de calcio en placas de 96 pocillos y probar el efecto de los biopolímeros en la morfología y estructura de los cristales de carbonato de calcio. En estos experimentos, el carbonato deamonio se descompone en amoníaco y CO2, que se difunden en soluciones de carbonato de calcio, lo que resulta en la formación de cristales de carb...
Discusión
El método descrito aquí está dirigido a la formación de cristales de carbonato de calcio en presencia de aditivos orgánicos y la evaluación del efecto de los biopolímeros orgánicos en la morfología y estructura de los cristales de carbonato de calcio in vitro. El método se basa en la comparación de los cristales formados en presencia de los aditivos orgánicos con los cristales de calcita formados en el experimento de control. Hemos demostrado cómo utilizar el método de difusión para formar los cristales de...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores desean agradecer a la Prof. Lia Addadi, al Prof. Jonathan Erez y al Dr. Yael Politi por sus fructíferas discusiones. Esta investigación ha sido apoyada por la Fundación Israelí de Ciencia (ISF), subvención 1150/14.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
Referencias
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados