A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
סידן קרבונט היווצרות בנוכחות של תוספים Biopolymeric
In This Article
Summary
אנו מתארים פרוטוקול למשקעים ואפיון של גבישי סידן פחמתי היוצרים בנוכחות biopolymers.
Abstract
ביומינרליזציה היא היווצרות של מינרלים בנוכחות של מולקולות אורגניות, הקשורות לעתים קרובות עם תפקידים פונקציונליים ו/או מבניים באורגניזמים חיים. זהו תהליך מורכב ולכן פשוט, בתוך מבחנה, מערכת נדרשת כדי להבין את ההשפעה של מולקולות מבודדות על תהליך ביומינרליזציה. במקרים רבים, ביומינרליזציה מופנית על ידי biopolymers במטריצה המלווה. כדי להעריך את ההשפעה של biopolymers מבודדים על המבנה ועל מבנה הקלציט במבחנה, השתמשנו בשיטת פיזור האדים למשקעים בסידן פחמתי, סריקת מיקרוסקופ אלקטרוני ומיקרו ראמאן לאפיון, ואולטרה-סגול לעין (UV/Vis) ספיגת למדידת כמות הביופולימרים בגבישים. בשיטה זו, אנו חושפים את הbiopolymers הבודדות, המומסים בתמיסת סידן-כלוריד, לאמוניה בעלת גז ופחמן דו-חמצני שמקורם בפירוק של אמוניום פחמתי מוצק. תחת התנאים שבהם מגיעה התוצר המסיסות של סידן פחמתי, נוצרים סידן-פחמתי וגבישים. סידן פחמתי יש פולימורטים שונים הנבדלים ביציבות תרמודינמיים שלהם: סידן פחמתי אמורפיות, vaterite, ארגוניט, ו קלציט. בהעדר biopolymers, בתנאים נקיים, סידן קרבונט הוא בעיקר בצורת הקלציט, שהוא הפולימלדינמי ביותר של סידן פחמתי. שיטה זו בוחנת את השפעת התוספים הbiopolymeric על המבנה ועל מבנה גבישי הסידן פחמתי. כאן, אנו להדגים את הפרוטוקול באמצעות לימוד של חלבון בקטריאלי מתוך החילוץ, טאפה, על היווצרות של גבישי סידן פחמתי. ליתר דיוק, אנו מתמקדים בניסוי שהוגדר, ואפיון שיטות, כגון מיקרוסקופ אופטי ואלקטרוני, כמו גם ספקטרוסקופיית מסוג ראמאן.
Introduction
ביומינרליזציה היא היווצרות של מינרלים בנוכחות של מולקולות אורגניות, הקשורות לעתים קרובות עם תפקידים פונקציונליים ו/או מבניים באורגניזמים חיים. ביומינרליזציה עשויה להיות תאיים, כמו היווצרות של מגנטיט בתוך חיידקים מגנטוטקטיקה1, או מסחטות, כמו היווצרות סידן פחמתי ב קיפוד ים קוצים2, של הידרוקסיטיט הקשור קולגן ב עצמות3 ו האמייל כי הוא קשור amelogenin בשיניים4. ביומינרליזציה הוא תהליך מורכב שתלוי בפרמטרים רבים באורגניזם החי. לכן, על מנת לפשט את המערכת בלמידה, יש צורך להעריך את ההשפעה של רכיבים נפרדים בתהליך. במקרים רבים, ביומינרליזציה נגרמת על ידי נוכחות של biopolymers. מטרת השיטה המוצגת כאן היא כדלקמן: (1) כדי ליצור גבישי סידן פחמתי בנוכחות biopolymers מבודדים במבחנה, באמצעות שיטת דיפוזיה אדים. (2) ללמוד את השפעת הbiopolymers על המבנה ועל מבנה הסידן קרבונט.
שלוש שיטות עיקריות לזרז סידן פחמתי בתוך מבחנה בנוכחות תוספים אורגניים משמשים5,6. השיטה הראשונה, שנתייחס אליה כאל שיטת הפתרון, מבוססת על ערבוב מלח מסיס של סידן (כגון CaCl2) עם מלח מסיס של קרבונט (למשל, נתרן פחמתי). תהליך ערבוב יכול להתבצע במספר דרכים: בתוך הכור עם שלושה תאים המופרדים על ידי נקבובי ממברנות7. כאן, כל אחד מהתאים החיצוניים מכיל מלח מסיס והתא המרכזי מכיל פתרון עם התוסף שייבדק. סידן פחמתי לפזר מן החיצוני לתא האמצעי, וכתוצאה מכך את המשקעים של קרבונט מסיסים פחות סידן כאשר ריכוזי סידן פחמתי לחרוג מוצר מסיסות שלהם, Ksp = [Ca2 +] [שיתוף3 2-]. שיטת ערבוב נוספת היא הפרוצדורה כפולה מטוס8. בשיטה זו, כל מלח מסיסים מוזרק ממזרק נפרד לפתרון מעורבב המכיל את התוסף, שבו סידן קרבונט מזרז. כאן, ההזרקה ולכן שיעור ערבוב הוא נשלט היטב, לעומת השיטה הקודמת שבה ערבוב נשלט על ידי דיפוזיה.
השיטה השנייה המשמשת כדי להתגבש CaCO3 היא שיטה הקיטאנו9. שיטה זו מבוססת על שיווי משקל פחמתי/מימן פחמתי (2hco3- (aq) + Ca2 +(aq) 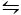 caco3 (עם) + CO2 (g) + H2O (l)). כאן, CO2 הוא בעבע לתוך פתרון המכיל caco3 בצורה מוצקה, העברת שיווי משקל שמאלה ולכן המסת סידן פחמתי. קרבונט הסידן הבלתי מומס מסונן והתוספים הרצויים נוספים לפתרון הביקרבונט-עשיר. CO2 מותר אז להתאדות, ובכך להעביר את התגובה ימינה, ויוצרים סידן פחמתי בנוכחות של התוספים.
caco3 (עם) + CO2 (g) + H2O (l)). כאן, CO2 הוא בעבע לתוך פתרון המכיל caco3 בצורה מוצקה, העברת שיווי משקל שמאלה ולכן המסת סידן פחמתי. קרבונט הסידן הבלתי מומס מסונן והתוספים הרצויים נוספים לפתרון הביקרבונט-עשיר. CO2 מותר אז להתאדות, ובכך להעביר את התגובה ימינה, ויוצרים סידן פחמתי בנוכחות של התוספים.
השיטה השלישית של התגבשות סידן פחמתי, אשר נתאר כאן, היא שיטת פיזור האדים10. בהגדרה זו, התוסף האורגני, הנמס בתמיסה של סידן כלוריד, מוצב בתא סגור ליד אמוניום פחמתי בצורת אבקה. כאשר האבקה אמוניום פחמתי מפרקת לתוך פחמן דו חמצני ו אמוניה, הם מפוזר לתוך הפתרון המכיל יוני סידן (למשל, CaCl2), סידן פחמתי הוא זירז (ראה איור 1 להמחשה). גבישי הסידן פחמתי יכולים לצמוח באמצעות משקעים איטיים או משקעים מהירים. עבור משקעים איטיים, פתרון המכיל את התוסף ב-CaCl2 פתרון ממוקם בdesiccator ליד אבקת אמוניום פחמתי. במשקעים מהירים, המתוארים באורך הפרוטוקול, הן הפתרון התוסף והן האמוניום קרבונט ממוקמים קרוב יותר בצלחת מרובת הצלחות. שיטת המשקעים האיטית תיצור פחות מרכזי התגררות וקריסטלים גדולים יותר, והמשקעים המהירים יגרמו ליותר מרכזי התגרמות וקריסטלים קטנים יותר.
השיטות המתוארות לעיל שונות במורכבות הטכנולוגית שלהם, ברמת השליטה ובקצב המשקעים. שיטת הערבוב מחייבת הערכה מיוחדת6 עבור הסילון הכפול ומערכת שלושה תאים. בשיטת הערבוב, נוכחותם של יונים מונים מסיסים אחרים (למשל, Na+, Cl-)6 היא בלתי נמנעת, ואילו בשיטת הקיטאנו, הסידן (bi) פחמתי הם היונים היחידים בתמיסה, והיא אינה כרוכה בנוכחות נוספים יונים מונים (לדוגמה, Na+, קלרנית-). יתרה מזאת, שיטת הערבוב דורשת כמויות גדולות יחסית ולכן היא אינה מתאימה לעבודה עם biopolymers יקר. היתרון של הסילון הכפול הוא שניתן לשלוט על קצב הזרקת הפתרון וכי הוא תהליך מהיר בהשוואה לשיטות אחרות.
היתרון של שיטת קיטאנו ואת שיטת דיפוזיה אדים היא כי היווצרות של סידן פחמתי נשלטת על ידי הדיפוזיה של CO2 לתוך/מתוך פתרון cacl2 , ובכך מאפשר לחקור התגררות איטי תהליכי משקעים מיכל בן 11 , 12. יתר על כן, סידן קרבונט היווצרות על ידי דיפוזיה של CO2 עשוי להידמות לתהליכי הסתיידות ב vivo13,14,15. בשיטה זו, קריסטלים מוגדרים היטב ומופרדים, נוצרים16. אחרון, ההשפעה של biopolymers יחיד או מרובים על היווצרות סידן פחמתי ניתן לבדוק. זה מאפשר מחקר שיטתי של ההשפעה של סדרה של ריכוזי התוסף על היווצרות סידן פחמתי, כמו גם מחקר של תערובות של biopolymers-all בוצע באופן מבוקר. שיטה זו מתאימה לשימוש עם מגוון רחב של ריכוזים וכמויות גדולות של תוספים. אמצעי האחסון המינימלי המשמש הוא כ 50 μL ולכן שיטה זו היא יתרון כאשר יש כמות מוגבלת של biopolymers זמין. אמצעי האחסון המקסימלי תלוי בנגישות של צלחת היטב גדולה יותר, או הdesiccator שאליה מוכנסים הלוחית או המבחנה המכילה את ה-CaCl2 . השיטה המתוארת להלן ממוטבת לעבודה בצלחת 96-באר עם ביופולימרים נבחר להיות החלבון טאפה17.
Protocol
1. התגבשות סידן פחמתי
- הכנה ואופטימיזציה של השליטה
- הכינו חתיכות זכוכית נקיות. השתמש באותו תהליך ניקוי כדי לנקות את כלי הזכוכית.
- השתמש בעט יהלום כדי לגזור פיסות של שקופית זכוכית מיקרוסקופ כך שהם מתאימים היטב של צלחת 96-באר.
הערה: 5 מ"מ x 5 מילימטר חתיכות צריך להתאים במידה רבה. - מניחים את חתיכות זכוכית בגביע עם מים מזוקקים משולשת (TDW) כך מים מכסה את שקופיות זכוכית sonicate באמבטיה sonicator עבור 10 דקות.
- Decant את המים, להוסיף אתנול לכסות את שקופיות זכוכית, ו sonicate באמבטיה sonicator עבור 10 דקות.
- יבש את השקופיות ואת כלי הזכוכית עם זרם של גז חנקן ולמקם אותם במנקה אוויר פלזמה 10 דקות ב 130 W.
- השתמש בעט יהלום כדי לגזור פיסות של שקופית זכוכית מיקרוסקופ כך שהם מתאימים היטב של צלחת 96-באר.
- מיטוב הריכוז של ה-CaCl2 המשמש בניסויי הסתיידות שבוצעו תחת התנאים הניסיוניים הרצויים כדי להשיג מדגם עשיר בגבישי קלציט חלקים (ללא או לפחות עם מספר נדיר של vaterite קריסטלים).
- ממלאים את הבארות בפינות של צלחת 96-באר עם אבקת אמוניום פחמתי לאטום את הצלחת באמצעות רדיד אלומיניום; כסות את רדיד הנייר בסרט פרפין. נקו כל שרידי אמוניום פחמתי. באמצעות גז חנקן
התראה: אמוניום פחמתי מרגיז האף והריאות; השתמש רק בתוך מכסה המנוע. - הכינו פתרון מניות של 0.5 M CaCl2. פתרון מניות זה ישמש כדי להכין הדרגתי של ריכוזים של CaCl2 פתרונות בצלחת מרובת היטב.
הערה: פתרון מניות של 10 מ"ל מספיק עבור הניסוי כולו. - מניחים את חתיכות זכוכית שנוקו בעבר לחמש בארות שונות. השתמשו בבארות הקרובות ביותר למרכז.
- מילוי כל טוב הנושאת פיסת זכוכית עם 100 μL של CaCl2 פתרון16. מערבבים TDW ו 0.5 M CaCl2 (מניות) כדי להשיג הדרגתי ריכוז הולך וגובר של cacl2 על פני בארות שונות. אם נעשה שימוש בצלחת בגודל שונה, התאימו את הריכוז של CaCl2 כדי להשיג קריסטלים של קלציט נפרדים (שלב 1.1.2.10, וראה מקטע דיונים).
הערה: הדרגה הגדלה של CaCl2 של 10, 20, 30, 40, 50 מ"מ ריכוזים בבארות נפרדות משמשת בפרוטוקול זה. כדי להגביר את טווח הריכוז או את מספר הריכוזים שנבדקו, השתמשו בבארות נוספות. - נקב את המכסה של כל הבארות המכילות אמוניום פחמתי 3x עם מחט.
- לשים בחזרה את המכסה, לאטום את הגבולות עם סרט פרפין ולשמור אותו ב 18 ° c באינקובטור במשך 20 h.
- לאחר הדגירה, לפתוח את המכסה בזהירות בתוך מכסה המנוע ולהסיר את הקריסטלים הנוצרים על ממשק המים/האוויר עם לולאה.
- השתמש בטוויזר כדי להעביר את חתיכות הזכוכית לתוך גביע המכיל מים כפולים בעלי החמצן (DDW). הסר את הדגימות מהגביע והשתמש בקלטת דו צדדית כדי לתקן את חתיכות הזכוכית על החלק התחתון של צלחת פטרי.
- מים יבשים מוגזמת נוגעים בגבולות השקופית עם מגבונים לרקמות. כסו את צלחת הפטרי והניחו אותה בdesiccator למשך 24 שעות.
- צפו בקריסטלים הנוצרים על פיסות הזכוכית באמצעות סטריאוסקופ (הגדלה של 3.5 x) ו/או מיקרוסקופ אופטי זקוף (הגדלה בגודל 10x-40x). אם פתרונות הבקרה נקיים, גבישים מעוכי מודרתיים (כנראה קלציט) יהיו מצופים במיקרוסקופ אופטי (איור 2א).
- אם בנוסף לקריסטלים מנגד, השליטה מכילה גבישים כדוריים (הסביר ביותר, איור 2ב'), או אם סריקת מיקרוסקופ אלקטרוני (SEM) מראה גבישים מעוכתיים עם פרצופים גסים ולא חלקים ( איור 3 A, B), חזור על פרוטוקול התגבשות וודא ששלב הניקוי (1.1.1) מבוצע כראוי. יתר על כן, לדאוג יותר כי אין אמוניום פחמתי באזורים על הצלחת פרט לבארות ייעודי. אחרת, המשך לשלב הבא.
- ממלאים את הבארות בפינות של צלחת 96-באר עם אבקת אמוניום פחמתי לאטום את הצלחת באמצעות רדיד אלומיניום; כסות את רדיד הנייר בסרט פרפין. נקו כל שרידי אמוניום פחמתי. באמצעות גז חנקן
- הכינו חתיכות זכוכית נקיות. השתמש באותו תהליך ניקוי כדי לנקות את כלי הזכוכית.
- התגבשות בנוכחות התוספים
- כדי ללמוד את ההשפעה של התוספים על התגבשות של CaCO3, להגדיר צלחת מרובת היטב המכילה (בבארות שונות), שליטה cacl2 פתרון ללא תוספים, ו-cacl2 פתרונות עם התוספים. השתמש בריכוז האופטימלי של CaCl2 שנמצא בסעיף 1.1.2 עבור הניסוי.
הערה: הפרוטוקול שלהלן משתמש בתנאים אופטימליים כפי שדווחו במחקר הקודם16. - חזור על שלב ה1.1.2.2.
- מניחים אבקה אמוניום פחמתי בפינות הלוחית כמתואר בשלב 1.1.2.1.
- בכל הבאר שבה יתרחש משקעים, הניחו פיסת זכוכית שנחתכה ונוקתה כמתואר בסעיף 1.1.1.
- כדי להכין בארות שליטה, פיפטה 90 μL של TDW לתוך בארות הבקרה. הכינו לפחות שכפול אחד של כל היטב כולל השליטה. אם התוסף המשמש בפתרון מאגר, אז פיפטה 90 μL של מאגר במקום המים TDW.
- הכן את הבארות המכילות את התוסף. חזור על שלב 1.2.5 על-ידי הוספת 90 μL של הפתרון התוסף במים. אם התוסף נמצא במאגר (במקום TDW), התאם מראש את ריכוז התוסף עם המאגר כדי לעמוד בהתרכזות הסופית הרצויה. שמור על נפח כולל של 90 μL; , קודם התוסף. ואז המאגר
הערה: ריכוז סופי של 10 μM של טאפה חלבון ב 100 mM הנאקל, 25 mM טריס pH 8.0 מאגר16 משמש בפרוטוקול זה. - הוסף 10 μL של 0.5 M CaCl2 מניות פתרון (מוכן בשלב 1.2.2) הן הפקדים ואת התוספים המכילים בארות כדי להגיע לריכוז הסופי של 50 MM cacl2.
- חזור על שלבים 1.1.2.5-1.1.2.9.
- כדי ללמוד את ההשפעה של התוספים על התגבשות של CaCO3, להגדיר צלחת מרובת היטב המכילה (בבארות שונות), שליטה cacl2 פתרון ללא תוספים, ו-cacl2 פתרונות עם התוספים. השתמש בריכוז האופטימלי של CaCl2 שנמצא בסעיף 1.1.2 עבור הניסוי.
2. אפיון גבישי סידן פחמתי
- עם מיקרוסקופ אלקטרוני סריקה, להתבונן בגבישים פחמתי סידן שנוצרו בנוכחות התוספים ברזולוציה גבוהה יותר מאשר מושגת על ידי מיקרוהעתק אופטי (ראה שלב 1.1.2.10).
- הר את חתיכות זכוכית המכילה את הקריסטלים על stub אלומיניום עם נייר פחמן דו צדדי.
- מעיל עם שכבה של Au/משטרת עבור 40-50 s.
- השיגו את התמונות. במתח של 5 kV
הערה: איור 3מראה תמונת SEM מייצגת של גבישי סידן פחמתי הנוצרת בניסוי שליטה נאות, בעוד שאיור 4 מראה תמונות מייצגות של גבישי סידן פחמתי שנוצרו בנוכחות החלבון טאפה .
- בצע ספקטרוסקופיית מיקרו כדי לקבוע את הסידן פחמתי פולימלי נוצר. מיקרו ראמאן מאפשר את האוסף של ספקטרום ראמאן מקריסטלים בודדים ולא מאבקה שלמה.
- השתמש במטרה 20x של המיקרוסקופ כדי לבחור את הקריסטל של הריבית.
- לאסוף את הספקטרום ראמאן בטווח של 100-3200 ס מ-1 באמצעות לייזר ארגון 514 ננומטר.
הערה: איור 5 מראה ספקטרום ייצוגי של קלציט (א) ו-vaterite (ב). עבור הספקטרום של ארגוניט, התייחס להפניה18.
-
כימות האחוז ההמוני של התוספים ב-CaCO3 מאיצים
- אמת/מדידה של מקדם המחיקה (ε) של התוסף שבשימוש. מקדם הכחדה של חלבון יכול להינתן על ידי שרתים מקוונים19. אם מקדם ההכחדה אינו ידוע, יש למדוד את ספיגת התוסף בריכוזים שונים, להתוות את ספיגת לעומת ריכוז ולחשב את מקדם ההשמדה משיפוע העקומה.
- שוקלים את חתיכות הזכוכית שבהן נוצרו הקריסטלים, רצוי להשתמש במיקרו-איזון.
- גרוטאות הגבישים את הזכוכית לתוך 1.2 mL של 0.1 M חומצה אצטית תמיסה, מערבולת וsonicate את המדגם. לאחסן את המדגם בטמפרטורת החדר עבור 24 שעות.
התראה: חומצה אצטית מסוכנת מאוד במקרה של העור או מגע העין; לטפל בזהירות ולהיפטר בהתאם לתקנות. - שוקלים את שקופית הזכוכית. לאחר גירוד הקריסטלים
- מדוד את הספקטרום האולטרא-סגול (A) של הפתרון. אם התוסף הוא חלבון, למדוד את ספיגת ב 280 ננומטר ולחשב את הריכוז שלה (ג), באמצעות משוואת בירה-למברט:
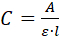
כאשר l הוא הנתיב האופטי בתוך קובט. - השתמשו בריכוז (C) שנמצאו ב2.3.5 ובאמצעי האחסון שבשימוש (V = 1.2 mL) כדי לחשב את המסה (m) של התוספים ב/על הקריסטלים. אם הריכוז הוא mg/mL, השתמש במשוואה C ● V = m.
- אם הריכוז הוא מול/L, אז לחשב את שומות (n) החלת C ● V = n. לאחר מכן השתמש במשקל המולקולרי (Mw) כדי לחשב את המסה (m) של התוספים (m = n ● Mw).
- לחשב את אחוז המשקל של התוספים ב/על הקריסטלים באמצעות
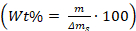 המשוואה:, כאשר m הוא מסה של התוספים, ו Δms הוא מסה של גבישי הסידן פחמתי שהיו מכוסות בזכוכית חתיכת.
המשוואה:, כאשר m הוא מסה של התוספים, ו Δms הוא מסה של גבישי הסידן פחמתי שהיו מכוסות בזכוכית חתיכת.
תוצאות
סכימטי של הערכה הניסיונית מוצג באיור 1. בקצרה, שיטת דיפוזיה משמש כדי ליצור גבישי סידן פחמתי ב 96-היטב צלחות ולבדוק את ההשפעה של biopolymers על המבנה ומבנה של גבישי סידן פחמתי. בניסויים אלה, אמוניום פחמתי מפורקת לתוך אמוניה ושות2, אשר מפוזר לתוך פתרונות סידן פחמתי, וכתוצאה מכך ...
Discussion
השיטה המתוארת כאן מיועדת ליצירת גבישי סידן פחמתי בנוכחות תוספים אורגניים והערכת ההשפעה של biopolymers אורגני על מורפולוגיה ומבנה של גבישי סידן פחמתי ב מבחנה. השיטה מבוססת על השוואת הקריסטלים הנוצרים בנוכחות התוספים האורגניים לקריסטלים הקלציט שנוצרו בניסוי השליטה. הצגנו כיצד להשתמש בשיטת הדי...
Disclosures
. למחברים אין מה לגלות
Acknowledgements
המחברים רוצים להודות לפרופ ' ליליה אדדאדי, פרופ ' יונתן ארז וד ר יעל פוליטי לדיונים פוריים. מחקר זה נתמך על ידי הקרן הישראלית למדע, הענקת 1150/14.
Materials
| Name | Company | Catalog Number | Comments |
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
References
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved