Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Formation de carbonate de calcium en présence d'additifs biopolymères
Dans cet article
Résumé
Nous décrivons un protocole pour la précipitation et la caractérisation des cristaux de carbonate de calcium qui se forment en présence de biopolymères.
Résumé
La biominéralisation est la formation de minéraux en présence de molécules organiques, souvent liées à des rôles fonctionnels et/ou structurels dans les organismes vivants. Il s'agit d'un processus complexe et, par conséquent, un système simple, in vitro, est nécessaire pour comprendre l'effet des molécules isolées sur le processus de biominéralisation. Dans de nombreux cas, la biominéralisation est dirigée par des biopolymères dans la matrice extracellulaire. Afin d'évaluer l'effet des biopolymères isolés sur la morphologie et la structure de la calcite in vitro, nous avons utilisé la méthode de diffusion de vapeur pour la précipitation du carbonate de calcium, la microscopie électronique à balayage et le micro Raman pour la caractérisation, et l'absorption ultraviolet-visible (UV/Vis) pour mesurer la quantité d'un biopolymère dans les cristaux. Dans cette méthode, nous exposons les biopolymères isolés, dissous dans une solution de chlorure de calcium, à l'ammoniac gazeux et au dioxyde de carbone qui proviennent de la décomposition du carbonate d'ammonium solide. Dans les conditions où le produit de solubilité du carbonate de calcium est atteint, le carbonate de calcium se précipite et des cristaux sont formés. Le carbonate de calcium a différents polymorphes qui diffèrent dans leur stabilité thermodynamique : carbonate de calcium amorphe, vaterite, aragonite et calcite. En l'absence de biopolymères, dans des conditions propres, le carbonate de calcium est principalement présent sous forme de calcite, qui est le polymorphe thermodynamiquement stable de carbonate de calcium. Cette méthode examine l'effet des additifs biopolymères sur la morphologie et la structure des cristaux de carbonate de calcium. Ici, nous démontrons le protocole par l'étude d'une protéine bactérienne extracellulaire, TapA, sur la formation de cristaux de carbonate de calcium. Plus précisément, nous nous concentrons sur la mise en place expérimentale, et les méthodes de caractérisation, telles que la microscopie optique et électronique ainsi que la spectroscopie Raman.
Introduction
La biominéralisation est la formation de minéraux en présence de molécules organiques, souvent liées à des rôles fonctionnels et/ou structurels dans les organismes vivants. La biominéralisation peut être intracellulaire, comme dans la formation de magnétite à l'intérieur des bactéries magnétotaxiques1, ou extracellulaires, comme dans la formation de carbonate de calcium dans les pointes d'oursins2, d'hydroxyapatite qui est liée au collagène dans os3 et de l'émail qui est associé à l'amélogénine dans les dents4. La biominéralisation est un processus complexe qui dépend de nombreux paramètres dans l'organisme vivant. Par conséquent, afin de simplifier le système à l'étude, il est nécessaire d'évaluer l'effet des composants distincts sur le processus. Dans de nombreux cas, la biominéralisation est induite par la présence de biopolymères extracellulaires. Le but de la méthode présentée ici est le suivant: (1) Pour former des cristaux de carbonate de calcium en présence de biopolymères isolés in vitro, en utilisant une méthode de diffusion de vapeur. (2) Étudier l'effet des biopolymères sur la morphologie et la structure du carbonate de calcium.
Trois méthodes principales pour précipiter le carbonate de calcium in vitro en présence d'additifs organiques sont utilisées5,6. La première méthode, que nous appellerons la méthode de solution, est basée sur le mélange d'un sel soluble de calcium (par exemple, CaCl2) avec un sel soluble de carbonate (par exemple, carbonate de sodium). Le processus de mélange peut être effectué de plusieurs façons: à l'intérieur d'un réacteur avec trois cellules qui sont séparées par des membranes poreuses7. Ici, chacune des cellules extérieures contient un sel soluble et la cellule centrale contient une solution avec l'additif à tester. Calcium et carbonate diffusent de l'extérieur à la cellule moyenne, ce qui entraîne la précipitation du carbonate de calcium moins soluble lorsque les concentrations de calcium et de carbonate dépassent leur produit de solubilité, Ksp -[Ca2'][CO 3) 2-]. Une méthode de mélange supplémentaire est la procédure de double-jet8. Dans cette méthode, chaque sel soluble est injecté à partir d'une seringue séparée à une solution agitée contenant l'additif, où le carbonate de calcium se précipite. Ici, l'injection et donc le taux de mixage est bien contrôlé, contrairement à la méthode précédente où le mélange est contrôlé par diffusion.
La deuxième méthode utilisée pour cristalliser CaCO3 est la méthode Kitano9. Cette méthode est basée sur l'équilibre carbonate/hydrogène carbonate (2HCO3- (aq) ' Ca 2' (aq) 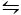 CaCO 3(s) ' CO 2(g) ' H2O (l)). Ici, le CO2 est regroupé dans une solution contenant CaCO3 sous une forme solide, déplaçant l'équilibre vers la gauche et dissolvant ainsi le carbonate de calcium. Le carbonate de calcium non dissous est filtré et les additifs désirés sont ajoutés à la solution riche en bicarbonate. Le CO2 est ensuite autorisé à s'évaporer, déplaçant ainsi la réaction vers la droite, formant du carbonate de calcium en présence des additifs.
CaCO 3(s) ' CO 2(g) ' H2O (l)). Ici, le CO2 est regroupé dans une solution contenant CaCO3 sous une forme solide, déplaçant l'équilibre vers la gauche et dissolvant ainsi le carbonate de calcium. Le carbonate de calcium non dissous est filtré et les additifs désirés sont ajoutés à la solution riche en bicarbonate. Le CO2 est ensuite autorisé à s'évaporer, déplaçant ainsi la réaction vers la droite, formant du carbonate de calcium en présence des additifs.
La troisième méthode de cristallisation du carbonate de calcium, que nous décrirarons ici, est la méthode de diffusion de vapeur10. Dans cette configuration, l'additif organique, dissous dans une solution de chlorure de calcium, est placé dans une chambre fermée près du carbonate d'ammonium sous forme de poudre. Lorsque la poudre de carbonate d'ammonium se décompose en dioxyde de carbone et en ammoniac, elle se diffuse dans la solution contenant des ions de calcium (p. ex. CaCl2), et le carbonate de calcium est précipité (voir la figure 1 pour illustrer). Les cristaux de carbonate de calcium peuvent se développer par des précipitations lentes ou par des précipitations rapides. Pour les précipitations lentes, une solution contenant l'additif dans la solution CaCl2 est placée dans un dessiccateur à côté de la poudre de carbonate d'ammonium. Dans les précipitations rapides, décrites en longueur dans le protocole, la solution additive et le carbonate d'ammonium sont rapprochés dans une plaque multi-puits. La méthode des précipitations lentes produira moins de centres de nucléation et de cristaux plus gros, et les précipitations rapides se traduiront par plus de centres de nucléation et de cristaux plus petits.
Les méthodes décrites ci-dessus diffèrent dans leur complexité technique, dans le niveau de contrôle et dans le taux du processus de précipitation. La méthode de mélange nécessite une configuration spéciale6 pour le double jet et le système à trois cellules. Dans la méthode de mélange, la présence d'autres contre-ions solubles (p. ex., Na,Cl-) 6 est inévitable, alors que dans la méthode Kitano, le calcium et le carbonate (bi) sont les seuls ions en solution et il n'implique pas la présence de contre ions (p. ex., Na,Cl-). En outre, la méthode de mélange nécessite des volumes relativement importants et, par conséquent, il n'est pas approprié pour travailler avec des biopolymères coûteux. L'avantage du double jet est qu'il est possible de contrôler le taux d'injection de solution et qu'il s'agit d'un processus rapide par rapport à d'autres méthodes.
L'avantage de la méthode Kitano et de la méthode de diffusion de vapeur est que la formation de carbonate de calcium est contrôlée par la diffusion du CO2 dans/hors d'une solution CaCl2, permettant ainsi de sonder des processus de nucléation et de précipitation plus lents 11 Ans, états-unis ( , 12. En outre, la formation de carbonate de calcium par diffusion du CO2 peut ressembler à des processus de calcification in vivo13,14,15. Dans cette méthode, des cristaux bien définis et séparés sont formés16. Enfin, l'effet d'un ou plusieurs biopolymères sur la formation de carbonate de calcium peut être testé. Cela permet une étude systématique de l'effet d'une série de concentrations additives sur la formation de carbonate de calcium ainsi qu'une étude des mélanges de biopolymères - tous effectués de manière contrôlée. Cette méthode est adaptée à une utilisation avec une large gamme de concentrations et de volumes d'additifs. Le volume minimal utilisé est d'environ 50 l et donc cette méthode est avantageuse lorsqu'il y a une quantité limitée de biopolymères disponibles. Le volume maximal dépend de l'accessibilité d'une plus grande plaque de puits, ou du dessiccateur dans lequel la plaque ou le bécher contenant CaCl2 doivent être insérés. La méthode décrite ci-dessous a été optimisée pour travailler dans une plaque de 96 puits avec un biopolymère choisi pour être la protéine TapA17.
Protocole
1. Cristallisation de carbonate de calcium
- Préparation et optimisation du contrôle
- Préparer des morceaux de verre propres. Utilisez la même procédure de nettoyage pour nettoyer la verrerie.
- Utilisez un stylo diamant pour couper des morceaux d'une lame de microscope en verre afin qu'ils s'adaptent dans un puits d'une plaque de 96 puits.
REMARQUE : Les pièces de 5 mm x 5 mm doivent s'adapter en grande partie. - Placez les morceaux de verre dans un bécher avec de l'eau distillée triple (TDW) de sorte que l'eau couvre les lames de verre et sonicate dans un sonicator de bain pendant 10 min.
- Décant l'eau, ajouter de l'éthanol pour couvrir les lames de verre, et sonicate dans un sonicator de bain pendant 10 min.
- Séchez les toboggans et la verrerie avec un jet de gaz azoté et placez-les dans un nettoyant à plasma d'air pendant 10 min à 130 W.
- Utilisez un stylo diamant pour couper des morceaux d'une lame de microscope en verre afin qu'ils s'adaptent dans un puits d'une plaque de 96 puits.
- Optimiser la concentration du CaCl2 utilisé dans les expériences de calcification effectuées dans les conditions expérimentales souhaitées pour obtenir un échantillon riche en cristaux de calcite à facettes lisses (sans ou du moins avec un nombre limité de vaterite cristaux).
- Remplir les puits aux coins d'une plaque de 96 puits avec de la poudre de carbonate d'ammonium et sceller la plaque à l'aide de papier d'aluminium; couvrir le papier d'aluminium avec du film de paraffine. Nettoyer tout carbonate résiduel d'ammonium à l'aide de gaz azoté.
CAUTION : Le carbonate d'ammonium irrite le nez et les poumons ; utiliser uniquement à l'intérieur du capot de fumée. - Préparer une solution d'actions de 0,5 M CaCl2. Cette solution de stock sera utilisée pour préparer un gradient de concentrations de solutions CaCl2 dans la plaque multi-puits.
REMARQUE : Une solution de stock de 10 ml est suffisante pour toute l'expérience. - Placez les morceaux de verre préalablement coupés et nettoyés dans cinq puits différents. Utilisez les puits les plus proches du centre.
- Remplir chaque puits portant un morceau de verre avec 100 l d'une solution CaCl2 16. Mélanger TDW et 0,5 M CaCl2 (stock) pour atteindre un gradient de concentration croissant de CaCl2 à travers les différents puits. Si une plaque de puits de taille différente est utilisée, ajuster la concentration de CaCl2 pour obtenir des cristaux de calcite séparés (étape 1.1.2.10, et voir la section Discussion).
REMARQUE : Un gradient caCl2 croissant de 10, 20, 30, 40 ,50 mM de concentrations dans des puits séparés est utilisé dans ce protocole. Pour augmenter la plage de concentration ou le nombre de concentrations testées, utilisez d'autres puits. - Perforer le couvercle de chacun des puits contenant du carbonate d'ammonium 3x avec une aiguille.
- Remettre le couvercle, sceller les bordures avec du film de paraffine et le garder à 18 oC dans un incubateur pendant 20 h.
- Après l'incubation, ouvrez soigneusement le couvercle à l'intérieur d'une hotte de fumée et retirez les cristaux formés à l'interface eau/air avec une boucle.
- Utilisez une pince à épiler pour transférer les morceaux de verre dans un bécher contenant de l'eau double distillée (DDW). Retirer les échantillons du bécher et utiliser un ruban à double face pour fixer les morceaux de verre sur le fond du plat Petri.
- Sécher l'eau excessive touchant les bordures de la glissière avec des lingettes de tissu. Couvrir le plat de pétri et le placer dans un dessiccateur pendant 24 h.
- Observez les cristaux formés sur les morceaux de verre avec un stéréoscope (grossissement de 3,5x) et/ou un microscope optique droit (grossissement 10x-40x). Si les solutions de contrôle sont propres, des cristaux rhombohédraux (probablement de la calcite) seront observés au microscope optique (Figure 2A).
- Si en plus des cristaux rhombohédraux, le contrôle contient des cristaux sphériques (probablement vaterite, Figure 2B), ou si les images du microscope électronique à balayage (SEM) montrent des cristaux rhombohédraux avec des visages rugueux plutôt que lisses ( Figure 3 A,B), répéter le protocole de cristallisation en s'assurant que l'étape de nettoyage (1.1.1) est effectuée correctement. En outre, faites mieux attention qu'il n'y a pas de carbonate d'ammonium dans les zones de la plaque autres que les puits dédiés. Sinon, passez à l'étape suivante.
- Remplir les puits aux coins d'une plaque de 96 puits avec de la poudre de carbonate d'ammonium et sceller la plaque à l'aide de papier d'aluminium; couvrir le papier d'aluminium avec du film de paraffine. Nettoyer tout carbonate résiduel d'ammonium à l'aide de gaz azoté.
- Préparer des morceaux de verre propres. Utilisez la même procédure de nettoyage pour nettoyer la verrerie.
- Cristallisation en présence des additifs
- Pour étudier l'effet des additifs sur la cristallisation de CaCO3, mettre en place une plaque multi-puits qui contient (dans différents puits), une solution de contrôle CaCl2 sans les additifs, et CaCl2 solutions avec les additifs. Utilisez la concentration optimale de CaCl2 trouvée dans la section 1.1.2 pour l'expérience.
REMARQUE : Le protocole ci-dessous utilise des conditions optimales comme celles rapportées dans une étude précédente16. - Répéter l'étape 1.1.2.2.
- Placer la poudre de carbonate d'ammonium dans les coins de la plaque tel que décrit à l'étape 1.1.2.1.
- Dans chaque puits où les précipitations se produiront, placez un morceau de verre qui a été coupé et nettoyé tel que décrit à la section 1.1.1.
- Pour préparer les puits de contrôle, pipette 90 'L de TDW dans les puits de commande. Préparer au moins une réplique de chaque puits, y compris le contrôle. Si l'additif utilisé se trouve dans une solution tampon, puis pipette 90 l de tampon au lieu de l'eau TDW.
- Préparer les puits contenant des additifs. Répétez l'étape 1.2.5 en ajoutant 90 L de la solution additive dans l'eau. Si l'additif est en mémoire tampon (au lieu de TDW), préajuster la concentration de l'additif avec un tampon pour répondre à la concentration finale désirée. Conserver un volume total de 90 l; pipette d'abord l'additif, puis le tampon.
REMARQUE : Une concentration finale de 10 M de la protéine TapA dans 100 mM NaCl, 25 mM Tris pH 8.0 tampon16 est utilisée dans ce protocole. - Ajouter 10 L de la solution de stock de 0,5 M CaCl2 (préparée à l'étape 1.2.2) aux puits de commande et contenant des additifs pour atteindre une concentration finale de 50 mM CaCl2.
- Répétez les étapes 1.1.2.5-1.1.2.9.
- Pour étudier l'effet des additifs sur la cristallisation de CaCO3, mettre en place une plaque multi-puits qui contient (dans différents puits), une solution de contrôle CaCl2 sans les additifs, et CaCl2 solutions avec les additifs. Utilisez la concentration optimale de CaCl2 trouvée dans la section 1.1.2 pour l'expérience.
2. Caractérisation des cristaux de carbonate de calcium
- À l'aucun-chef, observez les cristaux de carbonate de calcium formés en présence des additifs à une résolution plus élevée que celle obtenue par microcopie optique (voir l'étape 1.1.2.10).
- Montez les morceaux de verre contenant les cristaux sur un talon d'aluminium avec du ruban de carbone recto-verso.
- Enrober d'une couche d'Au/Pd pour 40-50 s.
- Acquérir les images à 5 kV tension d'accélération.
REMARQUE : La figure 3A montre une image SEM représentative des cristaux de carbonate de calcium formés dans une expérience de contrôle appropriée, tandis que la figure 4 montre des images représentatives de cristaux de carbonate de calcium formés en présence de la protéine TapA .
- Effectuez une spectroscopie micro-Raman pour déterminer les polymorphes de carbonate de calcium formés. Micro Raman permet la collecte d'un spectre Raman à partir de cristaux simples plutôt que d'une poudre entière.
- Utilisez un objectif 20x du microscope pour choisir le cristal d'intérêt.
- Recueillir le spectre Raman dans une gamme de 100 à 3200 cm-1 à l'aide d'un laser argon de 514 nm.
REMARQUE : La figure 5 montre des spectres représentatifs de calcite (A) et de vaterite (B). Pour le spectre de l'aragonite, se référer à la référence18.
-
Quantification du pourcentage de masse des additifs dans le CaCO3 précipite
- Vérifier/mesurer le coefficient d'extinction de l'additif utilisé. Le coefficient d'extinction d'une protéine peut être donné par les serveurs en ligne19. Si le coefficient d'extinction est inconnu, mesurez l'absorption de l'additif à différentes concentrations, tracez l'absorption par rapport à la concentration et calculez le coefficient d'extinction à partir de la pente de la courbe.
- Peser les morceaux de verre où les cristaux se sont formés, de préférence utiliser un microéquilibre.
- Mettre les cristaux hors du verre dans 1,2 ml de 0,1 M de solution d'acide acétique de 0,1 M, vortex et sonicate l'échantillon. Conserver l'échantillon à température ambiante pendant 24 h.
CAUTION: L'acide acétique est très dangereux en cas de contact avec la peau ou les yeux; gérer avec prudence et disposer en suivant les règlements. - Peser la glissière de verre après avoir gratté les cristaux.
- Mesurer le spectre UV/vis absorbance (A) de la solution. Si l'additif est une protéine, mesurez l'absorption à 280 nm et calculez sa concentration (C), en utilisant l'équation Beer-Lambert :
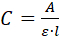
où l est le chemin optique à l'intérieur de la cuvette. - Utilisez la concentration (C) trouvée dans 2.3.5 et le volume utilisé(V à 1,2 ml) pour calculer la masse (m) des additifs dans/sur les cristaux. Si la concentration est en mg/mL, utilisez l'équation C et V m .
- Si la concentration est en mol/L, puis calculer les grains de beauté (n) en appliquant C ' V ' n. Ensuite, utilisez le poids moléculaire (Mw) pour calculer la masse (m) des additifs (m ' n ' Mw).
- Calculer le pourcentage de poids des additifs dans
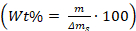 / sur les cristaux en utilisant l'équation: , où m est la masse des additifs, et ms est la masse des cristaux de carbonate de calcium qui ont été mis au rebut hors du verre morceau.
/ sur les cristaux en utilisant l'équation: , où m est la masse des additifs, et ms est la masse des cristaux de carbonate de calcium qui ont été mis au rebut hors du verre morceau.
Résultats
Un schéma de la mise en place expérimentale est montré dans la figure 1. En bref, la méthode de diffusion est utilisée afin de former des cristaux de carbonate de calcium dans des plaques de 96 puits et de tester l'effet des biopolymères sur la morphologie et la structure des cristaux de carbonate de calcium. Dans ces expériences, le carbonate d'ammonium est décomposé en ammoniac et co2, qui se diffusent en solutions de carbonate de calcium, ce qui entraîne la formation ...
Discussion
La méthode décrite ici vise à former des cristaux de carbonate de calcium en présence d'additifs organiques et à évaluer l'effet des biopolymères organiques sur la morphologie et la structure des cristaux de carbonate de calcium in vitro. La méthode est basée sur la comparaison des cristaux formés en présence des additifs organiques aux cristaux de calcite formés dans l'expérience de contrôle. Nous avons montré comment utiliser la méthode de diffusion pour former les cristaux de carbonate de calcium, comm...
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Les auteurs tient à remercier le professeur Lia Addadi, le professeur Jonathan Erez et le Dr Yael Politi pour leurs discussions fructueuses. Cette recherche a été soutenue par la Fondation israélienne pour la science (ISF), subvention 1150/14.
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
Références
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon