このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
生体高分子添加剤の存在下における炭酸カルシウム形成
要約
生体高分子の存在下で形成される炭酸カルシウム結晶の沈殿および特性形成のためのプロトコルについて述べた。
要約
バイオミネラリゼーションは、有機分子の存在下での鉱物の形成であり、多くの場合、生物の機能的および/または構造的役割に関連する。これは複雑なプロセスであり、したがって、単純なインビトロ、システムは、バイオミネラリゼーションプロセスに対する単離分子の影響を理解するために必要とされます。多くの場合、バイオミネラリゼーションは細胞外マトリックス中の生体高分子によって導けられる。単離された生体高分子がインビトロでのカルサイトの形態および構造に及ぼす影響を評価するために、炭酸カルシウムの沈殿、電子顕微鏡検査、マイクロラマンの沈殿に対する蒸気拡散法を用いて特性評価を行い、結晶中の生体高分子の量を測定するための紫外線可視(UV/Vis)吸光度。この方法では、単離された生体高分子を塩化カルシウム溶液に溶解し、固体炭酸アンモニウムの分解に起因する気体アンモニアおよび二酸化炭素に暴露する。炭酸カルシウムの溶解性積に達した条件下で、炭酸カルシウム沈殿物や結晶が形成されます。炭酸カルシウムは、熱力学的安定性が異なる異なる多形を有する:非晶質炭酸カルシウム、バセライト、アラゴネート、およびカルサイト。バイオポリマーが存在しない場合、クリーンな条件下では、炭酸カルシウムは、炭酸カルシウムの最も熱力学的に安定した多形であるカルサイト形態に主に存在する。この方法は、炭酸カルシウム結晶の形態および構造に対する生体高分子添加剤の影響を調べる。ここでは、細胞外細菌タンパク質TapAの研究を通じて、炭酸カルシウム結晶の形成に関するプロトコルを実証する。具体的には、実験設定と、光学顕微鏡や電子顕微鏡、ラマン分光法などの特性解析方法に焦点を当てています。
概要
バイオミネラリゼーションは、有機分子の存在下での鉱物の形成であり、多くの場合、生物の機能的および/または構造的役割に関連する。バイオミネラリゼーションは、磁気細菌1内のマグネタイトの形成のように細胞内であってもよいが、細胞外、ウニスパイク2における炭酸カルシウムの形成のように、コラーゲンに関連するヒドロキシアパタイトの骨3と歯4のアメロゲニンに関連するエナメル質の.バイオミネラリゼーションは、生物の多くのパラメータに依存する複雑なプロセスです。したがって、検討中のシステムを簡素化するためには、工程に対する別個の成分の影響を評価する必要がある。多くの場合、バイオミネラリゼーションは細胞外生体高分子の存在によって誘導される。ここで提示される方法の目的は、(1)インビトロで単離された生体高分子の存在下で炭酸カルシウム結晶を形成し、蒸気拡散法を用いる。(2)生体高分子が炭酸カルシウムの形態及び構造に及ぼす影響を研究する。
有機添加物の存在下でインビトロで炭酸カルシウムを沈殿させる3つの主要な方法が5,6を使用する。我々が溶液法として言及する最初の方法は、カルシウムの可溶性塩(例えば、CaCl2)と炭酸の可溶性塩(例えば、炭酸ナトリウム)を混合することに基づいている。混合プロセスは、いくつかの方法で行われてもよい:多孔質膜7によって分離された3つの細胞を有する反応器内。ここで、各外部細胞は可溶性塩を含み、中央細胞は試験対象の添加剤を含む溶液を含有する。カルシウムと炭酸塩が外側から中間細胞に拡散し、カルシウムと炭酸塩の濃度が溶解性を超えると可溶性の低い炭酸カルシウムの沈殿が生じ、K sp= [Ca 2+][CO3]2-]。追加の混合方法は、二重ジェット手順8である。この方法では、各可溶性塩を別々の注射器から添加剤を含む攪拌溶液に注入し、そこで炭酸カルシウムが沈殿する。ここで、注射およびしたがって混合速度は、混合が拡散によって制御される前の方法とは対照的に、よく制御される。
CaCO3を結晶化するために使用される第2の方法は、キタノ法9である。 この方法は、炭酸塩/水素炭酸塩平衡(2HCO3- (aq)+Ca2+(aq)CaCO 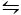 3(s)+CO2(g)+H2O(l))に基づいている。 ここで、CO2を固体形態でCaCO3を含む溶液に泡立て、平衡を左にシフトさせ、炭酸カルシウムを溶解させる。未溶解炭酸カルシウムを濾過し、所望の添加剤を重炭酸塩豊富な溶液に添加します。CO2は次いで蒸発させ、それによって反応を右にシフトさせ、添加剤の存在下で炭酸カルシウムを形成する。
3(s)+CO2(g)+H2O(l))に基づいている。 ここで、CO2を固体形態でCaCO3を含む溶液に泡立て、平衡を左にシフトさせ、炭酸カルシウムを溶解させる。未溶解炭酸カルシウムを濾過し、所望の添加剤を重炭酸塩豊富な溶液に添加します。CO2は次いで蒸発させ、それによって反応を右にシフトさせ、添加剤の存在下で炭酸カルシウムを形成する。
ここで説明する炭酸カルシウム結晶化の第3の方法は、蒸気拡散法10である。このセットアップでは、有機添加剤は、塩化カルシウムの溶液に溶解し、粉末状の炭酸アンモニウム近くの密閉室に配置される。炭酸アンモニウム粉末が二酸化炭素とアンモニアに分解すると、カルシウムイオンを含む溶液に拡散し(例えば、CaCl2)、炭酸カルシウムが析出します(図1参照)。 炭酸カルシウム結晶は、低速沈殿または速い沈殿によって成長することができます。低速沈殿のために、CaCl2溶液中の添加剤を含む溶液を炭酸アンモニウム粉末の隣のデシケータに入れます。プロトコルで長さに記載されている速い沈殿において、添加液と炭酸アンモニウムの両方がマルチウェルプレートに近づけられます。低速の降水法は、より少ない核生成中心とより大きな結晶を生成し、速い沈殿は、より多くの核生成中心と小さな結晶をもたらすでしょう。
上記の方法は、その技術的な複雑さ、制御レベル、および降水プロセスの速度で異なります。混合方法は、ダブルジェットと3セルシステムの両方に特別なセットアップ6を必要とします。混合方法では、他の可溶性カウンターイオン(例えば、Na +、Cl-)6の存在は避けられませんが、キタノ法では、カルシウムおよび(bi)炭酸塩は溶液中の唯一のイオンであり、追加の存在を伴いません。カウンターイオン(例えば、Na+、Cl-)。さらに、混合方法は比較的大量を必要とするため、高価なバイオポリマーの作業には適していません。ダブルジェットの利点は、溶液注入速度を制御することができ、他の方法と比較して迅速なプロセスであることです。
キタノ法と蒸気拡散法の利点は、炭酸カルシウムの形成がCaCl2溶液の中へのCO2の拡散によって制御されるため、より遅い核生成および沈殿プロセスをプローブできることです。11歳,12.さらに、CO2の拡散による炭酸カルシウム形成は、生体内13、14、15における石灰化プロセスに類似してもよい。この方法では、明確に定義された分離された結晶が16に形成される。最後に、炭酸カルシウム形成に対する単一または複数の生体高分子の効果を試験することができる。これにより、炭酸カルシウム形成に対する一連の添加剤濃度の効果の系統的研究と、バイオポリマーの混合物の研究が可能になります。この方法は、添加剤の濃度と量の広い範囲での使用に適しています。使用される最小容積はおよそ50 μLであるため、この方法は利用可能な生体高分子の限られた量がある場合に有利である。最大容積は、より大きなウェルプレートのアクセシビリティ、またはCaCl2を含むプレートまたはビーカーを挿入するデシケータに依存します。以下に説明する方法は、タンパク質TapA17として選択された生体高分子を有する96ウェルプレートで働くために最適化されている。
プロトコル
1. 炭酸カルシウム結晶化
- 制御の準備と最適化
- きれいなガラス片を準備します。同じクリーニング手順を使用して、ガラス製品をクリーニングします。
- ダイヤモンドペンを使用して、ガラス顕微鏡スライドの断片を96ウェルプレートの井戸に収まるようにします。
注:5ミリメートルx 5ミリメートルの部分は、主にフィットする必要があります。 - ガラス片をトリプル蒸留水(TDW)でビーカーに入れ、水がガラススライドを覆い、バスソニネーターで10分間超音波処理を行います。
- 水をデカントし、ガラススライドをカバーするためにエタノールを追加し、10分間バスソニケーターで超音波処理します。
- スライドとガラス製品を窒素ガスの流れで乾燥させ、130Wで10分間エアプラズマクリーナーに入れます。
- ダイヤモンドペンを使用して、ガラス顕微鏡スライドの断片を96ウェルプレートの井戸に収まるようにします。
- 目的の実験条件下で行われる石灰化実験で使用されるCaCl2の濃度を最適化し、滑らかな面の石灰質結晶を豊富に含むサンプルを達成する(少なくともバテライトの数が少ない場合)。結晶)。
- 炭酸アンモニウム粉末で96ウェルプレートのコーナーで井戸を埋め、アルミ箔を使用してプレートをシールします。パラフィンフィルムでホイルを覆う。窒素ガスを使用して、残留炭酸アンモニウムをきれいにします。
注意: 炭酸アンモニウムは、鼻や肺を刺激します;ヒュームフードの内側にのみ使用してください。 - 0.5 M CaCl2のストック ソリューションを準備します。このストック溶液は、マルチウェルプレート内のCaCl2溶液の濃度の勾配を調製するために使用されます。
注:10 mLのストックソリューションは、実験全体に十分です。 - 以前に切断し、洗浄したガラス片を5つの異なる井戸に置きます。中央に最も近い井戸を使用します。
- CaCl2溶液16の100 μLでガラス片を持つ各ウェルを充填します。TDWと0.5M CaCl 2(ストック)を混合して、異なるウェル間でCaCl2の濃度勾配を増加させます。異なるサイズのウェルプレートを使用する場合は、CaCl2の濃度を調整して別々のカルサイト結晶を達成します(ステップ1.1.2.10、および「ディスカッション」セクションを参照)。
注:このプロトコルでは、別々のウェル内の10、20、30、40、50 mM濃度の増加するCaCl2勾配が使用されます。濃度範囲または試験した濃度の数を増やすには、追加のウェルを使用します。 - 炭酸アンモニウム3xを含む各井戸のカバーを針で穿刺する。
- 蓋を戻し、パラフィンフィルムで境界線を密封し、20時間インキュベーターで18°Cに保ちます。
- インキュベーションの後、フュームフードの内側に慎重に蓋を開け、ループで水/空気界面で形成された結晶を取り除きます。
- 二重蒸留水(DDW)を含むビーカーにガラス片を転送するには、ツイザーを使用します。ビーカーからサンプルを取り出し、両面テープを使用してガラス片をペトリ皿の底に固定します。
- スライドの境界に触れる余分な水をティッシュワイプで乾かします。ペトリ皿を覆い、24時間デシケーターに入れます。
- ステレオスコープ(3.5倍倍)や直立光学顕微鏡(10x-40倍倍)でガラス片に形成された結晶を観察します。対照液がクリーンである場合、菱形結晶(最も可能性の高い石灰質)は光学顕微鏡で観察される(図2A)。
- 菱形結晶に加えて、コントロールに球状結晶(最も可能性の高いバテライト、図2B)が含まれている場合、または走査型電子顕微鏡(SEM)画像が滑らかな顔ではなく粗い菱形結晶を示す場合(図 3A,B,結晶化プロトコルを繰り返し、洗浄ステップ(1.1.1)が正しく実行されていることを確認します。さらに、専用の井戸以外のプレート上の領域に炭酸アンモニウムが存在しない場合は、より良い注意を払います。それ以外の場合は、次の手順に進みます。
- 炭酸アンモニウム粉末で96ウェルプレートのコーナーで井戸を埋め、アルミ箔を使用してプレートをシールします。パラフィンフィルムでホイルを覆う。窒素ガスを使用して、残留炭酸アンモニウムをきれいにします。
- きれいなガラス片を準備します。同じクリーニング手順を使用して、ガラス製品をクリーニングします。
- 添加剤の存在下での結晶化
- CaCO3の結晶化に対する添加剤の効果を調べるために、(異なるウェルに)含まれるマルチウェルプレート、添加剤を含まない対照CaCl2溶液、および添加剤を含むCaCl2溶液を設定する。 実験にはセクション1.1.2にあるCaCl2の最適濃度を使用します。
注: 以下のプロトコルは、以前の研究16で報告されたものと同様に最適な条件を使用します。 - 手順 1.1.2.2 を繰り返します。
- ステップ1.1.2.1に記載されているように、炭酸アンモニウム粉末をプレートの隅に置きます。
- 降水が発生する各井戸に、セクション1.1.1に記載されているように切断され、洗浄されたガラス片を配置します。
- 制御ウェルを準備するには、コントロールウェルにTDWのピペット90 μLを備えます。コントロールを含む各ウェルの少なくとも 1 つの反復を準備します。使用する添加剤が緩衝液中にある場合は、TDW水の代わりに90μLのバッファーをピペットします。
- 添加物含有井戸を調製します。水に添加液の90 μLを加えてステップ1.2.5を繰り返します。添加剤が(TDWの代わりに)バッファー内にある場合は、目的の最終濃度を満たすために、添加剤の濃度をバッファーで事前に調整します。総体積は90 μLに保ちます。ピペットは、最初に添加剤、次にバッファを行います。
注:100 mM NaClにおけるタンパク質TapAの10 μMの最終濃度は、このプロトコルで25mMトリスpH 8.0バッファー16が使用される。 - コントロールと添加剤含有ウェルの両方に0.5 M CaCl2ストック溶液(ステップ1.2.2で調製)の10 μLを追加し、最終的な濃度50mM CaCl2に到達します。
- 手順 1.1.2.5 - 1.1.2.9 を繰り返します。
- CaCO3の結晶化に対する添加剤の効果を調べるために、(異なるウェルに)含まれるマルチウェルプレート、添加剤を含まない対照CaCl2溶液、および添加剤を含むCaCl2溶液を設定する。 実験にはセクション1.1.2にあるCaCl2の最適濃度を使用します。
2. 炭酸カルシウム結晶の特性測定
- 走査型電子顕微鏡では、光学顕微鏡で得られたものよりも高い解像度で添加剤の存在下で形成された炭酸カルシウム結晶を観察します(ステップ1.1.2.10参照)。
- 両面カーボンテープでアルミスタブに結晶を含むガラス片を取り付けます。
- 40-50 sのためのAu/Pdの層とコート。
- 5 kV 加速度電圧で画像を取得します。
注:図3Aは、適切な対照実験で形成された炭酸カルシウム結晶の代表的なSEM画像を示し、図4はタンパク質TapAの存在下で形成された炭酸カルシウム結晶の代表的な画像を示す。.
- マイクロラマン分光法を実行して、形成された炭酸カルシウムポリモーフを決定します。マイクロラマンは、粉末全体からではなく、単結晶からラマンスペクトルの収集を可能にします。
- 目的の結晶を選択するには、顕微鏡の20倍の目的を使用してください。
- 514 nm アルゴン レーザーを使用して、100-3200 cm-1の範囲でラマンスペクトルを収集します。
注:図5は、カルサイト(A)およびバテライト(B)の代表的なスペクトルを示す。アラゴニーのスペクトルについては、参照18を参照してください。
-
CaCO3沈殿物中の添加剤の質量パーセンテージの定量
- 使用する添加剤の消滅係数(ε)を検証/測定します。タンパク質の絶滅係数は、オンラインサーバー19によって与えることができる。絶滅係数が不明な場合は、異なる濃度で添加剤の吸光度を測定し、吸光度対濃度をプロットし、曲線の傾きから絶滅係数を計算します。
- 結晶が形成されたガラス片の重量を量り、好ましくはマイクロバランスを用いる。
- 0.1 M酢酸溶液の1.2 mLにガラスから結晶をスクラップし、渦とサンプルを超音波処理します。サンプルを室温で24時間保存します。
注意:酢酸は、皮膚や目の接触の場合に非常に危険です。注意して取り扱い、規則に従って処分します。 - 結晶を削り取った後、ガラススライドの重量を量る。
- 溶液の UV/vis 吸光度(A)スペクトルを測定します。添加剤がタンパク質である場合は、280 nmで吸光度を測定し、その濃度(C)を、ビールランバート方程式を使用して計算します。
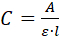
ここで lはキュベット内のオプティカル パスです。 - 2.3.5 で見つかった濃度(C)と使用される体積 (V = 1.2 mL) を使用して、結晶の中/上の添加剤の質量(m)を計算します。濃度が mg/mL の場合は、方程式Cを使用します 。
- 濃度がmol/Lの場合は、Cを適用するモル(n)を計算します。次に、分子量(Mw)を使用して添加剤の質量(m= n = Mw)を計算します。
- 方程式を使用して結晶の中/上の添加剤の重量パーセントを計算します:
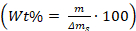 mは添加剤の質量であり、Δm sはガラスから廃棄された炭酸カルシウム結晶の質量です。作品。
mは添加剤の質量であり、Δm sはガラスから廃棄された炭酸カルシウム結晶の質量です。作品。
結果
実験設定の概略図を図 1に示します。簡単に言えば、拡散法は、96ウェルプレートに炭酸カルシウム結晶を形成し、炭酸カルシウム結晶の形態および構造に対する生体高分子の影響を試験するために使用される。これらの実験では、炭酸アンモニウムがアンモニアとCO2に分解され、炭酸カルシウム溶液に拡散し、炭酸カルシウム結晶が形成される(図1
ディスカッション
ここで説明する方法は、有機添加物の存在下で炭酸カルシウム結晶を形成し、インビトロで炭酸カルシウム結晶の形態および構造に対する有機生体高分子の影響を評価することを目的としている。この方法は、有機添加物の存在下で形成された結晶と対照実験で形成された石灰質結晶との比較に基づいている。拡散法を用いて炭酸カルシウム結晶を形成する方法、光学顕微鏡と電子顕微鏡を?...
開示事項
著者は何も開示していない。
謝辞
著者らは、リア・アダディ教授、ジョナサン・エレス教授、ヤエル・ポリティ博士に実りある議論をしてくださったことに感謝したいと思います。この研究は、イスラエル科学財団(ISF)、助成金1150/14によって支援されています。
資料
| Name | Company | Catalog Number | Comments |
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
参考文献
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved