Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Calciumcarbonatbildung in Gegenwart biopolymerer Additive
In diesem Artikel
Zusammenfassung
Wir beschreiben ein Protokoll zur Ausfällung und Charakterisierung von Calciumcarbonatkristallen, die sich in Gegenwart von Biopolymeren bilden.
Zusammenfassung
Biomineralisierung ist die Bildung von Mineralien in Gegenwart von organischen Molekülen, die oft mit funktionellen und/oder strukturellen Rollen in lebenden Organismen zusammenhängen. Es ist ein komplexer Prozess und daher ein einfaches, in vitro, System erforderlich, um die Wirkung isolierter Moleküle auf den Biomineralisierungsprozess zu verstehen. In vielen Fällen wird die Biomineralisierung durch Biopolymere in der extrazellulären Matrix gesteuert. Um die Wirkung isolierter Biopolymere auf die Morphologie und Struktur von Calcit in vitro zu bewerten, haben wir das Dampfdiffusionsverfahren zur Ausfällung von Calciumcarbonat, Rasterelektronenmikroskopie und Mikro Raman für die Charakterisierung, ultraviolett-sichtbare (UV/Vis) Absorption zur Messung der Menge eines Biopolymers in den Kristallen. Bei diesem Verfahren setzen wir die isolierten Biopolymere, die in einer Calciumchloridlösung gelöst werden, gasförmigem Ammoniak und Kohlendioxid aus, die aus der Zersetzung von festem Ammoniumcarbonat stammen. Unter den Bedingungen, unter denen das Löslichkeitsprodukt von Calciumcarbonat erreicht wird, bilden sich Calciumcarbonatausscheidungen und Kristalle. Calciumcarbonat hat verschiedene Polymorphe, die sich in ihrer thermodynamischen Stabilität unterscheiden: amorphes Calciumcarbonat, Vaterit, Aragonit und Calcit. In Ermangelung von Biopolymeren ist Calciumcarbonat unter sauberen Bedingungen meist in der Calcitform vorhanden, die das thermodynamisch stabileste Polymorph von Calciumcarbonat ist. Diese Methode untersucht die Wirkung der biopolymeren Additive auf die Morphologie und Struktur von Calciumcarbonatkristallen. Hier zeigen wir das Protokoll durch die Untersuchung eines extrazellulären bakteriellen Proteins, TapA, über die Bildung von Calciumcarbonatkristallen. Insbesondere konzentrieren wir uns auf die experimentelleN Einrichtung und Charakterisierungsmethoden, wie optische und Elektronenmikroskopie sowie Raman-Spektroskopie.
Einleitung
Biomineralisierung ist die Bildung von Mineralien in Gegenwart von organischen Molekülen, die oft mit funktionellen und/oder strukturellen Rollen in lebenden Organismen zusammenhängen. Die Biomineralisierung kann intrazellulär sein, wie bei der Bildung von Magnetit in magnetotaktischen Bakterien1, oder extrazellulär, wie bei der Bildung von Calciumcarbonat in Seeigelspitzen2, von Hydroxyapatit, das mit Kollagen in Knochen3 und von Zahnschmelz, der mit Amelogenin in den Zähnen assoziiert ist4. Biomineralisierung ist ein komplexer Prozess, der von vielen Parametern im lebenden Organismus abhängt. Um das untersuchte System zu vereinfachen, ist es daher notwendig, die Auswirkungen separater Komponenten auf den Prozess zu bewerten. In vielen Fällen wird die Biomineralisierung durch das Vorhandensein extrazellulärer Biopolymere induziert. Der Zweck der hier vorgestellten Methode ist wie folgt: (1) Calciumcarbonatkristalle in Gegenwart von isolierten Biopolymeren in vitro unter Verwendung einer Dampfdiffusionsmethode zu bilden. (2) Untersuchung der Wirkung der Biopolymere auf die Morphologie und Struktur von Calciumcarbonat.
Es werden drei Hauptmethoden zur Ausscheidung von Calciumcarbonat in vitro in Gegenwart organischer Zusatzstoffe verwendet5,6. Die erste Methode, die wir als Lösungsmethode bezeichnen werden, basiert auf dem Mischen eines löslichen Calciumsalzes (z.B. CaCl2) mit einem löslichen Salz aus Carbonat (z. B. Natriumcarbonat). Der Mischprozess kann auf verschiedene Weise durchgeführt werden: in einem Reaktor mit drei Zellen, die durch poröse Membranen getrennt sind7. Hier bei jeder der äußeren Zellen befindet sich ein lösliches Salz und die Zentralzelle enthält eine Lösung mit dem zu prüfenden Additiv. Calcium und Karbonat diffundieren von der äußeren in die mittlere Zelle, was zur Ausfällung des weniger löslichen Calciumcarbonats führt, wenn die Konzentrationen von Kalzium und Karbonat ihr Löslichkeitsprodukt überschreiten, Ksp = [Ca2+][CO3 2-]. Eine zusätzliche Mischmethode ist das Doppelstrahlverfahren8. Bei diesem Verfahren wird jedes lösliche Salz aus einer separaten Spritze in eine Rührlösung injiziert, die den Zusatzstoff enthält, wo Kalziumkarbonat ausfällt. Hierbei ist die Injektion und damit die Mischrate gut kontrolliert, im Gegensatz zur bisherigen Methode, bei der das Mischen durch Diffusion gesteuert wird.
Die zweite Methode, die verwendet wird, um CaCO3 zu kristallisieren, ist die Kitano-Methode9. Diese Methode basiert auf dem Carbonat/Wasserstoffcarbonat-Gleichgewicht (2HCO3- (aq) + Ca2+(aq) 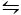 CaCO 3(s) + CO 2(g) + H 2O (l)). Hier wird CO2 in eine Lösung geblasen, die CaCO3 in fester Form enthält, das Gleichgewicht nach links verschiebt und somit das Calciumcarbonat auflöst. Das ungelöste Calciumcarbonat wird gefiltert und die gewünschten Additive in die bicarbonatreiche Lösung aufgenommen. CO2 darf dann verdampfen, wodurch die Reaktion nach rechts verschoben wird, wodurch Kalziumkarbonat in Gegenwart der Additive gebildet wird.
CaCO 3(s) + CO 2(g) + H 2O (l)). Hier wird CO2 in eine Lösung geblasen, die CaCO3 in fester Form enthält, das Gleichgewicht nach links verschiebt und somit das Calciumcarbonat auflöst. Das ungelöste Calciumcarbonat wird gefiltert und die gewünschten Additive in die bicarbonatreiche Lösung aufgenommen. CO2 darf dann verdampfen, wodurch die Reaktion nach rechts verschoben wird, wodurch Kalziumkarbonat in Gegenwart der Additive gebildet wird.
Die dritte Methode der Calciumcarbonatkristallisation, die wir hier beschreiben werden, ist die Dampfdiffusionsmethode10. In diesem Aufbau wird der organische Zusatzstoff, gelöst in einer Lösung von Calciumchlorid, in einer geschlossenen Kammer in der Nähe von Ammoniumcarbonat in Pulverform gelegt. Wenn Ammoniumcarbonatpulver in Kohlendioxid und Ammoniak zerfällt, diffundieren sie in die Lösung, die Calciumionen enthält (z. B. CaCl2), und Calciumcarbonat wird ausgefällt (abbildung 1 siehe Abbildung). Die Calciumcarbonatkristalle können durch langsamen Niederschlag oder durch schnelle Niederschläge wachsen. Bei gleichzeitigem Niederschlag wird eine Lösung, die das Additiv in CaCl 2-Lösung enthält, in einen Trockentrockner neben dem Ammoniumcarbonatpulver gelegt. Bei der im Protokoll beschriebenen schnellen Ausfällung werden sowohl die Additivlösung als auch das Ammoniumcarbonat in einer Mehrbrunnenplatte näher beieinander platziert. Die Methode der langsamen Ausfällung wird weniger Keimzentren und größere Kristalle produzieren, und die schnelle Ausfällung wird zu mehr Kernzentren und kleineren Kristallen führen.
Die oben beschriebenen Methoden unterscheiden sich in ihrer technischen Komplexität, in der Kontrollebene und in der Rate des Fällungsprozesses. Die Mischmethode erfordert eine spezielle Einrichtung6 sowohl für den Doppelstrahl als auch für das Dreizellsystem. Bei der Mischmethode ist das Vorhandensein anderer löslicher Gegenionen (z. B. Na+, Cl-)6 unvermeidlich, während bei der Kitano-Methode Kalzium und (Bi)carbonat die einzigen Ionen in Lösung sind und es nicht das Vorhandensein zusätzlicher Gegenionen (z.B. Na+, Cl-). Darüber hinaus benötigt das Mischverfahren relativ große Volumina und eignet sich daher nicht für die Arbeit mit teuren Biopolymeren. Der Vorteil des Doppelstrahls ist, dass es möglich ist, die Rate der Lösungsinjektion zu kontrollieren und dass es ein schneller Prozess im Vergleich zu anderen Methoden ist.
Der Vorteil der Kitano-Methode und der Dampfdiffusionsmethode besteht darin, dass die Bildung von Calciumcarbonat durch Diffusion von CO2 in/aus einer CaCl 2-Lösung gesteuert wird, wodurch langsamere Keim- und Niederschlagsprozesse untersucht werden können. 11 , 12. Darüber hinaus kann die Calciumcarbonatbildung durch Diffusion vonCO2 Verkalkungsprozessen in vivo13,14,15ähneln. Bei dieser Methode werden gut definierte und getrennte Kristallegebildet 16. Schließlich kann die Wirkung einzelner oder mehrerer Biopolymere auf die Kalziumkarbonatbildung getestet werden. Dies ermöglicht eine systematische Untersuchung der Wirkung einer Reihe von Additivkonzentrationen auf die Calciumcarbonatbildung sowie eine Untersuchung von Mischungen von Biopolymeren - die alle kontrolliert durchgeführt werden. Dieses Verfahren eignet sich für den Einsatz mit einer Vielzahl von Konzentrationen und Mengen von Additiven. Das minimale Volumen beträgt ca. 50 l und daher ist dieses Verfahren vorteilhaft, wenn eine begrenzte Menge der verfügbaren Biopolymere vorhanden ist. Das maximale Volumen hängt von der Zugänglichkeit einer größeren Wellplatte oder des Trockenmittels ab, in das die Platte oder der Becher, der CaCl2 enthält, eingesetzt werden soll. Das unten beschriebene Verfahren wurde für die Arbeit in einer 96-Well-Platte mit einem Biopolymer optimiert, das als Protein TapA17ausgewählt wurde.
Protokoll
1. Calciumcarbonatkristallisation
- Steuerungsvorbereitung und -optimierung
- Bereiten Sie saubere Glasstücke vor. Verwenden Sie das gleiche Reinigungsverfahren, um die Glaswaren zu reinigen.
- Verwenden Sie einen Diamantstift, um Teile eines Glasmikroskopschlittens zu schneiden, so dass sie in einen Brunnen einer 96-Well-Platte passen.
HINWEIS: 5 mm x 5 mm Stücke sollten weitgehend passen. - Legen Sie die Glasstücke in einen Becher mit dreifach destilliertem Wasser (TDW), so dass Wasser die Glasrutschen bedeckt und 10 min in einem Badebeschallungsgerät beschallt.
- Dekantieren Sie das Wasser, fügen Sie Ethanol hinzu, um die Glasglyse zu bedecken, und beschallen Sie in einem Bad Beschallungsgerät für 10 min.
- Trocknen Sie die Dias und die Glaswaren mit einem Stickstoffgasstrom und legen Sie sie 10 min bei 130 W in einen Luftplasmareiniger.
- Verwenden Sie einen Diamantstift, um Teile eines Glasmikroskopschlittens zu schneiden, so dass sie in einen Brunnen einer 96-Well-Platte passen.
- Optimieren Sie die Konzentration des CaCl 2, das in den Verkalkungsexperimenten verwendet wird, die unter den gewünschten Experimentellen Bedingungen durchgeführt werden, um eine Probe zu erreichen, die reich an glattfacettierten Calcitkristallen ist (ohne oder zumindest mit einer knappen Anzahl von Vateriten Kristalle).
- Füllen Sie die Brunnen an den Ecken einer 96-Well-Platte mit Ammoniumcarbonatpulver und versiegeln Sie die Platte mit Aluminiumfolie; die Folie mit Paraffinfolie bedecken. Reinigen Sie alle Restammoniumcarbonate mit Stickstoffgas.
VORSICHT: Ammoniumcarbonat reizt Nase und Lunge; nur innerhalb der Dunstabzugshaube verwenden. - Bereiten Sie eine Lagerlösung von 0.5 M CaCl2vor. Diese Lagerlösung wird verwendet, um einen Gradienten der Konzentrationen von CaCl 2-Lösungen in der Multi-Well-Platte vorzubereiten.
HINWEIS: Eine 10 ml Stofflösung ist ausreichend für das gesamte Experiment. - Legen Sie die zuvor geschnittenen und gereinigten Glasteile in fünf verschiedene Brunnen. Verwenden Sie die nächstgelegenen Brunnen zur Mitte.
- Füllen Sie jeden Brunnen mit einem Glasstück mit 100 l einer CaCl 2-Lösung16. Mischen Sie TDW und 0,5 M CaCl2 (Bestand), um einen zunehmenden Konzentrationsgradienten von CaCl2 über die verschiedenen Brunnen zu erreichen. Wenn eine well-Platte in unterschiedlicher Größe verwendet wird, stellen Sie die Konzentration von CaCl2 ein, um separate Calcitkristalle zu erzielen (Schritt 1.1.2.10, siehe Abschnitt Diskussion).
HINWEIS: In diesem Protokoll wird ein steigender CaCl 2-Gradient von 10, 20, 30, 40 ,50 mM In separaten Brunnen verwendet. Um den Konzentrationsbereich oder die Anzahl der getesteten Konzentrationen zu erhöhen, verwenden Sie zusätzliche Brunnen. - Punktieren Sie die Abdeckung der einzelnen Brunnen, die Ammoniumcarbonat 3x enthalten, mit einer Nadel.
- Den Deckel zurücklegen, die Ränder mit Paraffinfolie versiegeln und bei 18 °C in einem Inkubator 20 h aufbewahren.
- Nach der Inkubation öffnen Sie den Deckel vorsichtig in einer Dunstabzugshaube und entfernen Sie die Kristalle, die an der Wasser-Luft-Schnittstelle mit einer Schlaufe gebildet werden.
- Verwenden Sie eine Pinzette, um die Glasteile in einen Becher mit doppelt destilliertem Wasser (DDW) zu übertragen. Entfernen Sie die Proben aus dem Becher und verwenden Sie ein doppelseitiges Klebeband, um die Glasstücke auf der Unterseite der Petrischale zu befestigen.
- Trockenes übermäßiges Wasser, das die Ränder der Rutsche mit Gewebetüchern berührt. Bedecken Sie die Petrischale und legen Sie sie 24 stunden lang in einen Trockentrockner.
- Beobachten Sie die auf den Glasstücken gebildeten Kristalle mit einem Stereoskop (3,5-fache Vergrößerung) und/oder einem aufrechten optischen Mikroskop (10x-40x Vergrößerung). Wenn die Steuerungslösungen sauber sind, werden rhombohedrale Kristalle (höchstwahrscheinlich Calcit) mit einem optischen Mikroskop beobachtet (Abbildung 2A).
- Enthält die Steuerung zusätzlich zu den rhombohedralen Kristallen sphärische Kristalle (höchstwahrscheinlich Vaterit, Abbildung 2B), oder zeigen Rasterelektronenmikroskope (SEM)-Bilder rhombohedrale Kristalle mit rauen statt glatten Flächen ( Abbildung 3 A,B), wiederholen Sie das Kristallisationsprotokoll, um sicherzustellen, dass der Reinigungsschritt (1.1.1) korrekt ausgeführt wird. Darüber hinaus sollten Sie besser darauf achten, dass es in anderen Bereichen auf der Platte als den dafür vorgesehenen Brunnen kein Ammoniumcarbonat gibt. Fahren Sie andernfalls mit dem nächsten Schritt fort.
- Füllen Sie die Brunnen an den Ecken einer 96-Well-Platte mit Ammoniumcarbonatpulver und versiegeln Sie die Platte mit Aluminiumfolie; die Folie mit Paraffinfolie bedecken. Reinigen Sie alle Restammoniumcarbonate mit Stickstoffgas.
- Bereiten Sie saubere Glasstücke vor. Verwenden Sie das gleiche Reinigungsverfahren, um die Glaswaren zu reinigen.
- Kristallisation in Gegenwart der Additive
- Um die Wirkung der Additive auf die Kristallisation von CaCO3zu untersuchen, richten Sie eine Multi-Well-Platte ein, die (in verschiedenen Brunnen), eine Kontroll-CaCl 2-Lösung ohne die Additive und CaCl2-Lösungen mit den Additiven enthält. Verwenden Sie die optimale Konzentration von CaCl2 in Abschnitt 1.1.2 für das Experiment.
HINWEIS: Das folgende Protokoll verwendet optimale Bedingungen, wie in einer früheren Studieberichtet 16. - Wiederholen Sie Schritt 1.1.2.2.
- Ammoniumcarbonatpulver in die Ecken der Platte legen, wie in Schritt 1.1.2.1 beschrieben.
- Legen Sie in jedem Brunnen, in dem fällen wird, ein Glasstück, das wie in Abschnitt 1.1.1 beschrieben geschnitten und gereinigt wurde.
- Zur Vorbereitung von Steuerbrunnen, Pipette 90 L TDW in die Steuerbrunnen. Bereiten Sie mindestens eine Replikation jedes Brunnens einschließlich des Steuerelements vor. Wenn sich das verwendete Additiv in einer Pufferlösung befindet, dann Pipette 90 L Puffer anstelle von TDW-Wasser.
- Bereiten Sie die additivhaltigen Brunnen vor. Wiederholen Sie Schritt 1.2.5, indem Sie 90 l der additiven Lösung in Wasser hinzufügen. Wenn sich der Zusatzstoff im Puffer (anstelle von TDW) befindet, stellen Sie die Konzentration des Additivs mit Puffer vor, um die gewünschte Endkonzentration zu erreichen. Halten Sie ein Gesamtvolumen von 90 l; Pipette zuerst das Additiv, dann den Puffer.
HINWEIS: In diesem Protokoll wird eine Endkonzentration von 10 m des Proteins TapA in 100 mM NaCl, 25 mM Tris pH 8.0 Puffer16 verwendet. - Fügen Sie 10 l der 0,5 M CaCl 2-Lagerlösung (in Schritt 1.2.2) sowohl in den Kontrollen als auch in die additivenhaltigen Brunnen ein, um eine Endkonzentration von 50 mM CaCl2zu erreichen.
- Wiederholen Sie die Schritte 1.1.2.5-1.1.2.9.
- Um die Wirkung der Additive auf die Kristallisation von CaCO3zu untersuchen, richten Sie eine Multi-Well-Platte ein, die (in verschiedenen Brunnen), eine Kontroll-CaCl 2-Lösung ohne die Additive und CaCl2-Lösungen mit den Additiven enthält. Verwenden Sie die optimale Konzentration von CaCl2 in Abschnitt 1.1.2 für das Experiment.
2. Charakterisierung von Calciumcarbonatkristallen
- Beobachten Sie mit einem Rasterelektronenmikroskop die Calciumcarbonatkristalle, die in Gegenwart der Additive gebildet werden, mit einer höheren Auflösung als die optische Mikroskopie (siehe Schritt 1.1.2.10).
- Montieren Sie die Glasteile mit den Kristallen auf einem Aluminiumstummel mit doppelseitigem Carbonband.
- Mantel mit einer Schicht von Au/Pd für 40-50 s.
- Erfassen Sie die Bilder bei 5 kV Beschleunigungsspannung.
ANMERKUNG: Abbildung 3A zeigt ein repräsentatives SEM-Bild von Calciumcarbonatkristallen, die in einem ordnungsgemäßen Kontrollexperiment gebildet wurden, während Abbildung 4 repräsentative Bilder von Calciumcarbonatkristallen zeigt, die in Gegenwart des Proteins TapA gebildet wurden. .
- Führen Sie eine Mikro-Raman-Spektroskopie durch, um die gebildeten Calciumcarbonat-Polymorphe zu bestimmen. Micro Raman ermöglicht die Sammlung eines Raman-Spektrums aus einzelnen Kristallen und nicht aus einem ganzen Pulver.
- Verwenden Sie ein 20-faches Objektiv des Mikroskops, um den Kristall von Interesse zu wählen.
- Sammeln Sie das Raman-Spektrum in einem Bereich von 100 bis 3200 cm-1 mit einem 514 nm Argon-Laser.
ANMERKUNG: Abbildung 5 zeigt repräsentative Spektren von Calcit (A) und Vaterit (B). Das Spektrum von Aragonit finden Sie unter Referenz18.
-
Quantifizierung des Massenanteils der Additive in den CaCO3 Ausscheidungen
- Überprüfen/messen Sie den Aussterbekoeffizienten des verwendeten Additivs. Der Aussterbekoeffizient eines Proteins kann von Online-Servern19angegeben werden. Wenn der Aussterbekoeffizient unbekannt ist, messen Sie die Absorption des Additivs in verschiedenen Konzentrationen, zeichnen Sie die Absorption vs. Konzentration auf und berechnen Sie den Aussterbekoeffizienten aus der Steigung der Kurve.
- Wiegen Sie die Glasstücke, wo die Kristalle gebildet, vorzugsweise verwenden Sie eine Mikrobalance.
- Die Kristalle aus dem Glas in 1,2 ml 0,1 M Essigsäurelösung zerkleinern, Wirbel und Beschallung der Probe. Bewahren Sie die Probe bei Raumtemperatur für 24 h auf.
VORSICHT: Essigsäure ist sehr gefährlich bei Haut- oder Augenkontakt; mit Vorsicht umgehen und nach den Vorschriften entsorgen. - Wiegen Sie die Glasrutsche nach dem Abkratzen der Kristalle.
- Messen Sie das UV/Vis-Absorptionsspektrum (A) der Lösung. Wenn es sich bei dem Additiv um ein Protein handelt, messen Sie die Absorption bei 280 nm und berechnen Sie ihre Konzentration (C)mit der Beer-Lambert-Gleichung:
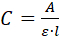
wobei l der optische Pfad innerhalb der Küvette ist. - Verwenden Sie die Konzentration (C) in 2.3.5 und das verwendete Volumen (V = 1,2 ml), um die Masse (m) der Additive in/auf den Kristallen zu berechnen. Wenn die Konzentration in mg/ml liegt, verwenden Sie die Gleichung C - V = m.
- Wenn die Konzentration in mol/L ist, dann berechnen Sie die Maulwürfe (n) unter Anwendung von C - V = n. Verwenden Sie dann das Molekulargewicht (Mw), um die Masse (m) der Additive zu berechnen (m = n Mw ).
- Berechnen Sie den Gewichtsprozentsatz der Additive in/auf den
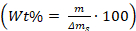 Kristallen mit der Gleichung: , wobei m die Masse der Additive ist, und s ist die Masse der Calciumcarbonatkristalle, die aus dem Glas verschrottet wurden stück.
Kristallen mit der Gleichung: , wobei m die Masse der Additive ist, und s ist die Masse der Calciumcarbonatkristalle, die aus dem Glas verschrottet wurden stück.
Ergebnisse
Ein Schaltplan der Versuchseinrichtung ist in Abbildung 1dargestellt. Kurz gesagt, wird die Diffusionsmethode verwendet, um Calciumcarbonatkristalle in 96-Well-Platten zu bilden und die Wirkung von Biopolymeren auf die Morphologie und Struktur der Calciumcarbonatkristalle zu testen. In diesen Experimenten wird Ammoniumcarbonat inAmmoniak und CO2 zerlegt, die in Calciumcarbonatlösungen diffundieren, was zur Bildung von Calciumcarbonatkristallen führt (Abbildu...
Diskussion
Das hier beschriebene Verfahren zielt darauf ab, Kalziumkarbonatkristalle in Gegenwart organischer Additive zu bilden und die Wirkung organischer Biopolymere auf die Morphologie und Struktur von Calciumcarbonatkristallen in vitro zu bewerten. Das Verfahren basiert auf dem Vergleich der Kristalle, die in Gegenwart der organischen Additive gebildet werden, mit den calcitkristallen, die im Kontrollexperiment gebildet wurden. Wir haben gezeigt, wie man die Diffusionsmethode zur Bildung der Calciumcarbonatkristalle verwendet,...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken Prof. Lia Addadi, Prof. Jonathan Erez und Dr. Yael Politi für fruchtbare Gespräche. Diese Forschung wurde von der Israeli Science Foundation (ISF), Stipendium 1150/14, unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Acetic acid | Gadot | 64-19-7 | |
| Ammonium carbonate | Sigma-Aldrich | 506-87-6 | |
| Calcium chloride dihydrate | Merck KGaA | 10035-04-8 | |
| Ethanol Absolute | Gadot | 64-17-5 | |
| Micro-Raman | Renishaw | inVia Reflex spectrometer coupled with an upright Leica optical microscope | |
| Microscope | Nikon | Eclipse 90i model | |
| Nis elements Br software | Nikon | For microscope imaging | |
| Scanning Electron Microscope | ThermoFisher Scientific | FEI Sirion microscope | |
| Spectrophotometer | JASCO | V-670 model | |
| Sputter coater | Polaron | SC7640 model |
Referenzen
- Blakemore, R. Magnetotactic bacteria. Science. 190 (4212), 377-379 (1975).
- Politi, Y., Arad, T., Klein, E., Weiner, S., Addadi, L. Sea Urchin Spine Calcite Forms via a Transient Amorphous Calcium Carbonate Phase. Science. 306 (5699), 1161-1164 (2004).
- Nudelman, F., Lausch, A. J., Sommerdijk, N. A. J. M., Sone, E. D. In vitro models of collagen biomineralization. Journal of Structural Biology. 183 (2), 258-269 (2013).
- Sigel, A., Sigel, H., Sigel, R. K. . Biomineralization: from nature to application. 12, (2008).
- Nielsen, M. H., Lee, J. R. I., De Yoreo, J. J. . Methods in Enzymology. 532, 209-224 (2013).
- Page, M. G., Cölfen, H. Improved Control of CaCO3 Precipitation by Direct Carbon Dioxide Diffusion: Application in Mesocrystal Assembly. Crystal Growth & Design. 6 (8), 1915-1920 (2006).
- Wang, H., Huang, W., Han, Y. Diffusion-reaction compromise the polymorphs of precipitated calcium carbonate. Particuology. 11 (3), 301-308 (2013).
- Sedlák, M., Antonietti, M., Cölfen, H. Synthesis of a new class of double-hydrophilic block copolymers with calcium binding capacity as builders and for biomimetic structure control of minerals. Macromolecular Chemistry and Physics. 199 (2), 247-254 (1998).
- Kitano, Y., Park, K., Hood, D. W. Pure aragonite synthesis. Journal of Geophysical Research. 67 (12), 4873-4874 (1962).
- Politi, Y., Mahamid, J., Goldberg, H., Weiner, S., Addadi, L. Asprich mollusk shell protein: in vitro experiments aimed at elucidating function in CaCO3 crystallization. CrystEngComm. 9 (12), 1171-1177 (2007).
- Gehrke, N., Cölfen, H., Pinna, N., Antonietti, M., Nassif, N. Superstructures of Calcium Carbonate Crystals by Oriented Attachment. Crystal Growth & Design. 5 (4), 1317-1319 (2005).
- Rudloff, J., et al. Double-Hydrophilic Block Copolymers with Monophosphate Ester Moieties as Crystal Growth Modifiers of CaCO3. Macromolecular Chemistry and Physics. 203 (4), 627-635 (2002).
- Boquet, E., Boronat, A., Ramos-Cormenzana, A. Production of Calcite (Calcium Carbonate) Crystals by Soil Bacteria is a General Phenomenon. Nature. 246, 527 (1973).
- Cohen, A. L., McConnaughey, T. A. Geochemical Perspectives on Coral Mineralization. Reviews in Mineralogy and Geochemistry. 54 (1), 151-187 (2003).
- Erez, J. Vital effect on stable-isotope composition seen in foraminifera and coral skeletons. Nature. 273, 199 (1978).
- Azulay, D. N., et al. Biopolymers from a Bacterial Extracellular Matrix Affect the Morphology and Structure of Calcium Carbonate Crystals. Crystal Growth & Design. 18 (9), 5582-5591 (2018).
- Abbasi, R., et al. The Bacterial Extracellular Matrix Protein TapA Is a Two-Domain Partially Disordered Protein. ChemBioChem. , (2018).
- Gauldie, R. W., Sharma, S. K., Volk, E. Micro-raman spectral study of vaterite and aragonite otoliths of the coho salmon, Oncorhynchus kisutch. Comparative Biochemistry and Physiology Part A: Physiology. 118 (3), 753-757 (1997).
- Gasteiger, E., et al. . The Proteomics Protocols Handbook. , 571-607 (2005).
- Gunasekaran, S., Anbalagan, G., Pandi, S. Raman and infrared spectra of carbonates of calcite structure. Journal of Raman Spectroscopy. 37 (9), 892-899 (2006).
- Trushina, D. B., Bukreeva, T. V., Kovalchuk, M. V., Antipina, M. N. CaCO3 vaterite microparticles for biomedical and personal care applications. Materials Science and Engineering: C. 45, 644-658 (2014).
- Weiss, I. M., Tuross, N., Addadi, L., Weiner, S. Mollusc larval shell formation: amorphous calcium carbonate is a precursor phase for aragonite. Journal of Experimental Zoology. 293 (5), 478-491 (2002).
- Yamamoto, Y., Nishimura, T., Saito, T., Kato, T. CaCO3/chitin-whisker hybrids: formation of CaCO3 crystals in chitin-based liquid-crystalline suspension. Polymer Journal. 42, 583 (2010).
- Magnabosco, G., et al. Insights on the interaction of calcein with calcium carbonate and its implications in biomineralization studies. CrystEngComm. 20 (30), 4221-4224 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten