需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
用螺旋粘度计对人血小板和细胞表面受体进行均匀剪切检测
摘要
我们描述了一种用邻面色谱法将均匀剪切应用于血小板表面受体的溶液法。这种方法也可以更广泛地应用剪切其他细胞类型和细胞片段, 不需要针对特定的配体受体对。
摘要
许多生物细胞组织通过机械感受器感知其局部环境的机械特性, 这些蛋白质可以对压力或机械扰动等力作出反应。机械感受器通过多种机制检测其刺激并传输信号。机械受体的一些最常见的角色是神经元的反应, 如触摸和疼痛, 或在平衡和听觉中发挥作用的毛细胞。对于经常暴露在剪切应力下的细胞类型, 如内皮细胞、血管线或在正常循环中经历剪切的血细胞, 机械培养也很重要。粘度计是检测流体粘度的设备。旋转粘度计也可用于对流体施加已知的剪切力。这些仪器在流体中引入均匀剪切的能力已被用来研究许多生物流体, 包括血液和血浆。粘度计也可用于将剪切作用于溶液中的细胞, 并测试剪切对特定配体受体对的影响。在这里, 我们利用面板粘度计测试内源性剪切应力水平对血小板的内源性水平的影响, 抗体对血小板机械感觉受体复合物 Gplib-ix 进行治疗。
引言
机械感受器是对机械刺激有反应的蛋白质, 如压力或机械摄动/变形。对于一些机械感受器来说, 感知这些机械扰动与它们表达的细胞类型的函数是明确的。以压力感受器神经元中的拉伸受体为例;这些机械敏感离子通道通过感知血管 "拉伸"1,2来调节血压。在内耳, 毛细胞上的离子通道检测声波3引起的机械变形,皮肤低阈值机械感受器 (ltmr) 有助于触觉信息的传递4。在其他情况下, 机械感受器为细胞建立粘附或生长提供了重要信息。细胞可以感觉到其局部环境的刚性, 并可能依靠收缩力通过肌动蛋白细胞骨架和整合素来决定生长或传播5,6。
在研究细胞或组织模型中的受体配体相互作用时, 存在着常见的检测方法, 可以快速、准确地报告温度、ph 值、配体浓度、色调、膜电位和许多其他参数的变化效果它在体内可能会有所不同。然而, 当涉及到检测机械力对受体激活的贡献时, 这些相同的检测方法可能会失败。无论细胞是感知它们的微环境、检测声波还是对拉伸的反应, 上述机械感受器的一个共同点是, 它们参与的相互作用是配体、受体或两者都锚定在表面。为测试机械力对受体相互作用的影响而开发的检测往往反映了这一范式。微流控和流室用于研究剪切流对细胞和受体的影响 7,8。这些类型的实验的优点是允许通过既定的流速微调剪切速率。其他技术使用荧光分子探针来检测细胞在富含配体表面施加的力, 从而准确地读出相互作用 9,10所涉及的力的大小和方向.
除了一个或两个伙伴锚定在表面的情况下发生的机械被组织外, 剪切应力还可能影响溶液中的蛋白质和细胞。这通常是在血液细胞/蛋白质中观察到的, 这些蛋白质在循环中不断存在, 并可能通过激活通常是表面锚定的11 的机械感受器或通过暴露将被阻断的目标序列而表现出来。静态条件12。然而, 测定剪切力对溶液中颗粒的影响的技术相对较少。一些溶液中的方法引入了不同速度和持续时间的流体悬浮液中通过涡旋细胞的剪切, 尽管这些方法可能无法非常精确地确定产生的剪切应力。旋转粘度计通过对流体施加特定的剪切力来测量粘度。本文介绍了一种用于确定特定层流剪切速率对溶液中细胞或细胞碎片的影响的方法。
血小板表面表达最强烈的蛋白质之一是糖蛋白 (GP) Ib-IX 复合物。GPIb-IX 是血浆蛋白 von Willebrand 因子 (VWF) 的主要受体。总之, 这种受体配体对一直被认为是血小板对剪切应力13 反应的基础。在血管损伤的情况下, VWF 与内皮下基质14中暴露的胶原蛋白结合, 从而通过 Vwf-gubib-ix 相互作用将血小板吸收到损伤部位。如果 GPIb-IX 在生理剪切应力作用下引起膜近端机械感域 (MSD) 的展开, 而膜近端机械传感器域 (MSD) 又会激活 Gpiib-ix 15, 则 VWF 与 gpibα亚基中的结合位点接触。在最近的一项研究中, 我们已经表明, 针对 GPIbα的抗体, 就像许多免疫血小板减少症 (ITP) 患者产生的抗体一样, 也能够通过在剪切应力下展开的 msd 诱导血小板信号。然而, 与 VWF 不同的是, 这种抗物质通过在正常循环下固定复合物来促进剪切诱导的 GPIb-IX 激活, 它能够通过 GPIb-IX 交联血小板, 并在循环中展开 MSD。这样, 通常通过剪切作用下的表面固定激活的机械感受器就可以在溶液中激活。在本报告中, 我们将演示如何利用基于粘度的均匀剪切分析来检测特定水平的剪切应力对溶液中受体激活的影响。
研究方案
本文所述的所有使用捐助者衍生的人体血小板的方法都得到了亚特兰大埃默国大学/儿童保健机构审查委员会的批准。
1. 抽血和血小板分离
- 在实验当天, 通过静脉穿刺将人血从健康的成人献血者身上抽入3.8% 的柠檬酸三钠。一个4.5 毫升的血液管是足够的血小板丰富血浆 (PRP) 为20-25 条件的捐献者, 血小板计数接近 250 x10 3 每μl。
注: 避免通过窄规格针 (小于 21 G) 抽血。 - 在22°C 和 140 x g 的温度下通过离心准备 prp, 使用长制动时间为12分钟。这将导致两个不同的层, 红血球在底部, 浅颜色的 PRP 在顶部。
- 通过在45°角的移液器尖端切割小心地进行移液, 隔离最高、多云、黄色的 PRP 层, 并通过完整的血细胞计数 (CBC) 获得血小板计数。
- 如有必要, 用 pipes 缓冲盐水清洗血小板 (150 mM 氯化钠, 20 mM 管) 在前列腺素 E1 (PGE1) 的存在下重新悬浮在 Tyland 的缓冲液中 (134 mM NaCl, 0.34 mM na 2 Hpo 4, 2.9 mM KCl, 1mm mmggcl2, 5 mm nagco3, 20 MM Hepes, ph 值 7.35) 与 5 mm 葡萄糖, 否则, 继续步骤1.5。以下步骤简要描述了清洗。
- 使用 pipes 缓冲盐水将 PRP 体积调整为 10 mL, 并添加 0.6Μm PGE1。
- 在 1, 900 x 克离心 8分钟, 然后丢弃上清液, 让血小板颗粒在400Μl 的 tyrode 和葡萄糖溶液中坐5分钟。
- 轻轻重新悬浮血小板颗粒, 使其不受干扰30分钟。
- 使用汇集的人血小板不良血浆 (PPP) 将血小板计数调整为 ~ 250 x10 3 每微米血小板, 并将悬浮液保持在22°c 不受干扰或温和旋转。
2. 配体和均匀剪切处理
注: 第2节中需要移液的所有步骤都应缓慢完成, 以免引入任何剪切。
- 将所需的抗体或配体加入 PRP 或清洗后的血小板中, 通过上下移液或用移液器尖端搅拌轻轻混合。在室温下保持不受干扰 5-10. 在负控制中添加相当于 PPP 或 Tyrode 缓冲区的体积。
- 打开圆锥板粘度计, 将板温度设置为 22°c, 并留出时间让板达到这个温度。
- 将经过处理的 PRP 或清洗后的血小板输送到直接位于板中心的温度控制的面板粘度计上。确保所有样品都在接触点的圆锥和板之间沉积, 而不是在圆锥边缘的外部。
- 以适当的速度和持续时间剪切。
- 计算剪切, 如粘度计手册所示, 或如前面显示的 15,16。
- 通过牛顿粘度定律确定粘度和所需剪切应力的剪切速率;
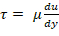 ;血浆粘度为 1.5-1.6 厘米 (cP)17。例如, 人体循环的正常剪切范围为 5-30 dyn/cm2 , 应在个位数的分钟时间尺度上应用剪切。
;血浆粘度为 1.5-1.6 厘米 (cP)17。例如, 人体循环的正常剪切范围为 5-30 dyn/cm2 , 应在个位数的分钟时间尺度上应用剪切。
- 将圆锥从板上提起, 使样品与板和圆锥保持接触, 并使用凝胶加载或其他长移液器尖端从样品体积的中心收集5-10μl。
- 在室温下, 用所需的标记将剪切样品加氢20分钟。对于磷脂酰丝氨酸的标记, β-半乳糖和 p-选择素接触使用乳酸菌素 C2 域 (LactC2) 在 0.08μm 18, 二尿草素 (ecl) 在6.25Μg/ml 和抗 p-选择素抗体 (20μg/ml), 分别。
- 在稀释或冷藏之前, 在 RT 将2% 的甲醛样品固定 20分钟, 然后进入步骤3.1 或将样品保存在4°c 不超过12小时。
3. 通过流式细胞仪检测表面标记和交联
- 通过流式细胞仪分析样品, 收集每个条件至少 20, 000个事件。
- 使用每个荧光体强度的高度值或几何平均荧光强度 (MFI) 定量荧光标记的信号强度。
- 如果以检测剪切处理后血小板交联为目标, 请在具有成像功能的流式细胞仪上对样品进行分析, 并按面积和长宽比参数对样品进行定量交联。
- 绘制面积和/或长宽比的直方图。
- 使用牛血清白蛋白 (bsa) 或车辆的负控制绘制一个门, 不包括最完全圆形的事件 (这个门通常绘制的长宽比约 0.819,20), 并量化这个门内的事件的百分比。长宽比较低的事件更有可能是交叉链接的。
结果
图 1概述了最初引入的 GPIb-IX 激活触发模型, 以解释锚定血管壁时与熊相关的受体激活, 也可能支持通过多价配体交联的血小板激活。图 2显示了由两种抗体对 GPIb-IX n 端域 (6B4 和 11a8) 和一种在剪切和静态条件下控制抗体 (正常 igg) 进行治疗的人血小板活化读数。在图 3中, 血小板用6B4 和抗体进行了治疗, 其不结合力太低, 无法触发 Gu...
讨论
本手稿中描述的协议允许快速和多才多艺的评估层剪切对血小板和细胞表面受体的影响。这里介绍的具体代表性结果强调了剪切流如何影响多价或二价配体的影响。除了这种应用外, 均匀的剪切分析在观察剪切依赖性效应方面也有广泛的应用。在没有已知的配体受体对的情况下, 均匀的剪切分析还可以检测剪切对细胞形状和信号等因素的影响, 尤其是与流式细胞仪分析配对时。图 5 b 部分提到
披露声明
作者没有什么可透露的。
致谢
与这项研究有关的工作得到了国家卫生研究院 (NIH) 国家心脏、肺和血液研究所的部分支持, 这些研究授予 HL082808、HL123984 (r. l.) 和 F31HL134241 (m. e. q.)。国家卫生研究院国家普通医学研究所也提供了 T32GM008367 (m. e. q.) 赠款;亚特兰大儿童保健和埃默里大学儿童流式细胞术核心的试点拨款。作者感谢 Hans Deckmyn 博士分享6B4 抗体, 并感谢埃默里·儿童儿童研究中心流式细胞术核心提供技术支持。
材料
| Name | Company | Catalog Number | Comments |
| APC anti-human CD62P (P-Selectin) | BioLegend | 304910 | |
| Brookfield Cap 2000+ Viscometer | Brookfield | - | |
| FITC-conjugated Erythrina cristagalli lectin (ECL) | Vector Labs | FL-1141 | |
| Pooled Normal Human Plasma | Precision Biologic | CCN-10 | |
| Vacutainer Light Blue Blood Collection Tube (Sodium Citrate) | BD | 369714 | |
| Vacutainer Blood Collection Set, 21G x ¾" Needle | BD | 367287 |
参考文献
- Sullivan, M. J., et al. Non-voltage-gated Ca2+ influx through mechanosensitive ion channels in aortic baroreceptor neurons. Circulation Research. 80 (6), 861-867 (1997).
- Lansman, J. B., Hallam, T. J., Rink, T. J. Single stretch-activated ion channels in vascular endothelial cells as mechanotransducers. Nature. 325 (6107), 811-813 (1987).
- Fettiplace, R. Hair Cell Transduction, Tuning, and Synaptic Transmission in the Mammalian Cochlea. Comprehensive Physiology. 7 (4), 1197-1227 (2017).
- Zimmerman, A., Bai, L., Ginty, D. D. The gentle touch receptors of mammalian skin. Science. 346 (6212), 950-954 (2014).
- Nelson, C. M., et al. Emergent patterns of growth controlled by multicellular form and mechanics. Proceedings of the National Academy of Sciences USA. 102 (33), 11594-11599 (2005).
- Yu, C. H., Law, J. B., Suryana, M., Low, H. Y., Sheetz, M. P. Early integrin binding to Arg-Gly-Asp peptide activates actin polymerization and contractile movement that stimulates outward translocation. Proceedings of the National Academy of Sciences USA. 108 (51), 20585-20590 (2011).
- Wen, L., et al. A shear-dependent NO-cGMP-cGKI cascade in platelets acts as an auto-regulatory brake of thrombosis. Nature Communications. 9 (1), 4301 (2018).
- Marki, A., Gutierrez, E., Mikulski, Z., Groisman, A., Ley, K. Microfluidics-based side view flow chamber reveals tether-to-sling transition in rolling neutrophils. Scientific Reports. 6, 28870 (2016).
- Brockman, J. M., et al. Mapping the 3D orientation of piconewton integrin traction forces. Nature Methods. 15 (2), 115-118 (2018).
- Wang, X., et al. Constructing modular and universal single molecule tension sensor using protein G to study mechano-sensitive receptors. Scientific Reports. 6, 21584 (2016).
- Quach, M. E., et al. Fc-independent immune thrombocytopenia via mechanomolecular signaling in platelets. Blood. 131 (7), 787-796 (2018).
- Cao, W., Krishnaswamy, S., Camire, R. M., Lenting, P. J., Zheng, X. L. Factor VIII accelerates proteolytic cleavage of von Willebrand factor by ADAMTS13. Proceedings of the National Academy of Sciences USA. 105 (21), 7416-7421 (2008).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Pareti, F. I., Niiya, K., McPherson, J. M., Ruggeri, Z. M. Isolation and characterization of two domains of human von Willebrand factor that interact with fibrillar collagen types I and III. Journal of Biological Chemistry. 262 (28), 13835-13841 (1987).
- Deng, W., et al. Platelet clearance via shear-induced unfolding of a membrane mechanoreceptor. Nature Communications. 7, 12863 (2016).
- Ikeda, Y., et al. The role of von Willebrand factor and fibrinogen in platelet aggregation under varying shear stress. Journal of Clinical Investigation. 87 (4), 1234-1240 (1991).
- Westerhof, N., Stergiopulos, N., Noble, M. I. . Snapshots of hemodynamics: an aid for clinical research and graduate education. , (2010).
- Liang, X., et al. Specific inhibition of ectodomain shedding of glycoprotein Ibalpha by targeting its juxtamembrane shedding cleavage site. Journal of Thrombosis and Haemostasis. 11 (12), 2155-2162 (2013).
- Samsel, L., et al. Imaging flow cytometry for morphologic and phenotypic characterization of rare circulating endothelial cells. Cytometry Part B: Clinical Cytometry. 84 (6), 379-389 (2013).
- Basiji, D. A., Ortyn, W. E., Liang, L., Venkatachalam, V., Morrissey, P. Cellular image analysis and imaging by flow cytometry. Clinics in Laboratory Medicine. 27 (3), 653-670 (2007).
- Quach, M. E., Chen, W., Li, R. Mechanisms of platelet clearance and translation to improve platelet storage. Blood. 131 (14), 1512-1521 (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。