Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Единый сдвига Ассси для человека тромбоцитов и клеточных поверхностных рецепторов через конус-пластины Viscometry
В этой статье
Резюме
Мы описываем в растворе метод нанесения равномерного сдвига на рецепторы поверхности тромбоцитов с помощью конусно-пластинной вискомерности. Этот метод также может быть использован более широко для нанесения сдвига на другие типы клеток и клеточных фрагментов и не нужно нацеливаться на конкретную пару лиганд-рецепторов.
Аннотация
Многие биологические клетки/ ткани ощущают механические свойства своей местной среды с помощью механорецепторов, белков, которые могут реагировать на такие силы, как давление или механические возмущения. Механорецепторы обнаруживают свои стимулы и передают сигналы через большое разнообразие механизмов. Некоторые из наиболее распространенных ролей для механорецепторов в нейронных реакций, как прикосновение и боль, или волосковые клетки, которые функционируют в равновесии и слуха. Mechanosensation также имеет важное значение для типов клеток, которые регулярно подвергаются стресс сдвига, таких как эндотелиальные клетки, которые выстраивают кровеносные сосуды, или клетки крови, которые испытывают сдвига в нормальном кровообращении. Вискометры являются устройствами, которые обнаруживают вязкость жидкостей. Вращающиеся вязки также могут быть использованы для применения известной силы сдвига к жидкостям. Способность этих инструментов вводить однородный нож для жидкости была использована для изучения многих биологических жидкостей, включая кровь и плазму. Viscometry также может быть использован для применения сдвига к клеткам в растворе, и для проверки влияния сдвига на конкретные пары лиганд-рецепторов. Здесь мы используем конусно-пластинную вискометрию для проверки влияния эндогенного уровня стресса сдвига на тромбоциты, обработанные антителами против тромбоцитов механосенсорного рецептора комплекса GPIb-IX.
Введение
Механорецепторы являются белки, которые реагируют на механические раздражители, такие как давление или механические возмущения / деформации. Для некоторых механорецепторов, зондирование этих механических возмущений явно функция типов клеток, в которых они выражаются. Возьмем, к примеру, растяжечные рецепторы в барорецепторных нейронах; эти механочувствительные ионные каналы регулируют кровяное давление, чувствуя сосудистые "растяжка"1,2. Во внутреннем ухе ионные каналы на волосяныхклетках обнаруживают механические деформации, вызванные звуковыми волнами 3, а кожные низкопороговые механорецепторы (LTMRs) облегчают передачу тактильной информации4. В других случаях механорецепторы предоставляют важную информацию клетке для установления сливов или роста. Клетки могут чувствовать жесткость их местной окружающей среды, и может полагаться на контрактные силы через актин цитоскелет и integrins диктовать рост или распространение5,6.
При изучении взаимодействия рецепторов-лигандов в клеточных или тканевых моделях существуют общие анализы, которые могут быстро и точно сообщать о последствиях изменения температуры, рН, концентрации лиганда, тонистики, мембранного потенциала и многих других параметров которые могут варьироваться в vivo. Тем не менее, эти же анализы могут не хватать, когда дело доходит до обнаружения вклада механической силы в активацию рецепторов. Ли клетки зондирования их микроокружения, обнаружения звуковых волн, или реагирования на стрейч, одна вещь, вышеупомянутые механорецепторы имеют в общем, что они участвуют в взаимодействиях, где лиганд, рецептор, или оба, закреплены на поверхности. Анализы, разработанные для проверки влияния механических сил на взаимодействия рецепторов, часто отражают эту парадигму. Микрофлюитика и камеры потока используются для изучения влияния сдвига потока на клетки и рецепторы7,8. Преимущество подобных экспериментов в том, что они позволяют точно настраивать скорость сдвига с помощью установленных скоростей потока. Другие методы используют флуоресцентные молекулярные зонды для обнаружения сил, применяемых клетками на богатых лигандой поверхностях, что дает точную считывание величины и ориентации сил, участвующих во взаимодействии9,10.
В дополнение к mechanosensation происходит, когда один или оба партнера закреплены на поверхности, сдвига стресс может повлиять на белки и клетки в растворе. Это часто наблюдается в клетках крови / белков, которые постоянно находятся в обращении, и может проявляться через активацию механорецепторов, которые, как правило, поверхностные якорь11, или через воздействие целевых последовательностей, которые будут окклюзии под статических условий12. Тем не менее, относительно меньше методов анализа влияния сдвига силы на частицы в растворе. Некоторые в решении подходов ввести сдвига через вихревые клетки в жидкости подвески с различной скоростью и продолжительностью, хотя эти подходы не могут позволить очень точное определение сдвига стресс генерируется. Вращающиеся вязкости измеряют вязкость, применяя определенную силу сдвига к жидкостям. Здесь мы описываем прикладной метод для определения влияния конкретных ставок ламинара сдвига на клетки или фрагменты клеток в растворе.
Одним из наиболее высоко выраженных белков на поверхности тромбоцитов является комплекс гликопротеинов (GP) Ib-IX. GPIb-IX является основным рецептором плазменного белка фон Виллебранд фактор (VWF). Вместе, эта рецептор-лиганд пара уже давно признана в качестве основы тромбоцитов ответ на сдвига стресс13. В случае повреждения сосудов, VWF связывается с открытым коллагеном в субэндотелиальной матрице14, таким образом, вербовка тромбоцитов к месту травмы через взаимодействие VWF-GPIb-IX. Участие VWF на своем связывающем месте в подразделении GPIb, если GPIb-IX при физиологическом стрессе сдвига индуцирует развертывание мембранно-проксимального механосенсорного домена (MSD), который, в свою очередь, активирует GPIb-IX15. В недавнем исследовании, мы показали, что антитела против GPIb, как и те, которые генерируются во многих иммунных тромбоцитопении (ITP) пациентов, также способны индуцировать тромбоцитов сигнализации через MSD разворачивается под сдвига стресс11. Однако, в отличие от VWF, который облегчает активацию GPIb-IX, индуцированной сдвигами, обездвиживая комплекс при нормальном обращении, двухвалентные антитела способны перекладывать тромбоциты через GPIb-IX и разворачивать MSD в обращении. Таким образом, механорецептор, который обычно активируется путем иммобилизации поверхности под сдвига может быть активирован в растворе. В настоящем докладе, мы продемонстрируем, как вискометр основе равномерного сдвига асссбыл использовать для обнаружения последствий конкретных уровней сдвига нагрузки на активацию рецепторов в растворе.
протокол
Все методы использования донорских тромбоцитов, полученных из донорских, описанных в нем, были одобрены Институциональным наблюдательным советом Университета Эмори/Детского здравоохранения Атланты.
1. Кровавая ничья и изоляция тромбоцитов
- Нарисуйте человеческую кровь из согласия здоровых взрослых доноров через venipuncture в день эксперимента в 3,8% тройного ситрата. Одной 4,5 мл трубки крови достаточно, чтобы дать достаточно богатой тромбоцитов плазмы (PRP) для 20-25 условий у доноров, чьи количество тромбоцитов близко к 250 х 103 на QL.
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ. Избегайте рисования крови с помощью узкоколейных игл (меньше, чем 21 G). - Подготовка PRP с помощью центрифугации при 22 градусах По кв. м и 140 х г в течение 12 мин с длинным тормозом. Это приведет к двум различным слоям, с красными кровяными тельцами в нижней части и светлого PRP в верхней части.
- Изолировать верхний, облачный, желтый слой PRP через тщательный трубач через наконечник пипетки вырезать под углом 45 "и получить количество тромбоцитов через полный анализ крови (CBC).
- При необходимости мыть тромбоциты в солевой растворе ТРУБЫ (150 мм NaCl, 20 mM PIPES) в присутствии простагландина E1 (PGE1) и повторно всасывать в буфер Tyrode (134 мм NaCl, 0,34 мМ Na2HPO4, 2,9 мм KCl, 1 мМ MgCl2, 5 мМ глюкозы, 12 мМ NaHCO 3,20 мМ HEPES, рН 7.35) с глюкозой 5 мМ, в противном случае, приступить к шагу 1.5. Следующие шаги описывают стирку вкратце.
- Отрегулируйте объем PRP до 10 мл с помощью фипом-буферизированного физраствора и добавьте 0,6 мкм PGE1.
- Центрифуга в течение 8 мин при 1900 х г, затем отбросьте супернатант и дайте гранулы тромбоцитов сидеть в 400 Л раствора Тироде и глюкозы в течение 5 мин.
- Аккуратно отретите гранулы тромбоцитов и держите его нетронутым в течение 30 мин.
- Отрегулируйте количество тромбоцитов до 250 х 103 тромбоцитов на МЛ с объединенной плазмой для тромбоцитов (PPP) и поддерживайте подвеску при 22 градусов по Цельсию без нарушения или при нежном вращении.
2. Лиганд и однородная обработка сдвига
ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ ПРИМЕЧАНИЕ оон Примечание при МЕЧАХ ЕС, которые требуют трубачирования, должны быть сделаны медленно, чтобы не вводить сдвига.
- Добавить желаемое антитела или лиганд в PRP или промывают тромбоциты и аккуратно перемешать, труба вверх и вниз или помешивая с кончиком пипетки. Оставьте его нетронутым при комнатной температуре в течение 5-10 мин. Добавьте эквивалентный объем ППС или буфера Tyrode к отрицательному контролю.
- Включите конусно-пластинный вискометр, установите температуру пластины до 22 градусов по Цельсию и дайте время, чтобы пластина достигла этой температуры.
- Pipette обработанные PRP или промытые тромбоциты на температурно-контролируемый вискометр-пластину сразу в центре плиты. Убедитесь, что весь образец откладывается между конусом и пластиной в точке контакта, а не на внешней стороне обода конуса.
- Ножстрим с соответствующей скоростью и длительностью.
- Рассчитайте сдвига, как указано в руководстве по вискометру, или, как ранее показано15,16.
- Определить скорость сдвига от вязкости и желаемого стресса сдвига через закон Ньютона вязкости;
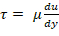 ; вязкость плазмы 1,5-1,6 центипоза (cP)17. Например, нормальный диапазон сдвига для циркуляции человека составляет 5-30 dyn/cm2 и сдвига должны быть применены на однозначной минутной временной шкале.
; вязкость плазмы 1,5-1,6 центипоза (cP)17. Например, нормальный диапазон сдвига для циркуляции человека составляет 5-30 dyn/cm2 и сдвига должны быть применены на однозначной минутной временной шкале.
- Поднимите конус от пластины slighlty (2 мм), так что образец остается в контакте как с пластиной и конусом, и использовать гель-загрузки или других длинных пипетки отзыв для сбора 5-10 qL от центра объема образца.
- Инкубировать стриженые образцы с желаемыми маркерами в течение 20 минут при комнатной температуре. Для маркеров фосфатидилсерина, - галактоза, и P-селецин воздействия использования Lactadherin C2 домена (LactC2) на 0,08 мкм18, Erythrina cristagalli лектин (ECL) на 6,25 мкг /мл, и анти-P-селецин антитела (20 мкг/мл), соответственно.
- Исправьте образцы в 2% параформальдегида в течение 20 минут на РТ до разбавления или холодного хранения, и приступить к шагу 3.1 или хранить образцы при 4 C в течение не более 12 ч.
3. Обнаружение поверхностных маркеров и перекрестные ссылки через цитометрию потока
- Проанализируйте образец с помощью цитометрии потока, собирая не менее 20 000 событий для каждого состояния.
- Квантитатная сила сигнала флуоресцентных маркеров с использованием значения высоты для интенсивности каждого флюорофора, или геометрической средней интенсивности флуоресценции (МФИ).
- Если целью обнаружить тромбоциты перекрестные после обработки сдвига, проанализируйте образец на цитометре потока, способном квитом, и квантитат по параметрам по области и соотношению сторон.
- Участок гистограммы области и / или соотношение сторон.
- Используйте отрицательный контроль с бычьей сывороткой альбумина (BSA) или транспортного средства, чтобы нарисовать ворота, исключая наиболее полно круглые события (эти ворота, как правило, обращается на соотношение сторон 0,819,20) и количественно процент событий внутри этих ворот. События с более низким соотношением сторон, скорее всего, будут взаимосвязаны.
Результаты
На рисунке 1 описывается, как триггерная модель активации GPIb-IX, первоначально введенная для объяснения активации рецепторов, зависящих от сдвига, при закреплении на стенке сосуда, может также поддерживать активацию тромбоцитов, перекрестных многовалентной лиганд.
Обсуждение
Протокол, описанный в данной рукописи, позволяет быстро и универсально оценить влияние ламинарового сдвига на тромбоциты и рецепторы поверхности клеток. Конкретные представленные здесь репрезентативные результаты подчеркивают, как влияние многомерных или двухвалентных лиганд може?...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Работа, относящееся к этому исследованию, была частично поддержана Национальными институтами здравоохранения (NIH) Национальным институтом сердца, легких и крови, гранты HL082808, HL123984 (R.L.) и F31HL134241 (M.E.). Финансирование также обеспечивается грантом Национального института общих медицинских наук НФН Т32Г008367 (М.Е.З.); и пилотные грантовые фонды от детского здравоохранения Атланты и Университета Эмори педиатрического потока Cytometry Core. Авторы хотели бы поблагодарить д-ра Ганса Декммина за совместное использование антител 6B4 и Детского научно-исследовательского центра Emory Flow Cytometry Core за техническую поддержку.
Материалы
| Name | Company | Catalog Number | Comments |
| APC anti-human CD62P (P-Selectin) | BioLegend | 304910 | |
| Brookfield Cap 2000+ Viscometer | Brookfield | - | |
| FITC-conjugated Erythrina cristagalli lectin (ECL) | Vector Labs | FL-1141 | |
| Pooled Normal Human Plasma | Precision Biologic | CCN-10 | |
| Vacutainer Light Blue Blood Collection Tube (Sodium Citrate) | BD | 369714 | |
| Vacutainer Blood Collection Set, 21G x ¾" Needle | BD | 367287 |
Ссылки
- Sullivan, M. J., et al. Non-voltage-gated Ca2+ influx through mechanosensitive ion channels in aortic baroreceptor neurons. Circulation Research. 80 (6), 861-867 (1997).
- Lansman, J. B., Hallam, T. J., Rink, T. J. Single stretch-activated ion channels in vascular endothelial cells as mechanotransducers. Nature. 325 (6107), 811-813 (1987).
- Fettiplace, R. Hair Cell Transduction, Tuning, and Synaptic Transmission in the Mammalian Cochlea. Comprehensive Physiology. 7 (4), 1197-1227 (2017).
- Zimmerman, A., Bai, L., Ginty, D. D. The gentle touch receptors of mammalian skin. Science. 346 (6212), 950-954 (2014).
- Nelson, C. M., et al. Emergent patterns of growth controlled by multicellular form and mechanics. Proceedings of the National Academy of Sciences USA. 102 (33), 11594-11599 (2005).
- Yu, C. H., Law, J. B., Suryana, M., Low, H. Y., Sheetz, M. P. Early integrin binding to Arg-Gly-Asp peptide activates actin polymerization and contractile movement that stimulates outward translocation. Proceedings of the National Academy of Sciences USA. 108 (51), 20585-20590 (2011).
- Wen, L., et al. A shear-dependent NO-cGMP-cGKI cascade in platelets acts as an auto-regulatory brake of thrombosis. Nature Communications. 9 (1), 4301 (2018).
- Marki, A., Gutierrez, E., Mikulski, Z., Groisman, A., Ley, K. Microfluidics-based side view flow chamber reveals tether-to-sling transition in rolling neutrophils. Scientific Reports. 6, 28870 (2016).
- Brockman, J. M., et al. Mapping the 3D orientation of piconewton integrin traction forces. Nature Methods. 15 (2), 115-118 (2018).
- Wang, X., et al. Constructing modular and universal single molecule tension sensor using protein G to study mechano-sensitive receptors. Scientific Reports. 6, 21584 (2016).
- Quach, M. E., et al. Fc-independent immune thrombocytopenia via mechanomolecular signaling in platelets. Blood. 131 (7), 787-796 (2018).
- Cao, W., Krishnaswamy, S., Camire, R. M., Lenting, P. J., Zheng, X. L. Factor VIII accelerates proteolytic cleavage of von Willebrand factor by ADAMTS13. Proceedings of the National Academy of Sciences USA. 105 (21), 7416-7421 (2008).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Pareti, F. I., Niiya, K., McPherson, J. M., Ruggeri, Z. M. Isolation and characterization of two domains of human von Willebrand factor that interact with fibrillar collagen types I and III. Journal of Biological Chemistry. 262 (28), 13835-13841 (1987).
- Deng, W., et al. Platelet clearance via shear-induced unfolding of a membrane mechanoreceptor. Nature Communications. 7, 12863 (2016).
- Ikeda, Y., et al. The role of von Willebrand factor and fibrinogen in platelet aggregation under varying shear stress. Journal of Clinical Investigation. 87 (4), 1234-1240 (1991).
- Westerhof, N., Stergiopulos, N., Noble, M. I. . Snapshots of hemodynamics: an aid for clinical research and graduate education. , (2010).
- Liang, X., et al. Specific inhibition of ectodomain shedding of glycoprotein Ibalpha by targeting its juxtamembrane shedding cleavage site. Journal of Thrombosis and Haemostasis. 11 (12), 2155-2162 (2013).
- Samsel, L., et al. Imaging flow cytometry for morphologic and phenotypic characterization of rare circulating endothelial cells. Cytometry Part B: Clinical Cytometry. 84 (6), 379-389 (2013).
- Basiji, D. A., Ortyn, W. E., Liang, L., Venkatachalam, V., Morrissey, P. Cellular image analysis and imaging by flow cytometry. Clinics in Laboratory Medicine. 27 (3), 653-670 (2007).
- Quach, M. E., Chen, W., Li, R. Mechanisms of platelet clearance and translation to improve platelet storage. Blood. 131 (14), 1512-1521 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены