Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo de cizalla uniforme para los receptores humanos de plaquetas y de superficie celular a través de Viscometry de placa cónica
En este artículo
Resumen
Describimos un método en solución para aplicar una cizalla uniforme a los receptores de superficie plaquetaria usando viscometry de placa cónica. Este método también se puede utilizar más ampliamente para aplicar cizallamiento a otros tipos de células y fragmentos de células y no necesita apuntar a un par de ligando-receptor específico.
Resumen
Muchas células/tejidos biológicos detectan las propiedades mecánicas de sus ambientes locales a través de mecánicos, proteínas que pueden responder a fuerzas como la presión o perturbaciones mecánicas. Los mecánicos detectan sus estímulos y transmiten señales a través de una gran diversidad de mecanismos. Algunas de las funciones más comunes para los mecánicos son las respuestas neuronales, como el tacto y el dolor, o las células ciliadas que funcionan en el equilibrio y la audición. La mechanosensation también es importante para los tipos celulares que se exponen regularmente a la tensión de cizallamiento como las células endoteliales, que la línea de los vasos sanguíneos, o células sanguíneas que experimentan cizalla en la circulación normal. Los viscometers son dispositivos que detectan la viscosidad de los fluidos. Los viscosítros rotatorios también se pueden utilizar para aplicar una fuerza de cizallamiento conocida a los fluidos. La capacidad de estos instrumentos para introducir una cizalla uniforme en los fluidos ha sido explotada para estudiar muchos fluidos biológicos, incluyendo sangre y plasma. Viscometry también se puede utilizar para aplicar cizallamiento a las células en una solución, y para probar los efectos de la cizalla en pares de ligando-receptores específicos. Aquí, utilizamos viscometría de placa cónica para probar los efectos de los niveles endógenos de estrés por cizallamiento en las plaquetas tratadas con anticuerpos contra el complejo de receptores mecanosensoriales plaquetarios GPIB-IX.
Introducción
Los mecánicos son proteínas que responden a estímulos mecánicos, como la presión o la perturbación/deformación mecánica. Para algunos mecánicos, la detección de estas perturbaciones mecánicas es explícita a la función de los tipos de células en las que se expresan. Tomar, por ejemplo, los receptores de estiramiento en las neuronas barorreceptora; estos canales de iones mecanosensibles regulan la presión arterial por detección vascular "estiramiento"1,2. En el oído interno, los canales de iones en las células ciliadas detectan las deformaciones mecánicas causadas por las ondas sonoras3, y los mecánicos de bajo umbral cutáneo (ltmrs) facilitan la transmisión de la información táctil4. En otros casos, los mecánicos proporcionan información importante a la célula para el establecimiento de la adherencia o el crecimiento. Las células pueden percibir la rigidez de su entorno local, y pueden depender de fuerzas contráctiles a través del citoesqueleto de actina e integrinas para dictar crecimiento o propagación de5,6.
Cuando se estudian interacciones receptor-ligando en modelos basados en células o tejidos, existen ensayos comunes que pueden reportar de forma rápida y precisa los efectos de alterar la temperatura, el pH, la concentración de ligando, la tonicidad, el potencial de la membrana y muchos otros parámetros que pueden variar en vivo. Sin embargo, estos mismos ensayos pueden caer corto cuando se trata de detectar la contribución de la fuerza mecánica a la activación del receptor. Ya sea que las células detectan su microambiente, detecten ondas sonoras o respondan al estiramiento, una cosa que los mecánicos antes mencionados tienen en común es que están participando en interacciones donde el ligando, receptor, o ambos, están anclados a un Superficie. Los ensayos desarrollados para probar los efectos de las fuerzas mecánicas en las interacciones del receptor a menudo reflejan este paradigma. Las cámaras de flujo y microfluidos se utilizan para estudiar los efectos del flujo de cizallamiento en las células y los receptores7,8. Estos tipos de experimentos tienen la ventaja de permitir el ajuste fino de las tasas de cizallamiento a través de velocidades de flujo establecidas. Otras técnicas emplean sondas moleculares fluorescentes para detectar las fuerzas aplicadas por las células en superficies ricas en ligando, produciendo una lectura precisa de la magnitud y las orientaciones de las fuerzas involucradas en la interacción9,10.
Además de la mecanosensación que ocurre cuando uno o ambos socios están anclados a una superficie, el estrés cortante puede afectar las proteínas y las células en solución. Esto se observa a menudo en las células sanguíneas/proteínas que están constantemente en la circulación, y puede manifestarse a través de la activación de los mecánicos que normalmente están anclados en la superficie11, o a través de la exposición de las secuencias de destino que sería ocludido bajo condiciones estáticas12. Sin embargo, relativamente menos técnicas de ensayo de los efectos de la fuerza de cizallamiento en partículas en solución. Algunos enfoques en la solución introducen la cizalla a través de las células de vórtex en la suspensión de fluidos con diferentes velocidades y duraciones, aunque estos enfoques pueden no permitir una determinación muy precisa de la tensión de cizallamiento generada. Los viscosítros rotatorios miden la viscosidad aplicando una fuerza de cizallamiento específica a los fluidos. Aquí describimos un método aplicado para determinar el efecto de las tasas de cizallamiento laminar específicas en las células o fragmentos celulares en solución.
Una de las proteínas más altamente expresadas en la superficie de las plaquetas es el complejo IB-IX de glicoproteína (GP). GPIb-IX es el receptor primario de la proteína plasmática von Willebrand factor (FWF). Juntos, este par receptor-ligand ha sido reconocido durante mucho tiempo como la base de la respuesta plaquetaria a la tensión de cizallamiento13. En caso de daño vascular, el VWF se une al colágeno expuesto en la matriz sub-endotelial14, reclutando así las plaquetas en el sitio de la lesión a través de la interacción vWF-GPIB-IX. La participación del VWF en su sitio de Unión en la subunidad GPIbα si el GPIb-IX bajo tensión fisiológica de cizallamiento induce el despliegue de un dominio mecanosensorial de membrana proximal (MSD) que a su vez activa el GPIb-IX15. En un estudio reciente, hemos demostrado que los anticuerpos contra el GPIbα, como los generados en muchos pacientes con trombocitopenia inmunitaria (PTI), también son capaces de inducir la señalización plaquetaria vía MSD desplegando bajo tensión de cizallamiento11. Sin embargo, a diferencia del VWF, que facilita la activación inducida por cizalla GPIb-IX ininmovilizando el complejo bajo circulación normal, los anticuerpos bivalentes son capaces de unir las plaquetas a través de GPIb-IX y desplegar el MSD en circulación. De esta manera, un mecánico que normalmente se activa por inmovilización superficial bajo cizalla se puede activar en solución. En el presente informe, demostraremos cómo se aprovechó un ensayo de cizallamiento uniforme basado en viscómetro para detectar los efectos de niveles específicos de tensión de cizallamiento en la activación del receptor en la solución.
Protocolo
Todos los métodos que utilizan plaquetas humanas derivadas de donantes descritos en el presente documento fueron aprobados por la Junta de revisión institucional de la Universidad Emory/children's Healthcare de Atlanta.
1. extraer sangre y aislamiento plaquetario
- Extraer sangre humana del consentimiento de donantes adultos sanos a través de la venopunción en el día del experimento en citrato de trisodio al 3,8%. Un tubo de 4,5 mL de sangre es suficiente para producir suficiente plasma rico en plaquetas (PRP) para 20-25 afecciones en donantes cuyos recuentos plaquetarios están cerca de 250 x 103 por μl.
Nota: Evite dibujar sangre a través de agujas de calibre estrecho (menores de 21 G). - Preparar PRP a través de centrifugación a 22 ° c y 140 x g durante 12 min con un freno largo. Esto resultará en dos capas distintas, con glóbulos rojos en la parte inferior y el PRP de color claro en la parte superior.
- Aísle la capa superior, nublada y amarilla del PRP mediante un pipeteo cuidadoso a través de un corte de punta de pipetas en un ángulo de 45 ° y obtenga el recuento de plaquetas a través de un hemograma completo (CBC).
- Si es necesario, lave las plaquetas en solución salina tamponada (150 mM NaCl, 20 mM PIPES) en presencia de prostaglandina E1 (PGE1) y resuspendio en el tampón de Tyrode (134 mM NaCl, 0,34 mM na2HPO4, 2,9 mM KCl, 1 mm MgCl2, 5 mm glucosa, 12 mm NaHCO 3, 20 mm HEPES, pH 7,35) con 5 mm de glucosa, de lo contrario, proceda al paso 1,5. Los siguientes pasos describen el lavado en breve.
- Ajuste el volumen de PRP a 10 mL con solución salina tamponada de tuberías y agregue 0,6 μM PGE1.
- Centrifugar durante 8 min a 1.900 x g, luego desechar el sobrenadante y dejar que el pellet de plaquetas se sienta en 400 ΜL de Tyrode y la solución de glucosa durante 5 min.
- Resuspende suavemente el pellet de plaquetas y Manténlo sin molestar durante 30 min.
- Ajustar el recuento de plaquetas a ~ 250 x 103 plaquetas por μl con plasma humano pobre en plaquetas (PPP) y mantener la suspensión a 22 ° c sin perturbaciones o bajo rotación suave.
2. ligand y tratamiento de cizallamiento uniforme
Nota: todos los pasos de la sección 2 que requieran pipetear deben realizarse lentamente, a fin de no introducir ninguna cizalla.
- Agregue el anticuerpo o ligando deseado a la PRP o las plaquetas lavadas y mezcle suavemente al pipetear hacia arriba y hacia abajo o revolviendo con una punta de pipetas. Déjalo sin molestar a temperatura ambiente durante 5-10 min. Agregue un volumen equivalente de PPP o búfer de Tyrode a un control negativo.
- Encienda el Viscosímetro de la placa cónica, ajuste la temperatura de la placa a 22 ° c y deje tiempo para que la placa alcance esta temperatura.
- Pipetear el PRP tratado o las plaquetas lavadas en el Viscosímetro de la placa cónica de temperatura controlada directamente en el centro de la placa. Asegúrese de que toda la muestra se deposita entre el cono y la placa en el punto de contacto, y no en el exterior de la llanta del cono.
- Cizallamiento a una velocidad y duración apropiadas.
- Calcule la cizalla según lo indicado por el manual del viscómetro, o como se muestra anteriormente15,16.
- Determine la velocidad de cizallamiento de la viscosidad y la tensión de cizallamiento deseada mediante la ley de viscosidad de Newton;
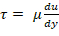 ; viscosidad del plasma es 1.5-1,6 centipoises (CP)17. Por ejemplo, un rango de cizallamiento normal para la circulación humana es 5-30 dyn/cm2 y la cizalla se debe aplicar en la escala de tiempo de minutos de un solo dígito.
; viscosidad del plasma es 1.5-1,6 centipoises (CP)17. Por ejemplo, un rango de cizallamiento normal para la circulación humana es 5-30 dyn/cm2 y la cizalla se debe aplicar en la escala de tiempo de minutos de un solo dígito.
- Levante el cono de la lámina de la placa (~ 2 mm) para que la muestra permanezca en contacto con la placa y el cono, y utilice una punta de carga de gel u otro extremo largo para recolectar 5-10 μL del centro del volumen de la muestra.
- Incubar las muestras esquiadas con los marcadores deseados durante 20 minutos a temperatura ambiente. Para los marcadores de fosfatidilserina, β-galactosa, y la exposición P-selectin utilizar Lactadherin C2 dominio (LactC2) a 0,08 μM18, Erythrina cristagalli lectina (ECL) en 6,25 μg/ml, y anti-P-selectin anticuerpo (20 μg/ml), respectivamente.
- Fije las muestras en el 2% de paraformaldehído durante 20 min en RT antes de la dilución o el almacenamiento en frío, y proceda al paso 3,1 o almacene las muestras a 4 ° c durante no más de 12 h.
3. detección de marcadores de superficie y reticulación mediante citometría de flujo
- Analice la muestra mediante citometría de flujo, recopilando al menos 20.000 eventos para cada condición.
- Cuantificación de la intensidad de la señal de los marcadores fluorescentes utilizando el valor de altura para la intensidad de cada fluoróforo, o la media geométrica de fluorescencia (IMF).
- Si tiene como objetivo detectar la reticulación plaquetaria después del tratamiento de cizallamiento, analice la muestra en un CITOMETRO de flujo con capacidad de imagen y cuantificese reticulación por área y parámetros de relación de aspecto.
- Trace un histograma de área y/o relación de aspecto.
- Utilice un control negativo con albúmina sérica bovina (BSA) o vehículo para dibujar una puerta excluyendo los eventos más totalmente circulares (esta puerta se dibuja generalmente en una relación de aspecto ~ 0,819,20) y cuantitar el porcentaje de eventos dentro de esta puerta. Los eventos con una relación de aspecto más baja son más propensos a ser reticulantes.
Resultados
La figura 1 describe cómo el modelo desencadenante de activación del GPIB-IX, inicialmente introducido para explicar la activación del receptor dependiente de la cizalla cuando se ancla a la pared del recipiente, también puede apoyar la activación de plaquetas reticuladas por un ligando multivalente. La figura 2 muestra lecturas de la activación plaquetaria humana tratadas por dos anticuerpos dirigidos al dominio N-terminal de GPIB-IX (6B4 y 11A8), y un an...
Discusión
El protocolo descrito en este manuscrito permite una evaluación rápida y versátil del efecto de la cizalla laminar sobre los receptores de las plaquetas y de la superficie celular. Los resultados representativos específicos presentados aquí subrayan cómo los efectos de los ligandos multiméricos o bivalentes pueden verse afectados por el flujo de cizallamiento. Además de esta aplicación, un ensayo de cizallamiento uniforme tiene amplias aplicaciones en la observación de efectos que dependen de la cizalla. En aus...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
El trabajo pertinente a este estudio fue apoyado en parte por los institutos nacionales de salud (NIH) del Instituto Nacional del corazón, los pulmones y la sangre otorga HL082808, HL123984 (R.L.), y F31HL134241 (M.E.Q.). Los fondos también proporcionados por el Instituto Nacional de ciencias médicas generales de NIH otorgan T32GM008367 (M.E.Q.); y fondos de becas piloto de children's Healthcare of Atlanta y la citometría de flujo pediátrica de la Universidad Emory Core. A los autores les gustaría agradecer al Dr. Hans Deckmyn por compartir el anticuerpo 6B4, y el centro de investigación pediátrica de la citometría de flujo de Emory children's para soporte técnico.
Materiales
| Name | Company | Catalog Number | Comments |
| APC anti-human CD62P (P-Selectin) | BioLegend | 304910 | |
| Brookfield Cap 2000+ Viscometer | Brookfield | - | |
| FITC-conjugated Erythrina cristagalli lectin (ECL) | Vector Labs | FL-1141 | |
| Pooled Normal Human Plasma | Precision Biologic | CCN-10 | |
| Vacutainer Light Blue Blood Collection Tube (Sodium Citrate) | BD | 369714 | |
| Vacutainer Blood Collection Set, 21G x ¾" Needle | BD | 367287 |
Referencias
- Sullivan, M. J., et al. Non-voltage-gated Ca2+ influx through mechanosensitive ion channels in aortic baroreceptor neurons. Circulation Research. 80 (6), 861-867 (1997).
- Lansman, J. B., Hallam, T. J., Rink, T. J. Single stretch-activated ion channels in vascular endothelial cells as mechanotransducers. Nature. 325 (6107), 811-813 (1987).
- Fettiplace, R. Hair Cell Transduction, Tuning, and Synaptic Transmission in the Mammalian Cochlea. Comprehensive Physiology. 7 (4), 1197-1227 (2017).
- Zimmerman, A., Bai, L., Ginty, D. D. The gentle touch receptors of mammalian skin. Science. 346 (6212), 950-954 (2014).
- Nelson, C. M., et al. Emergent patterns of growth controlled by multicellular form and mechanics. Proceedings of the National Academy of Sciences USA. 102 (33), 11594-11599 (2005).
- Yu, C. H., Law, J. B., Suryana, M., Low, H. Y., Sheetz, M. P. Early integrin binding to Arg-Gly-Asp peptide activates actin polymerization and contractile movement that stimulates outward translocation. Proceedings of the National Academy of Sciences USA. 108 (51), 20585-20590 (2011).
- Wen, L., et al. A shear-dependent NO-cGMP-cGKI cascade in platelets acts as an auto-regulatory brake of thrombosis. Nature Communications. 9 (1), 4301 (2018).
- Marki, A., Gutierrez, E., Mikulski, Z., Groisman, A., Ley, K. Microfluidics-based side view flow chamber reveals tether-to-sling transition in rolling neutrophils. Scientific Reports. 6, 28870 (2016).
- Brockman, J. M., et al. Mapping the 3D orientation of piconewton integrin traction forces. Nature Methods. 15 (2), 115-118 (2018).
- Wang, X., et al. Constructing modular and universal single molecule tension sensor using protein G to study mechano-sensitive receptors. Scientific Reports. 6, 21584 (2016).
- Quach, M. E., et al. Fc-independent immune thrombocytopenia via mechanomolecular signaling in platelets. Blood. 131 (7), 787-796 (2018).
- Cao, W., Krishnaswamy, S., Camire, R. M., Lenting, P. J., Zheng, X. L. Factor VIII accelerates proteolytic cleavage of von Willebrand factor by ADAMTS13. Proceedings of the National Academy of Sciences USA. 105 (21), 7416-7421 (2008).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Pareti, F. I., Niiya, K., McPherson, J. M., Ruggeri, Z. M. Isolation and characterization of two domains of human von Willebrand factor that interact with fibrillar collagen types I and III. Journal of Biological Chemistry. 262 (28), 13835-13841 (1987).
- Deng, W., et al. Platelet clearance via shear-induced unfolding of a membrane mechanoreceptor. Nature Communications. 7, 12863 (2016).
- Ikeda, Y., et al. The role of von Willebrand factor and fibrinogen in platelet aggregation under varying shear stress. Journal of Clinical Investigation. 87 (4), 1234-1240 (1991).
- Westerhof, N., Stergiopulos, N., Noble, M. I. . Snapshots of hemodynamics: an aid for clinical research and graduate education. , (2010).
- Liang, X., et al. Specific inhibition of ectodomain shedding of glycoprotein Ibalpha by targeting its juxtamembrane shedding cleavage site. Journal of Thrombosis and Haemostasis. 11 (12), 2155-2162 (2013).
- Samsel, L., et al. Imaging flow cytometry for morphologic and phenotypic characterization of rare circulating endothelial cells. Cytometry Part B: Clinical Cytometry. 84 (6), 379-389 (2013).
- Basiji, D. A., Ortyn, W. E., Liang, L., Venkatachalam, V., Morrissey, P. Cellular image analysis and imaging by flow cytometry. Clinics in Laboratory Medicine. 27 (3), 653-670 (2007).
- Quach, M. E., Chen, W., Li, R. Mechanisms of platelet clearance and translation to improve platelet storage. Blood. 131 (14), 1512-1521 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados