É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um ensaio de cisalhamento uniforme para receptores de superfície de células e plaquetas humanas através de Viscometry de cone-Plate
Neste Artigo
Resumo
Nós descrevemos um método da em-solução para aplicar a tesoura uniforme aos receptores de superfície da plaqueta usando o viscometry da cone-placa. Esse método também pode ser usado de forma mais ampla para aplicar cisalhamento a outros tipos de células e fragmentos de células e não precisa direcionar um par de receptor de ligante específico.
Resumo
Muitas células/tecidos biológicos sentem as propriedades mecânicas de seus ambientes locais através de mecanoreceptors, proteínas que podem responder a forças como pressão ou perturbações mecânicas. Os mechanoreceptors detectam seus estímulos e transmitem sinais através de uma grande diversidade de mecanismos. Alguns dos papéis os mais comuns para mecanorreceptores estão em respostas neuronal, como o toque e a dor, ou as pilhas de cabelo que funcionam no contrapeso e na audição. O mechanosensation é igualmente importante para os tipos da pilha que são expostos regularmente ao esforço de cisalhamento tal como pilhas endothelial, que alinham os vasos sanguíneos, ou as pilhas de sangue que experimentam a tesoura na circulação normal. Os viscometers são dispositivos que detectam a viscosidade dos líquidos. Os Viscosímetros rotatórios podem igualmente ser usados para aplicar uma força de tesoura conhecida aos líquidos. A capacidade destes instrumentos para introduzir a tesoura uniforme aos líquidos foi explorada para estudar muitos líquidos biológicos que incluem o sangue e o plasma. O viscometry pode igualmente ser usado para aplicar a tesoura às pilhas em uma solução, e para testar os efeitos da tesoura em pares específicos do ligand-receptor. Aqui, utilizamos o viscosimetria da cone-placa para testar os efeitos de níveis endógenos de tensão de cisalhamento em plaquetas tratadas com anticorpos contra o complexo do receptor mecanosensorial plaquetária GPIB-IX.
Introdução
Os mecanoreceptores são proteínas que respondem a estímulos mecânicos, como pressão ou perturbação mecânica/deformação. Para alguns mecanoreceptores, a detecção dessas perturbações mecânicas é explícita à função dos tipos de células em que são expressas. Tome, por exemplo, os receptores do estiramento em neurônios do barorreceptor; Estas canaletas mechanosensitive do íon regulam a pressão sanguínea detectando o "estiramento vascular"1,2. Na orelha interna, os canais iônicos nas células ciliadas detectam deformações mecânicas causadas por ondas sonoras3, e os mecanoreceptores cutâneos de baixo limiar (ltmrs) facilitam a transmissão da informação tátil4. Em outros casos, os mecanorreceptores fornecem a informação importante à pilha para o estabelecimento da adesão ou do crescimento. As pilhas podem sentir a rigidez de seu ambiente local, e podem confiar em forças contrátil através do citoesqueleto e das integrinas do actina para ditar o crescimento ou a propagação5,6.
Ao estudar as interações receptor-ligante em modelos celulares ou tecidos, existem ensaios comuns que podem relatar com rapidez e precisão os efeitos da alteração da temperatura, pH, concentração de ligantes, tonicidade, potencial de membrana e muitos outros parâmetros que pode variar in vivo. No entanto, esses mesmos ensaios podem ficar curtos quando se trata de detectar a contribuição da força mecânica para a ativação do receptor. Se as células estão sentindo seu microambiente, detectando ondas sonoras, ou respondendo a esticar, uma coisa que os mecanoreceptores acima mencionados têm em comum é que eles estão participando de interações onde o ligand, receptor, ou ambos, estão ancorados a um Superfície. Os ensaios desenvolvidos para testar os efeitos das forças mecânicas nas interações dos receptores freqüentemente refletem esse paradigma. Microfluínicos e câmaras de fluxo são usados para estudar os efeitos do fluxo de cisalhamento em células e receptores7,8. Estes tipos de experimentos têm a vantagem de permitir o ajuste fino das taxas de cisalhamento através de velocidades de fluxo estabelecidas. Outras técnicas empregam sondas moleculares fluorescentes para detectar forças aplicadas pelas células em superfícies ricas em ligantes, produzindo uma leitura acurada da magnitude e orientações das forças envolvidas na interação9,10.
Além do que o mechanosensation que ocorre onde um ou ambos os sócios são ancorados a uma superfície, a tensão de cisalhamento pode afetar proteínas e pilhas na solução. Isto é muitas vezes observado em células sanguíneas/proteínas que estão constantemente na circulação, e pode manifestar-se através da ativação de mecanoreceptors que normalmente são ancorados na superfície11, ou através da exposição de sequências-alvo que seriam fechadas condições estáticas12. No entanto, relativamente menos técnicas de ensaio os efeitos da força de cisalhamento sobre as partículas em solução. Algumas abordagens em solução introduzem cisalhamento através de células vortexing em suspensão fluida com velocidades e durações variadas, embora essas abordagens não permitam uma determinação muito precisa do estresse de cisalhamento gerado. Os Viscosímetros rotatórios medem a viscosidade aplicando uma força de tesoura específica aos líquidos. Nisto nós descrevemos um método aplicado para determinar o efeito de taxas laminar específicas da tesoura em pilhas ou em fragmentos da pilha na solução.
Uma das proteínas mais altamente expressas na superfície plaquetária é o complexo de glicoproteína (GP) IB-IX. O GPIb-IX é o principal receptor da proteína plasmática de von Willebrand factor (fvw). Junto, este par do receptor-ligand tem sido reconhecido por muito tempo como a Fundação da resposta da plaqueta ao esforço de cisalhamento13. Em caso de dano vascular, o fvw se liga ao colágeno exposto na matriz subendotelial14, recrutando assim plaquetas para o local de lesão por meio da interação VWF-GPIB-IX. Engajamento do VWF em seu local de ligação na subunidade GPIbα se GPIb-IX estresse fisiológico de cisalhamento induz o desdobramento de um domínio mecanosensorial membrana-proximal (MSD) que, por sua vez, ativa o GPIb-IX15. Em um estudo recente, nós mostramos que os anticorpos de encontro a GPIbα, como aqueles gerados em muitos pacientes do thrombocytopenia imune (ITP), são igualmente capazes de induzir a sinalização da plaqueta através do desdobramento de MSD o esforço de cisalhamento11. No entanto, diferentemente do fvw, que facilita a ativação do GPIb-IX induzida por cisalhamento ao imobilizar o complexo circulação normal, os anticorpos bivalentes são capazes de ligar as plaquetas através do GPIb-IX e desdobrar a MSD em circulação. Desta maneira, um Mecanorreceptor que seja ativado normalmente pela imobilização de superfície a tesoura pode ser ativado na solução. No presente relato, demonstraremos como um ensaio de cisalhamento uniforme baseado em viscosímetro foi aproveitado para detectar os efeitos de níveis específicos de estresse de cisalhamento na ativação do receptor em solução.
Protocolo
Todos os métodos que utilizam plaquetas humanas derivadas de doadores aqui descritos foram aprovados pelo Conselho de revisão institucional da Emory University/Children ' s Healthcare of Atlanta.
1. tração do sangue e isolação da plaqueta
- Desenhe sangue humano de doadores adultos saudáveis consentantes via punção venosa no dia do experimento em 3,8% de citrato trisódico. Um tubo de 4,5 mL de sangue é suficiente para produzir bastante plasma rico em plaquetas (PRP) para 20-25 condições em doadores cujas contagens de plaquetas estão próximas de 250 x 103 por μl.
Nota: Evite extrair sangue através de agulhas de bitola estreita (inferior a 21 G). - Prepare o PRP através da centrifugação a 22 ° c e 140 x g durante 12 min com um travão longo. Isso resultará em duas camadas distintas, com glóbulos vermelhos na parte inferior e a luz colorida PRP na parte superior.
- Isole a camada superior, nebulosa, amarela de PRP através da pipetagem cuidadosa através de uma ponta de pipeta cortada em um ângulo de 45 ° e obtenha a contagem de plaqueta através de uma contagem sanguínea completa (CBC).
- Se necessário, lave as plaquetas em soro fisiológico tamponado com tubos (150 mM NaCl, tubos de 20 mM) na presença de prostaglandina E1 (PGE1) e ressuscita no tampão de Tyrode (134 mM NaCl, 0,34 mM na2HPO4, 2,9 mm KCl, 1 mM MgCl2,5mm glucose, 12 mm NaHCO 3, 20 mm HEPES, pH 7,35) com 5 mm de glicose, caso contrário, avance para o passo 1,5. As etapas a seguir descrevem a lavagem em breve.
- Ajuste o volume PRP para 10 mL com solução salina tamponada por tubos e adicione 0,6 μM PGE1.
- Centrifugador por 8 min a 1.900 x g, em seguida, descarte o sobrenadante e deixe o pellet plaquetário sentar-se em 400 μL de solução de Tyrode e glicose por 5 min.
- Ressuspender suavemente a pastilha plaquetária e mantê-la intacta por 30 min.
- Ajuste a contagem de plaquetas para ~ 250 x 103 plaquetas por μl com plasma plaquetário humano pobre em agregados (PPP) e mantenha a suspensão a 22 ° c sem perturbações ou rotação suave.
2. ligand e tratamento uniforme da tesoura
Nota: todos os passos na secção 2 que necessitam de pipetagem devem ser feitos lentamente, de modo a não introduzir qualquer cisalhamento.
- Adicione o anticorpo ou ligante desejado ao PRP ou as plaquetas lavadas e misture suavemente pipetando para cima e para baixo ou mexendo com uma ponta de pipeta. Deixe-o não perturbado à temperatura ambiente por 5-10 min. Adicione um volume equivalente de PPP ou buffer de Tyrode a um controle negativo.
- Gire sobre o viscosímetro da cone-placa, ajuste a temperatura da placa a 22 ° c e deixe a hora de deixar a placa alcangar esta temperatura.
- Pipete o PRP Tratado ou as plaquetas lavadas no viscosímetro de placa de cone com temperatura controlada diretamente no centro da placa. Assegure-se de que toda a amostra esteja depositada entre o cone e a placa no ponto do contato, e não na parte externa da borda do cone.
- Cisalhamento a uma taxa e duração apropriadas.
- Calcule o cisalhamento como indicado pelo manual do viscosímetro, ou como mostrado anteriormente15,16.
- Determine a taxa da tesoura da viscosidade e do esforço de cisalhamento desejado através da lei de Newton da viscosidade;
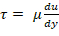 ; a viscosidade plasmática é de 1,5-1,6 centipoise (cP)17. Por exemplo, uma escala normal da tesoura para a circulação humana é 5-30 dyn/cm2 e a tesoura deve ser aplicada na escala de tempo do minuto do único dígito.
; a viscosidade plasmática é de 1,5-1,6 centipoise (cP)17. Por exemplo, uma escala normal da tesoura para a circulação humana é 5-30 dyn/cm2 e a tesoura deve ser aplicada na escala de tempo do minuto do único dígito.
- Levante o cone da placa com um pouco de comprimento (~ 2 mm) para que a amostra permaneça em contacto com a placa e o cone, e utilize uma ponta de pipeta longa ou de carga de gel para recolher 5-10 μL do centro do volume da amostra.
- Incubar as amostras cortadas com os marcadores desejados durante 20 min à temperatura ambiente. Para os marcadores de fosfatidilserina, β-galactose, e P-Selectin exposição uso lactadherin C2 domínio (LactC2) em 0, 8 μm18, Erythrina Erythrina lectina (ECL) em 6,25 μg/ml, e anti-p-Selectin anticorpo (20 μg/ml), respectivamente.
- Fixar amostras em 2% paraformaldeído durante 20 min em RT antes da diluição ou armazenamento a frio, e proceder à etapa 3,1 ou armazenar amostras a 4 ° c por não mais de 12 h.
3. detecção de marcadores de superfície e reticulação via citometria de fluxo
- Analise a amostra via citometria de fluxo, coletando pelo menos 20.000 eventos para cada condição.
- Quantificar a intensidade do sinal dos marcadores fluorescentes utilizando o valor de altura para a intensidade de cada fluoróforo, ou a média geométrica de fluorescência (MFI).
- Se com o objetivo de detectar a reticulação plaquetária após o tratamento de cisalhamento, analise a amostra em um citometro de fluxo capaz de imagem e quantificar reticulação por parâmetros de área e proporção.
- Plotar um histograma de área e/ou proporção.
- Use um controle negativo com albumina sérica bovina (BSA) ou veículo para desenhar um portão excluindo os eventos mais totalmente circulares (este portão é geralmente desenhado em uma relação de aspecto ~ 0,819,20) e quantificar a percentagem de eventos dentro deste portão. Eventos com uma taxa de proporção mais baixa são mais propensos a ser reticulado.
Resultados
A Figura 1 descreve como o modelo de gatilho da ativação do GPIB-IX, inicialmente introduzido para explicar a ativação do receptor dependente de cisalhamento quando ancorado na parede do vaso, também pode suportar a ativação de plaquetas reticuladas por um ligante multivalente. A Figura 2 mostra leituras de Ativação plaquetária humana tratadas por dois anticorpos direcionados ao domínio N-terminal de GPIB-IX (6b4 e 11A8) e um anticorpo controle (IgG n...
Discussão
O protocolo descrito neste manuscrito permite uma avaliação rápida e versátil do efeito da cisalhamento laminar nos receptores de plaquetas e de superfície celular. Os resultados representativos específicos aqui apresentados sublinham como os efeitos dos ligantes multiméricos ou bivalentes podem ser afetados pelo fluxo de cisalhamento. Além desta aplicação, um ensaio de cisalhamento uniforme tem amplas aplicações na observação de efeitos de cisalhamento-dependentes. Na ausência de um par conhecido do ligan...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O trabalho pertinente a este estudo foi apoiado em parte pelos institutos nacionais de saúde (NIH) National Heart, Lung e Blood Institute concede HL082808, HL123984 (R.L.), e F31HL134241 (M.E.Q.). Financiamento também fornecido pelo NIH National Institute of General Medical Sciences Grant T32GM008367 (M.E.Q.); e fundos de subvenção piloto da Children ' s Healthcare de Atlanta e Emory Universidade pediátrica fluxo cytometry Core. Os autores gostariam de agradecer ao Dr. Hans Deckmyn por compartilhar o anticorpo 6B4 e o núcleo de citometria de fluxo pediátrico do Emory Children ' s Center para suporte técnico.
Materiais
| Name | Company | Catalog Number | Comments |
| APC anti-human CD62P (P-Selectin) | BioLegend | 304910 | |
| Brookfield Cap 2000+ Viscometer | Brookfield | - | |
| FITC-conjugated Erythrina cristagalli lectin (ECL) | Vector Labs | FL-1141 | |
| Pooled Normal Human Plasma | Precision Biologic | CCN-10 | |
| Vacutainer Light Blue Blood Collection Tube (Sodium Citrate) | BD | 369714 | |
| Vacutainer Blood Collection Set, 21G x ¾" Needle | BD | 367287 |
Referências
- Sullivan, M. J., et al. Non-voltage-gated Ca2+ influx through mechanosensitive ion channels in aortic baroreceptor neurons. Circulation Research. 80 (6), 861-867 (1997).
- Lansman, J. B., Hallam, T. J., Rink, T. J. Single stretch-activated ion channels in vascular endothelial cells as mechanotransducers. Nature. 325 (6107), 811-813 (1987).
- Fettiplace, R. Hair Cell Transduction, Tuning, and Synaptic Transmission in the Mammalian Cochlea. Comprehensive Physiology. 7 (4), 1197-1227 (2017).
- Zimmerman, A., Bai, L., Ginty, D. D. The gentle touch receptors of mammalian skin. Science. 346 (6212), 950-954 (2014).
- Nelson, C. M., et al. Emergent patterns of growth controlled by multicellular form and mechanics. Proceedings of the National Academy of Sciences USA. 102 (33), 11594-11599 (2005).
- Yu, C. H., Law, J. B., Suryana, M., Low, H. Y., Sheetz, M. P. Early integrin binding to Arg-Gly-Asp peptide activates actin polymerization and contractile movement that stimulates outward translocation. Proceedings of the National Academy of Sciences USA. 108 (51), 20585-20590 (2011).
- Wen, L., et al. A shear-dependent NO-cGMP-cGKI cascade in platelets acts as an auto-regulatory brake of thrombosis. Nature Communications. 9 (1), 4301 (2018).
- Marki, A., Gutierrez, E., Mikulski, Z., Groisman, A., Ley, K. Microfluidics-based side view flow chamber reveals tether-to-sling transition in rolling neutrophils. Scientific Reports. 6, 28870 (2016).
- Brockman, J. M., et al. Mapping the 3D orientation of piconewton integrin traction forces. Nature Methods. 15 (2), 115-118 (2018).
- Wang, X., et al. Constructing modular and universal single molecule tension sensor using protein G to study mechano-sensitive receptors. Scientific Reports. 6, 21584 (2016).
- Quach, M. E., et al. Fc-independent immune thrombocytopenia via mechanomolecular signaling in platelets. Blood. 131 (7), 787-796 (2018).
- Cao, W., Krishnaswamy, S., Camire, R. M., Lenting, P. J., Zheng, X. L. Factor VIII accelerates proteolytic cleavage of von Willebrand factor by ADAMTS13. Proceedings of the National Academy of Sciences USA. 105 (21), 7416-7421 (2008).
- Kroll, M. H., Hellums, J. D., McIntire, L. V., Schafer, A. I., Moake, J. L. Platelets and shear stress. Blood. 88 (5), 1525-1541 (1996).
- Pareti, F. I., Niiya, K., McPherson, J. M., Ruggeri, Z. M. Isolation and characterization of two domains of human von Willebrand factor that interact with fibrillar collagen types I and III. Journal of Biological Chemistry. 262 (28), 13835-13841 (1987).
- Deng, W., et al. Platelet clearance via shear-induced unfolding of a membrane mechanoreceptor. Nature Communications. 7, 12863 (2016).
- Ikeda, Y., et al. The role of von Willebrand factor and fibrinogen in platelet aggregation under varying shear stress. Journal of Clinical Investigation. 87 (4), 1234-1240 (1991).
- Westerhof, N., Stergiopulos, N., Noble, M. I. . Snapshots of hemodynamics: an aid for clinical research and graduate education. , (2010).
- Liang, X., et al. Specific inhibition of ectodomain shedding of glycoprotein Ibalpha by targeting its juxtamembrane shedding cleavage site. Journal of Thrombosis and Haemostasis. 11 (12), 2155-2162 (2013).
- Samsel, L., et al. Imaging flow cytometry for morphologic and phenotypic characterization of rare circulating endothelial cells. Cytometry Part B: Clinical Cytometry. 84 (6), 379-389 (2013).
- Basiji, D. A., Ortyn, W. E., Liang, L., Venkatachalam, V., Morrissey, P. Cellular image analysis and imaging by flow cytometry. Clinics in Laboratory Medicine. 27 (3), 653-670 (2007).
- Quach, M. E., Chen, W., Li, R. Mechanisms of platelet clearance and translation to improve platelet storage. Blood. 131 (14), 1512-1521 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados