需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
大鼠运动皮层中的激光诱发脑损伤
* 这些作者具有相同的贡献
Erratum Notice
摘要
此处介绍的协议显示了创建脑损伤啮齿动物模型的技术。此处描述的方法使用激光照射和目标运动皮层。
摘要
在实验啮齿动物模型中诱导中风的一种常见技术涉及使用导管的中脑动脉(MCA)的瞬态(通常表示为 MCAO-t)或永久(指定为 MCAO-p)闭塞。然而,这种普遍接受的技术有一些局限性,从而限制了其广泛使用。该方法的中风诱导通常表现为缺血区定位和大小变化大、出血周期性发生、死亡率高等。此外,成功完成任何临时或永久程序都需要专业知识,通常持续约 30 分钟。在该协议中,提出了一种激光辐照技术,可以作为诱导和研究啮齿动物模型中脑损伤的替代方法。
与对照组和MCAO组大鼠相比,激光诱导的脑损伤在体温、梗塞量、脑水肿、颅内出血和死亡率方面变化减小。此外,使用激光引起的损伤只对运动皮层的脑组织造成损害,这与在 MCAO 实验中不同,在 MCAO 实验中观察到运动皮层和石体组织的破坏。
这项调查的结果表明,激光照射可以作为诱导运动皮层脑损伤的替代和有效的技术。该方法还缩短了完成该过程的时间,不需要专家处理程序。
引言
从全球程度上,中风是第二大死因,也是第三大残疾原因。中风还会导致严重的残疾,往往需要医务人员和亲属的额外护理。因此,需要了解与疾病相关的并发症,并提高取得更积极结果的潜力。
使用动物模型是了解疾病的第一步。为了确保最佳的研究成果,典型的模型将包括简单的技术、可负担性、高可重复性和最小的可变性。缺血性中风模型中的决定因素包括脑水肿体积、梗塞大小、血脑屏障(BBB)分解程度以及通常通过神经严重性评分2评估的功能损伤。
啮齿动物模型中应用最广泛的中风诱导技术暂时或永久地遮挡了中脑动脉(MCA)。3这种技术产生一个类似于人类的中风模型:它有一个五角体围绕中风区域,是高度可重复的,并调节缺血持续时间和再灌注4。然而,MCAO方法有一些并发症。该技术容易颅内出血和损伤的ipilater视网膜与视觉皮层功能障碍和常见的体温过高,往往导致额外的结果5,6,7。,6,7其他限制包括诱发性中风的高变异性(由于缺血可能扩展至意外区域(如外部胡萝卜动脉区域)、MCA 的闭塞不足以及过早再灌注。此外,不同菌株和大小的大鼠表现出不同的梗塞卷8。除了上述所有缺点外,MCAO模型不能诱发脑深区域的小孤立中风,因为它在技术上限制了其对导管最小体积的要求。这使得对替代模型的需要变得更加关键。另一种方法,光膜形成,提供了一个可能的替代MCAO程序,但没有提高效率9。此技术以光描边为目标,并针对以前的模型提供了一些改进。然而,光膜形成需要与继发性复合9相关的侵入性颅骨切除术。
鉴于概述的缺点,这里介绍的协议提供了一种能够替代激光技术,诱导啮齿动物的脑损伤。激光技术的作用机制基于激光对活组织产生光热效应,导致人体组织吸收光束并转化为热量。使用激光技术的优点是它的安全性和操作方便性。激光产生热量以阻止出血的能力使它在医学上非常重要,而它在给定的满足点上放大不同光束的能力确保激光避免破坏影响目标点10的健康组织。该协议中使用的激光束可以通过低液体介质(如骨骼),而不会释放其能量和/或造成任何破坏。一旦它达到高液体介质,如脑组织,它消耗其能量来摧毁目标组织。因此,这项技术只能在大脑的适当区域诱发脑损伤。
这里介绍的技术显示了巨大的能力来调节其辐照水平,产生从一开始所选择的脑损伤变异。与影响皮层和线状体的原始 MCAO 不同,激光技术能够调节脑损伤的影响,仅对预期的运动皮层造成伤害。本文提供了激光诱发脑损伤方案,并总结了对大鼠大脑皮层的手术具有代表性的结果。
研究方案
下列程序是按照欧洲共同体实验动物使用准则进行的。这些实验还得到了内盖夫本-古里安大学动物护理委员会的批准。
1. 动物选择和准备
- 选择65只重达300至350克的雄性Sprague-Dawley大鼠,此程序没有男性病理学。较小的尺寸对 MCAO 程序造成技术困难。
- 每个笼子分配3只老鼠,让它们适应至少3天。
2. MCAO 程序
- 选择25只大鼠为MCAO,允许10-20%的死亡率与程序11。
- 使用标准技术执行 MCAO,如前面详细描述的 12。
3. 激光引脑损伤实验程序
- 将20只大鼠分配给一个标记为激光组的组,将20只大鼠分配给另一组对照组(Sham-操作)。
- 激光组大鼠以下列方式在 50J X 10 点进行激光照射:
- 麻醉大鼠与2%异氟的氧气混合物,允许自发通风。通过用钳子捏住尾巴,检查是否有足够的麻醉深度,以查看没有退气反射。
- 在整个实验过程中,使用直肠温度调节加热垫,将大鼠的核心体温保持 37°C。
- 用剃须刀去除局部头发,用 70% 酒精和 0.5% 氯西丁葡萄糖酸盐进行消毒。再重复两次消毒步骤。
注:手术切口的大小应约为3厘米。在切口区域周围去除至少 2 厘米的头发。 - 将大鼠放在立体式头架上,放在易发位置,并做一个 3 厘米的切口,横向反射头皮,并露出布雷格玛和兰姆达之间的区域。
- 通过鼻锥保持麻醉。
- 使用Neodymium-YAG(Nd-YAG)激光(峰值波长1064nm)对右半球上方头骨的暴露区域施用50个J X 10点,脉冲持续时间为1秒。
- 确保仪器的激光生成部分与暴露区域的距离为 2 mm,以产生激光束。在仔细评估了不同的能量/表面组合后,选择了 50 J X 10 点。这种组合是有效的,不会造成骨质破坏后,给给不到一秒10。
注:2 mm 是激光束的端子(从它通过的光缆)和头骨之间的距离。在使用对焦镜头的情况下,应计算距离时应考虑到镜头倾斜的角度,以将光束对焦在所需的损坏区域。使用激光设备时,包括适当的训练和眼睛保护,确保适当的安全。 - 将大鼠从设备中取出,用3-0丝质手术缝合线关闭头皮。
- 停止麻醉,将大鼠返回到笼子进行恢复。局部管理0.1 mL 0.25%的百吉瓦卡因,在手术后立即减少术后疼痛。
注:如果执行正确,整个过程应持续少于 5 分钟。
- 观察大鼠在麻醉后恢复期间是否有危难迹象。在麻醉出现之前,给0.01mg/kg肌肉内丁丙诺啡进行术后镇痛,并持续重复剂量每12小时至少48小时。
- 使控制大鼠在相同的条件下,而不受激光照射。
4. 神经严重性评分 (NSS)
- 用43分13评估激光诱发脑损伤后24小时的神经严重性评分。测试动物的神经缺陷,行为障碍,光束平衡任务和反射,分配更高的分数,更严重的残疾,如前面详述的13。
5. 受伤后操作
- 在NSS评估后,通过让大鼠暴露在20%的氧气和80%的二氧化碳(通过灵感)中,对大鼠进行安乐死,并转心用肝素磷酸盐缓冲盐水(PBS,0.9%NaCl)使大鼠心动。
注:确保 CO2 按照机构动物护理和使用委员会准则以预定速度交付。此步骤也可以在 5% 异氟兰麻醉下执行。 - 收获大脑,并准备进一步检查,如前面的协议11所述。
- 评估亚脑出血(SAH)通过视觉检查整个大脑后,从头骨分离。如有必要,可以使用显微镜或放大镜用于此目的。
6. 脑损伤评估
-
通过TTC染色确定脑梗塞体积和脑水肿
注:2,3,5-三氯乙烯(TTC)染色是脑梗塞检测的一个方便的程序11。- 将收获的大脑切成6个日冕片,每个2毫米厚。
- 在 0.05% TTC 的 37 °C 下,从每个大脑孵育出一组切片 30 分钟。
- 染色后,用分辨率为 1600 X 1600 dpi的光学扫描仪扫描切片。
- 固定大脑切片的未污染区域被定义为梗塞12。
- 使用图像处理软件(例如,自由软件 图像J)测量6个日冕切片中每个未污染的梗塞区、ipsi和反向半球。
- 计算梗塞体积占大脑总数的百分比:
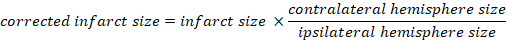
- 使用卡普兰方法计算脑水肿:
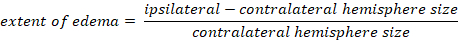
-
确定血脑屏障 (BBB) 破损的程度
注:在激光引起的脑损伤后评估 BBB 破损 24 小时,如下所示:- 管理2%埃文斯蓝与4 mL/kg盐水溶液静脉注射到大鼠通过可管的尾静脉,并允许溶液循环1小时。
- 安乐死大鼠暴露给20%的氧气和80%的CO2( 通过灵感)24小时后,最后NSS,如前面描述的13。
- 收获血管内局部染料,如下所示:
- 用手术针和手术剪刀打开老鼠的胸膛。
- 使用 110 mmHg 通过左心室用冷却 0.9% 盐水对动物进行接触,直到从右中庭获得无色灌注液。
- 收获大脑,把它们切成2毫米的切片。
- 将左脑切片与右部分开,分别评估受伤和非受伤的半球。
- 称重,用砂浆和害虫均质,然后用50%三氯乙酸孵育脑组织24小时。
- 将均质的脑片以10,000μg 离心 20分钟。
- 将离心大脑中1 mL的上流液与1:3时1.5 mL的96%乙醇混合,并使用荧光探测器在620nm激发波长(10 nm带宽)和680nm发射波长(10 nm带宽)时评估血脑屏障断裂。
注:两组大鼠都经过相同的协议来确定BBB分解。
结果
对照组或实验组无死亡或SAH登记(表1)。MCAO组的死亡率和SAH死亡率均达到20%。
尽管两组大鼠的变异性不同(表1),但两组大鼠的相对体温变化也相似。
与假操作对照组(1 ± 0.3)相比,激光(16 ±1.1)和MCAO(20±1.5)型号的NSS明显恶化。 表 1;p<0.01)。
与假操作对照组(2.4% = 0.3% 对 0.5% = 0.1) 相...
讨论
鉴于激光组没有死亡或SAH,可以公平地假设激光技术是微创的。死亡和SAH的主要死因是血管损伤,导致颅内压力升高(ICP),如最初的MCAO技术10所示。激光组没有死亡和SAH可能是由于激光的特定影响:它们对血管没有直接影响,在泄漏时可诱发凝固。低梗塞体积和脑水肿也有助于尽量减少死亡风险。鉴于最初的用于触发中风(瞬态和永久性)的 MCAO 技术已证明可导致死亡和 SAH
披露声明
作者没有什么可透露的。
致谢
我们要感谢索罗卡大学医学中心麻醉学系和内盖夫本-古里安大学的实验室工作人员在进行这一实验时提供的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
参考文献
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。