Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Laserinduzierte Hirnverletzung im Motor Cortex von Ratten
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Erratum Notice
Zusammenfassung
Das hier vorgestellte Protokoll zeigt eine Technik, um ein Nagetiermodell für Hirnverletzungen zu erstellen. Die hier beschriebene Methode verwendet Laserbestrahlung und zielt auf den motorischen Kortex ab.
Zusammenfassung
Eine gängige Technik zur Induktion von Schlaganfällen in experimentellen Nagetiermodellen beinhaltet die vorübergehende (oft als MCAO-t bezeichnet) oder permanente (als MCAO-p bezeichnet) Okklusion der mittleren Hirnarterie (MCA) mit einem Katheter. Diese allgemein anerkannte Technik hat jedoch einige Einschränkungen, wodurch ihre umfangreiche Nutzung eingeschränkt wird. Die Schlaganfallinduktion durch diese Methode ist oft durch eine hohe Variabilität in der Lokalisation und Größe des ischämischen Bereichs, periodische Vorkommnisse von Blutungen und hohe Sterberaten gekennzeichnet. Auch der erfolgreiche Abschluss eines der transienten oder permanenten Verfahren erfordert Fachwissen und dauert oft etwa 30 Minuten. In diesem Protokoll wird eine Laserbestrahlungstechnik vorgestellt, die als alternative Methode zur Induktion und Untersuchung von Hirnverletzungen in Nagetiermodellen dienen kann.
Im Vergleich zu Ratten in den Kontroll- und MCAO-Gruppen zeigte die Hirnverletzung durch Laserinduktion eine verminderte Variabilität der Körpertemperatur, des Infarktvolumens, des Hirnödems, der intrakraniellen Blutung und der Mortalität. Darüber hinaus verursachte die Verwendung einer laserinduzierten Verletzung Schäden am Hirngewebe nur im motorischen Kortex, anders als in den MCAO-Experimenten, bei denen die Zerstörung sowohl des motorischen Kortex als auch des striatalen Gewebes beobachtet wird.
Die Ergebnisse dieser Untersuchung deuten darauf hin, dass die Laserbestrahlung als alternative und effektive Technik zur Indutung von Hirnverletzungen im motorischen Kortex dienen könnte. Die Methode verkürzt auch die Zeit für den Abschluss des Verfahrens und erfordert keine expertengebundenen Handler.
Einleitung
Weltweit ist Schlaganfall die zweithäufigste Todesursache und die dritthäufigste Ursache für Behinderung1. Schlaganfall führt auch zu schweren Behinderungen, die oft zusätzliche Betreuung durch medizinisches Personal und Angehörige erfordern. Es besteht daher die Notwendigkeit, die Mit der Störung verbundenen Komplikationen zu verstehen und das Potenzial für positivere Ergebnisse zu verbessern.
Die Verwendung von Tiermodellen ist der erste Schritt zum Verständnis von Krankheiten. Um die besten Forschungsergebnisse zu gewährleisten, würde ein typisches Modell eine einfache Technik, Erschwinglichkeit, hohe Reproduzierbarkeit und minimale Variabilität umfassen. Die Determinanten in ischämischen Schlaganfall-Modellen sind Dasasidemvolumen, Infarktgröße, das Ausmaß des Blut-Hirn-Barrieren-Abbaus (BBB) und funktionelle Beeinträchtigungen, die in der Regel über neurologischeSchweregrad-Score 2ausgewertet werden.
Die am weitesten verbreitete Schlaganfall-Induktionstechnik in Nagetiermodellen versperrt die mittlere Hirnschlagader (MCA) vorübergehend oder dauerhaft3. Diese Technik erzeugt ein Schlagmodell ähnlich dem beim Menschen: Es hat einen Penumbra, der den gestrichelten Bereich umgibt, ist hoch reproduzierbar und reguliert Ischämiedauer und Reperfusion4. Dennoch hat die MCAO-Methode einige Komplikationen. Die Technik ist anfällig für intrakranielle Blutungen und Verletzungen der ipsilateralen Netzhaut mit einer Dysfunktion des visuellen Kortex und häufige Hyperthermie, die oft zu zusätzlichen Ergebnissen führen5,6,7. Weitere Einschränkungen sind hohe Variationen des induzierten Schlaganfalls (die sich aus der wahrscheinlichen Ausdehnung der Ischämie auf unbeabsichtigte Regionen, wie die äußere Halsschlagaderregion, eine unzureichende Okklusion des MCA und eine vorzeitige Reperfusion ergeben. Auch Ratten unterschiedlicher Sorten und Größen weisen verschiedene Infarktvoluminaauf 8. Zusätzlich zu allen genannten Nachteilen kann das MCAO-Modell keine kleinen isolierten Schlaganfälle in tiefen Hirnbereichen auslösen, da es technisch in Bezug auf seine Anforderung an die mindeste Gefäßgröße für die Katheterisierung begrenzt ist. Umso wichtiger ist die Notwendigkeit eines alternativen Modells. Eine andere Methode, die Photothrombose, bietet eine mögliche Alternative zu MCAO-Verfahren, verbessert aber nicht die Effizienz9. Diese Technik zielt auf Schlag mit Licht und bietet einige Verbesserungen gegenüber den vorherigen Modellen. Die Photothrombose erfordert jedoch eine invasive Kraniotomie, die mit sekundären Compications9verbunden ist.
Angesichts der umrissenen Mängel bietet das hier vorgestellte Protokoll eine leistungsfähige alternative Lasertechnik zur Induktion von Hirnverletzungen bei Nagetieren. Der Wirkmechanismus der Lasertechnik basiert auf den photothermischen Effekten des Lasers, die auf lebende Gewebe vermittelt werden, was zur Absorption von Lichtstrahlen durch Körpergewebe und deren Umwandlung in Wärme führt. Die Vorteile einer Lasertechnik sind ihre Sicherheit und einfache Manipulation. Die Fähigkeit eines Lasers, Wärme zu erzeugen, um Blutungen zu stoppen, macht ihn in der Medizin sehr wichtig, während seine Fähigkeit, verschiedene Strahlen an einem bestimmten Treffpunkt zu verstärken, sicherstellt, dass Laser die Zerstörung gesunder Gewebe vermeiden, die dem Zielpunkt10im Weg stehen. Der in diesem Protokoll verwendete Laserstrahl kann ein flüssigkeitsarmes Medium, wie z. B. Knochen, passieren, ohne seine Energie zu emittieren und/oder Zerstörungen zu verursachen. Sobald es ein hohes flüssiges Medium erreicht, wie Gehirngewebe, es verbraucht seine Energie, um das Zielgewebe zu zerstören. Die Technik kann daher nur im entsprechenden Bereich des Gehirns Hirnverletzungen auslösen.
Die hier vorgestellte Technik zeigte eine enorme Fähigkeit, ihre Bestrahlungsniveaus zu regulieren, was die gewählten Variationen von Hirnverletzungen produzierte, die von Anfang an beabsichtigt waren. Im Gegensatz zum ursprünglichen MCAO, das sowohl den Kortex als auch das Striatum beeinflusst, war die Lasertechnik in der Lage, die Auswirkungen von Hirnverletzungen zu regulieren, was verletzungende nur auf den beabsichtigten motorischen Kortex ausführte. Hierin werden das laserinduzierte Hirnverletzungsprotokoll und eine Zusammenfassung der repräsentativen Ergebnisse für das Verfahren an der Großhirnrinde von Ratten bereitgestellt.
Protokoll
Das folgende Verfahren wurde gemäß den Leitlinien für die Verwendung von Versuchstieren der Europäischen Gemeinschaft durchgeführt. Die Experimente wurden auch vom Animal Care Committee an der Ben-Gurion Universität des Negev genehmigt.
1. Tierauswahl und -zubereitung
- Wählen Sie 65 männliche Sprague-Dawley Ratten mit einem Gewicht von 300 bis 350 g ohne unüberteinige Pathologie für dieses Verfahren. Die geringere Größe stellt technische Schwierigkeiten für das MCAO-Verfahren dar.
- Weisen Sie 3 Ratten pro Käfig zu und lassen Sie sie sich für mindestens 3 Tage anpassen.
2. MCAO-Verfahren
- Wählen Sie 25 Ratten für MCAO aus, was eine Sterblichkeit von 10 bis 20 % im Zusammenhang mit dem Verfahren11ermöglicht.
- Führen Sie MCAO mit einer Standardtechnik aus, wie zuvor im Detailbeschrieben 12.
3. Laser-induzierte Hirnverletzung experimentelleverfahren
- Weisen Sie 20 Ratten einer als Lasergruppe markierten Gruppe und 20 Ratten einer anderen Kontrollgruppe zu (scheinbetrieben).
- Unterziehen Sie die Lasergruppenratten einer Laserbestrahlung um 50J X 10 Punkte in folgender Weise:
- Anästhesisieren Sie Dieratmit mit einer Mischung von 2% Isofluran in Sauerstoff, was eine spontane Beatmung ermöglicht. Prüfen Sie die ausreichende Anästhesietiefe, indem Sie den Schwanz mit Zangen kneifen, um das Fehlen des Rückzugsreflexes zu erkennen.
- Halten Sie die Körperkerntemperatur der Ratte während des gesamten Versuchs mit einem rektaltemperaturgeregelten Heizkissen bei 37 °C.
- Entfernen Sie lokales Haar mit einem Rasierer und desinfizieren Sie mit 70% Alkohol und 0,5% Chlorhexidingluconat. Wiederholen Sie den Desinfektionsschritt noch zwei Mal.
HINWEIS: Die Größe des chirurgischen Schnitts sollte ca. 3 cm betragen. Entfernen Sie das Haar mindestens 2 cm um den Schnittbereich. - Legen Sie die Ratte auf einen stereotaxic Kopfhalter in einer anfälligen Position und machen Sie einen 3 cm Schnitt, um die Kopfhaut seitlich zu reflektieren und den Bereich zwischen Bregma und Lambda freizulegen.
- Halten Sie die Anästhesie durch den Nasenkegel aufrecht.
- Verwenden Sie Neodymium-YAG (Nd-YAG) Laser (Spitzenwellenlänge 1064 nm), um 50J X 10 Punktemit 1 s Pulsdauer auf den exponierten Bereich des Schädels über der rechten Hemisphäre zu verabreichen.
- Stellen Sie sicher, dass sich der lasererzeugende Teil des Geräts in einem Abstand von 2 mm vom exponierten Bereich befindet, um einen Laserstrahl zu erzeugen. 50J X 10 Punkte wurden nach sorgfältiger Bewertung verschiedener Energie-Oberflächen-Kombinationen ausgewählt. Diese Kombination ist effizient und verursacht keine Knochenzerstörung des Schädels nach der Verabreichung für weniger als eine Sekunde10.
HINWEIS: 2 mm ist der Abstand zwischen der Klemme des Laserstrahls (vom optischen Kabel, durch das er geleitet wird) und dem Schädelknochen. Wenn eine Fokussierlinse verwendet wird, sollte der Abstand unter Berücksichtigung des Neigungswinkels der Linse berechnet werden, um den Strahl im gewünschten Schadensbereich zu fokussieren. Sorgen Sie für die richtige Sicherheit bei der Verwendung eines Lasergeräts, einschließlich entsprechender Schulung und Augenschutz. - Entfernen Sie die Ratte aus dem Gerät und schließen Sie die Kopfhaut mit 3-0 Seide chirurgische Nähte.
- Beenden Sie die Anästhesie und bringen Sie die Ratte zur Genesung in ihren Käfig zurück. 0,1 ml 0,25% Bupivacain lokal verabreichen, um die postoperativen Schmerzen unmittelbar nach der Operation zu reduzieren.
HINWEIS: Die gesamte Prozedur sollte weniger als 5 min dauern, wenn sie korrekt ausgeführt wird.
- Beobachten Sie die Ratte auf Anzeichen von Not während der Erholung nach der Anästhesie. Vor der Entstehung aus der Anästhesie, geben 0,01mg/kg intramuskuläres Buprenorphin für postoperative Analgesie und weiter mit wiederholten Dosen alle 12 h für mindestens 48 h.
- Untersien Sie Kontrollratten den gleichen Bedingungen, ohne sie dem Laser zu unterwerfen.
4. Neurologischer Schweregrad (NSS)
- Bewerten Sie den neurologischen Schweregrad 24 h nach der laserinduzierten Hirnverletzung mit einem 43-Punkte-Score13. Testen Sie die Tiere auf neurologische Defizite, Verhaltensstörungen, Strahlausgleichsaufgaben und Reflexe und weisen Sie höhere Werte für schwerere Behinderungen zu, wie zuvor beschrieben13.
5. Manipulationen nach der Verletzung
- Nach der NSS-Evaluierung die Ratten einschläfern, indem sie 20 % Sauerstoff und 80 % CO2 (über Inspiration) aussetzen und die Ratte transkardial mit heparinisierter phosphatgepufferter Saline (PBS, 0,9% NaCl) durchdringen.
HINWEIS: Stellen Sie sicher, dass CO2 gemäß den Richtlinien des Institutionellen Tierschutz- und Nutzungsausschusses zu einem vorgegebenen Preis geliefert wird. Dieser Schritt kann auch unter 5% Isoflurananästhesie durchgeführt werden. - Gehirne ernten und sich auf weitere Untersuchungen vorbereiten, wie in einem früheren Protokoll11beschrieben.
- Bewerten Sie für subarachnoide Blutungen (SAH) durch visuelle Untersuchung des gesamten Gehirns nach seiner Isolierung vom Schädel. Gegebenenfalls kann zu diesem Zweck ein Mikroskop oder eine Lupe verwendet werden.
6. Bewertung der Hirnverletzung
-
Bestimmung des Hirninfarktvolumens und des Hirnödems durch TTC-Färbung
HINWEIS: 2,3,5-Triphenyltetrazoliumchlorid (TTC) Färbung ist ein bequemes Verfahren für Hirninfarkt-Erkennung11.- Schneiden Sie die geernteten Gehirne in 6 koronale Scheiben, jeweils 2 mm Dicke.
- Inkubieren Sie den Satz von Scheiben aus jedem Gehirn für 30 min bei 37 °C in 0.05% TTC.
- Scannen Sie die Scheiben nach der Färbung mit einem optischen Scanner mit einer Auflösung von 1600 X 1600 dpi.
- Die ungefärbten Bereiche der festen Hirnscheiben werden als infarkt12definiert.
- Mit Hilfe einer Bildverarbeitungssoftware (z.B. Freeware Image J) messen Sie für jede der 6 koronalen Scheiben den ungefärbten Infarktbereich, ipsi- und kontralaterale Hemisphären.
- Berechnen Sie das Infarktvolumen als Prozentsatz des gesamten Gehirns:
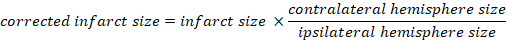
- Berechnen Sie Hirnödem eimt mit Kaplan-Methode:
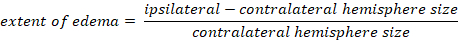
-
Bestimmung des Ausmaßes des Bruchs der Blut-Hirn-Schranke (BBB)
HINWEIS: Bewerten Sie BBB Bruch 24 h nach der laserinduzierten Hirnverletzung wie folgt:- 2% Evans Blue mit 4 ml/kg Salinelösung intravenös an Ratten über die konnulate Schwanzvene verabreichen und die Lösung 1 h zirkulieren lassen.
- Euthanisieren Sie Ratten, indem Sie sie 20% Sauerstoff und 80%CO2 (über Inspiration) 24 h nach dem letzten NSS aussetzen, wie zuvor beschrieben13.
- Den intravaskulär lokalisierten Farbstoff wie folgt ernten:
- Öffnen Sie die Brust der Ratten mit chirurgischen Pinzetten und chirurgischen Scheren.
- Durchnässen Sie die Tiere mit gekühlter 0,9% Saline über die linke Herzkammer mit 110 mmHg, bis sie eine farblose Perfusionsflüssigkeit aus dem rechten Vorhof erhalten.
- Die Gehirne ernten und rostrocaudal in 2 mm Scheiben schneiden.
- Trennen Sie die linken Gehirnscheiben von den rechten Abschnitten, um verletzte und nicht verletzte Hemisphären getrennt zu bewerten.
- Wiegen, homogenisieren mit Mörtel und Stößel, und dann inkubieren sie das Gehirngewebe in 50% Trichloressigsäure für 24 h.
- Zentrifugieren Sie die homogenisierten Gehirnscheiben bei 10.000 g für 20 min.
- Mischen Sie 1 ml des Überstandes aus dem zentrifugierten Gehirn mit 1,5 ml 96% Ethanol bei 1:3 und bewerten Sie den Bruch der Blut-Hirn-Schranke mit einem Fluoreszenzdetektor bei 620 nm Anregungswellenlänge (10 nm Bandbreite) und 680 nm Emissionswellenlänge (10 nm Bandbreite).
HINWEIS: Beide Rattengruppen durchlaufen dasselbe Protokoll zur Bestimmung des BBB-Zusammenbruchs.
Ergebnisse
Weder in den Kontroll- noch in den Versuchsgruppen wurden Todesfälle oder SAH registriert (Tabelle 1). Die MCAO-Gruppe hatte eine Sterblichkeitsrate von 20 % und sah.
Die relativen Veränderungen der Körpertemperatur bei den Ratten beider Gruppen waren ebenfalls ähnlich, trotz eines Unterschieds in der Variabilität beider Gruppen (Tabelle 1).
Sowohl bei den Lasermodellen (16 x 1,1) als auch bei MCAO (20 x 1,5) gab es eine deutli...
Diskussion
Es ist fair anzunehmen, dass die Lasertechnik minimal invasiv ist, da es in der Lasergruppe keine Todesfälle oder SAH gegeben hat. Die primäre Todesursache und SAH ist die Schädigung der Blutgefäße, die zu einer Erhöhung des intrakraniellen Drucks (ICP) führt, wie in den ursprünglichen MCAO-Techniken10gezeigt. Das Fehlen von Tod und SAH in der Lasergruppe ist wahrscheinlich auf die spezifischen Auswirkungen von Lasern zurückzuführen: Sie haben keine direkten Auswirkungen auf die Blutgef?...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken der Abteilung für Anästhesiologie des Soroka University Medical Center und dem Laborpersonal der Ben-Gurion Universität des Negev für ihre Hilfe bei der Durchführung dieses Experiments.
Materialien
| Name | Company | Catalog Number | Comments |
| 2,3,5-Triphenyltetrazolium chloride | SIGMA - ALDRICH | 298-96-4 | |
| 50% trichloroacetic acid | SIGMA - ALDRICH | 76-03-9 | |
| Brain & Tissue Matrices | SIGMA - ALDRICH | 15013 | |
| Cannula Venflon 22 G | KD-FIX | 1.83604E+11 | |
| Centrifuge Sigma 2-16P | SIGMA - ALDRICH | Sigma 2-16P | |
| Compact Analytical Balances | SIGMA - ALDRICH | HR-AZ/HR-A | |
| Digital Weighing Scale | SIGMA - ALDRICH | Rs 4,000 | |
| Dissecting scissors | SIGMA - ALDRICH | Z265969 | |
| Eppendorf pipette | SIGMA - ALDRICH | Z683884 | |
| Eppendorf Tube | SIGMA - ALDRICH | EP0030119460 | |
| Ethanol 96 % | ROMICAL | Flammable Liquid | |
| Evans Blue 2% | SIGMA - ALDRICH | 314-13-6 | |
| Fluorescence detector | Tecan, Männedorf Switzerland | model Infinite 200 PRO multimode reader | |
| Heater with thermometer | Heatingpad-1 | Model: HEATINGPAD-1/2 | |
| Infusion Cuff | ABN | IC-500 | |
| Isofluran, USP 100% | Piramamal Critical Care, Inc | NDC 66794-017 | |
| Multiset | TEVA MEDICAL | 998702 | |
| Olympus BX 40 microscope | Olympus | ||
| Optical scanner | Canon | Cano Scan 4200F | |
| Petri dishes | SIGMA - ALDRICH | P5606 | |
| Scalpel blades 11 | SIGMA - ALDRICH | S2771 | |
| Sharplan 3000 Nd:YAG (neodymium-doped yttrium aluminum garnet) laser machine | Laser Industries Ltd | ||
| Stereotaxic head holder | KOPF | 900LS | |
| Sterile Syringe 2 ml | Braun | 4606027V | |
| Syringe-needle 27 G | Braun | 305620 |
Referenzen
- World Health Organization. Global health estimates: deaths by cause, age, sex and country, 2000-2012. World Health Organization. 9, (2014).
- Meadows, K. L. Experimental models of focal and multifocal cerebral ischemia: a review. Reviews in the Neurosciences. 29, 661-674 (2018).
- Durukan, A., Strbian, D., Tatlisumak, T. Rodent models of ischemic stroke: a useful tool for stroke drug development. Current Pharmaceutical Designs. 14, 359-370 (2008).
- Fluri, F., Schuhmann, M. K., Kleinschnitz, C. Animal models of ischemic stroke and their application in clinical research. Drug Design, Development and Therapy. 9, 3445-3454 (2015).
- Li, F., Omae, T., Fisher, M. Spontaneous hyperthermia and its mechanism in the intraluminal suture middle cerebral artery occlusion model of rats. Stroke. 30, 2464-2470 (1999).
- Boyko, M., et al. An experimental model of focal ischemia using an internal carotid artery approach. Journal of Neuroscience Methods. 193, 246-253 (2010).
- Zhao, Q., Memezawa, H., Smith, M. L., Siesjo, B. K. Hyperthermia complicates middle cerebral artery occlusion induced by an intraluminal filament. Brain Research. 649, 253-259 (1994).
- Braeuninger, S., Kleinschnitz, C. Rodent models of focal cerebral ischemia: procedural pitfalls and translational problems. Experimental and Translational Stroke Medicine. 1, 8 (2009).
- Choi, B. I., et al. Neurobehavioural deficits correlate with the cerebral infarction volume of stroke animals: a comparative study on ischaemia-reperfusion and photothrombosis models. Environmental Toxicology and Pharmacology. 33, 60-69 (2012).
- Boyko, M., et al. An Alternative Model of Laser-Induced Stroke in the Motor Cortex of Rats. Biological Procedure Online. 21, 9 (2019).
- Bleilevens, C., et al. Effect of anesthesia and cerebral blood flow on neuronal injury in a rat middle cerebral artery occlusion (MCAO) model. Experimental Brain Research. 224, 155-164 (2013).
- Kuts, R., et al. A Middle Cerebral Artery Occlusion Technique for Inducing Post-stroke Depression in Rats. Journal of Visualized Experiments. (147), e58875 (2019).
- Boyko, M., et al. Morphological and neuro-behavioral parallels in the rat model of stroke. Behavioural Brain Research. 223, 17-23 (2011).
Erratum
Formal Correction: Erratum: Laser-Induced Brain Injury in the Motor Cortex of Rats
Posted by JoVE Editors on 2/07/2022. Citeable Link.
An erratum was issued for: Laser-Induced Brain Injury in the Motor Cortex of Rats. The Authors section was updated.
One of the author names was updated from:
Dmitri Frank
to
Dmitry Frank
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten